右美托咪定对热射病大鼠血清及外周血单个核细胞HMGB1表达的影响
王珊珊,杨晓明,王 涛
(中国人民解放军空军总医院麻醉科,北京 100142)
右美托咪定对热射病大鼠血清及外周血单个核细胞HMGB1表达的影响
王珊珊,杨晓明△,王涛
(中国人民解放军空军总医院麻醉科,北京 100142)
[摘要]目的研究右美托咪定对热射病大鼠血清及外周血单个核细胞(PBMCs)中高迁移率族蛋白1(HMGB1)表达的影响及其可能机制。 方法32只SD大鼠分为对照组(C组)、模型组(H组)、右美托咪定组(D组)和育亨宾组(Y组)。麻醉后将大鼠置于(40.0±0.5)℃环境,直至体温达到42 ℃,建立热射病模型。于热应激终点后1 h采血,酶联免疫吸附试验(ELISA)试剂盒测定血清HMGB1浓度,淋巴细胞分离液提取PMBCs,Western blot法测定PBMCs中HMGB1的水平。结果与C组相比,H组大鼠血清HMGB1浓度明显增加,而PBMCs中HMGB1水平明显降低(P<0.05);与H组相比,D组大鼠血清HMGB1浓度降低,而PBMCs中HMGB1水平增加(P<0.05);与D组相比,Y组大鼠血清HMGB1浓度增加,而PBMCs中HMGB1水平降低(P<0.05)。结论右美托咪定降低热射病大鼠血清HMGB1水平,其机制可能与作用于PBMCs表面α2受体,减少其HMGB1的释放有关。
[关键词]右美托咪定;热射病;高迁移率族蛋白1; PBMCs
热射病(heat stroke,HS)是一种由中心体温极度升高引起的威胁生命的疾病[1-2]。热射病常是致命的,至今尚缺乏特异性和有效的治疗。高迁移率族蛋白1(HMGB1)是一种核非组蛋白DNA结合蛋白,近年研究认为HMGB1是无菌损伤炎症和器官损伤的早期介质[3-4],由坏死的组织细胞释放或由单核巨噬细胞等炎症细胞分泌。研究表明,HMGB1参与热射病的发生与发展,阻断HMGB1通路可能改善热射病预后[5-6]。右美托咪定是一种α2肾上腺素受体激动剂,能够降低脓毒血症及缺血再灌注模型大鼠的血清细胞因子及HMGB1水平,改善其预后[7-9]。因此,本研究推测右美托咪定可能通过调节HMGB1水平,从而影响热射病预后。本实验通过测定热射病模型大鼠血清及血单个核细胞中的HMGB1水平来研究右美托咪定对热射病大鼠HMGB1水平的影响及其可能作用机制。
1材料与方法
1.1材料成年雄性240~280 g SD大鼠32只(中国人民解放军第304医院实验动物中心)。实验开始前,动物饲养在24 ℃环境中,12/12 h昼夜节律,自由摄食饮水,适应环境1周。
1.2方法
1.2.1热射病模型建立方法3%戊巴比妥钠(45 mg/kg)麻醉大鼠,置于预热至(40.0±0.5)℃的热舱中,每隔5 min监测记录肛温(代表中心体温),以中心体温达42.0 ℃为热应激终点[10]。
1.2.2分组与处理所有大鼠麻醉后分为4组,每组8只。对照组(C组):麻醉后直接放入24 ℃室温环境中。其余组大鼠麻醉后放于(40.0±0.5)℃的热舱中,达热应激终点后,模型组(H组):腹腔注射1 mL生理盐水;右美托咪定组(D组):腹腔注射含右美托咪定(25 μg/kg)的生理盐水1 mL(批号为14010632,江苏恒瑞有限公司);育亨宾组(Y组):热应激终点即刻腹腔注射育亨宾0.25 mg/kg(0.25 mg/mL,批号为101144729,sigma公司),5 min后腹腔注射右美托咪定(25 μg/kg),然后全部大鼠置于24 ℃常温环境中。
1.2.3酶联免疫吸附试验(ELISA)测HMGB1各组大鼠于给药后1 h采血,取2 mL放入促凝管,3 000 r/min离心10 min,取上清液,用ELISA试剂盒(上海西塘生物科技有限公司)测定血清HMGB1水平。
1.2.4外周血单个核细胞(PBMCs)的分离每只大鼠各取2 mL血放入枸橼酸钠抗凝管,参照说明用淋巴细胞分离液(天津市灏洋生物制品科技有限责任公司)分离单个核细胞(PBMCs):加同体积生理盐水稀释后,沿试管壁轻轻加入2 mL淋巴细胞分离液 (外周血∶淋巴细胞分层液=1∶1),3 000 r/min离心20 min,收集环状乳白色的淋巴细胞层的细胞放入含8 mL生理盐水的试管内,充分混匀,2 000 r/min离心10 min,沉淀反复洗涤2次,弃上清液,加l mL生理盐水重悬细胞,将细胞悬液转移至1.5 mL EP管中,2 000 r/min离心10 min,弃净上清液,-80 ℃冷藏,备用。
1.2.5PBMCs中HMGB1的Western blot检测提取PBMCs中HMGB1蛋白,用BCA蛋白浓度测定试剂盒(上海西唐生物科技有限公司的产品)测定蛋白浓度。进行十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,用湿转膜法转到聚偏二氟乙烯(PVDF)膜上,300 mA恒流转膜甘油醛-3-磷酸脱氢酶(GAPDH)60 min、 HMGB1 55 min;5%牛血清清蛋白(BSA)室温封闭2 h;TBST洗膜后加入TBST稀释的相应一抗(GAPDH 1∶20 000,上海海肽生物科技有限公司;HMGB1 1∶500,美国CST公司)4 ℃孵育过夜;洗膜,加入辣根过氧化物酶(HRP)标记的相应二抗(1∶10 000,上海前尘生物科技有限公司),室温孵育2 h;ECL法显色,暗室中用X胶片感光、显影、定影。采用 Quantity-One软件分析蛋白条带平均光密度值。以GAPDH为内参照,目标蛋白与内参照平均光密度的比值代表目标蛋白的相对表达量 。
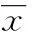
2结果
2.1各组大鼠血清HMGB1变化与C组相比,H、D及Y组大鼠血清HMGB1水平增加(P<0.05);与H组相比,D组大鼠血清HMGB1降低(P<0.05),而Y组大鼠血清HMGB1水平差异无统计学意义(P>0.05);与D组相比,Y组大鼠血清HMGB1水平升高(P<0.05),见图1。

图1 各组大鼠血清中HMGB1水平的比较

A:Western blot检测;B:PBMCs中HMGB1表达。
图2各组大鼠PBMCs中HMGB1表达的比较
2.2各组大鼠PBMCs中HMGB1水平的比较与C组相比,H、D和Y组大鼠PBMCs中HMGB1水平降低(P<0.05);与H组相比,D组大鼠PBMCs中HMGB1水平升高(P<0.05),而Y组大鼠血清HMGB1水平则差异无统计学意义(P>0.05);与D组相比,Y组大鼠PBMCs中HMGB1水平降低(P<0.05),见图2。
3讨论
热射病常以全身炎症反应(SIRS)及多器官功能障碍为特点,其许多后果是由于中性粒细胞和巨噬细胞产生过量细胞因子所致。HMGB1存在于几乎所有真核细胞内,在免疫炎症细胞内含量更多,在细胞内发挥多种生物学作用。在细胞外环境中HMGB1可以激活免疫系统,介导炎性反应,参与感染和非感染炎症[11]。细胞外的HMGB1来源于坏死细胞的释放及活化炎症细胞的分泌,HMGB1可以作用于炎症细胞表面的糖基化终产物受体(RAGE)、Toll样受体2(TLR2)、Toll样受体4(TLR4)、Toll样受体9(TLR9)等,令多种细胞的核因子κB(NF-κB)的移位,从而引起促炎细胞因子的分泌,引起炎性器官损伤[12-13]。Tong 等[5]研究表明,热射病患者在入院时血清HMGB1水平是健康志愿者的25倍,HMGB1可能在早期阶段释放入循环。PBMCs中包含单核细胞、淋巴细胞等免疫炎症细胞,本研究测定PBMCs中HMGB1来反应循环中炎症细胞内HMGB1改变。结果表明,热射病发生1 h后PBMCs中HMGB1水平降低,血清中HMGB1水平升高,这可能是由于热应激引起PBMCs中HMGB1释放至胞外,而自身HMGB1 mRNA及蛋白表达还没有相应增加所致。
多项研究表明,在动物脓毒血症、缺血再灌注及热射病模型中,抑制HMGB1可有效抑制炎症发展,阻断SIRS进展[14-17]。Gu等[8]研究表明,腹腔注射25 μg/kg右美托咪定可以降低肾脏缺血再灌注大鼠血清HMGB1水平,改善肾缺血再灌注损伤及远隔肺损伤。有体外研究表明临床相关剂量的右美托咪定可以抑制脂多糖诱导的巨噬细胞HMGB1的表达,其机制可能是通过NF-κB和α2受体途径[18]。此外,Kawasaki等[19]研究表明,右美托咪定在体外能够抑制脂多糖诱导的人全血细胞促炎介质的释放。本实验结果表明,热应激结束即刻给予右美托咪定能够降低热射病大鼠血清HMGB1水平,且D组大鼠PBMCs中HMGB1水平高于H病组。因此,右美托咪定能够降低血清HMGB1水平,改善炎性反应,这可能与其减少PBMCs释放 HMGB1相关,其具体作用机制并不清楚。
右美托咪定是一种高选择性α2受体激动剂,α2受体广泛存在于全身各组织器官,淋巴细胞和单核细胞等免疫炎症细胞也有α2受体表达,且α2受体参与抑制淋巴细胞细胞因子产生的调节[20-21]。育亨宾是一种α2受体阻滞剂,本实验予育亨宾拮抗右美托咪定的α2受体激动作用,以研究右美托咪定对热射病大鼠HMGB1影响是否通过α2受体介导。本研究表明,右美托咪定作为α2受体激动剂能够降低热射病大鼠血清HMGB1水平,抑制PBMCs中HMGB1由胞内至胞外的释放,而α2受体抑制剂育亨宾可以拮抗右美托咪定对热射病大鼠血清及PBMCs中HMGB1水平的影响。因此,右美托咪定降低热射病大鼠血清HMGB1水平,可能与其作用于PBMCs表面α2受体,抑制HMGB1的释放有关,但右美托咪定是否也通过作用于其他组织器官α2受体而抑制HMGB1释放有待进一步研究。
研究表明,低分子肝素钠[16]和高剂量抗凝血酶Ⅲ(ATⅢ)[17]提高热应激模型大鼠生存率,可能与多种炎性介质的调节相关,如肿瘤坏死因子α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素6 (IL-6)和HMGB1,但DA和ATⅢ可能活化抗凝系统,临床应用有很大风险。丁酸钠、氯喹抑制HMGB1信号通路,对脓毒症相关的多器官功能损害可能有保护效应,但对这些药物改善炎性反应方面的研究仍处于实验室阶段,临床效果并不清楚,且有多种不良反应。右美托咪定是一种临床常用镇静镇痛药,对呼吸及循环影响较小,且具有抗交感效应,本研究表明右美托咪定在镇静镇痛的同时还可降低血清HMGB1,改善炎性反应。因此,右美托咪定有镇静及抗炎双重作用,但其是否能够有效改善临床热射病患者的预后有待进一步研究。
综上所述,右美托咪定能够降低热射病大鼠血清HMGB1水平,其可能机制之一是激动PBMCs表面α2受体减少HMGB1的释放。因此,本研究认为右美托咪定可以通过减少炎症细胞HMGB1释放,改善热射病大鼠的炎性反应,可能对热射病有潜在的治疗效应,为右美托咪定更安全有效地应用于热射病患者的镇静、抗炎提供重要依据。
参考文献
[1]Leon LR,Bouchama A.Heat stroke[J].Compr Physiol,2015,5(2):611-647.
[2]Leon LR,Helwig BG.Heat stroke:role of the systemic inflammatory response[J].J Appl Physiol,2010,109(6):1980-1988.
[3]Andersson U,Tracey KJ.HMGB1 is a therapeutic target for sterile inflammation and infection[J].Annu Rev Immunol,2011,29:139-162.
[4]Dehbi M,Uzzaman T,Baturcam E,et al.Toll-like receptor 4 and high-mobility group box 1 are critical mediators of tissue injury and survival in a mouse model for heatstroke[J].PLoS One,2012,7(9):e44100.
[5]Tong HS,Tang YQ,Chen Y,et al.Early elevated HMGB1 level predicting the outcome in exertional heatstroke[J].J Trauma,2011,71(4):808-814.
[6]Hagiwara S,Iwasaka H,Goto K,et al.Recombinant thrombomodulin prevents heatstroke by inhibition of high-mobility group box 1 protein in sera of rats[J].Shock,2010,34(4):402-406.
[7]Pandharipande PP,Sanders RD,Girard TD,et al.Effect of dexmedetomidine versus lorazepam on outcome in patients with sepsis:an a priori-designed analysis of the MENDS randomized controlled trial[J].Crit Care,2010,14(2):R38.
[8]Gu J,Sun P,Zhao H,et al.Dexmedetomidine provides renoprotection against ischemia-reperfusion injury in mice[J].Crit Care,2011,15(3):R153.
[9]Xu L,Bao H,Si Y,et al.Effects of dexmedetomidine on early and late cytokines during polymicrobial sepsis in mice[J].Inflamm Res,2013,62(5):507-514.
[10]Chen GM,Xu HN,Gao LF,et al.Effects of continuous haemofiltration on serum enzyme concentrations,endotoxemia,homeostasis and survival in dogs with severe heat stroke[J].Resuscitation,2012,83(5):657-662.
[11]Klune JR,Dhupar R,Cardinal J,et al.HMGB1:endogenous danger signaling[J].Mol Med,2008,14(7/8):476-484.
[12]Bianchi ME,Manfredi AA.Immunology dangers in and out[J].Science,2009,323(5922):1683-1684.
[13]Mollnes TE.High mobility group box-1 protein:one step closer to the clinic?[J].Crit Care,2008,12(4):168.
[14]Gentile LF,Moldawer LL.HMGB1 as a therapeutic target for sepsis:it′s all in the timing! [J]Expert Opin Ther Targets,2014,18(3):243-245.
[15]Liu YT,Yang LQ,Tao KM,et al.Protective effects of Hydrogen enriched saline on liver ischemia reperfusion injury by reducing oxidative stress and HMGB1 release[J].BMC Gastroenterol,2014,14:12.
[16]Hagiwara S,Iwasaka H,Shingu C,et al.Danaparoid Sodium attenuates the effects of heat stress[J].J Surg Res,2011,171(2):762-768.
[17]Hagiwara S,Iwasaka H,Shingu C,et al.High-dose antithrombin Ⅲ prevents heat stroke by attenuating systemic inflammation in rats[J].Inflamm Res,2010,59(7):511-518.
[18]Chang Y,Huang X,Liu Z,et al.Dexmedetomidine inhibits the secretion of high mobility group box 1 from lipopolysaccharide-activated macrophages in vitro[J].J Surg Res,2013,181(2):308-314.
[19]Kawasaki T,Kawasaki C,Ueki M,et al.Dexmedetomidine suppresses proinflammatory mediator production in human whole blood in vitro[J].J Trauma Acute Care Surg,2013,74(5):1370-1375.
[20]Xiao J,Huang HW,Peng YP,et al.Modulation of natural killer cell function by alpha-adrenoreceptor-coupled signalling[J].Neuro Endocrinol Lett,2010,31(5):635-644.
[21]Bao JY,Huang Y,Wang F,et al.Expression of alpha-AR subtypes in T lymphocytes and role of the alpha-ARs in mediating modulation of T cell function[J].Neuroimmunomodulation,2007,14(6):344-353.
作者简介:王珊珊(1989-),住院医师,硕士,主要从事重要脏器损伤的保护研究。 △通讯作者,E-mail:yangxiaom2@hotmail.com。
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.15.009
[中图分类号]R594.1+1
[文献标识码]A
[文章编号]1671-8348(2016)15-2058-03
(收稿日期:2015-11-08修回日期:2016-01-15)
The impact of dexmedetomidine on the expression level of HMGB1 in the serum and PBMCs of heat stroke rats
Wang Shanshan,Yang Xiaoming△,Wang Tao
(DepartmentofAnesthesiology,ChinesePLAAirForceGeneralHospital,Beijing100142,China)
[Abstract]ObjectiveTo investigate the impact of dexmedetomidine on the levels of HMGB1 in the serum and PBMCs of heat stroke rats and explore the possible mechanism.MethodsThirty-two rats were divided into four groups (n=8):control group (group C),heat stroke model group (group H),dexmedetomidine group (group D) and yohimbine group (group Y).Anesthetized rats were subjected to heat stress(40.0±0.5) ℃ until the core temperature of the rats reached 42 ℃to induce heat stroke.The concentration of HMGB1 in the serum was measured by using ELISA kit at 1 h after the heat stress ending.Peripheral blood mononuclear cells (PBMCs) were extracted by using lymphocyte separation medium.The level of HMGB1 in the PBMCs was determined by western blot analysis.ResultsCompared with group C,the concentration of HMGB1 in the serum of rats in group H was increased significantly (P<0.05),and the level of HMGB1 in PBMCs was decreased (P<0.05);compared with group H,the concentration of HMGB1 in the serum of rats in group H was decreased significantly (P<0.05),and the level of HMGB1 in PBMCs was increased (P<0.05);compared with group D,the concentration of HMGB1 in the serum of rats in group Y was increased significantly (P<0.05),and the level of HMGB1 in PBMCs was decreased (P<0.05).ConclusionDexmedetomidine could decrease the level of HMGB1 in the serum of heat stroke rats,and the mechanism might be associated with interacting with the α2 receptor in the surface of PBMCs and reduced the release of HMGB1 from PBMCs.
[Key words]dexmedetomidine;heat stroke;HMGB1;PBMCs

