[Gly14]-Humanin减轻大鼠颅脑外伤后氧化应激及细胞凋亡☆
林正余智曾博尹康
[Gly14]-Humanin减轻大鼠颅脑外伤后氧化应激及细胞凋亡☆
林正*余智△曾博※尹康*
目的 探讨[Gly14]-Humanin(HNG)对大鼠颅脑外伤后脑组织超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)和细胞凋亡的影响。方法 135只SD大鼠分为空白组(n=45)、对照组(n=45)及HNG组(n=45),其中对照组及HNG组建立颅脑外伤模型后前者予右侧股静脉注射生理盐水2 mL/kg,后者则予HNG 2 μL/kg,此后各组每24 h予1次等量生理盐水/HNG,直至大鼠被处死;而空白组不予任何处理。根据处死时间随机分为1 h、3 d和7 d 共3个亚组,每亚组各15只。比较损伤灶周围脑组织MDA、SOD、GSH含量水平及细胞凋亡情况。结果 HNG组大鼠脑组织中MDA含量水平及凋亡细胞计数在损伤后1 h即升高,3 d达到最高值,后开始降低,但7 d时仍高于损伤后1 h水平,均显著低于同一时间点的对照组及空白组(P均<0.05);相反,SOD活性在损伤后迅速降低,3 d达到最低值,随后逐渐上升,但7 d时仍低于损伤后1 h水平,均显著高于同一时间点的对照组及空白组(P均<0.05);GSH变化规律与SOD基本一致,与各时间点的对照组比较亦有显著性(P均<0.05);HNG大鼠脑组织损伤后MDA含量水平与细胞凋亡数呈正相关(r=0.720,P<0.05),而SOD及GSH的含量与细胞凋亡数呈负相关(r=-0.702,P<0.05;r=-0.674,P<0.05)。结论 颅脑外伤后HNG抑制氧化应激反应,进一步减少细胞凋亡,从而发挥神经保护作用。
颅脑损伤 继发性脑损伤 [Gly14]-Humanin氧化应激 细胞凋亡
【Abstract】Objective To investigate the effects of[Gly14]-Humanin(HNG)on SOD,MDA,GSH and cell apoptosis in a rat model of secondary brain injury.Methods One hundred thirty-five adult and healthy male rats were randomly divided into 3 groups:sham model group(n=45),vehicle control group(n=45)and HNG group(n=45).Secondary brain injury was induced in the vehicle control and HNG groups using improved Feeney method.Vehicle control received abdominal injections of Sodium Chloride Injection(2 ml/kg)whereas the HNG group received abdominal injections of HNG(2 μL/kg)immediately and 24 h after injury.Each group was divided into three subgroups(n=15 rats per each group)by sacrificed time including 1 h,3 d,and 7 d after injury.The expression levels of SOD,MDA and GSH of the brain tissue were analyzed and the cell apoptosis was examined using TUNEL method after brain contusion.Results MDA and cell apoptosis around the lesion started to increased at 1h,reached a peak at 3d and then gradually subsided but still remained a higher level at 7 d than 1 h.HNG significantly attenuated brain injury-induced increase in MDA and apoptosis at all time points(P<0.05).By contrast,SOD started to decrease at 1h,reached the lowest point at 3 d and then gradu-ally recovered but still remained a lower level at 7 d than 1 h.HNG significantly mitigated brain injury-induced increase in MDA and apoptosis at all time points(P<0.05).The time course of GSH expression followed a pattern similar to that of MDA.MDA expression was strongly positive correlated with the number of cell apoptosis(r=0.720,P<0.05),strongly negative correlated with the level of SOD and GSH(r=-0.702,P<0.05;r=-0.674,P<0.05).Conclusions After brain injury,HNG inhibits oxidative stress levels and reduces apoptosis,thereby mitigating secondary brain injury.
【Key words】Traumatic brain injury Secondary brain injury[Gly14]-Humanin Oxidative stress Apoptosis
颅脑损伤(traumatic brain injury,TBI)的发病率呈现持续攀升的趋势[1],如何阻止颅脑损伤后继发性损伤是研究的热点。颅脑损伤机制十分复杂,其中氧化应激反应在其整个病理生理过程中发挥着枢纽性作用。低分子清除剂(如谷胱甘肽等)、酶清除剂(如超氧化合物歧化酶等)以及脂质过氧化的产物丙二醛(MDA)含量广泛用于衡量氧化应激水平,评估药物抗氧化应激的作用。既往有研究发现在机体中枢神经系统发育过程中,[Gly14]-Humanin(HNG)能抑制TBI诱导的细胞质膜完整性的破坏和自噬的激活[2],减少脑缺损体积,改善运动和记忆功能障碍,但目前具体保护机制尚未完全阐明。本研究采用改良Feeney法制备颅脑损伤模型,予以HNG干预后,观察损伤灶周围脑组织MDA、SOD及GSH含量,同时比较脑挫伤灶周围细胞凋亡情况,探讨颅脑损伤后HNG对继发性脑损伤的影响及可能机制,为进一步的临床应用提供理论依据。
1 材料和方法
1.1研究对象 清洁级SD雄性大鼠135只[浙江大学医学院动物实验中心提供,动物合格证号:SCXK(浙)2008-0033],体质量260~290 g,月龄4~5个月。SD大鼠室温,常规饲料、自由饮水。术前12 h禁食不禁水,以随机数字法分为空白组(n= 45)、对照组(n=45)及HNG组(n=45),再根据伤后处死时间随机分为1 h、3 d和7 d共3个亚组,每亚组各15只。试剂:HNG(Sigma公司,美国);超氧化物歧化酶(SOD)测试盒、丙二醛(MDA)测试盒及还原型谷胱甘肽(GSH)测试盒(武汉博士德);原位末端标记(TUNEL)试剂盒(Promega公司);电子显微镜(OLYMPUS,日本)等。
1.2动物模型制备及处置 空白组大鼠未给予任何外伤性干预,自由喂养;对照组及HNG组大鼠均采用改良的霍永强等[3]自由落体脑创伤模型制作闭合性颅脑损伤模型。模型成功标志[4]:存在不同程度的肢体抽搐、瞳孔改变及意识障碍,伤后各项反射消失并在30 min内恢复。待大鼠自然苏醒后对照组则经左侧股静脉注射生理盐水2 mL/kg,HNG组立即予以左侧股静脉注射HNG 2 μL/kg,以后每24 h左侧股静脉注射1次等量生理盐水/ HNG,直至动物被处死。3组共3只大鼠在击后10 min之内死亡,另随机抽取雄性SD大鼠补充。
1.3脑组织MDA含量、SOD水平及GSH含量水平测定 将-80℃冻存的距脑挫伤灶边缘约5 mm处脑皮质约(200±50)mg组织解冻后,严格按相关试剂盒检测要求进行操作。对照组中随机选取8只大鼠作相同处理。
1.4 TUNEL染色 取距脑挫伤灶后约5 mm厚的脑组织进行固定和石蜡包埋,获得的组织切片严格按照TUNEL染色试剂盒检测步骤进行操作。凋亡细胞(以胞核出现棕黄染色颗粒代表)计数:每只大鼠在伤侧皮质、海马随机选取5个高倍视野(×400),计数凋亡细胞数,以平均每100个细胞中含凋亡神经细胞数作为神经细胞凋亡指数。对照组中随机选取7只大鼠作相同处理。
1.5统计学分析 应用SPSS17.0进行统计处理。实验数据用±s表示。组内不同时间点比较采用重复测量方差分析(repeated measures-ANOVA);组间比较在单因素方差分析有意义的基础上采用多元方差分析进行两两比较;两变量之间相关关系采用Pearson相关分析,检测水准α=0.05。
2 结果
2.1颅脑损伤后损伤灶周围脑组织MDA、SOD及GSH的变化 3组MDA含量均在损伤后1 h即升高,3 d达到最高值,此后开始降低,但7 d时仍显著高于损伤后1 h水平(P均<0.05);相反,SOD及GSH活性在损伤后迅速降低(P均<0.05),3 d达到最低值,随后逐渐上升,但7 d时仍显著低于损伤后1 h水平;组内不同时间点比较经重复测量方差分析,协方差矩阵差异有统计学意义(F=1.614,P= 0.009)。3个时间点各指标分析,空白组、对照组与HNG组比较组间各指标均有差异,球形检验结果满足球形假设(0.191),方差分析差异有统计学意义(F=25.986,P<0.01),提示不同测量时间点之间有显著差异,组间比较差异有统计学意义(F= 8.831,P<0.01);而空白组和对照组间均无统计学差异(P均>0.05),见表1。
表1三组大鼠颅脑损伤后周围脑组织中各时间点MDA、SOD及GSH含量的比较(±s)
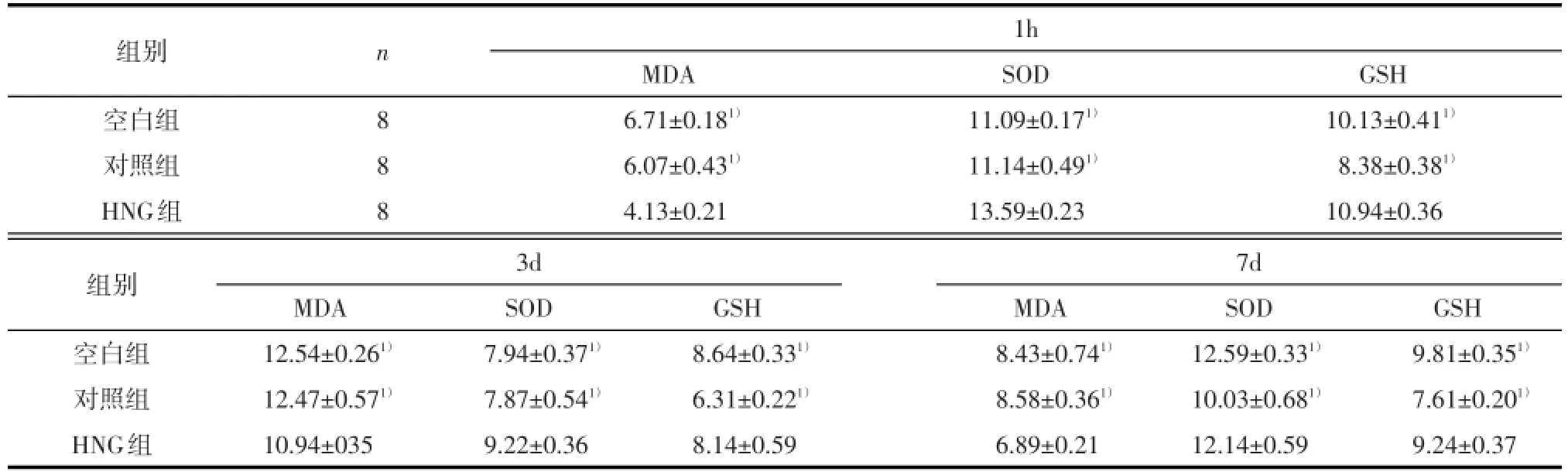
表1三组大鼠颅脑损伤后周围脑组织中各时间点MDA、SOD及GSH含量的比较(±s)
注:MDA单位为nmol/mg,SOD单位为U/mg,GSH单位为mg/g。1)采用多元方差分析,与HNG组比较,P<0.05
组别空白组对照组HNG组n 8 8 8 1h MDA 6.71±0.181)6.07±0.431)4.13±0.21 SOD 11.09±0.171)11.14±0.491)13.59±0.23 GSH 10.13±0.411)8.38±0.381)10.94±0.36组别空白组对照组HNG组3d 7d MDA 12.54±0.261)12.47±0.571)10.94±035 SOD 7.94±0.371)7.87±0.541)9.22±0.36 GSH 8.64±0.331)6.31±0.221)8.14±0.59 MDA 8.43±0.741)8.58±0.361)6.89±0.21 SOD 12.59±0.331)10.03±0.681)12.14±0.59 GSH 9.81±0.351)7.61±0.201)9.24±0.37
2.2颅脑损伤后脑组织细胞凋亡的变化 3组神经细胞凋亡数均在损伤后1 h即升高,3 d达到最高值,此后开始降低,但7 d时仍显著高于损伤后1 h水平;组内不同时间点比较经重复测量方差分析,协方差矩阵差异有统计学意义(F=1.376,P= 0.007)。3个时间点细胞凋亡指数分析,空白组、对照组与HNG组比较组间各指标均有差异,球形检验结果满足球形假设(0.163),方差分析差异有统计学意义(F=23.548,P<0.01),提示不同测量时间点之间有差异;组间比较差异有统计学意义(F= 7.973,P<0.01);而空白组和对照组间均无统计学差异(P均>0.05),见(图1及表2)。
2.3颅脑损伤后脑组织中MDA、SOD、GSH含量水平及细胞凋亡指数相关性分析 HNG大鼠脑组织损伤后MDA的含量与细胞凋亡指数呈正相关(r= 0.720,P<0.05),而SOD及GSH的含量与细胞凋亡指数呈负相关(r=-0.662,P<0.05;r=-0.674,P<0.05)。
3 讨论
目前TBI的发病率呈持续升高的趋势[5],造成劳动力的丧失并花费巨额的医疗资源,对家庭和社会造成巨大的影响。颅脑损伤后继发性脑损伤易导致颅内压的恶性上升[6],但其机制十分复杂,主要与氧自由基水平、细胞凋亡、炎症反应及坏死等紧密相关。因此,如何降低氧自由基水平,从而减少神经细胞的凋亡,减轻继发性脑损伤,是目前相关领域研究的热点和难点。脑外伤后4 h脑组织含水量开始升高,1 d达高峰,持续至3 d,5 d开始下降,7 d进一步降低。本研究结果同样发现颅脑损伤后两组大鼠脑组织氧化应激反应水平及凋亡细胞数较1 h即升高,3 d达到最高值,且差异有统计学意义(P均<0.05),与既往关于颅脑损伤机制研究结果相一致[7]。
氧化应激指标中,MDA是氧自由基水平的可靠指标,而SOD及GSH是机体抵抗氧化应激的能力及清除活性氧的重要指标[8]。研究发现HNG不仅能有效地抑制多种AD相关致病因子诱发的神经细胞和非神经细胞的死亡,还能保护各种应激对神经细胞和非神经细胞的损伤,包括I/R(hypoxia/reperfusion)诱导的鼠原代皮质神经元凋亡、LPS诱导的原代星形胶质细胞炎症反应[9]等。最近国外研究人员发现HNG通过糖原合成酶激酶-3β提供神经保护作用,其作用是通过抑制细胞凋亡相关PI3K-Akt/GSK-3β信号通路,并且发现HNG对Aβ-(25-35)诱导PC12细胞凋亡的影响[10-11]。
本研究发现,空白组及对照组大鼠脑组织中MDA含量在损伤后1 h即升高,3 d达到最高值,此后开始降低,但7 d时仍高于损伤后1 h水平,均显著高于同一时间点HNG组(P均<0.05)。相反,SOD活性在损伤后迅速降低,3 d达到最低值,随后逐渐上升,但7 d时仍低于损伤后1 h水平,均显著低于同一时间点HNG组(P均<0.05);GSH变化规律与SOD基本一致,与HNG组比较亦有显著性(P均<0.05)。说明氧自由基的产生及其酶清除活力的下降,导致脂质过氧化增强,在继发性脑损伤过程中起关键作用。
表2三组大鼠颅脑损伤后周围脑组织中各时间点细胞凋亡指数的比较(±s)

表2三组大鼠颅脑损伤后周围脑组织中各时间点细胞凋亡指数的比较(±s)
1)经多元方差分析,与HNG组比较,P<0.05
组别空白组对照组HNG组n 7 7 7细胞凋亡指数1h 14.73±1.291)15.15±1.831)11.47±1.31 3d 42.30±3.021)45.73±2.761)16.94±0.35 7d 28.60±3.441)27.58±0.681)21.20±2.17

图1 HNG组各时间点细胞凋亡(TUNEL染色×400),1 h时损伤灶周围组织少量细胞凋亡,3 d时凋亡细胞数最多,至7 d时有所降低,但仍高于同组损伤后1 h亚组
此外,细胞凋亡(Apoptosis)是细胞在体内外多种因素刺激诱导下,由多种基因调控的主动死亡过程。有研究人员证实,颅脑损伤后细胞凋亡广泛存在并参与了继发性脑损伤的发展过程[12]。本实验采用T'UNEL技术检测了神经细胞的凋亡情况,结果发现凋亡细胞主要位于损伤灶周围脑组织中(细胞核为棕褐色)。空白组及对照组存在较多凋亡细胞,损伤后1 h凋亡细胞数量较HNG组明显增多(P均<0.05),随后逐渐增多,并于损伤后3 d达到最高值,7 d时凋亡细胞有所降低,但仍高于损伤后1 h组,均显著高于同一时间点的HNG组(P均<0.05),故提示细胞凋亡参与了颅脑损伤后继发性脑损伤的发展过程。本研究还发现,颅脑损伤后脑组织MDA的含量与细胞凋亡数呈正相关,而SOD及GSH的含量与细胞凋亡数呈负相关,提示氧自由基的激活后促进凋亡相关基因的转录表达,从而导致细胞凋亡。
由此可见,HNG可通过降低损伤后的大鼠脑组织中MDA含量水平,升高SOD及GSH的含量水平,抑制氧化应激反应,减轻了大鼠颅脑损伤后继发性脑损伤,从而很好的减少细胞凋亡,为该药在颅脑损伤的治疗提供更为广阔的前景。
[1]PARK E,BELL JD,BAKER AJ.Traumatic brain injury:can the consequences be stopped?[J].CMAJ,2008,178(9):1163-1170.
[2]靳辉,胡海涛,王唯析.[Gyl14]-Humanin对Aβ_(25-35)诱导PC12细胞凋亡的影响[J].细胞与分子免疫学杂志,2010,11 (5):427-430.
[3]霍永强,谭源福.一种改进的落体脑创伤模型[J].广西医科大学学报,2007,24(2):217-219.
[4]KILBOURNE M,KUEHN R,TOSUN C,et al.Novel model of frontal impact closed head injury in the rat[J].J Neurotrauma,2009,26(12):2233-2243.
[5]PARK E,BELL JD,BAKER AJ.Traumatic brain injury:can the consequences be stopped?[J].CMAJ,2008,178(9):1163-1170.
[6]刘辉,杨树源,张建宁,等.神经干细胞移植对颅脑损伤大鼠脑皮层的神经保护作用[J].中国神经精神疾病杂志,2010,36(06):335-338.
[7]张毅,柏鲁宁,柯尊华,等.重型颅脑损伤患者术后脑积水形成相关因素分析[J].中国神经精神疾病杂志,2013,39(9):519-522.
[8]Grienberger HJ,Pillai DR,Schlachetzki F,et al.Detection of free radicals by isolated perfusion of the rat brain following hemorrhagic stroke:a novel approach to cerebrovascular biomarker research[J].Exp Brain Res,2010,206(3):311-317.
[9]JIN H,HU HT,WANG WX,et al.Effect of[Gly14]-Humanin on Abeta(25-35)-induced PC12 cell apoptosis[J].Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi,2010,26(11):427-430.
[10]ZHANG W,MIAO J,HAO J,et al.Protective effect of S14G-humanin against beta-amyloid induced LTP inhibition in mouse hippocampal slices[J].Peptides,2009,30(9):1197-1202.
[11]XU X,CHUA CC,GAO J,et al.Humanin is a novel neuroprotective agent against stroke[J].Stroke,2006,37(15):2613-2619.
[12]SOUSTIEL JF,PALZUR E,NEVO O,et al.Neuroprotective anti-apoptosis effect of estrogens in traumatic brain injury[J].J Neurotrauma,2005,22(3):345-352.
(责任编辑:甘章平)
[Gly14]-Humanin inhibits oxidative stress levels and controls apoptosis after traumatic brain injury in rats.
LIN Zheng,YU Zhi,ZENG Bo,YIN Kang.Department of Neurosurgery,the First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China.Tel:0577-55578166.
R651.1
A
10.3969/j.issn.1002-0152.2016.03.011
☆浙江省医药卫生科技计划项目(编号:201482575)
*浙江省温岭市第一人民医院神经外科(台州317500)
△浙江省淳安县第一人民医院神经内科
※温州医科大学附属第一医院神经外科
(E-mail:178485549@qq.com)
2015-07-20)

