新辅助放化疗联合手术治疗ⅠB2~ⅡA2期子宫颈癌临床预后因素分析
刘 健,崔艳艳,李胜泽,马 玲,李 群,李玉芝,郭苏阳,刘静波.蚌埠医学院第一附属医院妇瘤科,安徽 蚌埠 33004;. 怀远县第二人民医院妇产科,安徽 怀远 33400
新辅助放化疗联合手术治疗ⅠB2~ⅡA2期子宫颈癌临床预后因素分析
刘健1,崔艳艳2,李胜泽1,马玲1,李群1,李玉芝1,郭苏阳1,刘静波1
1.蚌埠医学院第一附属医院妇瘤科,安徽蚌埠233004;2. 怀远县第二人民医院妇产科,安徽怀远233400
[摘要]背景与目的:探讨ⅠB2~ⅡA2期子宫颈腺癌与腺鳞癌经新辅助放化疗联合手术治疗后的生存及复发情况,并分析其预后影响因素。方法:收集蚌埠医学院第一附属医院2005年4月—2011年10月50例ⅠB2~ⅡA2期患者的临床病理资料。患者均接受广泛全子宫切除+盆腔淋巴结清扫术,且术前均接受1次静脉化疗,宫颈肿瘤直径大于等于6cm,给予阴道腔内放疗1次。回顾分析患者的生存及复发情况,探讨其预后影响因素。结果:50例ⅠB2~ⅡA2期子宫颈腺癌和腺鳞癌患者中,随访期内死亡15例,2年和5年无进展生存率分别是80.12%和72.24%,中位无进展生存时间为68个月;2年和5年累积总生存率分别是95.38%和73.56%,中位总生存时间为80个月。单因素分析显示,盆腔淋巴结转移、宫颈间质浸润、宫旁浸润和新辅助放化疗后肿瘤最大直径缩短小于3cm的患者预后较差(P<0.05),而年龄、术后放化疗、淋巴管间隙受累分期、FIGO分期、是否保留卵巢和病理类型与预后无明显相关性(P>0.05)。多因素COX回归分析结果显示,盆腔淋巴结转移和放化疗后肿瘤直径缩小是宫颈腺癌和腺鳞癌的独立预后影响因素。结论:新辅助放化疗联合手术治疗提高了ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌手术切除率,而盆腔淋巴结转移及放化疗后宫颈肿瘤最大径消退程度是宫颈腺癌和腺鳞癌的独立预后因素。
[关键词]子宫颈癌;辅助放化疗;子宫切除术;预后
宫颈癌是严重威胁女性健康的常见恶性肿瘤,是世界范围内女性癌症死亡的第二大常见原因[1],位居全球常见恶性肿瘤的第5位。但是近年来宫颈腺癌和腺鳞癌的发病率却逐年上升,发病人群呈年轻化趋势[2],宫颈腺癌和腺鳞癌55岁以下人群的发病率由1985—1988年的8.9%上升到1977—2000年的20.9%,而宫颈腺癌的发病率则于1970—1996年之间增加了40%。Huang等[3]认为,生物学行为的差异导致宫颈腺癌和腺鳞癌总生存率均低于宫颈鳞癌。目前腺癌和腺鳞癌的治疗仍然存在争议,宫颈腺癌和腺鳞癌的综合治疗仍是妇科肿瘤研究的热点。ⅠB2~ⅡA2期宫颈癌是一组具有预后不良因素的高危型宫颈癌,此类宫颈癌由于宫颈肿瘤大,不易控制,具有发生淋巴结或远处转移的高危因素,5年生存率低,预后差[4]。美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)临床指南认为国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)临床分期的ⅠA2、ⅠB1和ⅡA1期的宫颈癌行宫颈癌根治术作为首选治疗[5]。相关文献报道同步放化疗指征已放宽到对于ⅠB2和ⅡA期的巨块型宫颈癌采用放射治疗作为首选治疗方案[6]。可见,放疗仍然是ⅠB2~ⅡA2期宫颈癌常规治疗模式。相关报道[3]认为腺癌对放射治疗的敏感性差,大量的临床实践认为放射治疗不能控制肿瘤周围的微转移灶及亚临床转移。放疗的远期并发症降低了患者的生存质量。10余年来宫颈腺癌和腺鳞癌的综合治疗及个体化治疗逐渐成为宫颈癌的主要治疗方法。本研究组对蚌埠医学院第一附属医院妇瘤科收治的新辅助放化疗联合手术治疗ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌50例患者的临床病理资料进行回顾性分析,探讨ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌患者的生存及复发情况,并分析其预后因素的影响,寻求最佳的综合治疗方案。
1 资料和方法
1.1资料来源
收集2005年4月—2011年10月蚌埠医学院第一附属医院收治的接受新辅助放化疗联合手术治疗的50例ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌患者的临床病理资料。所有患者经两位及两位以上肿瘤妇科高年资医师确定临床分期。所有患者病理切片经本院病理医师复片确诊为鳞癌、腺癌和腺鳞癌。确诊患者的中位年龄为49岁(29~66岁);临床分期按照国际妇产科联盟(FIGO)2009年的分期标准,其中ⅠB2期23例,ⅡA1期12例,ⅡA2期15例。病理类型腺癌32例,腺鳞癌18例;经影像学(MRI 或CT)检查,新辅助放化疗3周后肿瘤最大直径缩短大于等于3cm者33例,肿瘤最大直径消褪小于3cm者17例,其中7例患者达到完全缓解。50例ⅠB2~ⅡA2期子宫颈癌患者术前均接受1次静脉化疗,其中29例患者加腔内后装治疗1次。
1.2治疗
1.2.1手术治疗及术后病理情况
50例ⅠB2~ⅡA2期患者均接受宫颈癌根治术(PiverⅢ型全子宫切除+盆腔淋巴结清扫术),其中18例患者(年龄小于45岁,且是子宫颈鳞状细胞癌)保留了一侧或双侧卵巢(卵巢给予悬吊于同侧结肠旁沟),余32例患者术中行双附件切除。术后病理情况:间质浸润深度大于1/2的患者15例(30.00%),宫旁浸润的患者15例(30.00%),盆腔淋巴结转移的患者29例(58.00%);淋巴管间隙受累的患者19例(38.00%);保留附件的患者均未见转移,阴道残端未见肿瘤受侵。
1.2.2放化疗
紫杉醇联合铂类的新辅助化疗可提高巨块型宫颈癌患者的手术切除率,具有较肯定的近期疗效,不良反应轻,患者耐受性好[7]。但考虑多次放化疗后导致盆腔充血水肿,组织脆性增加,导致术中出血,手术时间延长。故50例ⅠB2~ⅡA2期宫颈癌患者术前均接受了新辅助化疗1次,方案统一为紫杉醇联合顺铂,其中29例ⅠB2~ⅡA2期子宫颈癌患者由于子宫颈肿瘤直径大于等于6cm,给予阴道腔内放疗1次(阴道2.0cm两球A点6Gy)。术前疗效评价,根据术前临床分期,接受新辅助放化疗的患者3周后通过妇科检查,影像学检查(MRI或CT),由资深技师测量肿瘤最大直径,肿瘤最大直径消褪大于等于3cm者33例,肿瘤最大直径消褪小于3cm者17例,其中7例患者达到完全缓解(表1)。具有高危因素的29例患者接受同步放化疗或单纯静脉化疗,高危因素包括盆腔淋巴结阳性、宫颈深层间质浸润、宫旁切缘阳性、阴道切缘阳性和淋巴管间隙受累等[8]。其中的27例患者由于具有两种或两种以上高危因素行同步放化疗。2例ⅡA1患者由于原发病灶大经新辅助放化疗后肿瘤消褪小于2cm,但无其他高危因素存在,术后给予单纯静脉化疗。其余21例患者术前经新辅助放化疗后肿瘤消褪明显。而盆腔淋巴结及阴道切缘均阴性,且患者随访条件好,术后没有行辅助治疗,密切随访。

表1 术前新辅助化疗组与新辅助放化疗组治疗前后肿瘤直径变化比较Tab.1 The comparison of before and after treatment of tumor diameter changes between preoperative neoadjuvant chemotherapy and neoadjuvant chemoradiotherapy group
1.3随访
50例ⅠB2~ⅡA2期患者均以治疗时间为起点进行随访。动态了解肿瘤的进展情况,从开始治疗初始至患者死于该肿瘤的时间为总生存时间。常规随诊内容:
①妇科检查:治疗结束后半年内每1~2个月检查1次,半年至1年内每2~3个月检查1次,2年内每3~4个月检查1次,2~3年内每4~6个月检查1次,3~5年内每6~12个月检查1次;②阴道脱落细胞学检查:治疗后每6~12个月检查1次,发现可疑情况时行组织病理检查并及时进行复诊;③子宫颈鳞状细胞抗原(SCC-Ag)水平检测;④影像学检查:当妇科检查或血清SCC-Ag水平检测发现可疑情况时行胸部X线摄片,彩超、MRI或正电子发射体层摄影术PET/CT检查。对没有来院进行复诊的患者采用电话随访。随访截止时间为2015年1月,中位随访时间为20个月(12~86个月),无失访者。
1.4统计学处理
采用SPSS16.0软件进行统计学分析。生存分析采用Kaplan-Meier方法,率之间的比较采用χ2检验。为了解变量的独立性预后价值,将单因素分析有统计学意义的指标进行多因素COX回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1术前肿瘤直径变化
两组治疗前后肿瘤直径变化情况见表1。结果显示,与治疗前比较,两组肿瘤直径变化差异均有统计学意义(P<0.01)。
2.2ⅠB2~ⅡA2期患者的生存及复发情况
50例ⅠB2~ⅡA2期患者中,在5年随访期内,21例术后没有辅助放化疗的患者14例无进展生存,7例复发,复发的患者中3例被控制,4例死亡。29例术后辅助放化疗的患者中,17例无进展生存,12例复发,复发的患者中9例死亡,3例被控制。整个随访期内15例患者死亡。ⅠB2~ⅡA2期患者的2年和5年累计无进展生存率分别为80.12%和72.24%。中位无进展生存时间为68个月。2年和5年累计总生存率分别为95.38%和73.56%,中位总生存时间为80个月。
随访期内19例患者出现复发转移,中位复发转移时间为9个月(3~30个月)。复发转移部位:盆腔复发11例,骨转移1例,肝转移1例,肺转移2例,脑转移1例,盆腔淋巴结转移3例。其中3例患者出现多发性转移(转移部位大于2个)。19例复发的患者中15例死亡,4例患者带瘤生存。
2.3影响ⅠB2~ⅡA2期巨块型宫颈癌患者预后的单因素分析
单因素生存分析显示,盆腔淋巴结转移、宫颈间质浸润、宫旁浸润和新辅助放化疗后3周子宫颈肿瘤经影像学检测肿瘤最大直径消褪小于3cm的患者预后较差(P<0.05)。术后辅以放化疗并未提高患者的生存率(P>0.05)。而年龄、术后放化疗、间质浸润深度、淋巴管间隙受累、FIGO分期、术中是否保留卵巢和局部晚期宫颈癌的病理类型等与患者的预后无关(P>0.05,表2)。
2.4多因素COX回归分析
多因素COX回归分析结果显示,盆腔淋巴结转移和放化疗后肿瘤直径缩小是宫颈癌的独立预后影响因素(表3)。
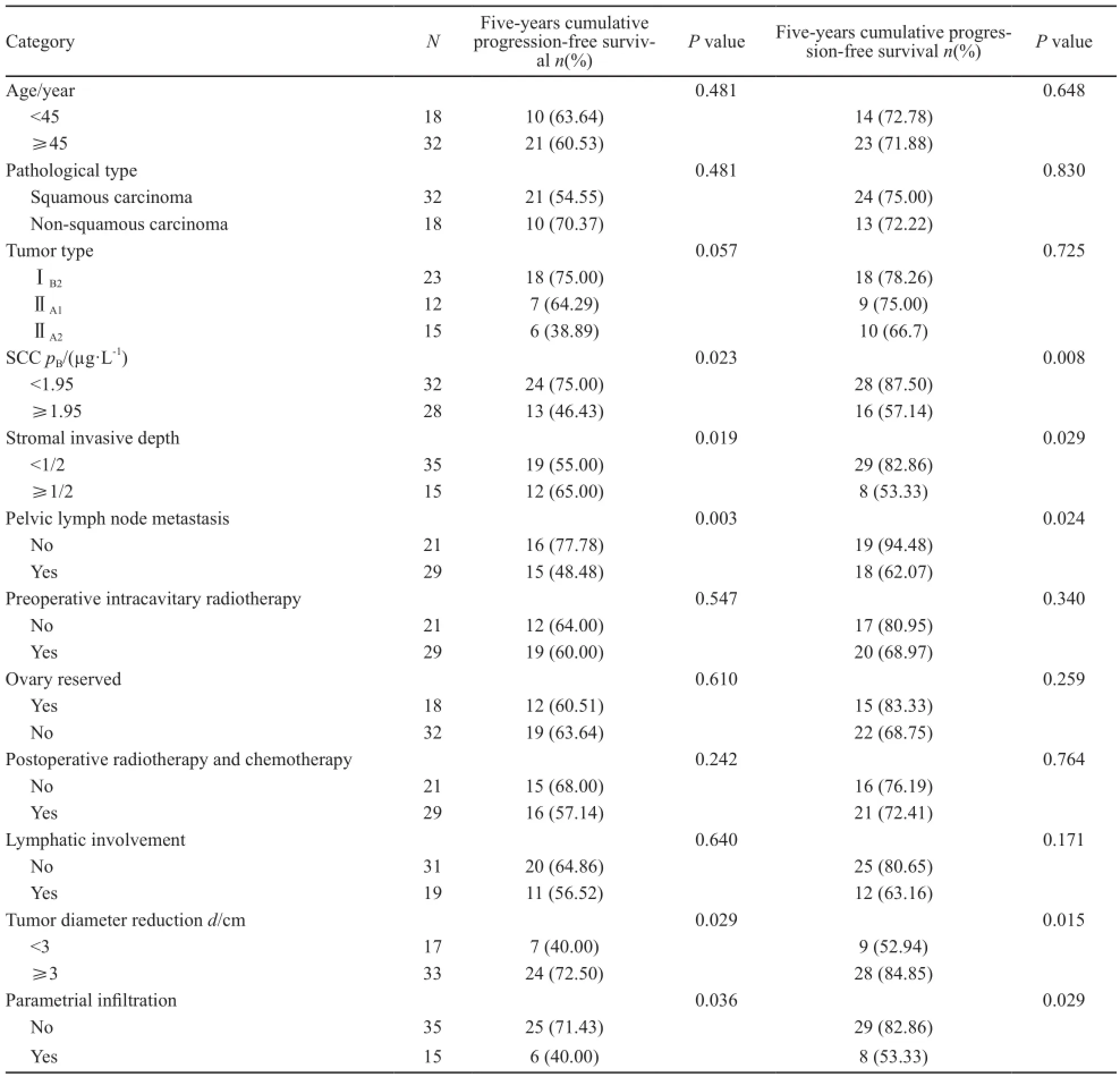
表2 ⅠB2~ⅡA2期宫颈癌患者预后的单因素分析Tab.2 Univariate analysis of the prognosis of ⅠB2-ⅡA2 cervical adenosquamous carcinoma

表3 ⅠB2~ⅡA2期宫颈腺鳞癌患者预后的多因素COX回归分析Tab.3 Multivariate analysis of the prognosis in patients with ⅠB2-ⅡA2 cervical adenosquamous carcinoma
3 讨 论
ⅠB2~ⅡA2期子宫颈癌,由于肿瘤体积大、手术切除困难、术后并发症多、易复发转移、生存质量差,一直是妇科肿瘤治疗的难点。ⅠB2~ⅡA2期子宫颈癌术后首选的辅助治疗方式是放疗或同步放化疗。Yessaian等[9]的一项研究结果显示,约10%的ⅠB2期宫颈癌行宫颈癌根治术作为独立的治疗手段。Okame等报道[10]认为,ⅠB2~ⅡB期宫颈腺癌根治性子宫切除术比放射性治疗有明显的优越性,根治性手术可提高患者的生存率和局部控制率。根治性子宫切除术,保护了卵巢功能,避免了放疗引起的相关并发症,并取得很好的预和提高了及生存质量。而具有高危因素的宫颈癌患者行根治性子宫切除术后要辅以放疗。辅助治疗可导致下肢淋巴水肿、盆腔淋巴囊肿、放射性膀胱炎及直肠炎和卵巢功能的损害等并发症,患者术后生存质量下降[11-12]。相关文献报道,淋巴水肿的发生率为11.4%~20.0%[11-14]。本研究组中,4例患者出现淋巴水肿,3例患者出现盆腔淋巴囊肿经B超引导下穿刺好转,1例患者出现放射性膀胱炎,生活质量下降,其余患者无综合治疗后引起的并发症。Jeusen等[15]的研究则表明,经根治性放射治疗的宫颈癌,2年后85%的患者无性欲,55%的患者出现性交痛。本研究组21例术后没有辅助治疗的患者14例无进展生存,7例复发,3例被控制,4例死亡,其5年生存率为80.95%,生存的患者无术后放化疗带来的并发症,提高了生存质量,为我们研究个体化治疗提供了理论基础。因此,寻找ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌的独立预后因素制定最佳治疗方案,以提高患者生存率及生活质量一直是妇科肿瘤研究的难点。
根治性子宫切除术需要辅助治疗的适应证,主要限于具有高危病理因素的患者包括盆腔淋巴结阳性、宫颈深层间质浸润、宫旁浸润和手术切缘阳性。该研究组没有因切缘阳性而行辅助治疗的患者。50例患者行新辅助放化疗后行宫颈癌根治术,21例患者没有给予术后辅助治疗,7例复发,其中3例患者病情控制稳定,4例患者因出现复发、转移而死亡。因此,本研究显示,新辅助放化疗后行宫颈癌根治术治愈了34.00%的ⅠB2~ⅡA2期的子宫颈癌患者,对于没有高危病理因素的ⅠB2~ⅡA2期子宫颈癌新辅助放化疗后行宫颈癌根治术是可以选择的综合治疗方式。
同步放化疗是治疗局部晚期宫颈癌的常用方法[16]。同步放化疗的适用范围已放宽到对于ⅠB2和ⅡA期的巨块型宫颈癌[6]。按照FIGO临床分期ⅠB2~ⅡB期宫颈癌5年生存率报道,接受化疗的5年生存率分别为:ⅠB2期66.9%,ⅡA期70.6%,ⅡB期70.5%[17]。这些生存数据包括不是巨块型的ⅡA1期及ⅡB宫颈癌。本研究组中ⅠB2和ⅡA期宫颈癌的5年生存率较报道中的5年生存率要高。行宫颈癌根治术后并辅以放化疗的患者5年生存率则分别为:ⅠB2期77.2%,ⅡA期78.8%,ⅡB期70.8%[17]。文献报道的ⅠB2和ⅡA期的5年生存率与本研究组得到的5年生存率是相似的。本研究中,有34.00%的ⅠB2~ⅡA2期的子宫颈癌术后没有行辅助治疗而取得80.95%的5年生存率。新辅助放化疗后可以有效地缩小肿瘤体积为手术创造了条件,改善预后,提高患者生存率及生存质量。进一步说明对于ⅠB2~ⅡA2期的子宫颈癌,新辅助放化疗后行宫颈癌根治术,没有高危因素的患者不需要辅助放化疗,避免了治疗过度,对于有高危因素的患者术后辅助放化疗是一种行之有效的综合治疗手段。
宫旁浸润作为评估宫颈癌预后的一个独立的因素[18]。报道认为,新辅助化疗是安全有效的,能缩小肿块,使宫旁浸润变软,提高手术切除率[19-23]。本研究组中15例ⅡA2期子宫颈癌有10例(66.7%)在行新辅助放化疗后阴道壁肿瘤消褪,宫旁变软,宽度增加,临床分期降低。15例患者中有6例患者在根治术后没有复发而存活。9例复发的患者中有5例死亡。本研究显示,新辅助放化疗后肿瘤消褪明显的患者预后较好。相关文献报道[22],宫颈深层间质浸润作为评估宫颈癌患者术后复发转移及预后的因素,而术前化疗可以降低转移发生的概率。而多因素分析没有显示宫旁浸润及宫颈深层间质浸润在ⅠB2~ⅡA2期巨块型宫颈癌作为一个独立的预后因素。因此,对于ⅡA2期巨块型宫颈癌经新辅助放化疗后宫旁间隙变宽,宫颈及阴道壁肿瘤消褪的患者而行宫颈癌根治术是一种行之有效的治疗手段。
淋巴结转移是评估宫颈癌预后最重要的一个独立预后因素[18]。报道称新辅助放化疗可减少淋巴结的阳性率,减少宫颈癌术后的病理高危因素[19-20]。该研究组中,ⅠB2期淋巴结的转移率为39.1%(9/23),ⅡA1期为33.33%(4/12),ⅡA2期为440.0%(6/15)。50例患者行宫颈癌根治术,5年随访间,10例患者死于宫颈癌,3例患者死于宫颈癌术后复发转移,10例患者中8例患者淋巴结转移,5例因复发死亡的患者中全部有淋巴结转移。本研究组认为,淋巴结阳性是很难控制的全身性的转移。多因素分析显示,淋巴结转移是评估ⅠB2~ⅡA2期的子宫颈癌预后最重要的一个独立预后因素。中位无进展生存期为191d。淋巴结阳性的患者经辅助治疗后多在1年内复发,目前还没有找到有效的治疗方案。因此,本研究组继续扩大样本量对ⅠB2~ⅡA2期宫颈癌综合治疗进一步研究,以明确淋巴结转移对预后的临床指导意义。
Biewenga等[22]认为,肿瘤直径大小对宫颈癌生存率的影响可作为独立的预后影响因素。本研究组单因素分析结果显示,新辅助放化疗后3周,子宫颈肿瘤最大直径缩小大于等于3cm和子宫颈肿瘤最大直径缩小小于3cm者其5年总生存率为84.85%和52.94%(P<0.05),提示对放化疗不敏感的ⅠB2~ⅡA2期子宫颈癌预后差。本研究组多因素分析结果提示,放化疗后肿瘤直径的缩小是宫颈癌独立预后因素,为我们研究综合治疗ⅠB2~ⅡA2期宫颈癌提供了方向。但如何提高ⅠB2~ⅡA2期宫颈癌患者的生存率及生存质量仍是临床急需解决的难题。
总之,ⅠB2~ⅡA2期子宫颈腺癌和腺鳞癌患者预后差,ⅠB2~ⅡA2期子宫颈腺癌和腺鳞癌最佳治疗方法尚存在争议,文献报道不一。为了避免治疗过度,提高患者的生存率及生存质量,本研究组继续对ⅠB2~ⅡA2期宫颈腺癌和腺鳞癌进行大样本随机对照实验,探索出一条行之有效的治疗ⅠB2~ⅡA2期子宫颈癌的综合治疗方案,以提高患者生存率,改善生活质量。
[参考文献]
[1]SIEGEL R, NAISHADHAM D, JEMAL A. Cancer statistics,2013[J]. CA Cancer J Clin, 2013, 63(1): 11-30.
[2]PIMENTA J M, GALINDO C, JENKINS D, et al. Estimate of the global burden of cervical adenocarcinoma and potential impact of prophylactic human papillomavirus vaccination [J]. BMC Cancer, 2013(1): 1-12.
[3]HUANG Y T, WANG C C, TSAI C S, et al. Clinical behaviors and outcomes for adenocarcinoma or adenosquamous carcinoma of cervix treated by radical hysterectomy and adjuvant radiotherapy or chemoradiotherapy[J]. Int J Radiat Oncol Biol Phys, 2012, 84(2): 420-427.
[4]OHARAK K, SUGAHARA S, KAGEIK K, et al. Retrospective comparison of clinical outcome between radiotherapy alone and surgery plus postoperative radiotherapy in the treatment of stages ⅠB-ⅡBcervical squamous cell carcinoma[J]. Radiat Med, 2004, 22(1): 42-48.
[5]NCCN Clinical Practice Guidelines in Oncology-cervical cancer v.1 (2011) National Comprehensive Cancer Network (http://www.nccn.org/professionalsphysician_gls/f_guidelines. asp).
[6]MONK B J, TEWARI K S, KOH W J. Multimodality therapy for locally advanced cervical carcinoma: state of the art and future directions[J]. J Clin Oncol, 2007, 25(20): 2952-2965.
[7]张蓉, 李斌, 白萍, 等. 紫杉醇联合铂类在局部晚期宫颈癌新辅助化疗中的应用[J]. 中华肿瘤杂志, 2011,33(8): 616-620.
[8]SHIMADA M, KIGAWA J, TAKAHASHI M, et al. Stromal invasion of the cervix can be excluded from the criteria for using adjuvant radiotherapy following radical surgery for patients with cervical cancer[J]. Gynecol Oncol, 2004,93(3): 628-631.
[9]YESSAIAN A, MAGISTRIS A, BURGER R A, et al. Radical hysterectomy followed by tailored postoperative therapy in the treatment of stage ⅠB2cervical cancer: feasibility and indications for adjuvant therapy[J]. Gynecol Oncol, 2004,94(1): 61-66.
[10]OKAME S, KOJJMA A, TERAMOTO N, et al. Type C2 radical hysterectomy may improve outcomes of locally advanced mucinous adenocarcinoma of the uterine cervix [J]. Int J Clin Oncol, 2015 Dec 22. [Epub ahead of print]
[11]OHBA Y, TODO Y, KOBAYASHI N, et al. Risk factors for lower-limb lymphedema after surgery for cervical cancer [J]. Int J Clin Oncol, 2011, 16(3): 238-243.
[12]TADA H, TERAMUKAI S, FUKUSHIMA M, et al. Risk factors for lower-limb lymphedema after lymph node dissection in patients with ovarian and uterine carcinoma [J]. BMC Cancer, 2009, 9: 47. doi: 10.1186/1471-2407-9-47.
[13]ACHOURI A, HUCHON C, BATS A S, et al. Complication of lymphadenectomy for gynecologic cancer[J]. Eur J Surg Oncol, 2013, 39(1): 81-86.
[14]KIM J H, CHOI J H, KI E Y, et al. Incidence and risk factors of lower-extremity lymphedema after radical surgery with or without adjuvant radiotherapy in patients with FIGO stage Ⅰto stage ⅡAcervical cancer[J]. Int J Gynecol Cancer, 2012,22(4): 686-691.
[15]JEUSEN P T, GROENVOLD M, KLEE M C, et al. Longitudinal study of sexual function and vaginal changes after radiotherapy for cervical cancer[J]. Int J Radiat Oncol Biol Phys, 2003, 56(4): 937-949.
[16]ROSE P G. Chemoradiotherapy: the new standard care for invasive cervical cancer[J]. Drugs, 2000, 60(6): 1239-1244.
[17]QUINN M A, BENEDET J L, ODICINO F, et al. Carcinoma of the cervix uteri. FIGO 26thAnnual Report on the Results of Treatment in Gynecological Cancer[J]. Int J Gynecol Obstet, 2006, 95(Suppl 1): 43-103.
[18]MONK B J, WANG J, IM S, et al. Rethinking the use of radiation and chemotherapy after radical hysterectomy: a clinical pathologic analysis of a Gynecologic Oncology Group/ Southwest Oncology Group/Radiation Therapy Oncology Group trial[J]. Gynecol Oncol, 2005, 96(3): 721-728.
[19]RYDZEWSKA L, TIERNEY J, VALE C L, et al. Neoadjuvant chemotherapy plus surgery versus surgery for cervical cancer [J]. Cochrane Database Syst Rev, 2010, 20(1): CD007406.
[20]韩娜娜, 邵文裕, 刘开江, 等.ⅠB2期巨块型宫颈癌术前不同治疗方法的疗效观察[J]. 中国癌症杂志, 2015, 25(1):56-59.
[21]王平, 彭芝兰, 张家文, 等. 子宫颈癌新辅助化疗中不同化疗途径的疗效比较[J]. 中华妇产科杂志, 2005, 40(4):227-230.
[22]BIEWENGA P, VAN DER VELDEN J, MOL B W, et al. Prognostic model for survival in patients with early stage cervical cancer[J]. Cancer, 2011, 117(4): 768-776.
DOI:10.3969/j.issn.1007-3969.2016.05.013
中图分类号:R737.33
文献标志码:A
文章编号:1007-3639(2016)05-0427-07
收稿日期:(2015-10-11修回日期:2016-03-01)
基金项目:安徽省自然科学基金(KJ2015B0966Y)。通信作者:刘健E-mail:Elitelj@126.com
Analysis of prognostic factors in patients with stage ⅠB2-ⅡA2 uterine cervical cancer treated witha combintion of neoadjuvant chemotherapy and surgery
LIU Jian1, CUI Yanyan2, LI Shengze1, MA Ling1, LI Qun1, LI Yuzhi1, GUO Suyang1, LIU Jingbo1
(1. Department of Gynecological Oncology, the First Affiliated Hospital of Bengbu Medical College, Bengbu 233004, Anhui Province, China; 2. Department of Gynecology and Obstetrics, the Second People's Hospital of Huaiyuan County, Huaiyuan 233400, Anhui Province, China)
Correspondence to: LIU Jian E-mail: Elitelj@126.com
[Abstract]Background and purpose: The aim of this study was to analyze the prognostic factors in uterine adenocarcinoma and adenosquamous carcinoma treated with a combination of neoadjuvant chemoradiotherapy and surgery. Methods: Clinicopathologic data from 50 patients with stageⅠB2-ⅡA2uterine cervical cancer were collected from the First Affiliated Hospital of Bengbu Medical College between Apr. 2005 and Oct. 2011. All patients underwent neoajuvant chemoradiotherapy, followed by radical hysterectomy and pelvic lymph node dissection. Before surgery,an intravenous chemotherapy was given. A particular vaginal brachytherapy was given to those with tumor diameter ≥6 cm. The survival and recurrence in patients were analyzed retrospectively to investigate the prognostic factors. Results: In 50 patients with ⅠB2-ⅡA2uterine adenocarcinoma and adenosquamous carcinoma, 15 died during the follow-up period. The 2-year and 5-year progression-free survival rates were 80.12% and 72.24%, respectively, and median progression-free survival was 68 months. The 2-year and 5-year overall survival rates were 95.38% and 73.56%, respectively, and median overall survival was 80 months. Univariate analysis revealed that pelvic lymph nodemetastasis, cervical stromal invasion, parametrial infiltration, tumor diameter reduction <3 cm and advanced stage were the prognostic factors in patients with cervical cancer (P<0.05). Age, postoperative radiochemotherapy, lymphatic clearance involvement, FIGO stage, preservation of ovary and pathologic type were not associated with prognosis (P>0.05). Multivariate Cox proportional analysis revealed that pelvic lymph node metastasis and tumor diameter reduction after radiation and chemotherapy were the independent prognostic factors in patients with cervical cancer. Conclusion: The combination of neoadjuvant chemotherapy and surgery improves the resectable rate of patients with ⅠB2-ⅡA2uterine adenocarcinoma and adenosquamous carcinoma. Pelvic lymph node metastasis and tumor diameter reduction after radiation and chemotherapy are the independent prognostic factors in patients with cervical cancer.
[Key words]Cervical cancer; Neoadjuvant chemotherapy; Hysterectomy; Prognosis

