恶性黑素瘤患者KIT基因突变分析
吕矫洁,孔蕴毅,蔡 旭,周晓燕复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032
恶性黑素瘤患者KIT基因突变分析
吕矫洁,孔蕴毅,蔡旭,周晓燕
复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海200032
[摘要]背景与目的:KIT基因突变在恶性黑素瘤的发生、发展中发挥了重要作用。该研究旨在探讨KIT基因在各种组织学类型恶性黑素瘤患者中的突变率和类型。方法:用聚合酶链反应(polymerase chain reaction,PCR)扩增和直接测序方法检测144例恶性黑素瘤患者肿瘤组织中KIT外显子9、11、13和17的突变情况。结果:KIT基因在恶性黑素瘤患者中的总体突变率为9.0%(13/144)。在肢端型、黏膜型、慢性日光损伤型(chronic sun-induced damage,CSD)和非慢性日光损伤型(non-chronic sun-induced damage,non-CSD)恶性黑素瘤组织中,KIT基因的突变率分别为7.7%(4/52)、20.0%(7/35)、14.3%(1/7)和2.8%(1/36);13例KIT基因突变中,有1例位于第9外显子,9例位于第11外显子,3例位于第13外显子。第11外显子L576P为最常见的突变类型。结论:KIT基因突变在恶性黑素瘤患者中最常见于第11外显子,它可能是恶性黑素瘤治疗药物作用的潜在靶点。
[关键词]KIT;基因突变;恶性黑素瘤
恶性黑素瘤是皮肤最常见的致命恶性肿瘤,其发病率在过去的几十年中增长迅速[1]。基于其解剖学位置和阳光照射的程度,恶性黑素瘤分为4个亚型:肢端型、黏膜型、慢性日光损伤型(chronic sun-induced damage,CSD)和非慢性日光损伤型(non-chronic sun-induced damage,non-CSD)[2]。肢端恶性黑素瘤是皮肤恶性黑素瘤一种独特类型,见于无毛发被覆部位的肢端皮肤,即手掌、足底和甲床。它在白色人种中,仅占所有皮肤恶性黑素瘤的1%~7%,然而它在黑色皮肤人种和亚洲黄色人种中最为普遍[3]。Chi等[4]统计的数据显示,肢端恶性黑素瘤是中国人最常见的类型,约占所有恶性黑素瘤的41.8%,而黏膜恶性黑素瘤占第2位,为22.6%。
与皮肤受紫外线暴露导致的恶性黑素瘤不同,肢端恶性黑素瘤和黏膜恶性黑素瘤的BRAF的突变率较低,却更容易发生KIT的突变[5]。KIT(CD117)是干细胞因子编码酪氨酸激酶受体,在黑素细胞的发展、转移和增殖中起重要作用[6]。它是数个小分子抑制剂如伊马替尼、舒尼替尼的作用靶点,这些药物已经用于临床,并且能明显提高具有KIT基因突变的胃肠道间质瘤患者的生存率。有研究表明,伊马替尼显著延长了在转移性恶性黑素瘤中表达KIT基因突变患者的生存期[7]。然而,关于KIT在各类型恶性黑素瘤中的基因突变的大规模研究很少,因此,本研究收集了复旦大学附属肿瘤医院收治的144例恶性黑素瘤患者的组织标本,进行了KIT基因突变检测,以期发现其与西方白种人所存在的差异。
1 资料和方法
1.1研究对象
收集复旦大学附属肿瘤医院2009—2014年间住院和门诊恶性黑素瘤患者的病灶组织蜡块144例,均经HE染色和病理诊断证实。144例患者分别为肢端型、黏膜型、CSD和non-CSD恶性黑素瘤52、35、7和36例,其余14例为原发灶不明确无法分类者。
1.2基因突变的筛查
参照文献[8],按照试剂盒说明书提取基因组DNA(QIAamp DNA mini kit),采用直接测序方法检测KIT基因第9、11、13和17外显子突变情况,引物序列及退火温度见表1。反应条件为:94℃反应7min;94℃反应30s;每种引物在其相关的退火温度下进行30s;在72℃30s中进行35个周期;72℃5min。聚合酶链反应(polymerase chain reaction,PCR)产物通过2%琼脂糖凝胶电泳鉴定并用PCR纯化试剂盒(QIA quick PCR purification kit)纯化后,所有纯化产物均在ABI3730XL测序仪上行双向测序验证。所有阳性标本需经2次独立实验重复证实。

表1 用于测序的引物Tab.1 The primers used for sequencing
2 结 果
2.1144例恶性黑素瘤患者中各组织学类型KIT基因突变率(表2)
KIT基因在144例恶性黑素瘤患者中总体突变率为9.0%。其在肢端型、黏膜型、CSD和non-CSD恶性黑素瘤中突变率分别为7.7%(4/52)、20.0%(7/35)、14.3%(1/7)和2.8%(1/36)。在肢端型,KIT基因在第11、13外显子突变率分别为75.0%(3/4)和25.0%(1/4)。而在黏膜型,KIT基因在第9、11和13外显子突变率为14.3%(1/7)、71.4%(5/7)和14.3%(1/7)。在CSD和non-CSD恶性黑素瘤中,各有1例突变,分别位于第11外显子和第13外显子。在所有KIT基因突变中,无一例位于第17外显子。
2.2KIT基因突变类型
检测到的13例基因突变中,1例突变位于KIT基因第9外显子,为鸟嘌呤(G)-腺嘌呤(A)的突变,密码子GTT变为ATT,为V489I突变,使得缬氨酸被异亮氨酸取代。9例突变位于KIT基因第11外显子,其中L576P(图1)共3例,为胸腺嘧啶(T)-胞嘧啶(C)的突变,密码子CTT突变为CCT,该突变导致膜旁结构域第576位亮氨酸被脯氨酸取代;V559G(图2)和V559D(图3)各1例:V559G为胸腺嘧啶(T)-鸟嘌呤(G)的突变,密码子GTT突为GGT,使缬氨酸被甘氨酸取代;V559D为胸腺嘧啶(T)-腺嘌呤(A)的突变,密码子GTT突变为GAT,使缬氨酸被天冬氨酸取代;其余4例分别为587密码子AAC>AAT(同义)且587-588密码子间插入CAC AAA TGG GAG TTT CCC AGA,可导致形成587-588insHKWEFPR;578-579密码子间插入GTT CCT TAT,可导致578-579insVPY;580-581密码子间插入27个碱基,可导致形成580-581insNPTQLPYDH;557-559密码子杂合性缺失并插入TTT,可导致形成557-559delWKVinsF。3例突变位于KIT基因第13外显子,其中2例为K642E(图4),为腺嘌呤(A)-鸟嘌呤(G)的突变,密码子AAA突变为GAA,使赖氨酸被谷氨酸取代;1例为T632I,为胞嘧啶(C)-胸腺嘧啶(T)的突变,密码子ACA突变为ATA,使苏氨酸被异亮氨酸取代。

表2 各组织学类型中KIT基因突变Tab.2 Genetic mutations of KIT in melanoma subtypes

图1 L576P突变Fig.1 L576P mutation

图2 V559G突变Fig.2 V559G mutation
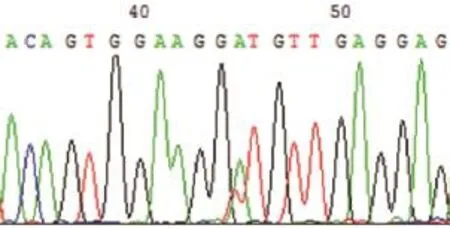
图3 V559D突变Fig.3 V559D mutation

图4 K642E突变Fig.4 K642E mutation
3 讨 论
中国人与西方白种人在恶性黑素瘤的发病上存在显著差异。在我国恶性黑素瘤患者中,以肢端型和黏膜型为主,而在西方白种人则以CSD为主,这可能与紫外线照射以及基因水平不同有关。Chi等[4]在中国人522例的大样本研究中报道,肢端型占41.8%(218/522),黏膜型占22.6%(118/522),而Kong等[7]研究也发现中国人肢端型占38.4%(193/502),黏膜型占33.3%(167/502),与以往来自日本和中国台湾省的报道数据基本一致[9-11]。在本报道中,肢端型占36.1%(52/144),黏膜型占24.3%(35/144),这两种组织学类型占我国恶性黑素瘤一半以上,且确诊时临床分期较晚,预后差,是我国恶性黑素瘤致死的主要原因。
本组研究中,KIT基因突变在黏膜型和CSD中发生率较高,而在肢端型及non-CSD中发生率相对较低。本组CSD的KIT突变率为14.3%(1/7),而Kong等[7]报道中CSD的KIT突变率达到20.7%(6/29),这可能与本组研究中CSD病例数样本量相对较少有关。
本研究报道的黏膜型恶性黑素瘤KIT基因突变比例与文献报道比例相似,而肢端型则略低于文献报道。KIT在黏膜型恶性黑素瘤患者中的突变率为20.0%(7/35),与Curtin等[12]的21.1%(8/38),Torres-Cabala等[13]的17.3%(9/52)、Carvajal等[14]的18.3%(17/93)、Abysheva等[15]的16.7%(8/48)、Beadling等[5]的15.6%(7/45)、Antonescu等[16]的15.0%(3/20)和Satzger等[17]的16.2%(6/37)数据结果相似,而高于Kong等[7]的9.6%(16/167)。这可能与所检测样本量的大小及来源于不同解剖部位有关。有待于进一步扩大样本量,并且按口腔黏膜、消化道黏膜等不同部位来分类检测。本次检测发现,KIT基因突变在肢端型恶性黑素瘤患者中,突变率为7.7%(4/52),比Beadling等[5]的2 3.1%(3/1 3)、Yu n等[1 8]的21.4%(18/84)、Mazurenko等[19]28.6%(4/14)、Carvajal等[14]的25.0%(4/40)和Curtin等[12]的10.7%(3/28)数值低,这些差异可能和样本量大小、人种差异等多方面的因素有关。在中国人恶性黑素瘤KIT突变的最大组报道中,Kong等[7]的突变阳性率也相对较低,为11.9%(23/193),且其研究结果表明,KIT基因突变与年龄、性别、分级、厚度以及原发灶有无溃疡无显著相关性,但存在KIT基因突变的恶性黑素瘤患者中位生存期(30个月)远低于不存在该突变的患者(53个月),并提出KIT基因突变可能是恶性黑素瘤的独立预后不良因素。
本研究检测到,KIT基因的突变包含第9、11、13和17外显子。13例突变中,第9外显子突变率为7.7%(1/13),第11外显子突变率为69.2%(9/13),第13外显子突变率为23.1%(3/13),第17外显子突变率为0%(0/13),以第11外显子突变为主,其中L576P共3例,是最常见的突变类型。其次是第13号外显子(3例),其中2例突变为K642E。文献报道的最常见KIT基因突变外显子类型是第11号外显子(如L576P、W557R、V559A和V559D),其次是第13号外显子(如K642E)和第17号外显子(如D816H)[5,13,18,20-22],本研究结果与文献报道相符。且有研究表明,L576P、K642E为伊马替尼敏感型突变[14,23-24],但确切结论尚需大样本临床试验验证。本组研究中所检测到的其余突变对功能的影响未见报道。
综上所述,本研究初步研究了本院收治的恶性黑素瘤患者中KIT基因突变情况,证实了黏膜型恶性黑素瘤及CSD两种组织学类型中KIT突变率较高。在这些突变中,以第11外显子突变为主。这些研究将为针对KIT基因突变尤其是第11外显子突变的靶向药物在中国恶性黑素瘤患者中的应用提供分子水平的依据。
[参考文献]
[1]KONG Y, SURESH M. KUMAR, XU X. Molecular pathogenesis of sporadic melanoma and melanoma-initiating cells [J]. Arch Pathol Lab Med, 2010, 134(12): 1740-1749.
[2]DAI B, CAI X, KONG Y, et al. Analysis of KIT expression and gene mutation in human acral melanoma: with a comparison between primary tumors and corresponding metastases/ recurrences [J]. Human Pathol, 2013, 44(8): 1472-1478.
[3]LEBOIT P E, BURG G, WEEDON D, et al. WHO classification of tumors of the skin [M]. IRAC Press: Lyon 2006.
[4]CHI Z, LI S, SHENG X, et al. Clinical presentation, histology,and prognoses of malignant melanoma in ethnic Chinese: astudy of 522 consecutive cases [J]. BMC Cancer, 2011, 11:85-95.
[5]BEADLING C, JACOBSON-DUNLOP E, HODI FS, et al. KIT gene mutations and copy number in melanoma subtypes [J]. Clin Cancer Res, 2008, 14(21): 6821-6128.
[6]GRICHNIK JM, BURCH JA, BURCHETTE J, et al. The SCF/ KIT pathway plays a critical role in the control of normal human melanocyte homeostasis [J]. J Invest Dermatol,1998, 111(2): 233-238.
[7]KONG Y, SI L, ZHU Y, et al. Large-scale analysis of KIT aberrations in Chinese patients with melanoma [J]. Clin Cancer Res, 2011, 17(7): 1684-1691.
[8]NI S, HUANG D, CHEN X, et al. c-kit gene mutation and CD117 expression in human anorectal melanomas [J]. Hum Pathol, 2012, 43(6): 801-807.
[9]CHANG J, YEH K Y, WANG C, et al. Malignant melanoma in Taiwan: a prognostic study of 181 cases [J]. Melanoma Res, 2004, 14(6): 537-541.
[10]ISHIHARA K, SAIDA T, OTSUKA F, et al. Statistical profiles of malignant melanoma and other skin cancers in Japan: 2007 update[J]. Int J Clin Oncol, 2008, 13(1): 33-41.
[11]ISHIHARA K, SAIDA T, YAMAMOTO A, Updated statistical data for malignant melanoma in Japan [J]. Int J Clin Oncol,2001, 6(3): 109-116.
[12]CURTIN J A, BUSAM K, PINKEL D, et al. Somatic activation of KIT in distinct subtypes of melanoma [J]. J Clin Oncol,2006, 24(26): 4340-4346.
[13]TORRES-CABALA C A, WANG W L, TRENT J, et al. Correlation between KIT expression and KIT mutation in melanoma: a study of 173 cases with emphasis on the acrallentiginous/mucosal type[J]. Mod Pathol, 2009, 22(11):1446-1456.
[14]CARVAJAL R D, ANTONESCU C R, WOLCHOK J D, et al. KIT as a therapeutic target in metastatic melanoma [J]. JAMA, 2011, 305(22): 2327-2334.
[15]ABYSHEVA S N, IYEVLEVA A G, EFIMOVA N V, et al. KIT mutations in Russian patients with mucosal melanoma [J]. Melanoma Res, 2011, 21(6): 555-559.
[16]ANTONESCU C R, BUSAM K J, FRANCONE T D, et al. L576P KIT mutation in anal melanomas correlates with KIT protein expression and is sensitive to specific kinase inhibition [J]. Int J Cancer, 2007, 121(6): 257-264.
[17]SATZGER I, SCHAEFER T, KUETTLER U, et al. Analysis of c-KIT expression and KIT gene mutation in human mucosal melanomas [J]. Br J Cancer, 2008, 99(12): 2065-2069.
[18]YUN J, LEE J, JANG J, et al. KIT amplification and gene mutations in acral/mucosal melanoma in Korea [J]. APMIS,2011, 119(6): 330-335.
[19]MAZURENKO N N, TSYGANOVA I V, LUSHNIKOVA A A, et al. The spectrum of oncogene mutations differs among melanoma subtypes [J]. Mol Biol, 2015, 49(6): 1022-1029.
[20]SCHOENEWOLF N L, BULL C, BELLONI B, et al. Sinonasal,genital and acrolentiginous melanomas show distinct characteristics of KIT expression and mutations [J]. Eur J Cancer, 2012, 48(12): 1842-1852.
[21]ROBERTS R, GOVENDER D. Gene of the month: KIT [J]. J Clin Pathol, 2015, 68(9): 671-674.
[22]GOLDINGER S M, MURER C, STIEGER P, et al . Targeted therapy in melanoma--the role of BRAF, RAS and KIT mutations [J]. Eur J Cancer, 2013, 11(2): 92-96.
[23]CONCA E, NEGRI T, GRONCHI A, et al. Activate and resist:L576P--KIT in GIST [J]. Mol Cancer Ther, 2009, 8(9):2491-2495.
[24]PUNTERVOLL H E, MOLVEN A, AKSLEN LA. Frequencies of KIT and GNAQ mutations in acral melanoma [J]. J Cutan Pathol, 2014, 41(11): 893-894.
DOI:10.3969/j.issn.1007-3969.2016.05.008
中图分类号:R735.9
文献标志码:A
文章编号:1007-3639(2016)05-0399-05
收稿日期:(2015-02-04修回日期:2016-01-17)
基金项目:上海市自然科学基金(12ZR1406600);国家临床重点专科建设项目。通信作者:孔蕴毅E-mail:kyunyidb@126.com
Analysis of KIT gene mutation in melanoma patients
LÜ Jiaojie, KONG Yunyi, CAI Xu, ZHOU Xiaoyan
(Department of Pathology, Fudan University Shanghai Cancer Center, Department of Oncology,Shanghai Medical College, Fudan University, Shanghai 200032, China)Correspondence to: KONG Yunyi E-mail: kyunyidb@126.com
[Abstract]Background and purpose: KIT mutation plays an important role during the pathogenesis of melanoma. This study was designed to investigate the mutation status of KIT in different subtypes of melanoma. Methods: A total number of 144 cases of melanoma were analyzed for KIT mutation (exon 9, 11, 13 and 17) by DNA sequencing using paraffin-embedded tissues. Results: The total incidence of KIT mutation in melanoma was 9.0% (13/144). KIT mutations in acral melanoma, mucosal melanoma, melanoma on skin with chronic sun-induced damage (CSD) and melanoma on skin without chronic sun-induced damage (non-CSD) was 7.7% (4/52), 20% (7/35), 14.3% (1/7) and 2.8% (1/36), respectively. Among 13 cases with KIT mutation, 1 mutation lay in exon 9, 9 lay in exon 11 and 3 in exon 13. L576P in exon 11 was the most common type of mutation. Conclusion: The most prevalent type of KIT mutation in patients lies in exon 11. KIT mutation could be the potential drug target in melanoma therapy.
[Key words]KIT; Gene mutation; Melanoma

