淫羊藿甙促进活性氧表达诱导甲状腺癌B-CPAP细胞凋亡的研究
郑传铭,葛明华,王佳峰,刘小珍.浙江省肿瘤医院头颈外科,浙江 杭州 300;.浙江省肿瘤医院生物标本库,浙江 杭州 300
淫羊藿甙促进活性氧表达诱导甲状腺癌B-CPAP细胞凋亡的研究
郑传铭1,葛明华1,王佳峰1,刘小珍2
1.浙江省肿瘤医院头颈外科,浙江杭州310022;2.浙江省肿瘤医院生物标本库,浙江杭州310022
[摘要]背景与目的:淫羊藿甙(icariin,ICA),是从檗科淫羊藿属植物中提取的重要黄酮类活性化合物。研究表明,ICA对肺癌和胃癌等肿瘤有很好的抑制作用,有望开发为疗效较好的抗肿瘤药,但其作为有前景抗肿瘤药物在甲状腺癌中的研究较少,其作用机制罕见报道。该研究拟探究不同浓度ICA对甲状腺癌B-CPAP细胞系增殖凋亡、细胞内活性氧(reactive oxygen species,ROS)及抗氧化酶系统的影响,探究ICA对甲状腺癌活性影响机制是否具有浓度-时间依赖性。方法:采用细胞计数试剂盒(cell counting kit-8,CCK-8)检测不同浓度ICA对B-CPAP细胞系增殖的影响,采用流式细胞仪技术检测ICA对细胞凋亡及细胞内ROS的影响,采用超氧化物歧化酶(superoxide dismutase,SOD)试剂盒检测ICA对细胞内SOD表达影响,采用丙二醛(malondialdehyd,MDA)检测试剂盒检测ICA对细胞内MDA表达的影响,采用蛋白[质]印迹法(Western blot)检测Bcl-2及γ-HA2X蛋白的表达。结果:ICA处理48h后B-CPAP细胞活性降低,细胞凋亡率上升,呈剂量-时效依赖性(P<0.01)。ICA50和200mg/L处理组ROS生成量依次是对照组(Control组)的(2.12±0.14)倍和(2.41±0.12)倍。ICA促进细胞膜脂质化产物MDA的累积,降低抗氧化酶SOD活性,活性比Control组下降(9.35±1.45)%和(21.5±1.52)%。ICA200mg/L处理组抗凋亡蛋白Bcl-2表达降低(13.64±1.71)%。结论:ICA具有良好的抑制甲状腺癌B-CPAP细胞活性的作用,并呈现剂量依赖性,其主要作用途径可能是促进细胞内ROS高表达,抑制SOD表达,抗凋亡蛋白Bcl-2低表达,导致细胞不可逆损伤,从而诱导细胞凋亡。
[关键词]淫羊藿甙;甲状腺癌;活性氧;超氧化物歧化酶
《2012中国肿瘤登记年报》数据显示,甲状腺癌已进入高发范围,在全国范围内的恶性肿瘤排名中,甲状腺癌发病率已上升至第10位,在城市及沿海地区甲状腺癌发病率已上升至第4位。淫羊藿甙(icariin,ICA)是一种极具应用前景的抗癌中药,对肺癌、胃癌、肝癌以及血液系统肿瘤等有很好的抑制作用[1-3],但ICA在抗甲状腺癌中的研究较少,其作用机制探究不深。本研究拟观察不同浓度ICA对甲状腺癌B-CPAP细胞系增殖凋亡、细胞内活性氧(reactive oxygen soecies,ROS)及抗氧化酶系统的影响,探究ICA对甲状腺癌细胞活性的影响机制。
1 材料和方法
1.1细胞及培养
人甲状腺癌B-CPAP细胞系获赠于中国医学科学院,置于37℃、CO2体积分数为5%、含10%胎牛血清RPMI-1640培养基(Thermo Fisher Scientific,MA,USA)的恒温培养箱内培养。
1.2主要试剂
ICA(大于98%)购自上海阿拉丁生化科技股份有限公司,WST法总超氧化物歧化酶试剂盒、脂质氧化检测试剂盒检测和BCA蛋白检测试剂盒皆购自南京碧云天生物技术有限公司,β-actin、Bcl-2和γ-H2AX等抗体均购自美国Abcam公司,细胞计数试剂盒(cell counting kit-8,CCK-8)细胞增殖试剂盒购自东仁化学科技(上海)有限公司,DCFH-DA购自美国Sigma Aldrich公司,Annexin Ⅴ-FITC/PI细胞凋亡试剂盒购自美国Invitrogen公司。
1.3CCK-8增殖实验
以每孔1×103个细胞密度接种于96孔板中,每孔100μL,温育过夜后依次加入ICA 12.5(ICA12.5组)、25(ICA25组)、50(ICA50组)、100(ICA100组)和200 mg/L(ICA200组),未经ICA处理的细胞设为对照组(Control组),培养24、48和72 h后,每孔换终浓度10%的CCK-8培养基温育2 h,然后在酶标仪450 nm处读取吸光度(D)值。
1.4细胞凋亡检测
收集ICA 50和200mg/L处理48h的B-CPAP细胞和对照组细胞1×106个,置于离心管中,1000×g离心3min,去除上清液,按照Invitrogen凋亡试剂盒说明书进行操作,每管加入100μL缓冲液,依次加入5μL Annexin V-FITC,1μL PI,室温温育15min,采用流式细胞仪检测细胞凋亡变化,收集1×104个细胞。
1.5细胞内ROS检测
采用胰蛋白酶消化ICA50和200mg/L处理48h的B-CPAP细胞和对照组细胞。每管采用10μmol/LDCFH-DA工作液,37℃避光温育15min后采用BD双波长激光流式细胞仪进行检测细胞内的荧光强度来分析细胞内ROS水平。每个样品收集1×104个细胞。
1.6细胞内丙二醛(malondialdehyde,MDA)检测
采用脂质氧化检测试剂盒检测不同处理组细胞内MDA(操作方法参照试剂说明书),根据标准曲线计算待测样品内MDA含量,其中采用BCA蛋白检测试剂盒对所有样品的总蛋白进行定量,无任何处理为对照组细胞。
1.7超氧化物歧化酶(superoxide dismutase,SOD)检测
从数据来看,M0/(M1-M0)、M0/M1的比率继续下降,到2011年开始有所回升。M1/(M2-M1)、M0/(M2-M1)的比率总体呈现下降趋势。这个结论与我们当前的实际情况也是不相吻合的。
ICA50和200mg/L分别处理B-CPAP细胞48h后,采用细胞刮棒轻缓刮脱细胞,每孔加入150μL含蛋白酶抑制剂的细胞裂解液,转至于预冷EP管中;充分混匀强力涡旋振荡15s,16000×g离心5min;吸取上清液置于EP管待测检测。细胞内SOD表达量采用WST法总SOD试剂盒进行检测(操作方法参照试剂说明书),其中采用BCA蛋白检测试剂盒对所有样品的总蛋白进行定量。计算公式:样品中SOD酶活力单位=检测体系中SOD酶活力单位=抑制百分率/(1-抑制百分率)units,抑制百分率=(A空白对照1-A样品)/ (A空白对照1-A空白对照2)×100%,无任何处理为对照组。
1.8蛋白[质]印迹法(Western blot)检测
同上1.6操作收集获取细胞总蛋白液,加入适量SDS上样缓冲液于100℃金属浴解交联。蛋白样品进行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭非特异性结合,然后依次温育一抗及二抗后,用化学发光法显影,检测50和200mg/L ICA处理的B-CPAP细胞中Bcl-2及γ-H2AX相关蛋白水平的变化,无任何处理为对照组。
1.9统计学处理
2 结 果
2.1ICA抑制甲状腺癌B-CPAP细胞增殖
通过不同ICA浓度的动态观察,与对照组比较,ICA在24h时对细胞无明显的抑制作用,48h处理抑制效果明显,表明ICA抑制细胞活性具有时间依赖性。同对照组比,ICA12.5组、ICA25组、ICA50组、ICA100组和ICA200组48h后,细胞活性依次下降(8.84±1.21)%、(17.80±2.19)%、(19.50±0.54)%、(24.02±4.30)%和(43.0±1.58)%;ICA不同浓度处理组对细胞活性的影响呈剂量依赖性,200mg/L细胞活性抑制作用最强。ICA处理72h对细胞活性抑制趋势同48h相似,与Control组相比,差异有统计学意义(图1)。

图1 ICA抑制B-CPAP细胞增殖Fig.1 ICA inhibited the proliferation of B-CPAP cells
与对照组比,ICA处理B-CPAP细胞48h后,细胞凋亡数明显提高,细胞生存率下降(P<0.01),ICA50组和ICA200组细胞凋亡率分别提高(10.00±1.70)%和(20.06±2.72)%,ICA浓度越高细胞凋亡率上升,呈剂量依赖性(图2)。
2.3ICA提高B-CPAP细胞内ROS生成
用ICA50和200mg/L处理48h后,B-CPAP细胞内ROS明显上升,差异有统计学意义(P<0.01),ICA50组和ICA200组细胞内ROS生成量分别是CTRL组(2.12±0.14)倍和(2.41±0.12)倍。同时,ICA提高细胞内ROS生成呈剂量依赖性,ICA200组ROS生成比ICA50组提高(13.9±5.45)%(图3)。
2.4ICA提高B-CPAP细胞内MDA累积
收集ICA50和200mg/L处理B-CPAP细胞48h后检测发现,ICA200组促使细胞内膜脂质过氧化物MDA累积,提高(44.67±19.58)%(图4)。
2.5ICA对B-CPAP细胞内SOD生成影响
ICA50和200mg/L处理B-CPAP细胞48h后,明显降低细胞内SOD生成,分别下降(9.35±1.45)%和(21.5±1.52)%。ICA组间差异有统计学意义(P<0.01),ICA200组SOD生成量比ICA50组降低(13.5±1.7)%,呈剂量依赖性(图5)。

图2 ICA促进B-CPAP细胞凋亡Fig.2 ICA promoted the apoptosis of B-CPAP cells

图3 ICA促使B-CPAP细胞内ROS生成Fig.3 ICA improved the intracellular ROS of B-CPAP cells
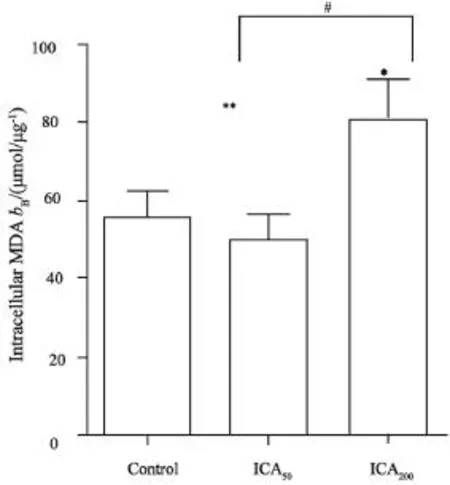
图4 ICA促使B-CPAP细胞内MDA累积Fig.4 ICA improved the accumulation of MDA in B-CPAP cells

图5 ICA降低B-CPAP细胞内SOD生成Fig.5 ICA reduced the intracellular SOD of B-CPAP cells
2.6ICA对Bcl-2及γ-H2AX蛋白水平的影响
ICA处理48h后,采用Western blot检测细胞内抑制凋亡蛋白Bcl-2及DNA双链损伤修复蛋白γ-H2AX表达。与对照组相比,ICA200组Bcl-2表达降低(13.64±1.71)%(图6A),与流式细胞凋亡检测结果相对应。ICA处理能明显降低γ-H2AX表达,对照组γ-H2AX依次是ICA50组、ICA200组的1.71倍和1.70倍(图6B)。

图6 ICA降低B-CPAP细胞内Bcl-2(A)、γ-H2AX(B)表达Fig.6 ICA reduced the expression of Bcl-2(A) and γ-H2AX(B) in B-CPAP cells
3 讨 论
ICA是淫羊藿植物中主要黄酮类药用成分,被喻为最有潜力的抗癌中药之一,对肺癌、胃癌、肝癌及血液系统肿瘤等有很好的抑制作用,而ICA对甲状腺癌的影响研究较少。近年来随着对ROS生物学功能研究的深入,ROS杀伤肿瘤细胞的作用也逐渐被认识,并形成了新兴的自由基生物医学研究领域。作为有前景抗癌药物ICA对甲状腺癌细胞内ROS和抗氧酶(SOD、H2O2酶等)影响相关研究鲜见详细报道。本研究结果显示,ICA明显降低高甲状腺癌B-CPAP细胞活性,提高细胞凋亡率并呈浓度-时间依赖性,同时ICA处理组B-CPAP细胞内ROS呈浓度依赖性增加,则显示ICA处理细胞凋亡率与细胞内ROS量呈正相关。ROS是指由分子氧直接或间接转化而来、具有比分子氧更活泼的化学反应性的一类含氧物,ROS作用方式与其浓度相关,微摩尔水平的ROS可导致细胞凋亡,毫摩尔水平的ROS引起细胞的损伤死亡[4-5],细胞凋亡的3条途径:线粒体通路、内质网通路和死亡受体通路均与ROS密切相关。Li等[6]研究表明,ISA可通过依赖线粒体的ROS/c-Jun氨基末端激酶(ROS/JNK)信号转导通路诱导人肝癌SMMC-7721。马振秋等[7]研究发现,二氢青蒿素(DHA)能浓度和时间依赖性抑制大鼠C6胶质瘤细胞的增殖,DHA作用2h后,C6细胞内ROS增多,这种效应与DHA的浓度呈正相关。膜脂过氧化重要产物MDA,能加剧膜的损伤。本研究显示,ICA处理组MDA生成量增加,这与ROS介导的膜损伤有关。细胞膜、线粒体膜和内质网膜易遭到ROS攻击,致使膜的结构和功能受损。线粒体膜受到ROS攻击后发生脂质过氧化、MDA生成量增加,膜的通透性改变,导致Ca2+外流和细胞色素C释放,激活caspase-3从而引起细胞凋亡[8],本研究与此相符。SOD是普遍存在于动植物体内的重要抗氧化酶,主要功能是消除体内自由基。本研究显示,ICA处理组SOD表达量显著减少,对细胞内ROS清除率下降,促进细胞凋亡,与凋亡数据相符。同理,本研究显示,高浓度ICA处理组Bcl-2蛋白表达量下降,ROS高表达,细胞氧化损伤严重,从而诱导细胞凋亡相关途径。ROS介导的DNA氧化损伤,若对DNA的氧化损伤严重以致无法修复,则可直接导致细胞死亡。
γ-H2AX是组蛋白H2A家族中的一员H2AX的磷酸化形式(亚型),参与DNA损伤早期反应,为评估DNA损伤、修复的指标。而本研究ICA各处理组γ-H2AX表达量降低,这可能是细胞同时在进行的DNA的修复作用超过了损伤作用,γ-H2AX的去磷酸化水平超过了磷酸化水平,这与邹鹏等[9]的研究结果相一致。
综上所述,ICA可以降低甲状腺癌B-CPAP细胞活性,提高凋亡率,且降低细胞内抗氧化酶活性,提高脂质过氧化物MDA升高,这与细胞内ROS提高引起的氧化损伤有关。更多与ICA促进生成的ROS与细胞凋亡相关的调控分子机制有待进一步探究,这为将ICA应用与甲状腺癌临床治疗提供新思路,利于推进中药抗肿瘤的进程。
[参考文献]
[1]LEE K S, LEE H J, AHN K S, et al. Cyclooxygenase-2/ prostaglandin E2 pathway mediates icariside Ⅱ induced apoptosis in human PC-3 prostate cancer cells [J]. Cancer Lett, 2009, 280(1): 93-100.
[2]WANG Y, DONG H, ZHU M, et al. Icariin exerts negative effects on human gastric cancer cell invasion and migration by vasodilator-stimulated phosphoprotein via Rac1 pathway [J]. Eur J Pharmacol, 2010, 635(1-3): 40-48.
[3]ZHOU J, WU J, CHEN X, et al. Icariin and its derivative, ICT,exert anti-inflammatory, anti-tumor effects, and modulate myeloid derived suppressive cells (MDSCs) functions [J]. Int Immunopharmacol, 2011, 11(7): 890-898.
[4]DING Y, WANG H, NIU J, et al. Induction of ROS overload by alantolactone prompts oxidative DNA damage and apoptosis in colorectal cancer cells[J]. Int J Mol Sci, 2016, 17(4). pii:E558. doi: 10. 3390/ijms17040558.
[5]ZHU B, LI Y, LIN Z, et al. Silver nanoparticles induce HePG-2 cells apoptosis through ROS-mediated signaling pathways[J]. Nanoscale Res Lett, 2016, 11(1): 198.
[6]LI S G, DONG P, WANG J, et al. Icariin, a natural flavonol glycoside, induces apoptosis in human hepatoma SMMC-7721 cells via a ROS/JNK-dependent mitochondrial pathway [J]. Cancer Lett, 2010, 298(2): 222-230.
[7]马振秋, 黄晓佳, 张纬萍, 等. 二氢青蒿素抑制大鼠胶质瘤C6细胞增殖和诱导凋亡[J]. 浙江大学学报: 医学版,2007, 36(3): 267-272.
[8]FRANCESCO A, MONICA M, MICHAEL S. Mitochondria and reactive oxygen species [J]. Hypertension, 2009, 53(6):885-892
[9]邹鹏, 杨晓丽, 陈先, 等. 博来霉素对肝癌细胞DNA损伤以及H2AX相互作用蛋白的影响[J]. 复旦学报:自然科学版, 2011, 50(2): 172-177.
DOI:10.3969/j.issn.1007-3969.2016.05.006
中图分类号:R736.1
文献标志码:A
文章编号:1007-3639(2016)05-0388-06
收稿日期:(2015-08-09修回日期:2016-02-10)
基金项目:2014年浙江省中医药科学研究基金项目(2014ZB025)。通信作者:葛明华E-mail:gemingh@163.com
Icarrin induces apoptosis of the thyroid carcinoma cell line B-CPAP via promotion of reactive oxygenspecies
ZHENG Chuanming1, GE Minghua1, WANG Jiafeng1, LIU Xiaozhen2
(1. Department of Head and Neck Surgery, Zhejiang Cancer Hospital, Hangzhou 310022, Zhejiang Province, China; 2. The Biospecimen Repository of Zhejiang Cancer Hospital, Hangzhou 310022, Zhejiang Province, China)Correspondence to: GE Minghua E-mail: gemingh@163.com
[Abstract]Background and purpose: Icariin (ICA) is the important active flavonoids extracted from Berberidaceae epimedium. It has been shown to be effective in suppressing cancers including lung cancer and gastric cancer. Thus, it is expected to be developed for cancer treatment. However, there were few studies on icariin as a promising anticancer drug for the treatment of thyroid cancer. The mechanisms underlying anticancer effects of ICA in thyroid cancer are rarely reported. This study was to explore the proliferation and apoptosis, intracellular ROS and antioxidant enzyme systems of the thyroid carcinoma cell line B-CPAP treated with different concentrations of ICA. It aimed to explore the mechanism underlying anticancer effects of ICA, and to determine whether it is concentrationor time-dependent manner. Methods: The proliferation of B-CPAP cell line treated with different concentrations of ICA was detected by cell counting kit-8 (CCK-8). The cell apoptosis and intracellular ROS were observed by flow cytometry. The expression of intracellular superoxide dismutase and intracellular malondialdehyde were measured by SOD detection kit and MDA assay kit, respectively. Bcl-2 and γ-HA2X were detected by Western blot. Results: ICAreduced B-CPAP cell activity, increased the rate of apoptosis in a dose- and time-dependent manner after 48 h (P<0.01). The ROS of ICA 50 mg/L and 200 mg/L groups were (2.12±0.14)-fold and (2.41±0.12)-fold of the control group,respectively. ICA promoted accumulation of malondialdehyde, and reduced antioxidant enzyme SOD activity. The SOD activity was decreased by (9.35±1.45)% (ICA 50 mg/L group) and (21.5±1.52)% (ICA 200 mg/L group) compared with the control group, respectively. The anti-apoptotic protein Bcl-2 in ICA 200 mg/L group was decreased by (13.64±1.71)% compared with the control group. Conclusion: Icariin inhibited activity of thyroid cancer B-CPAP cells in a dose- and time-dependent manner. It plays an important role in promoting intracellular ROS expression, inhibiting superoxide dismutase expression and decreasing Bcl-2, which leads to irreversible damage to the cell, thereby inducing apoptosis.
[Key words]Icariin; Thyroid carcinoma; Reactive oxygen species; Superoxide dismutase

