miR-483-5p在上皮性卵巢癌中的表达及其对顺铂敏感性的影响
张彭南,孙 红,蒋红元复旦大学附属妇产科医院妇科,上海 200090
miR-483-5p在上皮性卵巢癌中的表达及其对顺铂敏感性的影响
张彭南,孙红,蒋红元
复旦大学附属妇产科医院妇科,上海200090
[摘要]背景与目的:顺铂是目前临床上治疗上皮性卵巢癌的一线化疗药物之一,但许多患者对铂类药物耐药。miR-483-5p在肺癌中过表达,然而目前尚未见miR-483-5p在上皮性卵巢癌中的研究。该研究检测miR-483-5p在上皮性卵巢癌组织和上皮性卵巢癌细胞系中的表达并探讨其对上皮性卵巢癌细胞对顺铂敏感性的影响。方法:采用实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测43例上皮性卵巢癌患者的肿瘤组织、8例正常卵巢组织和5种上皮性卵巢癌细胞系中miR-483-5p的表达情况;通过慢病毒上调或敲低卵巢癌细胞miR-483-5p表达,应用CCK-8实验检测miR-483-5p对上皮性卵巢癌细胞系顺铂敏感性的影响。结果:上皮性卵巢癌组织中miR-483-5p表达明显高于正常卵巢组织(P<0.01)。此外,miR-483-5p在晚期上皮性卵巢癌组织中的表达水平显著高于早期肿瘤组织(P<0.05)。5种上皮性卵巢癌细胞系中SKOV3细胞表达miR-483-5p的量最低;miR-483-5p在上皮性卵巢癌顺铂耐药A2780/CP细胞中表达量最高。上调SKOV3细胞中miR-483-5p的表达能够降低上皮性卵巢癌细胞对顺铂的敏感性,并下调p21 及Bcl-2的表达;下调A2780/CP细胞miR-483-5p的表达能够增加细胞对顺铂的敏感性,并上调p21及Bcl-2的表达。结论:miR-483-5p在上皮性卵巢癌组织中高表达并对顺铂耐药,可以作为临床预测上皮性卵巢癌对顺铂敏感性的生物标志物之一。
[关键词]上皮性卵巢癌;miR-483-5p;顺铂;耐药
卵巢癌的发病率位居女性生殖系统恶性肿瘤第3位,死亡率位居首位,上皮性卵巢癌是其主要类型。顺铂是治疗上皮性卵巢癌最常用临床药物之一。近年来,越来越多的上皮性卵巢癌对顺铂耐受,严重影响了上皮性卵巢癌患者的预后[1]。探索、阐明卵巢癌的化疗耐药作用机制,提高卵巢癌对化疗的敏感性是妇科肿瘤研究领域亟待解决的问题之一。
微小RNA(microRNA,miRNA,miR)在转录后水平调控细胞的增殖、凋亡、分化、代谢、发育等方面。近年来研究证实,异常的miRNA表达与多种肿瘤的发生、发展具有密切的关系[2-3]。研究发现,miR-483-5p肺癌中过表达,具有癌基因的功能[4]。本研究旨在检测miR-483-5p在上皮性卵巢癌及正常组织中的表达,并在上皮性卵巢癌细胞中检测其表达对顺铂敏感性的影响。
1 材料和方法
1.1组织、细胞系及主要实验试剂
组织标本取自复旦大学附属妇产科医院2013年1月—2013年6月经手术治疗的上皮性卵巢癌患者43例,正常卵巢组织8例(均为因患子宫肌瘤或子宫腺肌症行全子宫加双侧卵巢、输卵管切除的患者)。术中取材后,标本立即放入液氮中速冻后并于-80℃条件下保存以提取RNA。所有组织均由病理诊断证实。上皮性卵巢癌患者年龄41~69岁。TNM分期:Ⅰ~Ⅱ期20例,Ⅲ~Ⅳ期23例。所有卵巢癌患者术前均未经任何治疗,其中浆液性囊腺癌22例,黏液性囊腺癌18例,其他类型3例。本研究经复旦大学附属妇产科医院伦理委员批准,且均在患者知情的情况下取得标本。人上皮性卵巢癌细胞SKOV3、CAOV3、A2780、Hey和A2780/CP由本实验室保存。DMEM高糖培养基、RPMI-1640培养基、Optim-MEM培养基购自美国Gibco公司。TRIzol、脂质体LipofectamineTM2000购自美国Invitrogen公司。实时荧光定量聚合酶链反应(real-time fluorescent quantitative polymerase chain reaction,RTFQ-PCR)检测试剂盒购自宝生物工程(大连)有限公司。miR-483-5p过表达及干扰慢病毒购自上海吉凯基因化学技术有限公司。P21、Bcl-2及甘油醛-3-磷酸脱氢酶(GAPDH)抗体购自美国Santa公司。
1.2方法
1.2.1组织及细胞RNA提取
从超低温冰箱(-80℃)中取出组织,放入预冷的研钵中进行研磨,期间不断地加入液氮保持低温直至研磨成粉末。取0.25g组织粉到EP管中,加入1mL TRIzol混匀,在室温下裂解组织粉末15min。常规培养各细胞,待细胞生长至培养瓶约80%时,弃去培养基,PBS洗涤细胞2次,加入1mL TRIzol,移液枪轻轻吹打瓶壁,裂解细胞,待充分匀浆后转入1.5mL EP管中,室温静置15min。在上述细胞或组织裂解液的EP管中加入氯仿200μL,漩涡仪上振荡30s,室温放置10min后,于12000×g(4℃)条件下离心15min。取上层水置于新EP管中,加入500μL异丙醇,颠倒混匀后冰浴10min,12000×g (4℃)离心10min。弃上清液,加入预冷无RNA酶的75%乙醇1mL,涡旋混合,于7500×g (4℃)条件下离心5min,弃上清液,空气中干燥RNA10min。加入适量无RNA酶的去离子水溶解RNA。电泳检测RNA质量,琼脂糖凝胶电泳观察5S、18S及28S条带,紫外分光光度计检测260nm及280nm处吸光度(D)值,计算RNA浓度。放置-80℃超低温冰箱冻存备用。
1.2.2RTFQ-PCR检测
按照反转录试剂盒说明书对于组织和各细胞系所提取的总RNA进行反转录。RTFQ-PCR引物按说明书进行稀释,操作按试剂盒说明书进行。反应结束后确认RTFQ-PCR的扩增曲线和融解曲线,相对miRNA表达采用Ct值精确计算。U6snRNA为内参。
1.2.3CCK-8实验检测上皮性卵巢癌细胞对顺铂的敏感性
消化后的上皮性卵巢癌细胞以每孔2000个细胞接种到96孔板中常规培养过夜。随后分别加入0.2、1、5、25和125μmol/L顺铂,继续培养72h,更换新鲜培养基,加入100μL CCK-8工作液,继续培养2h,应用酶标仪测定D450nm值。抑制率=(1-D药物处理组/D对照组)×100%,计算IC50值。
1.2.4蛋白[质]印迹法(Western blot)检测
收集指数生长期细胞,加入蛋白裂解液,冰上裂解1h。12000×g离心15min,取上清液,采用BCA法蛋白定量。每孔总蛋白上样量30μg,采用12%十二烷基硫酸钠-聚丙烯氨酸凝胶电泳2h后转至硝酸纤维素膜上,5%脱脂牛奶封闭1h,加入l∶1000稀释的一抗4℃温育24h,经磷酸盐缓冲液(10%吐温-20)洗涤后,与1∶1000稀释的荧光二抗在室温下温育2h。按照SuperSignal West Pico化学发光检测试剂盒(美国Pierce公司)说明书等比例混合底物和增强剂,压片后显影。于FR-200A全自动成像系统扫描,以GAPDH作为内参对照。
1.3统计学处理
2 结 果
2.1miR-483-5p在上皮性卵巢癌组织中的表达
RTFQ-PCR检测结果显示,miR-483-5p在上皮性卵巢癌组织中表达水平显著高于正常卵巢组织(P<0.01,图1)。
此外,miR-483-5p在Ⅲ~Ⅳ期卵巢癌组织中表达水平显著高于Ⅰ~Ⅱ期卵巢组织(P<0.05,图1)。
2.2miR-483-5p在上皮性卵巢癌细胞中的表达
本研究采用RTFQ-PCR检测了5株上皮性卵巢癌细胞系中的miR-483-5p表达水平。结果显示,上皮性卵巢癌顺铂耐药细胞A2780/CP 中miR-483-5p表达水平显著高于其他4株细胞(P<0.01,图2)。
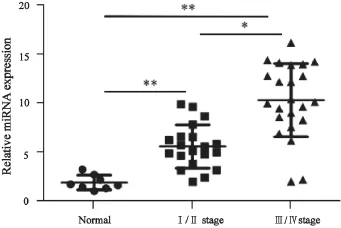
图1 miR-483-5p在上皮性卵巢癌组织及正常卵巢组织中的表达Fig.1 The expressions of miR-483-5p in epithelial ovarian cancer and normal ovarian tissues detected by RTFQ-PCR
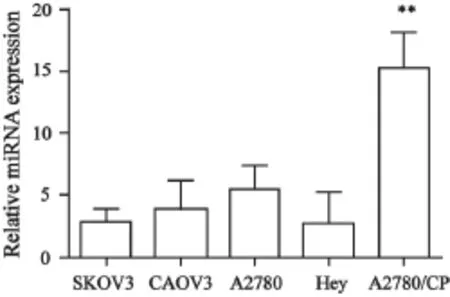
图2 miR-483-5p在上皮性卵巢癌细胞中的表达Fig.2 The expressions of miR-483-5p in 5 cell lines of epithelial ovarian cancer detected by RTFQ-PCR
2.3上调miR-483-5p表达诱导上皮性卵巢癌细胞对顺铂耐药
上述研究结果显示,miR-483-5p在上皮性卵巢癌顺铂耐药细胞株A2780/CP中表达显著高于其他细胞。因此,我们推测miR-483-5p过表达可能参与上皮性卵巢癌对顺铂耐药。本研究通过慢病毒上调上皮性卵巢癌SKOV3细胞中的miR-483-5p表达(P<0.01,图3A)。进一步通过CCK-8实验检测上调miR-483-5p表达后,细胞对顺铂敏感性的变化。结果显示,miR-483-5p过表达细胞和阴性对照细胞(negative control,NC)对顺铂的IC50值分别为17.81±1.20 和7.78±0.43(P<0.05,图3B)。提示上调miR-483-5p表达,SKOV3细胞对顺铂的敏感性显著降低。
2.4下调miR-483-5p增加上皮性卵巢癌细胞对顺铂的敏感性
为了进一步证实miR-483-5p过表达与上皮性卵巢癌顺铂耐药相关。我们通过慢病毒介导的shRNA敲低上皮性卵巢癌细胞A2780/CP中的miR-483-5p表达(P<0.01,图4A)。进一步通过CCK-8实验检测下调miR-483-5p表达后,细胞对顺铂敏感性的变化。结果显示,miR-483-5p敲低细胞和阴性对照细胞(NC)对顺铂的IC50值分别为9.59±1.02和24.19±2.88(P<0.01,图4B)。提示下调miR-483-5p表达,A2780/CP细胞对顺铂的敏感性显著增加。
2.5miR-483-5p可能通过调节p21及Bcl-2在上皮性卵巢癌中对顺铂耐药
为了进一步研究miR-483-5p在上皮性卵巢癌中对顺铂耐药的相关机制,我们在SKOV3细胞中上调miR-483-5p表达,在A2780/CP细胞中下调miR-483-5p的表达,然后检测p21及Bcl-2的蛋白表达。结果发现:上调miR-483-5p后,p21及Bcl-2的蛋白表达增加;下调miR-483-5p后,p21及Bcl-2的蛋白表达降低(图5)。
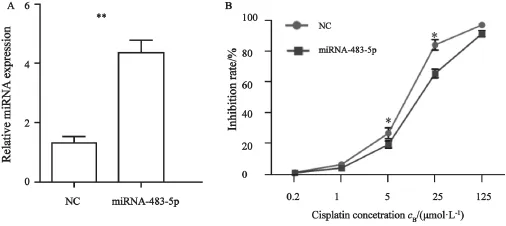
图3 上调miR-483-5p表达诱导上皮性卵巢癌细胞对顺铂耐药Fig.3 Forced miR-483-5p expression in SKOV3 cells reduced their sensitivity to cisplatin

图4 下调miR-483-5p增加卵巢癌细胞对顺铂的敏感性Fig.4 Reduced miR-483-5p expression in A2780/CP cells increased their sensitivity to cisplatin
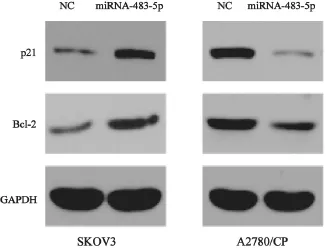
图5 Western blot检测上调或下调miR-483-5p对p21及Bcl-2蛋白表达的影响Fig.5 The expressions of p21 and Bcl-2 detected by Western blot with forced or reduced miR-483-5p
3 讨 论
上皮性卵巢癌是最常见的妇科恶性肿瘤之一,病死率居各类妇科肿瘤的首位[5]。铂类药物是目前临床上治疗上皮性卵巢癌的一线化疗药物之一。遗憾的是,许多患者对铂类药物耐药。因此,深入探讨上皮性卵巢癌的化疗耐药机制,寻找更为有效的治疗靶点是上皮性卵巢癌治疗亟待解决的问题之一。
Boren等[6]利用化疗药物对化疗耐受的卵巢癌细胞株进行处理后,随后检测了其中335种miRNA。结果发现,有27种miRNA的表达水平在药物处理前后表达水平发生变化,该变化至少与1种或多种化疗药物的反应性有关[6]。miR-106a异常表达与卵巢癌对紫杉醇耐药相关[7]。随着miRNA在卵巢癌中的研究不断深入,异常表达的miRNA可为卵巢癌的治疗提供新靶点。本研究发现,miR-483-5p在上皮性卵巢癌组织中高表达,且在Ⅲ~Ⅳ期肿瘤组织中表达水平高于Ⅰ~Ⅱ期肿瘤组织。此外,我们发现,miR-483-5p在上皮性卵巢癌顺铂耐药细胞A2780/CP中的表达显著高于其他细胞,并通过实验进一步证实miR-483-5p过表达在上皮性卵巢癌对顺铂耐药中具有重要作用。p21基因表达涉及数种癌症的耐药[8]。研究结果表明,原癌基因Bcl-2的过度表达延迟诱导细胞凋亡[9],Bcl-2表达的下调可以恢复癌细胞对抗癌药物的敏感性[10]。本研究发现:上调miR-483-5p表达后,p21及Bcl-2蛋白的表达增加;下调miR-483-5p表达后,p21及Bcl-2的蛋白表达降低。因此miR-483-5p可能通过调节p21及Bcl-2在上皮性卵巢癌中对顺铂耐药。
综上所述,本研究发现miR-483-5p在上皮性卵巢癌组织中高表达,并且与临床分期相关;其过表达与上皮性卵巢癌对顺铂耐药相关。因此miR-483-5p可能参与了上皮性卵巢癌的发生、发展的过程。
[参考文献]
[1]WENHAM R M, LAPOLLA J, LIN H Y, et al. A phase Ⅱtrial of docetaxel and bevacizumab in recurrent ovarian cancer within 12 months of prior platinum-based chemotherapy [J]. Gynecol Oncol, 2013, 130(1): 19-24.
[2]SAPLACAN R M, MIRCEA P A, BALACESCU L, et al. MicroRNAs as non-invasive screening biomarkers of colorectal cancer [J]. Clujul Med, 2015, 88(4): 453-456.
[3]SIM J, AHN H, ABDUL R, et al. High microRNA-370 expression correlates with tumor progression and poor prognosis in breast cancer [J]. J Breast Cancer, 2015,18(4): 323-328.
[4]SONG Q, XU Y, YANG C, et al. miR-483-5p promotes invasion and metastasis of lung adenocarcinoma by targeting RhoGDI1 and ALCAM [J]. Cancer Res, 2014, 74(11):3031-3042.
[5]SIEGEL R, MA J, ZOU Z, et al. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014, 64(1): 9-29.
[6]BOREN T, XIONG Y, HAKAM A, et al. MicroRNAs and their target messenger RNAs associated with ovarian cancer response to chemotherapy [J]. Gynecol Oncol, 2009,113(2): 249-255.
[7]HUH J H, KIM T H, KIM K, et al. Dysregulation of miR-106a and miR-591 confers paclitaxel resistance to ovarian cancer [J]. Br J Cancer, 2013, 109(2): 452-461.
[8]OHKOSHI S, YANO M, MATSUDA Y. Oncogenic role of p21 in hepatocarcinogenesis suggests a new treatment strategy [J]. World J Gastroenterol, 2015, 21(42): 12150-12156.
[9]ZHANG Z, ZHOU Q, MIAO Y, et al. MiR-429 induces gastric carcinoma cell apoptosis through Bcl-2 [J]. Cell Physiol Biochem, 2015, 37(4): 1572-1580.
[10]RAHA P, THOMAS S, THURN K T, et al. Combined histone deacetylase inhibition and tamoxifen induces apoptosis in tamoxifen-resistant breast cancer models, by reversing Bcl-2 overexpression [J]. Breast Cancer Res, 2015, 17(2): 26.
DOI:10.3969/j.issn.1007-3969.2016.05.007
中图分类号:R737.31
文献标志码:A
文章编号:1007-3639(2016)05-0394-05
收稿日期:(2015-11-15修回日期:2016-01-18)
通信作者:蒋红元E-mail:jianghy@fudan.edu.cn
Expression of miR-483-5p in epithelial ovarian cancer and its effects on cisplatin resistance in epithelial ovarian cancer cells
ZHANG Pengnan, SUN Hong, JIANG Hongyuan
(Department of Gynecology, Obstetrics and Gynecology Hospital, Fudan University, Shanghai 200090, China)Correspondence to: JIANG Hongyuan E-mail: jianghy@fudan.edu.cn
[Abstract]Background and purpose: Although cisplatin-based chemotherapies are used as the first-line treatment for ovarian cancers, the majority of patients eventually progress with platinum-resistant disease. miR-483-5p is overexpressed in lung cancer. However, the research on miR-483-5p in epithelial ovarian cancer (EOC) is still unclear. This study aimed to investigate the expression of miR-483-5p in EOC and its effects on cisplatin resistance in EOC cells. Methods: This study analyzed the expression of the miR-483-5p by real-time fluorescent quantitative polymerase chain reaction (RTFQ-PCR) in EOC tissues, normal ovarian tissues, and EOC cells. The role of miR-483-5p in EOC was evaluated in vitro by lentivirus-mediated knockdown of miR-483-5p or overexpression of miR-483-5p in EOC cell lines. Drug sensitivity assay was carried out by CCK-8 kit. Results: miR-483-5p was upregulated in EOC tissues as compared with normal tissues (P<0.01). Furthermore, miR-483-5p expression in advanced stage (Ⅲ-Ⅳ)EOC was significantly higher than that in early stage (Ⅰ-Ⅱ) EOC (P<0.05). Interestingly, miR-483-5p expression was higher in cisplatin-resistant A2780/CP cells than other cells. Increased miR-483-5p expression caused EOC cell resistance to cisplatin and downregulated the expression of p21 and Bcl-2, whereas reduced miR-483-5p expression induced its sensitivity and upregulated the expression of p21 and Bcl-2. Conclusion: The results suggest that miR-483-5p is highly expressed in EOC and contributes to cisplatin resistance. Thus, miR-483-5p is a potential therapeutic target for ovarian cancer.
[Key words]Epithelial ovarian cancer; miR-483-5p; Cisplatin; Drug resistance

