花生蛋白饮料中花生蛋白免疫检测方法的建立
王 宇,戚 平,肖 剑,梁智安,王成龙
(广州市食品检验所,广东广州 510410)
花生蛋白饮料中花生蛋白免疫检测方法的建立
王宇,戚平,肖剑,梁智安,王成龙
(广州市食品检验所,广东广州510410)
建立基于竞争酶联免疫分析(ELISA)的花生蛋白饮料中花生蛋白定量方法。以变性的花生Ara h 1,Ara h 2,Ara h 9为抗原,分别制备抗这3种蛋白的多克隆抗体,构建竞争ELISA方法。分析了9个花生品系的Ara h 1,Ara h 2和Ara h 9的含量。基于花生Ara h 1与可溶蛋白的比例关系,得出了植物蛋白饮料中花生蛋白含量的计算方法。该方法线性范围均为1.0~50.0 μg/mL(R2=0.99);花生Ara h 1蛋白含量除以系数0.15可换算得到蛋白饮料中花生蛋白含量;使用巴氏杀菌、超高温瞬时灭菌和高压灭菌的蛋白平均回收率分别为95%,93%,80%;方法相对标准偏差<14%。
花生;蛋白饮料;ELISA;定量
0 引言
花生(Arachis hypogaea L.)是一种营养丰富的食物,脂肪含量高且多为不饱和脂肪酸,蛋白质含量丰富,氨基酸构成比例合理,含有人体必需的氨基酸及具有促进脑细胞发育、增强记忆功能的营养元素[1]。同时,花生蛋白具有易于消化、易被人体吸收、稳定血糖和保持心脏健康等优点,使其成为理想的植物蛋白饮料原料。
花生蛋白饮料作为消费量较大的植物蛋白饮料之一,因其味道香甜深受消费者喜爱。现行国家卫生标准(GB 16322—2003)或企业产品标准(QB/T 2438—2006) 均规定植物蛋白饮料中的蛋白质含量应该不低于0.5 g/100 mL。目前,针对蛋白质含量的测定方法主要有凯氏定氮法、双缩脲法、紫外吸收法等化学法和光谱法,但由于其灵敏度较低、操作步骤繁琐,且容易受到外部添加物质的干扰,同时一些不法商贩受利益驱使在食品中使用非法添加物,给传统蛋白质检测方法在实际样品检测中的应用带来了挑战。当前,在植物蛋白饮料中可冒充蛋白使用的物质众多,并且存在使用廉价的大豆蛋白、牛奶蛋白冒充高价蛋白的可能。因此,必须要有针对性地对食品中和原料相关的特定蛋白含量进行检测。目前,医学上肿瘤标志物的研究方法已越来越多的用于食品中特定蛋白质的检测[2-7],即通过蛋白质组学寻找物种蛋白定量标志物。这些定量标志物在物种中稳定存在,具有热稳定性,且易于提取,因此可通过对其定量和推算,得出该物种蛋白在食品中的含量。
1 材料和方法
1.1材料
1.1.1试剂和样品
四甲基联苯胺(TMB)、弗氏完全佐剂和弗氏不完全佐剂、二硫苏糖醇(DTT),购自Sigma公司;其余试剂均为国产分析纯,购自广州化学试剂公司。ELISA反应检测用试液和配制方法,参照冷泉港实验室手册[4];其他花生蛋白饮料,随机采购于广州市场和网络销售平台。
1.1.2主要仪器设备
iMARK酶标分析仪,BIORAD公司产品;VCX750型超声破碎仪,Sonics and Materials公司产品;Kjeltec 8400型蛋白测定仪,Foss公司产品;高速离心机,Sigma公司产品;精密电子天平等常规仪器。
1.2试验方法
1.2.1抗体的制备
Ara h 1,Ara h 2,Ara h 9分别按照参考文献[5-7]提供的方法进行纯化,即将Ara h 1,Ara h 2,Ara h 9分别溶解于0.1%DTT的7 mol/L尿素中进行变性处理,免疫前使用0.01 mol/L pH值7.4的PBS缓冲液稀释10倍,配制成质量浓度为1 mg/mL的免疫试剂。皮下免疫新西兰大白兔,每只剂量0.1 mL。多克隆抗体制备方法参考冷泉港实验室手册的方法进行[4],使用硫酸铵沉淀法纯化抗体[8]。
1.2.2ELISA标准品
分别配制10 mg/mL花生Ara h 1,Ara h 2,Ara h 9的PBS缓冲溶液,于沸水浴中加热30 min。加入固体DTT和尿素,使其形成含有0.1%DTT的7 mol/L尿素溶液,经超声处理10 min,再用0.01 mol/L pH值7.4的PBS缓冲液稀释。
1.2.3竞争ELISA操作
在96孔微孔板中,每孔加花生Ara h 1,Ara h 2,Ara h 9蛋白包被液100 μL,于4℃下孵育过夜。次日甩掉包被液,用洗涤液清洗1次,每孔加入200 μL封闭液,于37℃下孵育3 h,甩掉封闭液。每孔加50 μL酶标多克隆抗体和50 μL样品(或为蛋白标准溶液),阴性对照孔用PBS代替。于37℃下反应0.5 h,反应完后用PBST洗3次。加底物液,于37℃下反应10 min,加10%的H2SO4溶液终止反应后酶标仪读数。采用棋盘法试验优化包被抗原和酶标抗体的最佳稀释倍数,建立花生蛋白分析方法。以蛋白质量浓度为横坐标,A/A0为纵坐标绘制标准曲线(A为样品或标准品的吸光度,A0为空白溶液的吸光度),使用Origin 7.5软件四参数拟合计算标准曲线的IC50。
1.2.4ELISA检测抗体特异性
选择其他植物蛋白饮料中常见的蛋白作检测对象,采用竞争ELISA方法检测抗体与其他蛋白之间的交叉反应,交叉反应率按照花生蛋白半抑制率与其他蛋白半抑制率的百分比计算。
1.2.5花生可溶蛋白提取
花生可溶蛋白的提取方法参照董贝森[9]报道的方法并略作改进,具体如下:干花生于40℃鼓风干燥箱内继续干燥48 h后,使用锤式旋风磨进行细粉碎,确保90%以上通过60目筛。称取10 g粉碎的花生粉,于40℃恒温条件下,使用1 000 mL蒸馏水分5次超声提取花生蛋白,每次提取时间为1 h。将5次提取的提取液合并,然后使用GB 5009.5—2010食品安全国家标准食品中蛋白质的测定中规定的凯氏定氮法测定可溶蛋白含量;使用1.2.4建立的酶联免疫法测定花生Ara h 1,Ara h 2,Ara h 9蛋白含量。其他用于交叉反应测试的坚果和豆类可溶蛋白均使用该方法提取。
1.2.6检测样品前处理
固体蛋白饮料采用含0.1%DTT的7 mol/L尿素作为样品提取液,提取固体蛋白饮料中的蛋白成分。采用捣碎、研磨等方法对固体样品进行均质处理,称取5 g样品,使用样品提取液定容至100 mL。超声提取10 min后离心,分离上清液,使用0.01 mol/L pH值7.4 PBS适当稀释至ELISA标准曲线线性范围(为避免变性剂和还原剂对ELISA的影响,至少需稀释100倍)。液体蛋白饮料直接加入DTT和尿素,使其添加量和终浓度分别为0.1%和7 mol/L,后续处理步骤同固体蛋白饮料。
1.2.7样品模拟热加工试验
花生的模拟热加工工艺参考张彩等人[10]的报道方法:采用蒸馏水对花生匀浆处理1 h,加入8%的蔗糖,0.08%的单甘油脂肪酸酯,0.12%的蔗糖脂肪酸酯,0.04%的黄原胶和0.05%的海藻酸钠;继续匀浆1 h后,以转速3 000 r/min离心10 min,保留上清液,分别采用巴氏杀菌(65℃,30 min)、超高温瞬时灭菌(137℃,4 s)、高压灭菌(121℃,15 min)进行热加工;采用1.2.6所述的前处理方法和1.2.4建立的ELISA方法进行检测。
2 结果与讨论
2.1ELISA方法
蛋白质是物种基因表达的产物,同样承载了大量的遗传信息。因此,通过蛋白质组学研究寻找物种蛋白的定量标志物是可行的。蛋白特异性定量的灵敏度和准确性一定程度上取决于蛋白定量标志物的选择是否准确。同时,由于免疫反应大多数在水系中进行,因此蛋白定量标志物必须为组织中的高丰度蛋白,且能溶于水。此外,在加工食品中,物种蛋白定量标志物必须具有热稳定性。由于花生是人类可食用蛋白质的重要来源之一,研究较为透彻。花生Ara h 1,Ara h 2,Ara h 9是花生中具有水溶性、热稳定性,且有着较高丰度的3种蛋白质[11]。ELISA是蛋白质定量检测的经典方法。在ELISA方法中,双抗夹心法因其具有特异性高、反应灵敏等优势,是检测大分子蛋白的经典反应模式,常被用于过敏原检测。然而在热处理过程中,部分蛋白发生水解使其不能同时被2个抗体结合。张世伟和王士峰等人[12-13]证明,竞争法检测经过热处理的蛋白比双抗夹心法定量更为准确。在竞争ELISA方法中,1个抗原分子只结合1个抗体,大分子蛋白即使被水解,只要抗原决定簇不受破坏,仍然可被抗体识别。因此,本研究基于竞争ELISA法,建立了检测花生Ara h 1,Ara h 2,Ara h 9蛋白的ELISA方法。
花生Ara h 1,Ara h 2,Ara h 9的竞争ELISA标准曲线见图1。

图1 花生Ara h 1,Ara h 2,Ara h 9的竞争ELISA标准曲线
传统方法进行蛋白抗体制备往往使用天然蛋白免疫实验动物,但本研究的目的主要是用于检测热加工食品,因此使用热处理后的变性蛋白更有利于筛选到识别热加工蛋白的特异性抗体。因此,本研究采用经还原剂和变性剂处理过的花生Ara h 1,Ara h 2,Ara h 9蛋白作为抗原,分别制备出相应的多克隆抗体,并以变性处理的蛋白为标准分析物建立了ELISA标准曲线。由图1可知,抗体检测花生Ara h 1,Ara h 2,Ara h 9蛋白的IC50分别为8.6,34.3,2.6 μg/mL;线性范围分别为1.0~50.0 μg/mL,5.0~100 μg/mL和0.2~10.0 μg/mL,相关系数均大于0.99。
2.2食品中花生蛋白的测定方法
根据方法选定的蛋白定量标志物,推算所检测对象中总蛋白含量的前提是定量标志物和总蛋白的比例不因物种的品系和产地差异而变化较大,然而基于花生品系之间这3种蛋白含量的差异尚未见报道。本研究通过市场、网络销售平台采集了来自国内9个品系的花生样品,主要研究蛋白定量标志物和可溶蛋白的比值,通过评估其比值变化以确定蛋白定量标志物,通过建立的ELISA方法分析其花生Ara h 1,Ara h 2,Ara h 9蛋白含量,通过凯氏定氮法测定其可溶蛋白含量。
不同花生品系中Ara h 1,Ara h 2,Ara h 9含量(n=6)见表1。

表1 不同花生品系中Ara h 1,Ara h 2,Ara h 9含量(n=6)
由表1可知,这3个蛋白在这9个品系中的相对标准偏差分别为7.0%,30.8%和34.1%。Ara h 2,Ara h 9品系间含量差异过大,因此不适合作为花生蛋白的定量标志物。本研究采用花生Ara h 1蛋白作为定量标志物,植物蛋白饮料中花生蛋白含量可使用以下公式计算:
C花生蛋白含量=C花生Ara h 1蛋白含量/0.15.
单位均为mg/g(固体)或mg/mL(液体)。
2.3方法的特异性
植物蛋白饮料可能同时存在几种植物蛋白和乳蛋白[14]。交叉反应试验结果表明,所建立的检测方法特异性较好,与包括其他种子蛋白和乳蛋白均无交叉反应。
与其他蛋白的交叉反应率见表2。

表2 与其他蛋白的交叉反应率
2.4热加工对蛋白定量的影响
由于蛋白在高温加热中会发生变性、水解、聚集等作用,这些作用将不同程度影响到定量的准确性。参照张世伟等人[12]报道的方法,本研究使用含0.1%DTT的7 mol/L尿素溶液溶解变性蛋白,将不同变性程度的蛋白还原为较为统一的状态,模拟花生蛋白饮料的加工工艺考察了3种杀菌方式对蛋白测定的影响,从而获得更准确的定量结果。
不同加热方式的花生蛋白ELISA检测结果比较见图2。
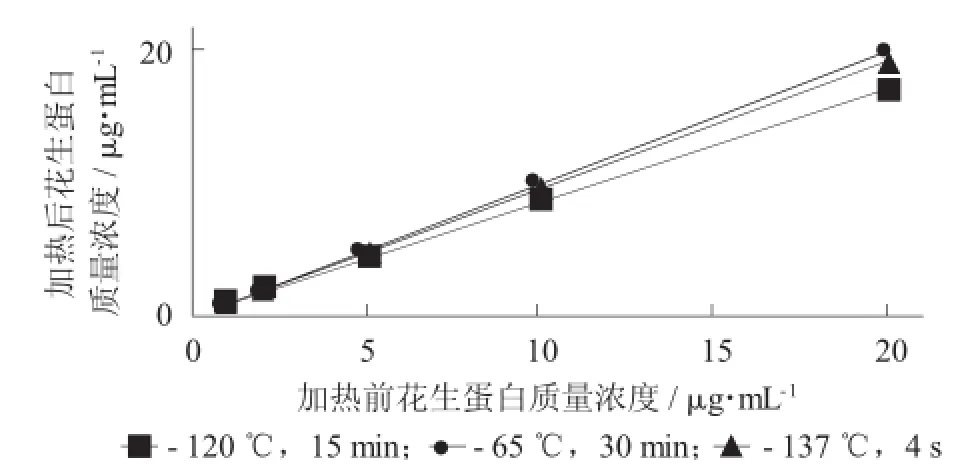
图2 不同加热方式的花生蛋白ELISA检测结果比较
由图2可知,基于以上优化的前处理方法和ELISA反应模式,对巴氏杀菌、超高温瞬时灭菌和高压灭菌的蛋白平均回收率分别为95%,93%和80%,结果说明本方法对热加工的花生蛋白定量较为可靠,但剧烈的热加工方式会对花生蛋白的定量结果准确性产生一定的影响。
2.5实际样品检测
从广州市场和网络销售平台随机购买花生乳、速溶花生粉样品,采用所建立的ELISA方法和国标GB 5009.5—2010规定的凯氏定氮法进行检测。
市售样品中花生蛋白含量检测结果(n=6)见表3。

表3 市售样品中花生蛋白含量检测结果(n=6)
由表3可知,4款花生乳按凯氏定氮法检测蛋白含量均合格(≥5 mg/g),然而通过特定蛋白定量发现,2款产品的花生蛋白含量远小于5 mg/g;速溶花生粉也有3款和凯氏定氮法有较大差异,说明其添加有其他种类的蛋白。尽管ELISA方法的相对标准偏差接近14%(大于凯氏定氮法),但是使用ELISA方法仍然能够检测出其中花生蛋白所占的比例,一定程度上反应出食品中特定原料的使用情况。
3 结论
植物蛋白饮料的特点是主要原料来源于特定的植物种子,然而QB/T 2438—2006规定其蛋白测定方法为凯氏定氮法,不能反映其原料的生物属性,因此存在使用廉价的牛奶蛋白、大豆蛋白配合香精香料冒充花生蛋白的可能。基于蛋白质组中蛋白定量标志物的定量方法,为珍贵的食用蛋白定量检测提供了可行的技术路线,也为食品掺伪检测提供了有效的技术手段。
[1]徐满清,郑为完.花生蛋白饮料的现状与展望 [J].食品研究与开发,2002,23(6):6-9.
[2]Ayako Y,Yutaka T,Takahiro N.Enzyme immunoassay for phycocyanin as the main component of Spirulina color in foods[J].Biosci Biotech Biochem,1996,60(1):57-60.
[3]Zhang S,Lai X,Liu X,et al.Competitive enzyme-linked immunoassay for sialoglycoprotein of edible bird's nest in food and cosmetics[J].J Agric Food Chem,2012,60(14):3 580-3 585.
[4]HarlowE,LaneD.Antibodies:Alaboratorymanual[M].New York:Cold Spring Harbor Laboratory Press,Cold Spring Harbor Laboratory Press,1988:139-242.
[5]Maleki S,Kopper R D,Park C,et al.Structure of the major peanut allergen Ara h 1 may protect IgE-binding epitopes from degradation[J].Journal of Immunology,2000,164(11):5 844-5 849.
[6]张英坤,陈红兵.离子交换层析法分离花生过敏原Ara h2的研究 [J].食品科学,2006,27(12):259-262.
[7]Lauer I,Dueringer N,Pokoj S,et al.The non-specific lipid transfer protein,Ara h 9,is an important allergen in peanut[J].Clinical&Experimental Allergy,2009,39(9):1 427-1 437.
[8]Wengatz I,Stoutamire D,Gee S J,et al.Development of an enzymelinked immunosorbent assay for the detection of the pyrethroid insecticide fenpropathrin[J].J Agric Food Chem,1998,46(6):2 211-2 221.
[9]董贝森.花生蛋白粉的制取及在食品工业中的应用 [J].中国油料作物学报,1998(3):85-89.
[10]张彩,童华荣,章道明,等.植物蛋白饮料配方优化研究 [J].西南农业大学学报,2006,28(2):197-200.
[11]隗啸南,高金燕,李欣,等.花生过敏原蛋白分离纯化方法研究进展 [J].食品科学,2011,32(17):371-375.
[12]张世伟,赖心田,洪晓明,等.竞争酶联免疫法测定食品中鸡蛋过敏原 [J].检验检疫学刊,2012(6):41-43.
[13]王士峰,张世伟,赖心田,等.高灵敏间接竞争ELISA检测羊乳样本中的牛乳成分 [J].中国乳品工业,2015,43(10):41-43.
[14]Zhang S,Lai X,Yang G.Enzyme-linked Fab'fragment based competitive immunoassay for ovalbumin in hot-processed food[J].Journal of Immunoassay and Immunochemistry,2013,34(4):393-403.◇
Development of Immunoassay for the Determination of Peanut Protein in Peanut Protein Beverage
WANG Yu,QI Ping,XIAO Jian,LIANG Zhian,WANG Chenglong
(Guangzhou Institute for Food Control,Guangzhou,Guangdong 510410,China)
The aim of this research is to develop competitive enzyme linked immunosorbent assay(ELISA)for quantitation of peanut protein in peanut protein beverage.Denatured Ara h 1,Ara h 2,Ara h 9 are used as antigen respectively to prepare polyclonal antibody and establish competitive ELISA.Ara h 1,Ara h 2,Ara h 9 content in peanut of 9 strains is detected. Based on the proportionate relationship between the soluble protein content and the Ara h 1 content,the calculation method of peanut protein in peanut protein beverage is given.The linear detection range of the competitive ELISA are all 1.0~50.0 μg/mL (R2=0.99) .The peanut protein content in peanut protein beverage could be calculated by dividing the Ara h 1 content by 0.15.The average recovery rates are 95%,93%and 80%under the sterilization condition of pasteurization,ultra high temperature treated and autoclaved sterilization,respectively.The relative standard deviations of the assay are<14%.
peanut;protein beverage;enzyme linked immunosorbent assay;quantitation
TS27
A
10.16693/j.cnki.1671-9646(X).2016.06.031
1671-9646(2016)06b-0016-04
2016-04-12
广州市科技计划项目(201510010035)。
王宇(1980— ),男,博士,中级工程师,研究方向为食品质量安全。

