异丙醇/盐双水相分离制备高色价栀子黄
郭晶莹,张红萍
异丙醇/盐双水相分离制备高色价栀子黄
郭晶莹,张红萍
(邵阳学院生物与化学工程系,湖南 邵阳 422000)
采用异丙醇/盐组成的双水相体系分离栀子黄。综合考察了盐的种类、浓度、pH值和温度等因素对栀子黄分离效果的影响,并且采用紫外-可见分光光度法和HPLC对异丙醇/盐双水相体系分离得到的栀子黄进行评价。结果表明,在35℃条件下由1.6g的柠檬酸三钠和2mL的异丙醇组成双水相体系,pH等于8.7,分离得到栀子黄和OD值分别为0.382、542。
栀子黄;分离;双水相
Gardenia jasminoides Ellis(Rubiaceae)的中文名字是栀子,是一种药食同源的药材。栀子中的主要成分是栀子苷和栀子黄,现代药理学研究表明栀子中的栀子苷具有多种药理作用,例如抑制肝硬化、降低血糖、预防动脉硬化和缓解失眠等[1-3]。栀子黄包括藏花素-1、藏花酸和少量的栀子苷,其中藏花素-1是藏花酸与单糖和二糖形成的酯类化合物,它是栀子黄中的主要成分。栀子黄是一种天然色素,广泛用于食品染色和染料敏化太阳能电池中[4]。到目前为止,从栀子中分离纯化栀子黄的方法有超临界CO2、结晶、色谱以及大孔树脂吸附等[5-8]。但是,这些方法存在耗时、生产成本高、操作繁琐等缺点。因此,需要建立一种简单有效的方法,低成本、高效率地从栀子中分离栀子黄。
自从Albertson首次引用双水相技术(ATPE)后,双水相技术就作为一种高效的分离方法运用到了生物活性成分的分离中,例如蛋白质、酶和抗生素的分离[9-11]。经典双水相体系是由两种互不相溶的高聚物或一种高聚物与一种无机盐组成,通过使用ATPE,可以得到高纯度和高收率的目标产物,并且不会破坏目标产物的生物活性。最近Pan使用传统的ATPS从栀子中成功分离得到栀子苷。这个双水相体系是由20%的环氧乙烷和80%的氧化丙烯、KH2PO4和乙醇组成的[12]。相对于高聚物/盐形成的双水相,短链醇/亲水溶剂组成的双水相体系具有以下的优点:低黏度,分相速度快,溶剂可以循环使用,低毒性。在异丙醇/盐ATPS中,异丙醇-K3PO4-H2O体系被成功用于人尿液中睾酮和表睾酮的分离提取[13]。目前为止,还没有使用异丙醇/盐双水相体系分离栀子黄的报道。
本试验以异丙醇/盐组成的双水相体系进行栀子黄的分离,讨论了盐的种类、浓度、pH值和温度等因素对栀子黄分离效果的影响。
1 实验材料
1.1 化学药品及试剂
栀子苷标准品(99.8% HPLC),藏花素-1(栀子黄,99.5%,HPLC),异丙醇,分析试剂盐,其它用于试验和检测的药物均是分析纯试剂。实验用水都是去离子水。C-18(SPD,日本)用于HPLC分析检测,分析检测过程中使用的溶剂是高效液相层析级溶剂。
2 实验方法
2.1 栀子果的粗提取液
从当地药店购买干燥的栀子果实。将栀子果研磨干燥,过0.42mm的金属筛,最终得到栀子果粉(500g)。采用索氏提取法,以石油醚(沸点60~90℃)为溶剂,去除果粉中的一部分多糖,然后将得到的果粉,用40%(4L)的乙醇冷凝回流2次,最终将乙醇提取液混合浓缩到1.0L,粗提取液在4℃条件下保存,备用。
2.2 双水相体系的建立
采用浊点法绘制异丙醇-盐双水相图[14]。实验操作如下:在15mL的离心管中,加入一定量的异丙醇,直至体系恰好形成浑浊,然后再滴加适量的水,使体系恰好形成浑浊。记录每个浊点时,异丙醇的添加量和体系的总质量。
2.3 双水相体系中分离栀子黄
为了考察双水相体系组成、盐的添加量、体系的温度和pH值对栀子黄分离效果的影响,进行如下实验:取1mL栀子果粉的粗提取物(1g·mL-1)添加到双水相体系中,在磁力搅拌下充分混合,然后静置40min,分离上下相,测量上下相的体积,使用紫外分光光度计测量上下相中栀子黄的含量。
2.4 分析方法
2.4.1 工作曲线的绘制
藏花素-1是栀子黄混合物中含量最高的色素,所以选用它作为衡量栀子黄含量的标准。测量不同浓度的藏花素-1在440 nm处的吸光度,绘制栀子黄的标准曲线见图1。
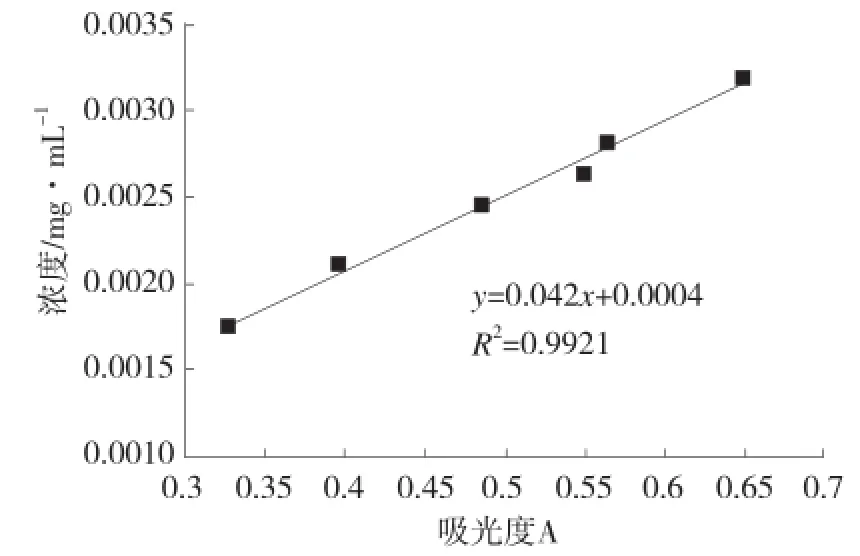
图1 栀子黄标准曲线Fig.1 The calibration curve of gardenia yellow
2.4.2 分配系数
栀子黄的分配系数(K)采用公式(1)计算:

式中,CT和CB分别是相平衡时栀子黄在上相和下相的浓度。
2.4.3 栀子黄的收率


式中,VT和VB分表代表上下相的体积。
2.4.4 栀子黄色价的测量
栀子黄的色价采用GB 7912-2010的标准要求进行测量。具体操作如下:取0.015g的栀子黄标准品溶解在去离子水中,然后将溶液转移到10mL的容量瓶中,定容;取1mL的液体,将其转移到10mL的容量瓶中,定容;用UV-2600紫外可见分光光度计测量栀子黄在440nm的吸光度(吸光度应控制在0.3~0.7)。栀子黄的色价和OD值的计算采用下述公式:

式中,E是栀子黄的色价,A是溶液在440nm处的吸光度,C是稀释后的栀子黄的浓度,g·mL-1。2.4.5 HPLC分析
用LC-20A的HPLC(二极管阵列检测器和C18色谱柱,4.6nm×250nm,5μm)检测藏花素-1。流动相是甲醇(溶剂A)和水(溶剂B,含有0.1%醋酸)。按如下比例进行洗脱:0~4min,20% A;4~40min,20%~90% A。 流 速:1.00mL·min-1;检 测 波 长440nm;进样量:10μL;柱温30℃。
3 结果与讨论
3.1 盐的种类和用量对双水相体系的影响
为了选择一个最佳的双水相体系,在室温下,研究了不同的盐(磷酸氢二钾、硫酸铵、柠檬酸三钠、碳酸钾)和异丙醇形成的双水相体系对栀子黄的分离效果,结果如表1所示。当使用2mL的异丙醇与盐形成的双水相,加入的粗提取液的体积是1.0mL时,这4种盐对栀子黄的提取率影响有所不同。实验结果显示,当盐的含量增加时,栀子黄在上相的K和Y都随之增加。造成这一结果的主要原因是:随着盐含量的增加,高浓度的盐引起盐析作用,导致上相异丙醇含量升高,由此可以看出栀子黄易溶于异丙醇中。从表1可以看出,异丙醇-硫酸铵和异丙醇-柠檬酸三钠对栀子黄色素回收率的影响相近。使用2.0g的硫酸铵形成双水相,栀子黄在上相的分配系数和回收率分别是15.11和87.17%。对于2.0g的柠檬酸三钠形成的双水相体系,栀子黄的分配系数和回收率分别是13.87和86.44%。从环保的角度来说,使用柠檬酸三钠比硫酸铵更合适,因为硫酸铵易引起湖泊的富营养化,而柠檬酸三钠则可以被生物降解,对环境污染较小。因此,异丙醇-柠檬酸三钠更适合用于栀子黄在上相的富集,同时,粗提取液中含有的其它成分进入到双水相的下相。基于上述事实,后续的试验选用2g的柠檬酸三钠与异丙醇形成的双水相作为栀子黄的分离体系。

表1 不同盐形成的双水相体系对栀子苷和栀子黄富集体系的影响Table 1 Extraction of gardenia yellow using differrent isopanol/salt ATPS
3.2 温度对双水相体系的影响
为了考察温度对栀子黄分离效果的影响,本试验考察20℃、25℃、30℃、35℃、40℃下栀子黄的分离效果,其它实验均设在上述的最佳实验条件下,实验结果如图2所示。从图2中可以看出,栀子黄在上相的收率随着温度的升高而升高。但是,在20~40℃范围内,栀子黄在上相的收率变化都在80%左右。由此可见,温度对栀子黄分离效果的影响很小。接下来的实验都在室温下进行。
3.3 pH对双水相体系的影响

图2 温度对栀子黄收率的影响2.0mL isopropanol, 2g sodium citrate and 1.0mL crude xtracts of gardenia fruitsFig.3 Effect of temperature on the recovery of gardenia yellow
为了确定分离栀子黄的最佳双水相体系,需要考察pH值对栀子黄分离效果的影响。采用不同体积比例的0.1mol·L-1HCl和0.1mol·L-1NaOH,调节体系上相的pH值,使pH在2~12之间,而其它的参数均为上述得到的最佳参数,结果见表2。

表2 pH对栀子黄分离效果的影响Table 2 Effect of pH on gardenia yellow partition behavior using isopropanol/ sodium citrate ATPS
由表2可知, 随着体系pH值的改变,栀子黄在上相的收率有一个很小的波动,但是收率基本在82%~85%之间变化。
3.4 正交试验
根据单因素试验的结果,选取影响栀子黄提取效果各因素中有意义的水平做正交试验,对结果进行极差分析,以确定最佳的提取条件。采用L9(34)正交表,以柠檬酸三钠(A)、温度(B)、pH(C)作为3个考察因素,选取3个水平进行试验。

表3 异丙醇-柠檬酸三钠分离栀子黄工艺L9(34)正交实验因素水平表Table3 Factors and levels for L9(34) orthogonal design

表4 异丙醇-柠檬酸三钠提取栀子黄工艺L9(34)正交试验设计及结果Table4 L9(34) orthogonal design and results
由表4的极差分析结果看出,这3个因素对异丙醇-柠檬酸三钠分离栀子黄的影响大小依次为:柠檬酸三钠的添加量(A)>温度(B)>pH(C)。3个因素中,柠檬酸三钠和温度的影响较为显著,其中,柠檬酸三钠的添加量对分离效果影响最为显著。在试验设计范围内,优化得到分离栀子黄的最佳试验条件为A2B3C3,即柠檬酸三钠1.6g,提取温度35℃,pH值为8.7。
3.5 双水相分离栀子黄效果评价
取等体积的栀子黄粗提取液,按照上述最佳试验结果提取栀子黄,对得到的栀子黄进行HPLC分析(检测波长440nm,检测器:紫外检测器)。从HPLC分析(图3)可以看出,栀子黄标准品的保留时间为21.2min,经过双水相分离得到的栀子黄的保留时间也在21.2min,产物的纯度达到87.6%。采用紫外分光光度法测定双水相体系中上相的栀子黄含量,通过栀子黄的标准曲线和栀子黄色价的计算方法得到的栀子黄的色价是542,OD值是0.382。与通过部分传统方法得到的栀子黄的色价和OD值相比,此色价和OD值较好。由此可以看出,ATPE可以用于栀子黄的提取。

图3 HPLC分析a. crocin-1 reference substance; b. fraction into gardenia yellow after ATPEFig.3 HPLC chromatograms with UV detection at 440nm
4 结论
本实验探究了栀子黄在异丙醇-柠檬酸三钠体系中的分配情况。正交实验结果表明,在35℃条件下,1.6g柠檬酸三钠和2mL的异丙醇,在pH=8.7的条件下,栀子黄更容易富集于上相,而多糖等杂质则富集于下相。相比传统的分离方法,异丙醇-柠檬酸三钠双水相萃取得到的栀子黄,具有很高的色价和OD值。
运用此双水相体系分离栀子黄,不仅降低了分离栀子黄的成本,还缩短了分离时间。该体系在分离栀子黄色素中的成功应用,不仅拓宽了异丙醇-盐双水相体系的应用范围,也为栀子黄的分离提供了新的方法和思路。
[1]Ji-Hyun Park, Jaewoo Yoon, Ki Yong Lee, et al.Effects of geniposide on hepatocytes undergoing epithelial mesenchymal transition in hepatic fibrosis by targeting TGFβ/Smad and ERK-MAPK signaling pathways [J]. Biochimie, 2015 (113):26-34.
[2]Song Xiaojing, Guo Mengyao, Wang Tiancheng, et al. Geniposide Inhibited lipopoly-saccharide-induced Apoptosis by Modulating TLR4 and Apoptosisrelated Factors in mouse Mammary Glands[J]. Life Science, 2014, 119(1/2):9-17.
[3]Liu Jianhui, Yin Fei, He Xiao, et al. Glucagon-like peptide receptor plays an essential role in geniposide attenuating lipotoxicity-induced β-cell apoptosis[J]. Tocicology in vitro, 2012, 26(7): 1093-1097.
[4]Oh Oun Kwon, Eui Jin Kim, Jae Hyeok Lee, et al. Photovoltaic performance of TiO2electrode adsorbed with gardenia yellow purified by nonionic polymeric sorbent in dyesensitized solar cells[J]. Spectrochimical acta Part A: Molecular and Biomolecular Spectroscopy, 2015(136): 1460-1466.
[5]李雄,陈茜文.栀子黄色素的二氧化碳超临界萃取研究[J].湖南农业科学,2010 (1):93-95.
[6]张德权,吕飞杰,台建祥,等.超临界CO2流体技术精制栀子黄色素的研究[J].农业工程学报,1999,15(4):226-230.
[7]蒋志国,陈文学,刘四新,等.低速逆流色谱分离制备栀子黄色素中的藏花素[J].色谱,2011,29(3):277-280.
[8]吕晓玲,姚中铭,姜平平.凝胶层析法精制栀子黄色素的研究[J].食品与发酵工业,2001,27(4):39-42.
[9]Natália Luiza Penna Dallora, João Gabriel Degam Klemz. Partitioning of model proteins in aqueous two-phase systems containing polyethylene glycol and ammonium carbamate[J]. Biochemical Engineering Journal, 2007(34): 92-97.
[10]Mirjana G. Antov, Draginja M. Pericin, Milica G. Dašic. Aqueous two-phase partitioning of xylanase produced by solid-state cultivation of Polyporus squamosus[J].Process Biochemistry, 2006(41): 232-235.
[11]Babak Mokhtarani, Ramin Karimzadch, Mohammad Hassan Amini, et al. Partitioning of ciprofloxacin in aqueous two-phase system of poly(ethylene glycol) and sodium sulphate[J]. Biochenical Engineering Journal, 2008(38):241-247.
[12]I.-Horng Pan, Hsi-Ho Chiu, Chu-Hsun Lu, et al. Aqueous two-phase extraction as an effective tool for isolation of geniposide from gardenia fruit[J]. Journal of Chromatography A, 2002(977): 239-246.
[13]Liu Hailing, He Chiyang, Wen Dawei, et al. Extraction of testosterone and epitestosterone in human urine using 2-propanol-salt-H2O system[J]. Analytica Chimica Acta, 2006, 57(1/2): 329-336.
[14]Mohammed Taghi Zafarani-Moattar, Sepideh Banisaeid,Mohammad Ali Shamsi Beirami. Phase Diagrams of Some Aliphatic Alcohols+Potassium or Sodium Citrate+Water at 25℃[J]. Chem. Eng. Data., 2005(50): 1409-1413.
Abstrat:Gardenia yellow was separated by employing isopropanol-salt aqueous two-phase system. The factors such as kinds of salt,concentration of the salt, pH and temperture on the gardenia yellow separation efficiency were investigated, and the gardenia yellow was analyzed by spectrophotometric method and HPLC. The results showed that the aqueous two-phase system which was formed by isopropanol alcohol(2mL) and sodium citrate (1.6g)was effective for the separation of gardenia yellow from gardenia fruit in 35℃ and pH=8.7,and the color value and the OD of the gardenia yellow were 542 and 0.382,respectively.
Separation of Gardenia Yellow by Isopropanol Alcohol/Salt Aqueous Two-Phase System
GUO Jing-ying ,ZHANG Hong-ping
(Department of Chemistry and Biology Engineering, Shaoyang University, Shaoyang 422000, China)
gardenia yellow; separation; aquous two phase system
TS 202. 3
A
1671-9905(2016)03-0007-05
邵阳市科技局科研项目(2015GX38);邵阳学院研究生科研创新项目(CX2015SY035),
郭晶莹(1987-),女,河南许昌人,邵阳学院2014级硕士研究生,研究方向:食品安全
通讯联系人:张红萍(1973-),女,汉族,湖南邵阳人,教授,主要从事有机合成研究。E-mail: zhp4901@163.com
2016-01-13

