缬沙坦胶囊的处方设计
朱宇阜宁县食品药品监测所 (阜宁224400)
缬沙坦胶囊的处方设计
朱宇
阜宁县食品药品监测所(阜宁224400)
摘要选用“Diovan”、缬克进行对照研究,采用粉末直接灌装对缬沙坦胶囊进行了研制。通过反复实验确定了缬沙坦胶囊中各种辅料的用量并进行处方筛选
关键词粉末直接灌装;缬沙坦;溶出度;有关物质;稳定性中图分类号:R914
文献标识码:A
文章编号:1003-3319(2016)01-00026-02
1 处方筛选及工艺设计思路
通过查阅FDA批准的“Diovan”说明书,使用的辅料包括微晶纤维素、交联聚维酮、微粉硅胶、硬脂酸镁。经处方分析,其中微晶纤维素作为填充剂,交联聚维酮为崩解剂,微粉硅胶为助流剂,硬脂酸镁为润滑剂。因此,为保证研制品与被仿制品特性基本等同,我们参照国外处方,选择优质辅料进行处方筛选。另外,市售品“缬克”内容物为粉末状,并有少量细颗粒,因此,我们采用粉末直接灌装工艺。
2 处方筛选和工艺研究
2.1剂型选择依据
本品主要成份为缬沙坦:(S)-N-戊酰基-N-{[2′-(1H-5-四氮唑-基)[1,1′-联二苯]-4-基]甲基}-缬氨酸。分子式:C24H29N5O3,分子量:435.52。
缬沙坦为白色结晶或白色、类白色粉末;无臭,无味;在乙醇中极易溶,在甲醇中易溶,在乙酸乙酯中略溶,在水中几乎不溶。
2.2赋形剂的选择
根据Diovan、缬克的说明书了解到缬沙坦胶囊的规格为80mg,本品为仿制品,为了保持产品质量和稳定性一致,我们选择缬克使用的辅料种类,结合缬克的装量和工艺,在此基础上对各种辅料的使用量做进一步筛选和优化。
2.3处方筛选
3.1辅料在处方中的作用
微晶纤维素填充剂;硬脂酸镁润滑剂;微粉硅胶助流剂;交联聚维酮崩解剂
3.2原料粒径范围筛选
采用粉末直接填装工艺,原料粒径对溶出度、流动性及均匀性有较大影响,故对原料粒径进行考察,以溶出度为考察指标。分别取过80目、100目、120目的原料约80mg直接填装胶囊,照缬沙坦胶囊加正标准WS1-(X-240)2003Z(修订)“溶出度”项下方法进行试验,并分别于5、10和30分钟取样,测定溶出度。三种原料溶出度如表1所示。
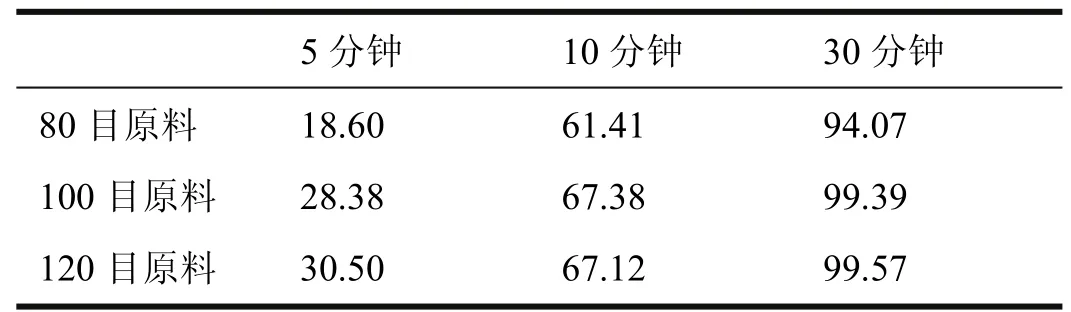
表1 三种原料溶出度
由上表可知,不同粒径范围的原料在30min内溶出度均超过90%,80目原料的溶出度略低于100目和120目。但粒径降低时,极易产生静电,对流动性和均匀性有较大影响。故从实际生产的可操作性考虑,原料过80目筛即可。
3.3微晶纤维素用量范围考察
称取原料及微晶纤维素适量,其中微晶纤维素分别占40%、50%、60%、70%(w/w),混合均匀,测定休止角。结果微晶纤维素用量在40%、50%、60%、70%时测得休止角分别为49º、47º、47º、46º。
上表结果表明,MCC用量在50%以上时,流动性较好,增加用量,流动性未见显著改善,故其用量应控制在50%用量以上。
3.4PVPP用量范围考察
固定装量以及原料、微粉硅胶、硬脂酸镁用量,调节PVPP用量,同时调节MCC用量,制备胶囊,测定30min时溶出度。各处方的原料、微粉硅胶、硬脂酸镁、PVPP、MCC的用量(mg)、溶出度(%)如表2所示。

表2 MCC用量变化对实验结果的影响
表2结果表明,增加PVPP用量,溶出度略有改善,用量超过6%(w/w)时,溶出度增加不明显,故选择PVPP用量为6%(w/w)。
3.5硬脂酸镁用量考察
固定原料、微粉硅胶、PVPP用量及装量不变,调节硬脂酸镁用量,分别占1%、3%、5%(w/w),混合均匀,测定休止角。原料、微粉硅胶、硬脂酸镁、PVPP、微晶纤维素的用量(mg)、休止角(°)结果如表3所示。
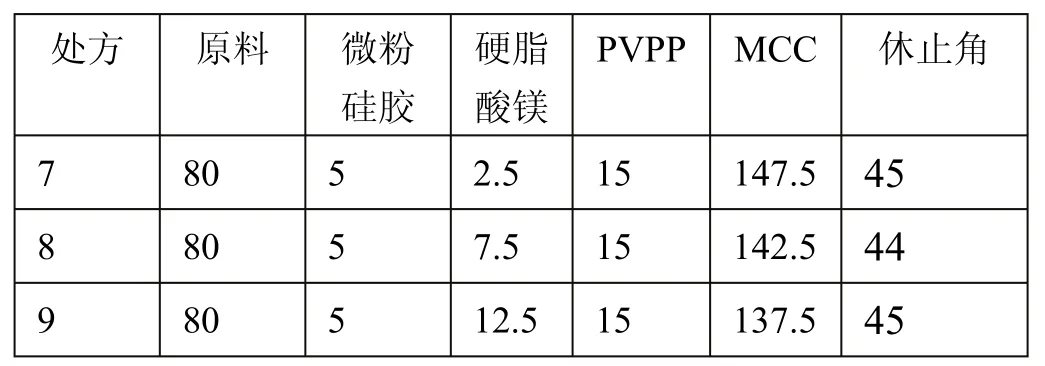
表3 硬脂酸镁用量变化对实验结果的影响
上表结果表明,增加硬脂酸镁用量对流动性影响不大,故硬脂酸镁用量为1%。
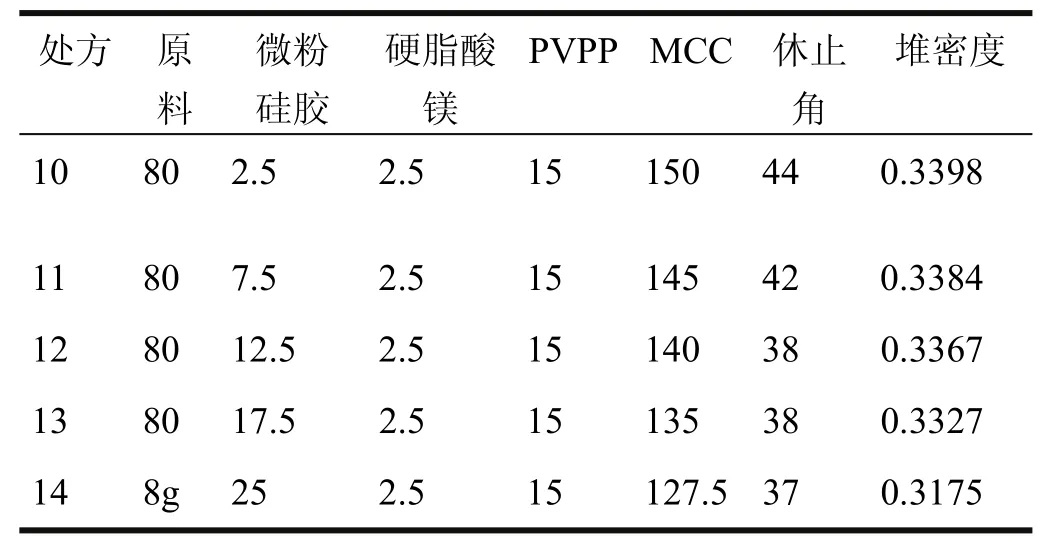
表4 微粉硅胶用量变化对实验结果的影响
3.6微粉硅胶用量考察
固定原料、硬脂酸镁、PVPP用量装量不变,调节微粉硅胶用量,使分别占总重的1%、3%、5%、7%、10%,混合均匀。原料、微粉硅胶、硬脂酸镁、PVPP、微晶纤维素、休止角(°)、堆密度(g/cm3)结果如表4所示。
表4结果表明,增加微粉硅胶用量,流动性略有改善,但堆密度略微降低。为兼顾堆密度和流动性,拟定微粉硅胶用量5%。
3.7处方优化
固定原料、硬脂酸镁及装量(250mg),调节其他辅料用量,测定休止角、堆密度、溶出度。各处方中缬沙坦、微粉硅胶、硬脂酸镁、PVPP、微晶纤维素的用量(mg)、休止角(°)、堆密度(g/cm3)、溶出度(%)数值如表5所示:

表5 其他辅料用量变化对实验结果的影响
上表结果表明,微量调节辅料的用量,各项指标加异很小。考虑到微粉硅胶、PVPP对吸湿性及溶出度有一定的影响,故选择处方15、处方16作为较优处方。
按处方15及处方16制备胶囊,作影响因素考察,分别取样品置高温(60℃及40℃)、高湿(RH92.5%及RH75%)、强光照射(4500±500Lx)条件下,分别于第5天、10天取样,观察外观,测定增失重、含量、有关物质、溶出度,并将结果与0天进行比较。结果两处方在RH92.5%条件下5天吸湿增重均超过5%,故未对其他指标进行测定;在60℃条件下,两处方有关物质增加明显,故选择在40℃时进行考察。处方15RH75%湿度下吸湿增重低于处方16,且有关物质低于处方16,故选择处方15为最优处方。
参考文献
[1]“Diovan”缬沙坦胶囊说明书.常州四药制药有限公司生产上市销售的缬沙坦胶囊(商品名:缬克)所附说明书.
[2]缬沙坦胶囊国家药品标准WS1-(X-240)-2003Z
[4]国家药典委员会.中华人民共和国药典[M].中国医药科技出版社,2005
(责任编辑:文婷)

