金纳米棒的合成、光学特性、修饰及其在生物学中的应用
徐冬梅,刘建,高军,刘迪,刘晓伟(山东科技大学化学与环境工程学院,山东 青岛266590)
综述与专论
金纳米棒的合成、光学特性、修饰及其在生物学中的应用
徐冬梅,刘建,高军,刘迪,刘晓伟
(山东科技大学化学与环境工程学院,山东 青岛266590)
摘要:由于具有独特的光学和电子特性,金纳米棒受到人们越来越多的关注。金纳米棒的这些性质主要取决于它自身的形状、大小和长径比。尤其金纳米棒独特的、可调的表面等离子体共振特性,使其在生物标记、生物成像及生物医学等领域有非常广阔的应用前景。本论文详细介绍了金纳米棒的几种合成方法及其光学特性和金纳米棒的表面修饰手段,综述和比较了金纳米棒在生物分子探针技术、荧光探针和癌症诊断和光热治疗领域的研究进展,对其存在的问题做了具体分析并对金纳米棒在生物学中的应用方向进行了展望。
关键词:金纳米棒;合成方法;光学性质;表面修饰;生物应用
贵金属纳米颗粒因其特殊的光电特性而广泛应用于光电信息存储和生物医学等领域。其中金纳米棒由于其特殊的物理性质而备受关注。金纳米颗粒表面电子的运动局限于纳米尺度内,使其具有不同于宏观物质的特殊性能,而这种性能受其形状和大小的影响[1]。
最初,人们发现了各向同性生长方式的球形纳米粒子,为了得到更多其他形状的纳米颗粒,研究者不断探索如何获得各向异性生长的反应条件。在20世纪90年代中期,第一类各向异性的纳米棒被发现。金纳米棒具有化学和光学的各向特异性,同时它与球形的纳米颗粒类似,因表面等离子体激元共振(surface plasmon resonance,SPR)效应导致其可以吸收不同波长的光。金纳米棒具有横向和纵向两个不同表面带,即横向表面等离子体激元共振和纵向表面等离子体激元共振。在可见光和近红外区,表面等离子体激元的横向吸收峰主要在500nm左右,但表面等离子体激元的纵向吸收峰可以实现人为调控[2],它随着金纳米棒的长径比和整体尺寸而变化,这样可以实现金纳米棒对光的强吸收及发射较强的散射光,也可以控制金纳米棒对周围介质的敏感程度[3]。
相比于其他的纳米材料,金纳米棒因其独特、可调的表面等离子特性,在生物医学等领域显示出更大的优越性。金纳米棒的合成通常在十六烷基三甲基溴化铵(CTAB)存在下完成,如果CTAB对金纳米棒的包覆结构遭到破坏,金纳米棒就容易出现部分或完全聚集。然而金纳米棒表面过多的CTAB分子会对人体细胞和生物体产生毒性,在一定程度上干扰生物免疫过程,并且金纳米棒表面包覆的CTAB分子也在一定程度上阻碍金纳米棒与生物分子的偶联[4],所以对金纳米棒表面进行修饰和改性,提高其稳定性并降低其生物毒性是金纳米棒在涉及生物体系应用中需要解决的关键问题。本论文阐述了金纳米棒的合成方法、光学特性、表面修饰及其在生物领域中的应用。
1 金纳米棒的合成
1.1 电化学法
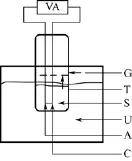
图1 电化学合成法的装置示意图
最先报道的合成高质量的金纳米棒的方法是电化学法,后来这种方法成为晶种生长法的先驱[5]。20世纪90年代,WANG等[5]报道的金纳米棒是在双电极电池下完成的,如图1所示。其中金板作为阳极,铂板作为阴极,两者都嵌入到电解池当中。用十六烷基三甲基溴化铵和四溴十二烷基铵(TDTAB)的混合表面活性剂溶液作为电解池溶液也可以得到一定长径比的纳米棒。电解过程金离子以 AuBr-的形式从阳极经由电解池移动到阴极,最后在阴极被还原成金单质。银板逐渐嵌入到电解池中以控制金纳米棒的长径比,其中银离子的消耗量是通过金离子和银板之间的氧化还原反应来实现的。反应体系中也会添加少量丙酮和己烷以促进棒状结构的形成,整个过程处于超声状态[6],如图2。

图2 两个不同长径比的金纳米棒电镜图[5]
1.2 晶种生长法
晶种生长法是合成金纳米棒最普遍的方法,该方法过程简单,能合成高质量、高产率的金纳米棒,且形状大小容易控制。MURPHY等[7]用四氯金酸代替了电化学中的金板作为金源,用较弱的还原剂抗坏血酸(AA)和硝酸银取代了电化学中的氧化还原反应,将原来的混合表面活性剂体系 CTAB和TDTAB换成了CTAB一种,但保留原来的丙酮和己烷。在这个合成方法中。低浓度的AA并没有把四氯金酸还原成金属态,而是以 Au–存在。然而加入3nm的金粒子(作为晶种)后,接着生长溶液在金粒子表面催化作用下,Au–被氧化成金单质,逐渐变成类球形,最后形成棒状结构。人们已经证实加入的晶种越少,金纳米棒的长径比越高,然而金纳米棒的产率仍然很低,会产生较多的球形粒子。将晶种溶液添加到不同的生长溶液中可以控制金纳米棒的长径比。
2003年,EL-SAYED等[8]将这种方法改进,大大降低了球状粒子的产率,提高了棒状结构的产率,如图3(a)所示。由这种方法开创了两种体系,一种是用高浓度的CTAB包覆晶种,再加上一定浓度的硝酸银会得到95%以上的棒状产率,长径比可达到4.5,纵向表面等离子体共振吸收峰波长可达到850nm,如图3(b)所示;另一种是CTAB和苯基二甲基十六烷基氯化铵(BDAC)混合作为表面活性剂,这种体系获得的金纳米棒长径比可达到10,纵向表面等离子体共振吸收峰波长可达 1300nm,如图3(c)所示。
通过控制硝酸银和四氯金酸的浓度可以在一定程度上调节纵向表面等离子体共振吸收峰的位置。其吸收峰的位置会随着硝酸银和四氯金酸的浓度增加而向长波方向移动,但是浓度增加到一定程度后,反而会抑制其移动,如图3(d)所示。JIANG等[9]发现每一批合成的金纳米棒的纵向表面等离子体共振吸收峰的位置都会有不同,这与许多因素有关,尤其是与晶种的关系最为密切。由于合成晶种需要加入硼氢化钠,而硼氢化钠的加入量稍微有所增加,杂质就会大大增加[10]。这种规律在晶种的颜色上就可以轻易分辨出来。另外,四氯金酸与AA比例的变化会导致纵向表面等离子体共振吸收峰位置的变动,已发现比例减小会产生较短的金纳米棒及较低的吸收峰位。最近MURRAY等[11]报道了一种合成金纳米棒的新技术-采用芳香族添加剂和低浓度CTAB。这种方法已被证实可以得到高长径比的金纳米棒,并且产生的杂质较少。
尽管晶种生长法能产生较高收率的金纳米棒,其中有许多参数,如种子溶液的浓度、老化时间、温度、pH和CTAB浓度的变化都会显著影响到金纳米棒的形状、长径比、产量以及吸收峰的位置[12-18]。如需重复合成出某个长径比的金纳米棒,必须保持所有关键参数的一致性。
1.3 其他方法
除了电化学法、晶种生长法外,其他金纳米棒的合成方法有模板法、电子束光刻法、光化学合成法[19]等。模板法是利用聚碳酸酯或氧化铝膜为模板,采用电化学沉积也是合成金纳米棒的一种方法。这种方法最初用于合成微电极[20],用该方法合成的金纳米棒长度很难控制,且产率很低。
2 金纳米棒的光学性质

图3 晶种生长法合成金纳米棒的紫外光谱图及其电镜表征图[8]
相对于块体金属材料而言,金属纳米材料有着优越的光学性质。当光入射到金属纳米颗粒表面时,如果入射光子频率与金属传导电子的振动频率相匹配,纳米颗粒就会对该入射光有很强的吸收,从而发生局域表面等离子体共振(localized surface plasmon resonance,LSPR)现象[21]。光电场与纳米粒子中的自由电子相互作用,导致自由电子与金属原子核分离,而自由电子之间的库仑排斥力作为一种“恢复力”,又促使自由电子往反方向运动,因此造成自由电子的集体振荡,即产生 LSPR。不同尺寸、形状或不同材料的金属纳米颗粒会呈现不同的吸收能力,同时也显示出不同的颜色。对金纳米棒而言,其结构的各向异性会在吸收光谱上产生两个吸收带,如图4(a)是金纳米棒发生横向和纵向表面等离子体共振,图4(b)分别对应着两个共振吸收峰,横向表面等离子体共振吸收峰和纵向表面等离子体共振吸收峰。金纳米棒的横向表面等离子体共振已被发现对金纳米棒的大小和周围折射率的变化反应不敏感,相反纵向则十分敏感。因此,纵向表面等离子体共振的性质很大程度上依赖于金纳米棒的尺寸、形状及周围介质的介电常数。随着长径比的改变,纵向吸收峰的位置能在可见光-近红外较宽波段内发生位移,而横向吸收峰位置移动较小。所以,不同长径比的金纳米棒溶液可以显示出蓝色、褐色和红色等不同颜色[22]。
如图4所示,对于金属纳米棒而言,GANS预测,对于小的、椭球形、偶极近似纳米粒子,由于表面的曲率和几何形状的不同,表面等离子体形式可分为两种完全不同的形式。在解释金纳米棒的光学性质时,这些小棒普遍被视为椭球体。因此GANS理论可以应用于描述金纳米棒的光学特性[23]。根据GANS方程,EL-SAYED等[24]对金纳米棒的吸收光谱模拟出其长径比的参数(介质的介电常数恒定的情况下),如图5(a)。从光谱图中可以看出:在可见光和近红外光区域分别出现了较弱的横向表面等离子体共振和较强的纵向表面等离子体共振两个吸收峰,其中纵向吸收峰位置随长径比的增加发生红移,横向移动则很小。图5(b)是根据金纳米棒的吸收光谱模拟出其介质的介电常数的函数(长径比恒定的情况下),从图5(b)中可以看出,两个吸收峰都随介质的介电常数增加而发生位移,但纵向吸收峰波长的红移量大得多,这表明纵向表面等离子体共振对周围介质的介电常数的变化更敏感。
3 金纳米棒的表面修饰技术
在应用到生物化学和生物医学等领域时,需要金纳米棒具有较好的生物相容性和胶体稳定性。对于晶种生长法和电化学法合成的金纳米棒,其表面都覆盖了带有正电荷的CTAB双分子层。在金纳米棒的制备过程中,CTAB不仅在控制粒子成形时起结构导向剂的作用,而且能防止金纳米棒聚集,起稳定剂和保护剂的作用。然而CTAB包覆的金纳米棒仅在较低pH的溶液中表现出很好的稳定性,当转移到其他溶液中,如有机溶剂,金纳米棒则易发生聚集,而且CTAB包覆的金纳米棒还会抑制细胞的内吞作用[25]。为了改良金纳米棒的稳定性和生物相容性,避免金纳米棒的聚集,合适的表面修饰是金纳米棒在涉及生物功能化及生物体系应用中需要解决的关键问题。
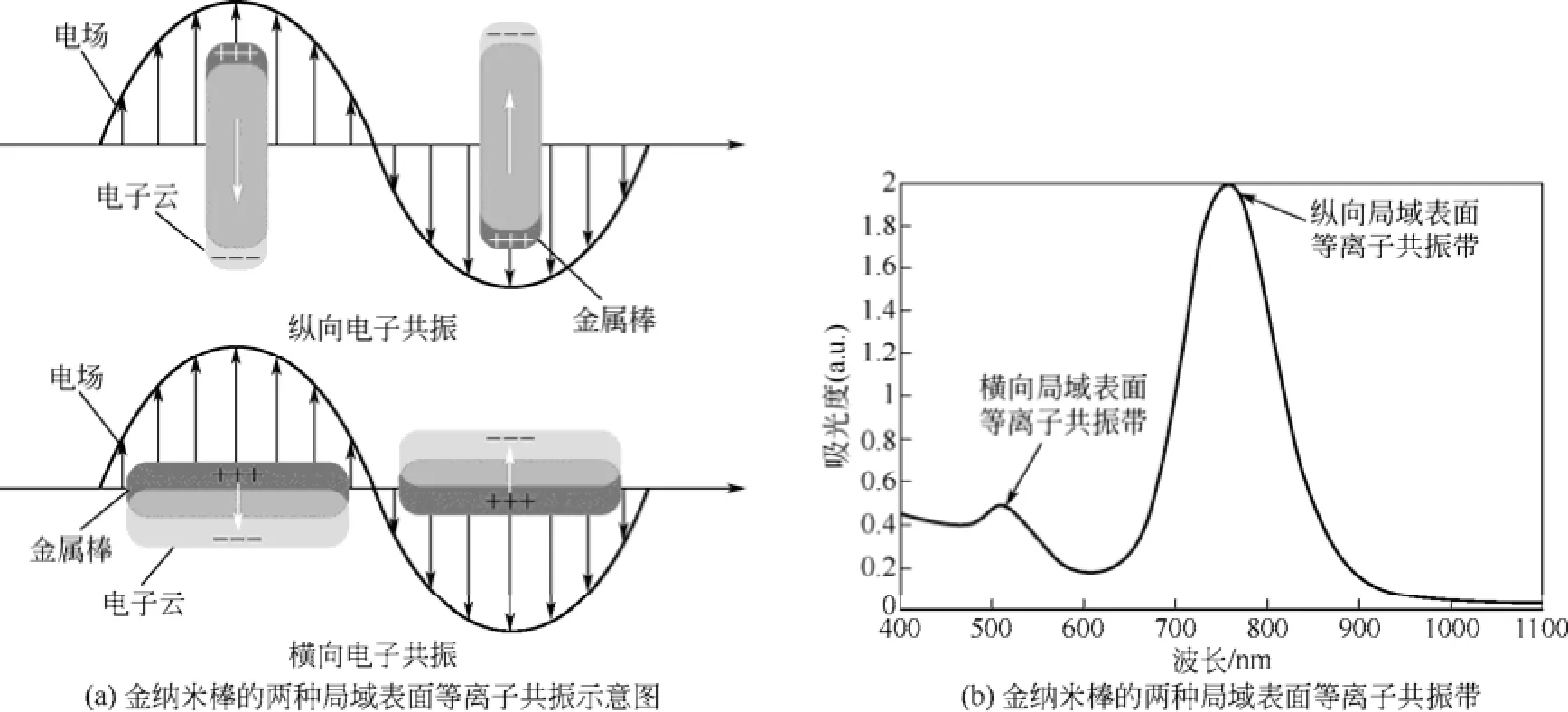
图4 金纳米棒的局域表面等离子体共振图[22]
目前,对CTAB包覆的金纳米棒进行表面修饰,有多种方法相继提出。通常情况下,金纳米棒的表面修饰有两种途径:一种是配体交换,指表面修饰分子,通常是一些小分子化合物,与金纳米棒表面依靠化学键结合;另一种是表面包覆,指用有机或无机材料(通常是高分子材料、生物分子和表面活性剂等)直接包覆金纳米棒[26]。
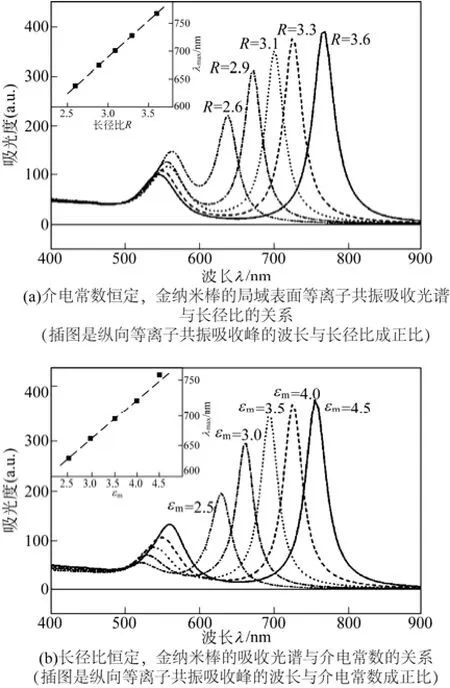
图5 金纳米棒的局域表面等离子共振吸收光谱与其各影响因素的关系[24]
3.1 配体交换法
该方法是用巯基化合物作为配体取代CTAB双分子层,利用Au—S共价键将巯基化合物稳固地结合在金纳米棒表面。表面修饰后的金纳米棒再经过化学或生物手段功能化后,可以广泛应用于生物化学和生物医学等领域。另外,移除CTAB分子后可以有效降低金纳米棒的生物毒性。但同时,修饰过程中由于金纳米棒失去CTAB分子的保护,导致金纳米棒聚集的概率大大增加。因此,修饰过程需严格控制实验条件,以避免金纳米棒的聚集。巯基化合物聚乙二醇(mPEG-SH)是在金纳米棒表面修饰中一个常用的配体。由于聚乙二醇(PEG)是水溶性的聚合物,因此可以在水中对金纳米棒进行修饰。另外,PEG在一些有机溶剂中具有较高的稳定性,在体内也有较广泛的应用。HAFNER等[27]利用mPEG-SH,置换一部分金纳米棒表面的CTAB分子,得到了稳定的金纳米棒。但是PEG分子的偶联步骤繁琐、耗时,因此寻找一种生物小分子且生物修饰简单易操作的方法是十分重要的。
很多研究指出11-巯基十一烷酸(MUA)能够完全的置换CTAB分子,实现金纳米棒的表面修饰[28]。MUA是一端带有羧基的巯基化合物,当MUA分子共价结合到金纳米棒表面后,再经过 1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC)/N-羟基琥珀酰亚胺(NHS)交联剂作用,生物分子就很容易地结合到金纳米棒表面上,有利于金纳米棒在生物医学等领域的应用。然而,MUA不是水溶性的,它仅溶于有机溶剂,如乙醇和氯仿,而金纳米棒在有机溶剂中不稳定,直接用MUA修饰会导致金纳米棒聚集。2007年,YU等[29]报道一种用MUA完全置换金纳米棒表面上的CTAB分子的新方法。将溶有MUA的乙醇溶液添加到金纳米棒溶液中,不断超声处理以避免金纳米棒的聚集,得到MUA修饰的金纳米棒。尽管用MUA修饰的金纳米棒已经广泛地应用于生物医疗等领域,但是实验过程还是会发生金纳米棒的聚集,这需要严格地控制实验条件,以避免聚集的发生。
3.2 表面包覆法
这种方法是指无机纳米材料、表面活性剂利用化学结合或物理吸附等方法在金纳米棒表面形成单层、双层或多层结构,带有功能基团的表面活性剂可以锚定在金纳米棒的表面,改变金纳米棒的表面性质。一种简单的修饰方法就是将阴离子聚合电解质[如聚苯乙烯磺酸钠(PSS)],通过静电吸附结合在包覆有CTAB的金纳米棒表面上。
PSS不仅能使金纳米棒的表面转换成负电,还能使抗体通过疏水作用结合到金纳米棒表面上[30]。另外,聚丙烯酸(PAA)也是一种阴离子聚合电解质,一旦带有羧基的 PAA修饰到金纳米棒的表面上,蛋白质就能通过EDC/NHS交联作用共价结合到修饰有 PAA的金纳米棒上,这与金纳米棒修饰MUA 相似。MURPHY 等[31]提出了层层组装(layer-by-layer assembly,LBL)的方法,在CTAB稳定的金纳米棒表面通过静电作用依次吸附上PSS和聚二一烯丙基二甲基氯化铵,重复该过程可吸附多层聚电解质。这种聚合电解质包覆法简单、快捷,但是在长期存放或进行生物体内实验时,聚电解质包覆的金纳米棒的稳定性仍是存在的问题。
另一种修饰途径是使用无机材料对金纳米棒进行表面包覆,通常使用的无机材料有银、四氯化三铁和二氧化硅等[6]。包覆后的复合体,通常是由处于中心的金纳米棒和外层的无机材料层组成,这种复合结构不仅可以阻止金纳米棒发生聚集,外层包覆层还可以结合多种生物化学配体。例如,二氧化硅具有良好的生物相容性、亲水性以及化学稳定性和胶体稳定性,而且还容易进行表面生物分子的修饰。二氧化硅包覆的金纳米棒为表面生物分子难以修饰问题提供了一种有效的解决途径。二氧化硅涂层包覆法是由LIZ-MARZAN等[32]提出的,这种方法修饰的金纳米棒已经在生物检测、生物识别等领域得到了广泛应用[33]。
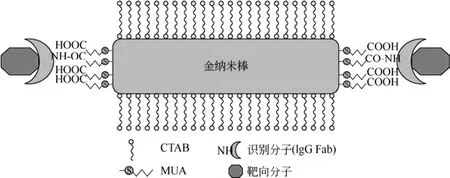
图6 金纳米棒生物分子探针示意图[35]
4 金纳米棒的应用
金纳米棒有着优异的光学性质,尤其它的LSPR特性,使其在生物分子探针、癌细胞定位与检测等领域有着广泛应用。
4.1 生物探针技术
目前,金纳米棒在进行生物应用时,首先要在表面修饰一些功能性生物分子,如抗体、蛋白质分子等形成金纳米棒分子探针,使其具有特异性识别抗原的作用,如图6所示。由于抗体等分子较大,难以稳定在金纳米棒表面上,通常的解决方法是先修饰小分子,再通过小分子偶联金纳米棒和抗体。这种方法唯一的缺点就是金纳米棒在有机溶剂中易发生聚集。关于这个问题,目前已有大量相关的研究,如DAI等[34]成功用MUA完全置换CTAB且无聚集发生。在2007年,IRUDAYARAJ等[35]又成功在MUA上偶联抗体并能特异性识别靶细胞。另外,生物分子偶联金纳米棒的另一种方式是用聚合物去包覆金纳米棒,如图 7。聚合物通常是聚(4-苯乙烯磺酸钠)(PSS)和聚(丙烯胺盐酸盐)(PAH),PAH能够在金纳米棒表面上提供一个羧酸基团。因此,抗体等蛋白分子就能在EDC/NHS交联剂作用下连接在金纳米棒表面上[36]。在金纳米棒的功能化应用中,TEBBE等[37]提出蛋白质包覆理论。蛋白质是一种高分子量带电聚合物,对金纳米棒能提供电空间稳定性,同时又具有良好的 pH响应能力[38-39]。通常,当 pH高于等电点时,蛋白质是呈负电荷的。因此,在静电吸引力的作用下,蛋白质分子就能直接吸附在金纳米棒的表面上。值得注意的是,由于正负电荷的中和作用,金纳米棒容易发生聚集。为了避免聚集的发生,调整金纳米棒与蛋白分子的最佳比值是非常重要的。在进行体内实验时,金纳米棒的稳定性还需要进一步验证。
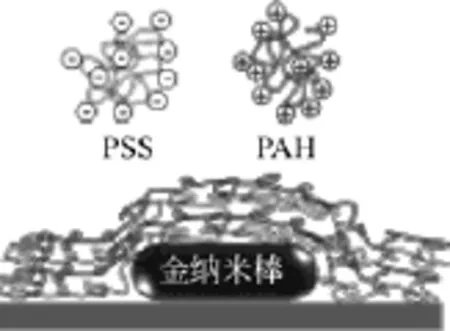
图7 聚合物包覆玻璃基底上金纳米棒示意图[36]
目前,WANG等[40]首先用Traut’s试剂在硫醇基上连接上了抗体,抗体不但没有失活而且特异性存在,带有抗体的硫醇可直接通过Au—S结合在不同长径比的金纳米棒表面上。通过这种方式可以消除传统的金纳米棒表面改性时遇到的问题,同时也简化了金纳米棒生物功能化的复杂过程。金纳米棒在进一步特异性识别抗原时,为了减少非特异性结合带来的影响,需要加入一定量的聚乙二醇硫醇(PEG-SH)。总之,生物受体(抗体)的硫醇化为金纳米棒的生物功能化提供了一个新的方法,这使金纳米棒应用于生物医学的前景更光明。
4.2 生物医学的“荧光探针”
贵金属纳米材料由于电子在价带间跃迁,自身具有荧光特性,但荧光效率低。研究表明,金纳米棒由于表面等离子体共振产生激发场耦合作用,因而具有较强的荧光效率。在生物学领域中,活体生物组织的荧光成像技术存在很多难题,比如在可见光区域,标记分子所发出的信号会被细胞自发的荧光所掩盖,从而很难对目标分子进行长期荧光标记检测等[41]。相对于常规的荧光成像,金纳米棒具有更高的亮度和对比度。目前,金纳米棒作为一种荧光探针已经被广泛应用于生物医学领域。金纳米棒的LSPR吸收峰通过调节长径比可以在600~1400nm区域移动,而这区域也是生物组织的最佳透过波段。孙桂敏等[42]将金纳米棒经由静电作用非特异性标记到HepG2人肝癌细胞表面上,在可见近红外区域,HepG2细胞无任何吸收,而标记的HepG2人肝癌细胞的吸收光谱显示出金纳米棒的特征吸收峰。他们进一步用荧光实验去验证金纳米棒的作用,然后用480nm波长激发时,HepG2人肝癌细胞无任何荧光信号显示,而受标记细胞的荧光光谱又出现了金纳米棒的特征荧光峰。此外,在480nm波长激发时,金纳米棒标记的HepG2细胞获取红色与绿色两种荧光图像,而未标记的细胞则没有显示荧光。因为金纳米棒的抗光漂白能力很强,连续用氙灯照射4h后,其荧光强度仅仅下降4%,相比于传统有机染料低很多。因此,金纳米棒作为荧光探针很有可能代替传统荧光染料应用于细胞荧光标记。
4.3 肿瘤细胞的检测与光热疗法
金纳米棒作为新型的标记材料和造影剂,越来越受到人们的重视。另外,金纳米棒容易被与其纵向表面等离子体共振吸收峰波长相近的近红外光诱导产生热量。因此金纳米棒在肿瘤细胞的定位、检测与光热疗法中将具有特殊的优越性。PEG聚合物被广泛应用于金纳米棒的表面改性。金纳米棒通过主动靶向利用共轭聚合,如凝集素-碳水化合物、配体-受体以及抗体-抗原相互作用特异性结合肿瘤标记物[33]。抗体、叶酸或啡呔分子结合到金纳米棒表面后,再通过特异性结合到靶向受体来过度表达肿瘤细胞。很多肿瘤细胞的表面都覆盖着表皮生长因子受体(EFGR),EFGR为癌症提供治疗新靶点,而正常细胞就不会出现这种蛋白质。2007年,EL-SAYED等[43]将金纳米颗粒与抗-EFGR结合,选择性标记肿瘤细胞,用暗场光学显微镜对肿瘤细胞成像。对于可见光不容易穿透的生物组织,具有合适长径比的金纳米棒对皮下组织的癌症治疗和诊断有着明显的优势,而对可见光有强吸收特性的金纳米球只能对癌细胞进行选择性破坏。由于金纳米棒在近红外区域(800~1200nm)有着较强的光吸收和光辐射能力,因此选择与金纳米棒纵向SPR吸收峰波长相近的近红外激光作为光源,能够诱导皮下深层组织的金纳米棒产生热量,从而使金纳米棒对皮下深层组织的肿瘤细胞能同时起到诊断和光热疗法的双重作用[44]。EL-SAYED等[45]研究出利用寡肽标记的金纳米棒进行细胞核标记,暗场光学显微镜能够明显地把正常细胞与肿瘤细胞分开,如图8(a),并且利用800nm的激光照射可以选择性致使癌细胞死亡,如图8(b)。
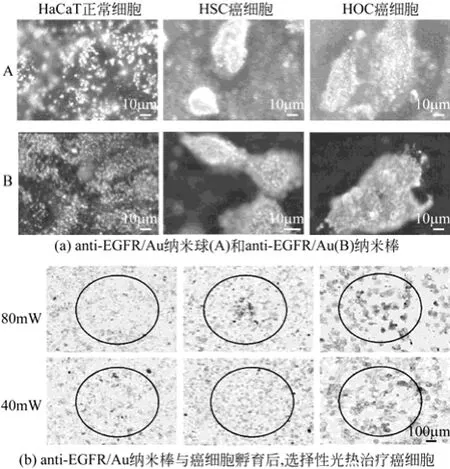
图8 金纳米棒对细胞核标记后的暗场显微镜和激光照射图[45]
5 总结与展望
金纳米棒独特的表面等离子光学性质使其在生物标记、生物医学、生物检测与成像、疾病治疗等领域有了广泛的应用前景。同时金纳米棒在合成、表面修饰以及功能化应用方面也有很大进步。然而,金纳米棒还有两方面需要改善。首先,金纳米棒合成效率需要提高,这可能需要进一步理解金纳米棒在溶液中生长的过程机制。第二,虽然已经提出了金纳米棒功能化的各种方法,但很难直接去表达功能化后的几何形状,从而推进金纳米棒更深层次的功能化应用。随着现代科学技术的进步,金纳米棒的研究必定会从体外到体内,从动物实验再到临床方向发展。目前,金纳米棒在癌症诊断和光热治疗的研究成果越来越多,相信在不久的将来,金纳米棒可以推进到临床应用。
参考文献
[1] DANIEL M C,ASTRUC D.Gold nanoparticles:assembly,supramolecular chemistry,quantum-size-related properties,and applications toward biology,catalysis,and nanotechnology[J].Chemical Reviews,2004,104(1):293-346.
[2] WU H Y,HUANG W L,HUANG M H.Direct high-yield synthesis of high aspect ratio gold nanorods[J].Crystal Growth & Design,2007,7(4)831-835.
[3] CHEN H,KOU X,YANG Z,et al.Shape-and size-dependent refractive index sensitivity of gold nanoparticles[J].Langmuir,2008,24(10):5233-5237.
[4] CONNOR E E,MWAMUKA J,GOLE A,et al.Gold nanoparticles are taken up by human cells but do not cause acute cytotoxicity[J].Small,2005,1(3):325-327.
[5] CHANG S S,SHIH C W,CHEN C D,et al.The shape transition of gold nanorods[J].Langmuir,1999,15(3):701-709.
[6] CAO J,SUN T,GRATTAN K T V.Gold nanorod-based localized surface plasmon resonance biosensors:a review[J].Sensors and actuators B:Chemical,2014,195:332-351.
[7] JANA N R,GEARHEART L,MURPHY C J.Seed-mediated growth approach for shape-controlled synthesis of spheroidal and rod-like gold nanoparticles using a surfactant template[J].Advanced Materials,2001,13(18):1389.
[8] NIKOOBAKHT B,EL-SAYED M A.Preparation and growth mechanism of gold nanorods (NRs) using seed-mediated growth method[J].Chemistry of Materials,2003,15(10):1957-1962.
[9] JIANG X C,BRIOUDE A,PILENI M P.Gold nanorods:limitations on their synthesis and optical properties[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2006,277(1):201-206.
[10] KHANAL B P,ZUBAREV E R.Rings of nanorods[J].Angewandte Chemie International Edition,2007,46(13):2195-2198.
[11] YE X,JIN L H,CAGLAYAN H,et al.Improved size-tunable synthesis of monodisperse gold nanorods through the use of aromatic additives[J].ACS Nano,2012,6(3):2804-2817.
[12] KABASHIN A V,EVANS P,PASTKOVSKY S,et al.Plasmonic nanorod metamaterials for biosensing[J].Nature Materials,2009,8 (11):867-871.
[13] HUANG X,NERETINA S,EL-SAYED M A.Gold nanorods:from synthesis and properties to biological and biomedical applications[J].Advanced Materials,2009,21(48):4880-4910.
[14] MURPHY C J,SAU T K,GOLE A M,et al.Anisotropic metal nanoparticles:synthesis,assembly,and optical applications[J].The Journal of Physical Chemistry B,2005,109(29):13857-13870.
[15] GOLE A,MURPHY C J.Seed-mediated synthesis of gold nanorods:role of the size and nature of the seed[J].Chemistry of Materials,2004,16(19):3633-3640.
[16] GOU L,MURPHY C J.Fine-tuning the shape of gold nanorods[J].Chemistry of Materials,2005,17(14):3668-3672.
[17] JIANG X C,PILENI M P.Gold nanorods:influence of various parameters as seeds,solvent,surfactant on shape control[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2007,295(1):228-232.
[18] LIU M , GUYOT-SIONNEST P.Synthesis and optical characterization of Au/Ag core/shell nanorods[J].The Journal of Physical Chemistry B,2004,108(19):5882-5888.
[19] PENNER R M,MARTIN C R.Preparation and electrochemical characterization of ultramicroelectrode ensembles[J].Analytical Chemistry,1987,59(21):2625-2630.
[20] FOSS Jr C A,HORNYAK G L,STOCKERT J A,et al.Template-synthesized nanoscopic gold particles:optical spectra and the effects of particle size and shape[J].The Journal of Physical Chemistry,1994,98(11):2963-2971.
[21] BOHREN C F,HUFFMAN D R.Absorption and scattering of light by small particles[M].Wiley-YCH,1998.
[22] CHEN P,CHUNG M T,MCHUGH W,et al.Multiplex serum cytokine immunoassay using nanoplasmonic biosensor microarrays[J].ACS Nano,2015,9(4):4173-4181.
[23] PETRYAYEVA E,KRULL U J.Localized surface plasmon resonance:nanostructures,bioassays and biosensing—a review[J].Analytica Chimica Acta,2011,706(1):8-24.
[24] LINK S,MOHAMED M B,EL-SAYED M A.Simulation of the optical absorption spectra of gold nanorods as a function of their aspect ratio and the effect of the medium dielectric constant[J].The Journal of Physical Chemistry B,1999,103(16):3073-3077.
[25] HULTEEN J C.A general template-based method for the preparation of nanomaterials[J].Journal of Materials Chemistry,1997,7(7):1075-1087.
[26] 杨玉东,徐菁华,杨林梅,等.金纳米棒表面修饰技术及其功能化的研究进展[J].化工进展,2010,29(3):389-396.
[27] LIAO H,HAFNER J H.Gold nanorod bioconjugates[J].Chemistry of Materials,2005,17(18):4636-4641.
[28] WIJAYA A,HAMAD-SCHIFFERLI K.Ligand customization and DNA functionalization of gold nanorods via round-trip phase transfer ligand exchange[J].Langmuir,2008,24(18):9966-9969.
[29] YU C,VARGHESE L,IRUDAYARAJ J.Surface modification of cetyltrimethylammonium bromide-capped gold nanorods to make molecular probes[J].Langmuir,2007,23(17):9114-9119.
[30] HUANG X,EL-SAYED I H,QIAN W,et al.Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J].Journal of the American Chemical Society,2006,128 (6):2115-2120.
[31] GOLE A,MURPHY C J.Polyelectrolyte-coated gold nanorods:synthesis,characterization and immobilization[J].Chemistry of Materials,2005,17(6):1325-1330.
[32] LIZ-MARZAN L M,GIERSIG M,MULVANEY P.Synthesis of nanosized gold-silica core-shell particles[J].Langmuir,1996,12 (18):4329-4335.
[33] HUANG X,NERETINA S,EL-SAYED M A.Gold nanorods:from synthesis and properties to biological and biomedical applications[J].Advanced Materials,2009,21(48):4880-4910.
[34] DAI Q,COUTTS J,ZOU J,et al.Surface modification of gold nanorods through a place exchange reaction inside an ionic exchange resin[J].Chem.Commun.,2008(25):2858-2860.
[35] YU C,IRUDAYARAJ J.Multiplex biosensor using gold nanorods[J].Analytical Chemistry,2007,79(2):572-579.
[36] GOLE A,MURPHY C J.Biotin-streptavidin-induced aggregation of gold nanorods:tuning rod-rod orientation[J].Langmuir,2005,21 (23):10756-10762.
[37] TEBBE M,KUTTNER C,MÄNNEL M,et al.Colloidally stable andsurfactant-free protein-coated gold nanorods in biological media[J].ACS Applied Materials & Interfaces,2015,7(10):5984-5991.
[38] CHANANA M,CORREA-DUARTE M A,LIZ-MARZAN L M.Insulin-coated gold nanoparticles:a plasmonic device for studying metal-protein interactions[J].Small,2011,7(18):2650-2660.
[39] CHANANA M,RIVERA-GIL P,CORREA-DUARTE M A,et al.Physicochemical properties of protein-coated gold nanoparticles in biological fluids and cells before and after proteolytic digestion[J].Angewandte Chemie International Edition,2013,52(15):4179-4183.
[40] WANG X,MEI Z,WANG Y,et al.Gold nanorod biochip functionalization by antibody thiolation[J].Talanta,2015,136:1-8.
[41] 柯善林,阚彩侠,莫博,等.金纳米棒的光学性质研究进展[J].物理化学学报,2012,28(6):1275-1290.
[42] 孙桂敏,杨培慧,孙俊环,等.金纳米棒标记HepG2人肝癌细胞的荧光成像及其AFM探测[J].发光学报,2011,32(6):0636-0641.
[43] JAIN P K,EL-SAYED I H,EL-SAYED M A.Au nanoparticles target cancer[J].Nano-Today,2007,2(1):18-29.
[44] 马占芳,田乐,邸静,等.基于金纳米棒的生物检测、细胞成像和癌症的光热治疗[J].化学进展,2009,21(1):0134-0142.
[45] HUANG X,EL-SAYED I H ,QIAN W,et al.Cancer cell imaging and photothermal therapy in the near-infrared region by using gold nanorods[J].J.Am.Chem.Soc.,2006,128:2115-2120.
第一作者及联系人:徐冬梅(1975—),女,博士,副教授,硕士生导师,研究方向为化工分离工程、精细化工工艺和精细化学品、化工过程模拟与优化、化工系统工程。E-mail xudongmei.cn@163.com。
中图分类号:O 611.4
文献标志码:A
文章编号:1000-6613(2016)07-2121-09
DOI:10.16085/j.issn.1000-6613.2016.07.026
收稿日期:2015-09-09;修改稿日期:2016-03-14。
基金项目:国家自然科学基金项目(21306106)。
Gold nanorods:synthesis,properties,modification and applications
XU Dongmei,LIU Jian,GAO Jun,LIU Di,LIU Xiaowei
(College of Chemical and Environmental Engineering,Shandong University of Science and Technology,Qingdao 266590,Shandong,China)
Abstract:Gold nanorods have received more and more attention due to their unique optical and electronic properties.In particular,the tunable surface plasmon resonance characteristics of gold nanorods allow them to gain wide applications in bio-labeling,imaging,bioanalysis,biomedicine,etc.This review discussed the optical properties of gold nanorods and several surface modification methods,and summarized the applications of gold nanorods in the fields of biological molecular probe,fluorescent probe,cancer diagnosis and photothermal therapy.The main issues on gold nanorods and their applications in biology are also discussed.
Key words:gold nanorods;synthetic methods;optical properties;surface modification;biological applications

