碳化硅基碳复合核壳固体酸的制备及催化合成苯甲醛-1,3-丙二醇缩醛
王康,吴之强,何康丽,毕淑娴,詹海娟,马保军,刘万毅(宁夏大学化学化工学院,宁夏 银川 750021)
研究开发
碳化硅基碳复合核壳固体酸的制备及催化合成苯甲醛-1,3-丙二醇缩醛
王康,吴之强,何康丽,毕淑娴,詹海娟,马保军,刘万毅
(宁夏大学化学化工学院,宁夏 银川 750021)
摘要:以碳化硅粉体为载体,葡萄糖、油酸、腐植酸钠等为碳源,采用水热法炭化及400℃低温炭化获得SiC/C材料,继而气相磺化合成了碳基碳化硅核壳固体酸催化剂。采用XRD、IR、XPS、TG、SEM和TEM对催化剂进行了结构表征,酸滴定法测得其酸度为1.33mmoL/g。以其催化苯甲醛和1,3-丙二醇缩合反应为探针反应测试了其催化活性。考察了原料配比、催化剂用量、反应时间及催化剂重复使用性对缩合产率的影响。结果表明,适宜反应条件为:苯甲醛投料量为0.1mol时,催化剂用量为0.075g,醛醇摩尔比1∶1.5,100℃回流2h产率可达83%,该催化剂可以重复使用4次以上。
关键词:碳基碳化硅;核壳固体酸;苯甲醛1,3-丙二醇缩醛;催化合成
缩醛(酮)是一类重要的有机化合物,通常用作一些特殊反应的溶剂[1-2],同时更大量的用于生产香精、香料类的原料[3]。苯甲醛 1,3丙二醇缩醛具有新鲜的苹果香味,可用于多种日化香精有效成分,其传统生产方法以苯甲醛和丙二醇为原料,多采用无机强酸[4]作催化剂,但该方法由于强酸的存在,加剧了设备的腐蚀,同时产生了大量的酸性废水,对环境造成严重的污染。近年来,广大科研工作者相继开发出妮酸[5]、三氯化铁[6]、钒磷氧[7]等不同类型催化剂用于苯甲醛 1,3-丙二醇缩醛的合成,在很大程度上避免了液体酸的催化弊端。其中碳基固体 酸[8-10]以其低成本、易制备等优点引起了诸多关注。本文报道纳米级碳化硅粉体为载体,充分利用其高力学性能和良好的热稳定性及纳米尺寸效应等特点,通过与碳源前体如葡萄糖等的复合,经过适度碳化、磺化工艺获得具有高力学性能的碳/碳化硅核壳型固体酸,测试分析了其结构,并以苯甲醛1,3-丙二醇缩醛反应为探针反应,系统地考察了该复合型催化剂的催化特性,获得了有意义的结果,其反应如式(1)。
1 实验方法
1.1 试剂与仪器
苯甲醛、1,3-丙二醇、环己烷、葡萄糖、腐植酸钠、氢氧化钠、氯化钠、甲醛等均为分析纯;碳化硅由α-SiC组成,由北方民族大学所制,其平均粒径为120nm,纯度≥97%,游离C=1%,游离Si ≤0.5%;SETSYS-1750型热重分析仪;铜靶2kW,Modd:SA-HF3型X射线粉末衍射仪;KBYB-2800B型扫描电子显微镜;FEI Tecnai G20高分辨透射电镜;FTIR-8400型红外光谱仪;Thermo ESCALAB 250XI多功能成像电子能谱仪。
1.2 催化剂的制备
在100mL的水热釜中,加入4.0g SiC,6.0mL油酸,超声0.5h,将1.0g腐植酸钠溶于2.5mL水中,并将其加入上述碳化硅油酸混合液中,将上述两者充分搅拌,再加入8.0g葡萄糖,充分搅拌。加入2mL甲醛,再加入6滴硫酸,此时溶液变黏稠。将其装入高压反应釜中,180℃水热反应 12h,取出后在400℃氮气气氛炭化2h。得到SiC/C材料。取0.5g上述碳/碳化硅复合型材料用10mL发烟硫酸80℃气相磺化1.5h,用80℃左右的热水洗涤磺化后的样品,直至洗液中检测不到SO为止,80℃干燥,得到碳基碳化硅核壳固体酸催化剂(SiC/C-SO3H),测其酸值为1.33mmoL/g。
1.3 碳化硅基碳复合核壳固体酸催化活性的评价
在装有分水器及回流装置的 100mL三口烧瓶中依次加入0.1mol苯甲醛、一定量的催化剂、环己烷和 1,3-丙二醇,搅拌下加热回流反应一定时间。反应完成后,待温度降至室温后移出混合液,并用氯化钠溶液洗涤两次,蒸馏水洗一次,最后以无水硫酸镁做干燥剂干燥,常压蒸馏收集230~250℃的馏分,得无色透明液体产物,对其进行分析。
1.4 催化剂的表征
采用SA-HF3型X射线粉末衍射仪(X射线源为CuKα辐射,λCuKα=1.5406Å,1Å=0.1nm)测定样品的XRD谱图;采用FTIR-8400型红外光谱仪测定样品的红外光谱;采用KBYB-2800B型扫描电子显微镜和FEI-Tecnai G20高分辨透射电镜表征 SiC/C-SO3H核壳固体酸催化剂的形貌与结构;采用Thermo ESCALAB 250XI多功能成像电子能谱仪测定 SiC/C-SO3H核壳固体酸催化剂的表面元素组成及含量。催化剂的酸量测定采用酸碱滴 定法[11]。
2 结果与讨论
2.1 催化剂表征
2.1.1 XRD分析

图1 SiC/C-SO3H的XRD图
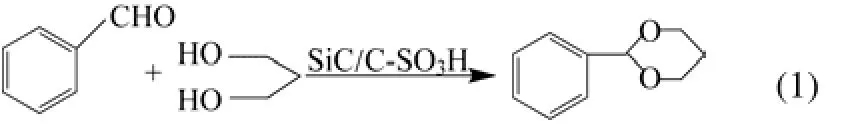
由图1可知,SiC/C-SO3H在2θ=10°~30°处有一宽的衍射峰,归属为由许多芳香碳环无序堆积构成的无定形炭[12],因为有晶型较好的碳化硅存在,所以从XRD图上看到的无定形炭的衍射峰不是太明显。该样品中所含的碳化硅为α-SiC,而且其结晶相为6H晶型的六方相[13]。SiC/C材料谱图的其他吸收峰可能是来源于原料腐植酸钠引入的最终杂质,如钠盐的衍射峰。SiC/C材料经磺化后,钠盐被洗涤流失,所以在SiC/C-SO3H的谱图上只有 α-SiC和游离 Si的衍射峰。SiC/C-SO3H较SiC/C在2θ=10°~30°处宽的衍射峰稍强,说明磺化过程使得SiC/C材料表面的碳层进一步炭化。
2.1.2 红外光谱分析
图2是催化剂SiC/C-SO3H的IR图。从图2中可以看出,在1654cm–1和1380cm–1处出现的吸收峰是催化剂中多环芳烃的 C=C键的伸缩振动吸收峰,在 1716cm–1左右有较强的吸收峰,是C=O键的伸缩振动吸收峰,在3433cm–1左右有较强的吸收峰,这是羟基的特征吸收峰,在1049cm–1和 1166cm–1左右出现了较强的吸收峰,分别是—SO2—的对称伸缩振动和—SO2—的不对称伸缩振动[14-15]。证明—SO3H、—OH、—COOH已被引入到C/SiC核壳基体表面的稠环芳香烃上;催化剂在811cm–1处的吸收峰是Si—C键的吸收峰[14],表明碳化硅核的存在。
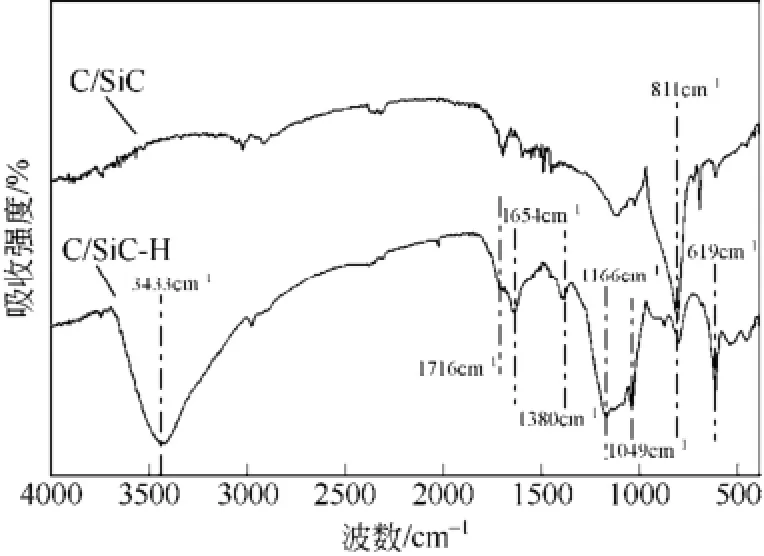
图2 SiC/C-SO3H的IR图
2.1.3 催化剂的TG分析
图3是催化剂SiC/C-SO3H的TG图,样品在空气气氛受热下,分别在 35~110℃、285~700℃两个区间出现失重现象。从35℃到130℃样品质量下降约6.04%,可能归属于碳基固体酸催化剂中的物理吸附水;在130~285℃出现了一个失重比较缓慢的区间,在此区间可能是碳层上少量的羧基和酚羟基、以及少量的磺酸基等有机官能团逐步分解。说明在这个温度段,催化剂性能稳定存在。在 285~680℃温度范围内的明显失重(30%),可能是SiC/C-SO3H核壳磺化固体酸催化剂表面无定形碳上的C、H 元素以CO2、H2O 蒸气的形式逸出[15]。在温度升高至 680℃后,出现了一个稳定台,可能是耐烧蚀的碳化硅。总体而言,此固体酸在 285℃以下有很好的热稳定性。

图3 SiC/C-SO3H的TG图
2.1.4 催化剂的元素分析
表1是SiC/C-SO3H固体酸的主要元素组成,其中 S2p特征峰的质量相对含量是 4.73%,说明 S元素已经成功键合在SiC/C材料的表面。C1s特征峰为 68.69%,而 Si2p特征峰的质量相对含量仅为0.9%,这也进一步说明碳已经成功包裹在 SiC的表面。
图4(a)是催化剂SiC/C-SO3H的全元素XPS谱图;看到核壳型催化剂的表面有C、S、O元素,只有极少量的Si元素,Si2p为103.5eV,说明极少量的Si是以SiC形式存在的[16]。没有其他杂质存在于催化剂表面,图4(b)是S2p的XPS图谱,从图上可看出S2p的电子结合能为168.5eV,说明催化剂中的S元素以—SO3H形式存在,这也表明只有—SO3H基团存在,碳催化剂的表面上没有任何其他硫状态。
2.1.5 催化剂的SEM和TEM分析

表1 催化剂SiC/C-SO3H中的元素分析
图5(a)为催化剂的SEM照片,从图中可以清晰地看到,该催化剂主要是由一些形状不规则,大小为 0.5~3μm的无定形颗粒组成,这些颗粒大多具有片状或层状的结构,并且表面粒子堆积得比较紧密,这与文献报道的基本类似[17]。图5(b)为催化剂的 TEM照片,可以看到内层颜色较深的为碳化硅核且有团聚现象,外层颜色较浅的为碳层壳,表明在制备过程中原料纳米级磺化聚集并被包埋在碳层中,形成了核壳结构的碳基固体酸,这与文献报道的碳基固体酸类基本一致[18]。这可能是由于分散的不均匀以及纳米碳化硅与加入的碳源前体之间存在相这为互融合作用,即油酸的分散作用使粒度具有一定的纳米效应,在后续的热处理过程中碳源前体分解产生了碳层包裹的碳化硅,导致制备的核壳颗粒状催化剂的粒径较大,为1μm左右。这也表明所制备的碳/碳化硅核壳型固体酸,由于SiC的纳米尺寸效应,能在一定程度上起到增强和增韧碳层的作用,克服单纯碳基固体酸存在机械强度差、重复使用性差等的缺点奠定了结构基础。相关验证见后续的催化探针试验结论。
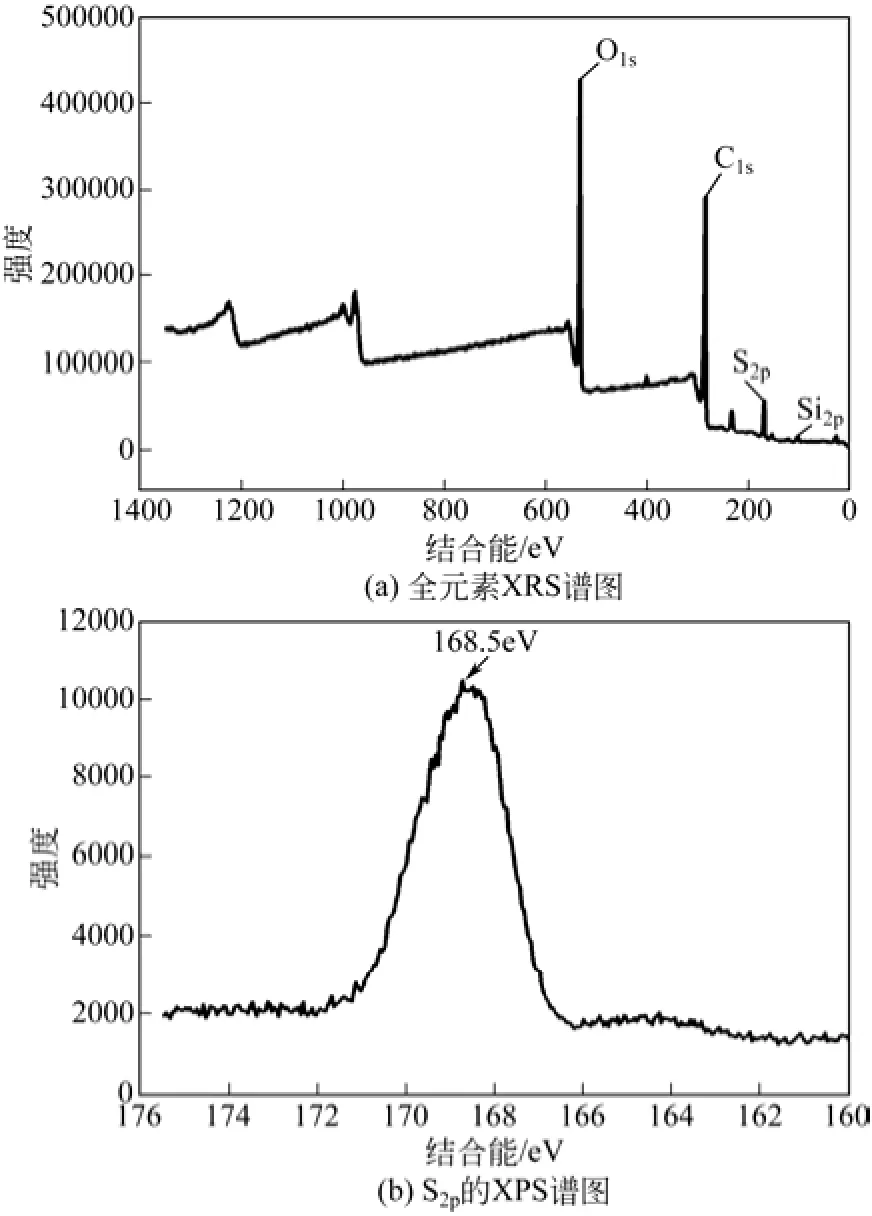
图4 SiC/C-H的全元素和S2p的XPS谱图

图5 SiC/C-SO3H的SEM和TEM图
2.2 催化剂对缩合反应的影响
2.2.1 醛醇摩尔比对缩合产率的影响
以反应底物苯甲醛投料量为0.1mol计,固定催化剂用量为0.1g,带水剂环己烷为6mL,在回流温度下即100℃反应2h。考察醇醛摩尔比对缩醛产率的影响。由图6可知,随着醇醛摩尔比的增大,缩合产率先增大后减小,当醇醛摩尔比为1∶1.5时,缩合产率达到最大,为73%,当醇醛摩尔比继续增加,缩合产率则明显下降,与文献[7]报道的类似。这可能是由于继续增大醇用量使得催化剂和苯甲醛相对浓度降低,而苯甲醛的易氧化性使得反应过程中部分苯甲醛氧化,进一步导致体系内苯甲醛含量降低;另外,增大醇用量后使得催化剂表面的路易斯酸点和醇表面的路易斯碱点反应,导致催化剂活性中心减少,致使产率下降。因此本实验条件下较适宜的醛醇摩尔比为1∶1.5。
2.2.2 催化剂用量对缩合产率的影响
由图 7可知,以反应底物苯甲醛投料量为0.1mol计,当醛醇的摩尔比为1∶1.5时,在回流温度下反应,随着催化剂用量的增加,缩合产率先提高后减小,当催化剂用量为0.075g时,缩合产率最大为82%,但当催化剂用量增大时,缩合产率反而有所下降,可能是催化剂用量过多引起了副反应的发生,降低了主反应的选择性。
2.2.3 反应时间对缩合产率的影响
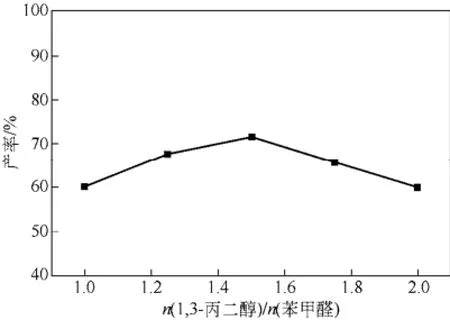
图6 醇醛摩尔比缩合产率的影响

图7 催化剂用量对缩合产率的影响
图8是反应时间对缩合产率的影响。以反应底物苯甲醛投料量为0.1mol计,当醛醇的摩尔比为1∶1.5、催化剂用量为0.075g时,在回流温度下反应,从图上可以看出缩合产率随着时间加长先增大后减小,当反应时间是2h时,其产率达到最大,为80%。这与文献报道的其他固体酸催化该反应的规律一致[6-7,20],当反应2h基本达到平衡状态,反应时间过短导致缩合不完全;而反应时间过长,导致氧化、乙二醇自聚等副反应增多。

图8 反应时间对缩合产率的影响
2.2.4 带水剂对缩合产率的影响
图 9是带水剂环己烷用量对缩合产率的影响图,从图中可以看出,当环己烷用量是7mL时,缩合产率达到最大为83%,当环己烷量较少时,带水不完全,且反应温度升高导致副反应发生,而使收率下降;带水剂用量过大,反应体系温度过低,且反应物的浓度降,低使得缩醛收率下降,故本实验最适宜的带水剂用量为7mL。

图9 带水剂用量对缩合产率的影响
2.2.5 催化剂使用次数对缩合产率的影响
在本固体酸催化缩合反应的适宜反应条件下,对催化剂的回收利用性能进行了考察。结果如图10所示。从图10中可以看出,当催化剂使用5次后,其缩合产率有所下降,但仍然可以达到57%,说明催化剂有一定的重复使用性,产率下降可能是在使用过程中由于搅拌的作用使碳基碳化硅核壳固体酸中的—SO3H流失所致。而文献[19-20]所使用的催化剂难以回收再利用。该催化剂的回收使用次数较高,说明所制备的碳/碳化硅核壳型固体酸,由于SiC的纳米效应,能在一定程度上起到增强和增韧碳层的作用,可以克服单纯碳基固体酸存在机械强度差、重复使用性差等的缺点,可以作为催化剂的优良载体。

图10 催化剂使用次数对缩合产率的影响
总之,由上述单因数实验结果表明,本固体酸催化缩合反应的适宜反应条件是:以反应底物苯甲醛投料量为0.1mol计,醛醇的摩尔比为1∶1.5,催化剂用量为0.075g,相当于苯甲醛用量的0.71%,带水剂环己烷用量为7mL,在回流温度即100℃反应2h,缩合产物的产率达到最大为83%。
2.3 产品的分析鉴定
所得产品冷却至室温为白色蜡状固体,缩合产率最大为82%,测其熔点为40~41℃,与文献值一致。红外光谱(KBr压片)测试:存在苯环 C—H吸收峰(3045cm–1),烃基C—H吸收峰(2958cm–1,2869cm–1),苯环骨架吸收峰(1613cm–1,1459cm–1),C—O吸收峰(1241cm–1,1146cm–1,1103cm–1),取代苯环吸收峰(765cm–1,670cm–1)。证明产物为苯甲醛-1,3-丙二醇缩醛[4]。
3 结 论
(1)本研究以碳化硅粉体为载体、以葡萄糖及油酸为碳源经过适度的混合、炭化、磺化工艺,制备出了SiC/C-SO3H核壳型固体酸催化剂。该催化剂的主要特征是:由于碳化硅粉体的纳米效应,在一定程度上起到增强和增韧碳层的作用,克服了单纯碳基固体酸存在机械强度差、重复使用性差等缺点,而且其酸值较高,为1.33mmol/g。
(2)考察了所制备的催化剂催化合成甲醛-1,3-丙二醇缩醛的反应特性。结果显示,该催化剂催化的缩合反应具有催化剂用量少且可以回收再利用 4次以上,投料的醇醛比小,产率较高,有望作为缩醛的优良催化剂。适宜的缩醛反应条件为:苯甲醛投料量为0.1mol时,催化剂用量为0.075g,醛醇摩尔比1∶1.5,100℃回流2h,产率可达83%。该催化剂催化合成其他缩醛(酮)的反应工艺研究有待进一步探究。
参考文献
[1] 刘贤响,杨柱,袁治冶,等.硫酸铵改性粉煤灰催化合成环己酮乙二醇缩酮[J].化工进展,2009,28(3):499-503.
[2] 尹琨,蒋建兰,白鹏,等.以 N,N-二甲基甲酰胺为溶剂萃取精馏制备高纯度甲缩醛[J].化工进展,2011,30(7):1440-1443.
[3] 李永红.缩醛 (酮) 类香料及合成研究进展[J].滁州学院学报,2008,9(6):53-56.
[4] 刘春生,罗根祥.苯甲醛 1,3-丙二醇缩醛的绿色合成研究[J].化学试剂,2005,27(4):245-246.
[5] 俞善信,彭红阳.三氯化铁催化合成缩醛(酮)[J].现代化工,1994,14(12):29-30.
[6] 田志新,龚健.铌酸催化缩醛反应[J].精细石油化工,2000(23):23-25.
[7] 刘春生,罗根祥.钒磷氧催化合成苯甲醛乙二醇缩醛[J].香料香精化妆品,2004(2):20-21.
[8] 占昌朝,曹小华,严平,等.碳基固体酸催化合成乙酰水杨酸[J].化工进展,2012,31(5):1121-1125.
[9] 刘宁.磁性核壳碳基固体酸催化剂的制备及其应用[D].银川:宁夏大学,2013.
[10] 郑瑞元.煤基碳基固体酸材料的制备,表征及催化应用[D].银川:宁夏大学,2013.
[11] MELERO J A,VAN GRIEKEN R,MORALES G,et al.Friedel Crafts acylation of aromatic compounds over arenesulfonic containing mesostructured SBA-15 materials[J]. Catalysis Communications,2004,5(3):131-136.
[12] SUGANUMA S,NAKAJIMA K,KITANO M,et al.Synthesis and acid catalysis of cellulose-derived carbon-based solid acid[J].Solid State Sciences,2010,12(6):1029-1034.
[13] 任克刚,陈克新,周和平,等.碳化硅纳米线合成及显微结构分析[J].稀有金属材料与工程,2009,38(A02):52-54.
[14] SUGANUMA S,NAKAJIMA K,KITANO M,et al.Hydrolysis of cellulose by amorphous carbon bearing SO3H,COOH,and OH groups[J].Journal of the American Chemical Society,2008,130 (38):12787-12793.
[15] MANOCHA L M,YASUDA E,TANABE Y,et al.Sol-gel processing of carbidic glasses[J].Bulletin of Materials Science,2000,23(1):1-4
[16] 汤海鹏,王英华,田民波,等.溅射SiC薄膜的 XPS 分析[J].材料研究学报,1989,3(3):57-60.
[17] 任立国,张晓丽,高文艺.碳基固体酸催化大豆油与乙醇酯交换制备生物柴油[J].农业机械,2011(16):79-83.
[18] 王华瑜,张长斌,贺泓,等.磁性碳基磺酸化固体酸催化剂的制备及其催化水解纤维素[J].物理化学学报,2010,26(7):1873-1878.
[19] 王海萍,周扬.改性活性炭催化合成苯乙酮 1,3-丙二醇缩酮工艺研究[J].广东化工,2012,39(2):72-73.
[20] 李晓鸥,刘春生,严红燕,等.碘催化合成 1,3-丙二醇缩环己酮[J].辽宁石油化工大学学报,2004,24(2):5-7.
第一作者:王康(1990—),男,硕士研究生,从事煤基功能材料开发研究工作。E-mail 13649501714@163.com。联系人:刘万毅,博士生导师。E-mail liuwy@nxu.edu.cn。
中图分类号:O 622.5
文献标志码:A
文章编号:1000-6613(2016)07-2103-06
DOI:10.16085/j.issn.1000-6613.2016.07.023
收稿日期:2015-10-20;修改稿日期:2016-02-17。
基金项目:国家自然科学基金项目(51364038,21166021,21467022)。
Preparation of silicon carbide based carbon composite core-shell structure solid acid catalyst for the synthesis of benzaldehyde 1,3-propanediol acetal
WANG Kang,WU Zhiqiang,HE Kangli,BI Shuxian,ZHAN Haijuan,MA Baojun,LIU Wanyi
(School of Chemistry and Chemical Engineering,Ningxia University,Yinchuan 750021,Ningxia,China)
Abstract:The core-shell structure silicon carbide based carbon composite solid acid catalyst was prepared via gas sulfonation progress from SiC/C composites which was synthesized by hydrothermal method and low temperature carbonization at 400℃ using glucose,oleic acid and humic acid sodium as carbon source and silicon carbide as carrier.The catalyst was characterized by XRD,IR,XPS,TG,SEM and TEM.The result showed that the acid value of the solid acid catalyst measured by acid titration method was 1.33mmoL/g.Its catalytic activity was tested by the benzaldehyde and 1,3-propanediol condensation reaction.Effects of molar ration of raw material,the amount of catalyst,reaction time and reusability of the catalyst on the condensation yield had been investigated.When 0.075g catalyst was used for 0.1 mol benzaldehyde and the molar ration of alcohol to aldehyde in the precursors was equal to 1.5 and the reflux condensation was kept for 2h at 100℃,the condensation yield was 83% and the catalyst could be reused for more than four times.
Key words:carbon-based silicon carbide;core-shell structure solid acid;benzaldehyde 1,3-propanediol acetal;catalysis synthesis

