一株细菌纤维素生产菌株Gluconacetobacter xylinus的分离鉴定及其产物分析
咸 赫, 史素娟, 毛静静, 王 倩, 刘好宝*
(1. 中国农业科学院烟草研究所,山东 青岛 266101;2. 青岛市第九中学,山东 青岛 266012;3. 青岛农业大学 农学与植物保护学院,山东 青岛 266109)
一株细菌纤维素生产菌株Gluconacetobacter xylinus的分离鉴定及其产物分析
咸 赫1,2, 史素娟1, 3, 毛静静1, 王 倩1, 刘好宝1*
(1. 中国农业科学院烟草研究所,山东 青岛 266101;2. 青岛市第九中学,山东 青岛 266012;3. 青岛农业大学 农学与植物保护学院,山东 青岛 266109)
摘 要:为获得具有机械强度及弹性模量高等优点的细菌纤维素,满足其在食品工业、生物医学、造纸、声学器材和石油开采等方面的广泛应用。本研究通过初步活化和分步富集的方法获得细菌纤维素生产菌株,经过16S rDNA及形态学鉴定后,利用单因子试验对该菌株的发酵条件进行了优化,并利用扫描电子显微镜、红外光谱分析以及X-衍射等技术对获得的细菌纤维素进行表征。最终筛选获得一株细菌纤维素生产菌株,经鉴定为木葡糖酸醋杆菌Gluconacetobacter xylinus,命名为G. xylinus 5-2;经碳源、氮源、pH及其他影响因素的优化,该菌株发酵生产的细菌纤维素纯化干燥后干重达到13.2 g/L;发酵分离产物经扫描电子显微镜、红外光谱分析以及X-衍射等表征分析,证明该产物为细菌纤维素;对细菌纤维素进行力学性质表征分析,表明该细菌纤维素的弹性模量达到3.38 GPa。因此,本研究筛选获得了一株在生产效率和产品性能等方面都较为优异的纤维素生产菌株G. xylinus 5-2,并对其细菌纤维素的发酵条件进行了初步分析,为工业化生产高性能细菌纤维素奠定了基础。
关键词:细菌纤维素;Gluconacetobacter xylinus;筛选;性能分析
纤维素是葡萄糖分子经过β-1,4糖苷键连接而成的多聚物,主要来源于植物,包括树木、棉花等。植物来源的纤维素是造纸业、纺织业、建筑业以及化工领域的主要原材料。同时,一些细菌,如木醋杆菌、根瘤菌、土壤杆菌及假单胞菌等,也能以异养方式高效地产生胞外纤维素,又称细菌纤维素(bacterial cellulose,BC)[1-2]。通常而言,植物源纤维素由于被木质素、半纤维素等杂质包裹,生产过程较为复杂。而细菌纤维素则多以纯纤维素的形式存在,纤维素直径在几到几十纳米之间。因其独特的合成方式,细菌纤维素具有机械强度及弹性模量高、吸水性及生物相容性好等特点,在食品工业、生物医学、造纸、声学器材和石油开采等方面有巨大的应用潜力。特别是在生物医学材料领域,细菌纤维素作为绷带、人工皮肤、工程支架、人造血管、药物载体等原料的优质替代品,受到人们的广泛关注[2-5]。
目前,细菌纤维素生物合成的研究主要集中在培养方式改造、培养装备设计、发酵条件优化、发酵菌株的代谢工程改造以及特效发酵生产纤维素菌株的筛选等方面。Hornung等研发出一种带有喷雾装置的反应器,通过该喷雾装置把葡萄糖等营养成分和氧气喷洒到纤维素表面,使纤维素的产量高达9 g干重/天[6-7]。Chao等研制出底部有气孔的发酵罐,通过输入高浓度氧气,节省能源降低成本,产量达到10.4 g/L。Hwang等通过优化培养基 pH和溶氧浓度,使得木醋杆菌 Acetobacter xylinum BRC5中纤维素的合成率达到0.3 g/L·h,最高产量达到 15 g/L干重[8]。Shigemats等通过基因敲除手段构建了木葡糖酸醋杆菌Gluconacetobacter xylinus BPR2001葡萄糖脱氢酶缺陷型菌株GD-I,改造后菌株的葡萄糖合成纤维素的能力比原始菌株提高了1.7倍[9]。另外,Carolina等克隆了G. hansenii ATCC23769纤维素合酶操纵子中的基因 bcsA、bcsB、bcsC、bcsD、cmcax、ccpAx和bglx,以期通过过表达这些基因提高纤维素产量[10]。除了利用基因工程改造菌株外,细菌纤维素生物合成研究在培养工艺等方面也进行了大量的优化并取得了长足的进步,具体措施包括在培养过程中添加乙醇或1-甲基环丙烯等,采用混合菌发酵等,在一定程度上大幅度提高纤维素的产量[11-14]。
尽管细菌纤维素生物合成在培养装备、培养工艺和菌株代谢工程改造等方面取得了良好进展,从源头上筛选具有良好的纤维素生产能力的菌株,优化其合成条件,表征获得纤维素,仍然具有重要的研究意义和应用价值。本工作从细菌纤维素生产菌株的筛选展开,通过菌株鉴定、发酵条件的优化和获得纤维素的表征等研究,以期获得适合工业化生产的细菌纳米纤维素生产菌株。
1 实验
1.1 主要试剂和仪器
酵母浸膏和胰蛋白胨购自OXOID公司;葡萄糖、蔗糖、碳酸钙、乙酸、乙酸钠、乙醇、琼脂、柠檬酸、Na2HPO4·12H2O、KH2PO4、MgSO4·7H2O等化学试剂均达到试剂纯纯度。试验中所需的Taq DNA聚合酶、细菌DNA提取试剂盒等购自宝生物工程(大连)有限公司。所用引物由北京六合华大科技股份有限公司合成。
SW-CJ-2FD型双人单面净化工作台购自苏州净化设备有限公司,LDZM-80KCS型蒸汽灭菌器购自上海申安医疗器械厂,GSP-9080MBE型隔水式培养箱购自上海博讯实业有限公司,DHG-9076A电热恒温鼓风干燥箱购自上海精宏实验设备有限公司,Nicolet 6700傅里叶变换红外分析仪购自美国Thermo公司,D8 Advance X-衍射仪购自德国Bruker公司。
1.2 培养基
1.2.1 富集培养基
5%葡萄糖,0.5%酵母膏,0.2%乙酸钠,1%CaCO3,pH5.0,121℃灭菌20 min。灭菌后加入2%乙醇和Nystatin(制霉菌素)50 mg/L。
1.2.2 斜面菌株保存培养基
5%葡萄糖,0.5%蛋白胨,0.5%酵母膏,0.1%柠檬酸,0.2% Na2HPO4·12H2O,0.1% KH2PO4,0.025% MgSO4·7H2O,2%琼脂,pH5.8,121℃灭菌20 min。
1.2.3 初始发酵培养基
2%葡萄糖,1%蛋白胨,0.27% Na2HPO4,0.115%柠檬酸,pH5.0,121℃灭菌20 min。
1.3 菌株的富集与筛选
采集不同类型的腐烂水果、茶水及土豆淀粉等样品。将1 g采集样品用10 mL无菌水浸提1 h,静置得到上清液。吸取1 mL上清液接种于10 mL富集培养基中,30℃静置培养5~7 d,待管内液面出现乳白色菌苔,吸取1 mL菌液到新鲜富集培养基中,30℃静置培养5~7 d。富集得到的菌液适当稀释后,取100 μL涂平板,分离单菌落,30℃静置培养48 h。随机挑取菌落直径大、表面光滑、边缘整齐的菌落接种于发酵培养基中,30℃静置培养5~7 d,观察并测定获得的细菌纤维素。
1.4 细菌纤维素膜的处理方法
细菌纤维素膜的处理方法参照Putra等[15],具体步骤如下:蒸馏水洗涤细菌纤维素膜并抽滤,去除膜表面的培养基及杂质;用0.1 mol/L NaOH溶液浸泡并沸水浴30 min;取出纤维素膜,用0.5%乙酸溶液浸泡5~10 min以中和NaOH溶液;用蒸馏水多次浸泡冲洗纤维素膜,直至其呈半透明乳白色;用滤纸吸干膜表面水分,60℃干燥至恒重。细菌纤维素产量用干重g/L表示。
1.5 16S rDNA鉴定
接种筛选获得菌株于富集培养基,经24 h静置培养后离心收集菌体,提取细菌基因组。以基因组为模版 , 采 用 细 菌16S rDNA通 用 引 物fD1( 5'-GAGTTTGATCCTGGTCAG-3') 和rP2 (5'-ACGGCTACCTTGTTACGACT T-3')进行扩增,获得16S rDNA PCR扩增产物。PCR产物送北京六合华大科技股份有限公司测序,测序结果与GenBank数据库进行BLAST比对,初步确定其种属。根据细菌伯杰氏手册对细菌种类进行鉴定。
1.6 菌株培养方法及优化
培养基的优化以初始发酵培养基为基础(详见“1.2”),对影响细菌纤维素产量的主要因素,包括碳源、氮源、pH值以及其他条件进行了研究。
1.6.1 不同碳源培养基的配制及处理
取活化后菌液,以5%接种量接种至50 mL含不同碳源(2%葡萄糖、2%果糖或2%蔗糖)的初始发酵培养基中,摇匀后30℃静置培养7 d,按照“1.4”中的方法处理纤维素,称重。
1.6.2 不同氮源培养基的配制及处理
利用“1.6.1”中优化获得的最佳碳源,按照“1.6.1”中的方法,分析含酵母膏(1%)、蛋白胨(1%)、酵母膏和蛋白胨(各0.5%)或氯化铵(1%)等不同氮源对纤维素产量的影响。
1.6.3 不同化学品培养基的配制及处理
以碳源和氮源优化后的初始发酵培养基为基础,分别添加1 g/L的不同的化学品,研究其对该菌株细菌纤维素产量的影响。添加化学品包括:乙醇、吐温80、MgCl2、CaCl2和柠檬酸。
1.6.4 不同初始pH培养基的配制及处理
采用碳源、氮源和化学品优化后的发酵培养基,调整培养基初始pH值至5.0、6.0、7.0和8.0,对比不同pH对细菌纤维素产量的影响。
1.7 细菌纤维素膜的表征
1.7.1 细菌纤维素膜的电镜观察
细菌纤维素膜按照“1.4”中方法进行处理,后经用3%戊二醛溶液固定12 h,用pH7.0的磷酸缓冲液(0.1 mol/L)清洗3次,后分别用15%、30%、50%、70%、80%、90%、95%的乙醇脱水20 min,无水乙醇脱水3次(30 min/次),最后用醋酸异戊酯置换2次(20 min/次),临界点干燥后采用扫描电子显微镜进行观察[16-17]。
1.7.2 细菌纤维素膜的红外分析
提纯后的细菌纤维素薄膜在空气中自然干燥,于室温下用傅立叶红外光谱分析仪Nicolet 6700测试其红外光谱,扫描范围为400 cm-1~4000 cm-1,分辨率4 cm-1。
1.7.3 细菌纤维素膜的X-衍射分析
X-衍射是鉴定细菌纤维素的重要指标之一。本研究X射线衍射采用铜镍发射靶,波长0.154 06 nm,加速电场36 kV,电流20 mA,干纤维素膜固定在旋转靶上,扫描补偿0.01º。衍射特征峰位置为布拉格角。根据布拉格公式计算出纤维素的晶体面间距(d)[18]。
1.7.4 细菌纤维素膜的综合力学性能分析
将薄膜切成约15mm×4mm的长方形样条,用单纤维强力机进行测试。拉伸速率为20mm/min,测试夹距为10mm,每个样品测试10次。拉伸强度为断裂负荷与试样宽度和试样厚度的比值。
2 结果与讨论
2.1 菌株的筛选
采集不同类型的腐烂水果、茶水及土豆淀粉等样品,利用新鲜的富集培养基进行富集,后经过固体培养基涂布筛选,共获得23株生产纤维素的细菌菌株。将所获菌株接种于发酵培养基中,30℃静置培养7 d。挑取纤维素菌膜,按照“1.4”中的处理方法,测定纤维素的产量。最后,选取纤维素产量最高的5-2号菌株进行后续研究。
2.2 菌株的16S rDNA鉴定
对5-2号菌株进行16S rDNA鉴定。将该菌株16S rDNA序列(1355 bp)提交GenBank数据库进行BLAST分析。结果表明,该序列与葡糖酸醋杆菌(Gluconacetobacter xylinus)16S rDNA序列的同源性为99%。5-2号菌株细胞从椭圆到杆状、直或弯,0.6~0.8 μm × 1.0~4.0 μm,单生、成对或成链。有的菌体有退化体,它们呈球状、膨大、棒状、弯的或丝状体,革兰氏染色阴性。该菌株从形态、生理生化和16S rDNA的同源性等方面均与葡糖酸醋杆菌具有很高的相似度,因此将该菌株命名为G. xylinus 5-2。
2.3 菌株的培养方法与优化
2.3.1 碳源对细菌纤维素产量的影响
本研究分析了葡萄糖、蔗糖和果糖三种常见碳源对发酵产量的影响(图 1a)。结果显示,相对于其他两种碳源,发酵培养基的碳源为2%葡萄糖时,细菌纤维素的产量最高,达到7.24 g/L,比果糖和蔗糖分别提高23%和27%。该试验表明,不同碳源对G. xylinus 5-2菌株的纤维素合成量有较大的影响,葡萄糖更利于5-2菌株的纤维素的产出。
2.3.2 氮源对细菌纤维素产量的影响
在确定以葡萄糖为碳源的基础上,本研究进一步分析了酵母膏(1%)、蛋白胨(1%)、酵母膏和蛋白胨(各 0.5%)或氯化铵(1%)等常用微生物培养氮源对细菌纤维素产量的影响(图 1b)。结果显示,当使用1%无机氮源氯化铵时,细菌纤维素的产量最低;氮源分别为1%蛋白胨或1%酵母膏时,纤维素的产量居中;氮源为0.5%酵母膏和0.5%蛋白胨复配时,细菌纤维产量最高,达到8.92 g/L。该产量比单独使用酵母膏或蛋白胨处理提高了 20%,是氯化铵处理中细菌纤维素产量的 5倍。该试验表明,不同氮源对G. xylinus 5-2菌株的纤维素合成量的影响很大,酵母膏和蛋白胨的混合组合更利于5-2菌株的纤维素的产出。
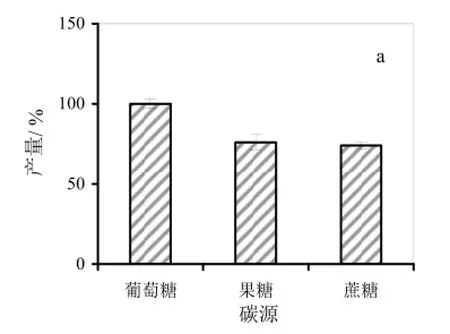
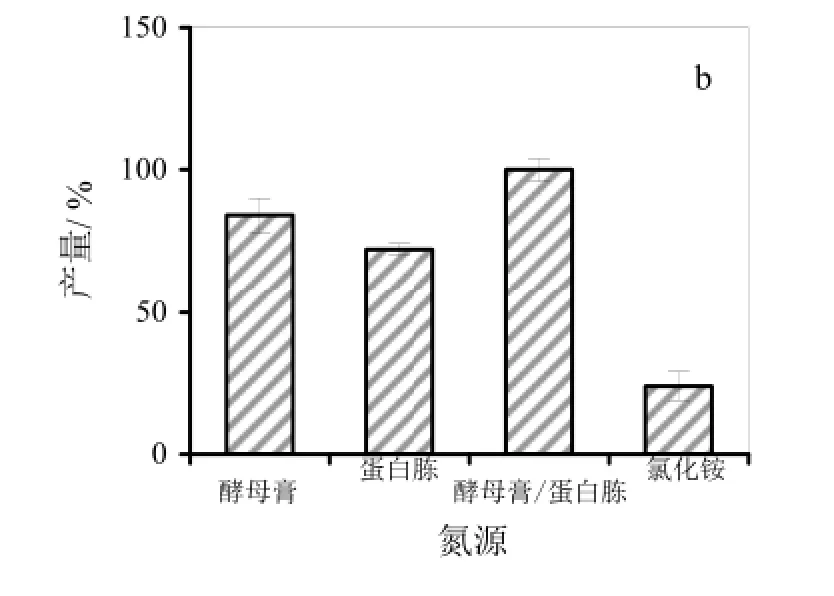
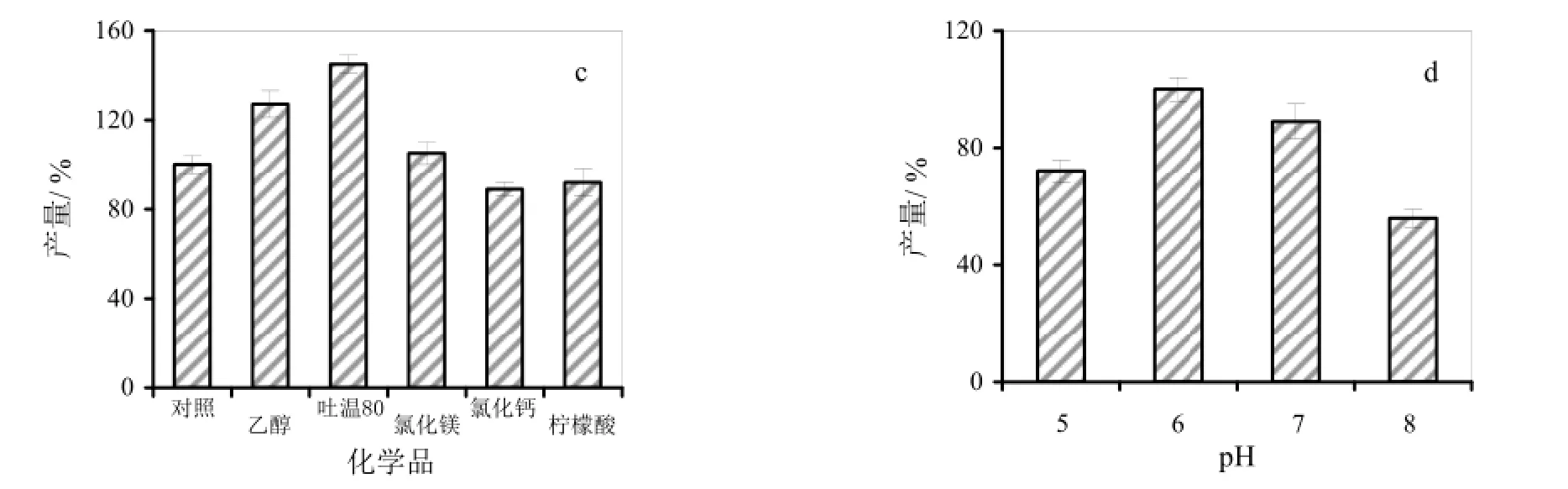
图1 G. xylinus 5-2菌株细菌纤维素发酵培养基的优化
2.3.3 不同化学品对细菌纤维素产量的影响
本研究进一步分析了5种不同化学品(乙醇、吐温80、MgCl2、CaCl2和柠檬酸)对对细菌纤维素产量的影响(图1c)。结果显示,乙醇和吐温80能够较大幅度地提高细菌纤维素的产量。其中,添加1 g/L的吐温80后,细菌纤维素的产量比空对照提高40%左右。MgCl2对细菌纤维素产量的影响不大,而CaCl2和柠檬酸略微抑制细菌纤维素的产生。乙醇对细菌纤维素生产能力的影响与已有研究相似,均能够提高菌株的细菌纤维素生产能力[19]。吐温 80是一种常用的表面活性剂,能够提高细菌细胞膜的流动性,推测其可能通过增强菌株的纤维素排出能力,提高了细菌纤维素的产量。
2.3.4 不同初始pH对细菌纤维素产量的影响
pH不仅影响细菌中酶的催化活性,也影响细菌细胞膜的通透性。因此,本研究对比了初始pH分别为5.0、6.0、7.0和8.0的培养基对细菌纤维素产量的影响(图1d)。试验表明,初始培养基pH为6.0时,细菌纤维素的产量最高,pH值为7.0时,次之;pH为8.0时,产量最低,约为pH6.0时的50%。该结果表明,pH过高或高低,均会降低细菌纤维素的产量。
综上,本试验中G. xylinus 5-2菌株的纤维素发酵培养基初步优化为:2%葡萄糖,0.5%蛋白胨,0.5%酵母膏,0.27%Na2HPO4,1 g/L吐温,1 g/L乙醇,0.115%柠檬酸,初始pH值为6.0。随后,本研究以G. xylinus 5-2为发酵菌株,采用50 mL优化发酵培养基,在500 mL的摇瓶中发酵7 d,细菌纤维素干重提高至13.2 g/L,表明该优化培养基更加适用于该菌株纤维素的产出。
2.4 细菌纤维素膜的表征
本研究采用扫描电镜、红外光谱扫描分析、X-衍射分析等方法对G. xylinus 5-2产出的细菌纤维素进行了初步表征,并对其力学性能进行了测定。
2.4.1 细菌纤维素膜的电镜观察
G. xylinus 5-2菌株发酵7天后,菌液表面生成明显的胶状菌膜,其韧性、弹性与文献报道的物理特性相同,表明该菌株具有较强的合成纤维素能力。菌膜经处理后,在电镜下可观测到明显的纤维素网状结构(如图 2所示)。单根纤维素直径在0.1 μm~0.5 μm之间,比棉纤维直径(>5 μm)低一个数量级。根据扫描电镜的观察结果,初步确定G. xylinus 5-2菌株的合成产物为纳米级纤维素。

图2 G. xylinus 5-2菌株细菌纤维素的电镜扫描结果
2.4.2 细菌纤维素膜的红外分析
为进一步对所获细菌纤维素的性质进行确定,本研究利用红外光谱扫描仪对G. xylinus 5-2菌株发酵产品的分子结构进行了检测(如图3所示)。谱图数据表明,在3419 cm-1处有强吸收峰,主要为-OH官能团的伸缩振动峰,由纤维素分子间的氢键引起;2924 cm-1处的吸收峰由-CH2或-CH3官能团的伸缩振动引起;在1539 cm-1和1384 cm-1处由于-CH3和-CH2的弯曲振动出现了较强吸收峰;在1000 cm-1附近出现的几个吸收峰是由于葡萄糖分子间形成的半缩醛的伸缩振动引起。与标准谱图进行比对,分子结构与 cellophane(玻璃纸,一种以棉浆、木浆等天然纤维为原料制成的透明薄膜)的扫描谱图匹配良好,匹配度达77.48%。
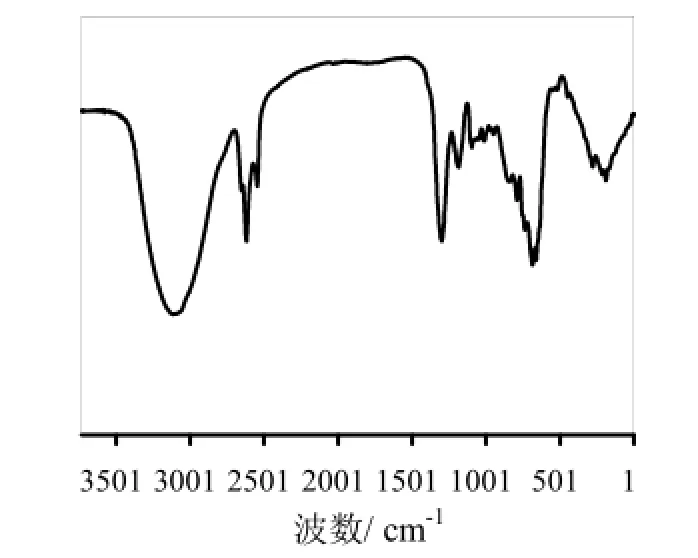
图3 G. xylinus 5-2菌株细菌纤维素的红外图
2.4.3 细菌纤维素的X-衍射分析
随后,本研究对所获的纤维素膜进行了X-衍射分析(如图4所示)。从衍射谱图可以看出,在2θ = 14.564、16.874、22.687处有较强的衍射峰,表明该纤维素为I型纤维素。三个衍射角分别对应纤维素(1,-1,0)、(1,1,0)、(2,0,0)的三个晶面、结晶度和各个晶面的晶粒大小(如表1所示)。
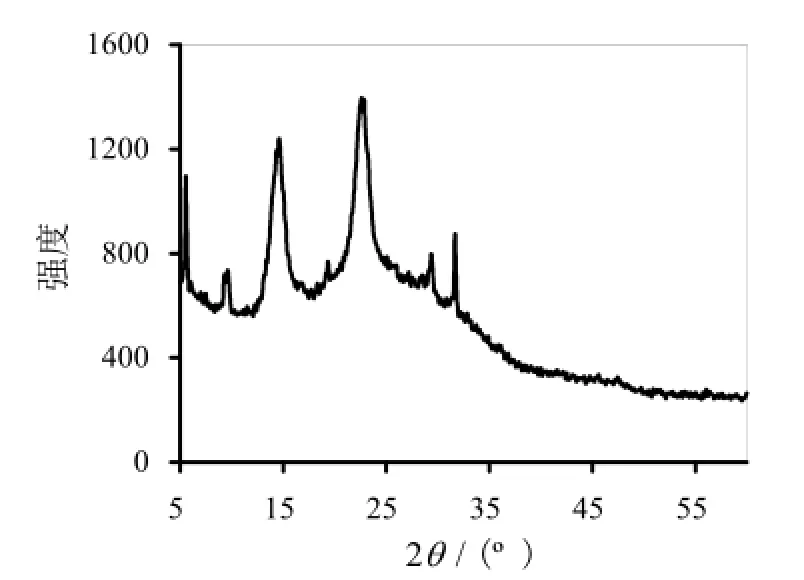
图4 G. xylinus 5-2菌株细菌纤维素的X-衍射谱图
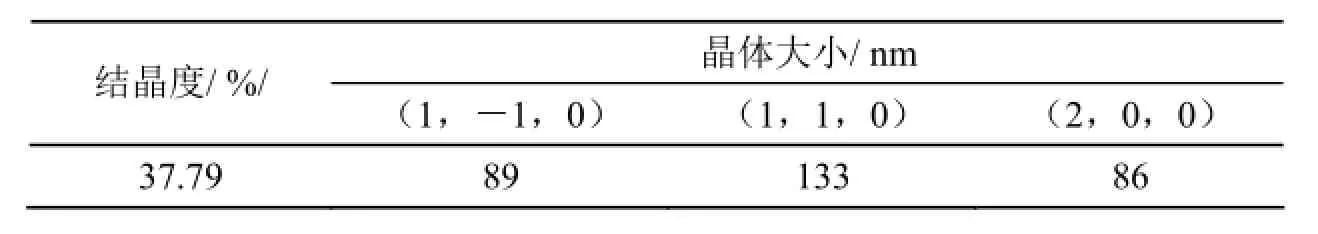
表1 G. xylinus 5-2菌株细菌纤维素X-衍射分析(结晶度和晶面大小)
2.4.4 细菌纤维素膜的综合力学性能分析
本研究对G. xylinus 5-2菌株细菌纤维素产品的拉伸强度和弹性模量进行了测量(如表2所示)。本试验所获细菌纤维素产品的拉伸强度约为12.41 MPa,弹性模量为3.38 GPa。

表2 G. xylinus 5-2菌株细菌纤维素力学性质测定
3 结论
培养基的优化对提高细菌纤维素的产量具有重要的意义,是细菌纤维素产业化过程中的必经阶段和基础。本试验通过利用单因子试验,将G. xylinus 5-2菌株的纤维素发酵培养基进行了初步优化,使细菌纤维素干重提高至13.2 g/L,表明该优化培养基更加适用于该菌株纤维素的产出。由于目前所获数据均来源于普通摇瓶发酵水平,预示着随着后续设备改造的优化,纤维素产量还有很大的提升空间[6-8]。
在研究不同碳源对发酵产量的试验中,发现本研究采用的5-2菌株与关晓辉等获得的木葡糖酸醋杆菌在碳源利用效率方面存在一定差异[20]。葡萄糖是自然界中低品质纤维素和淀粉等生物质的主要成分。本研究中采用的G. xylinus 5-2菌株能够利用葡萄糖为主要碳源,高效合成细菌纤维素,为生物质的综合高值化利用提供了一条可参考的途径。
氮源为0.5%酵母膏和0.5%蛋白胨复配时,细菌纤维产量最高,达到8.92 g/L,明显优于其他处理。推测原因可能是酵母膏和蛋白胨的混合使用为菌株提供了更多的生长因子,使其能更好地生长和发酵。因此,后续放大试验中采用酵母膏/蛋白胨的混合组合进行发酵。
G. xylinus 5-2发酵生成的细菌纤维素产品的拉伸强度为12.41 MPa,弹性模量为3.38 GPa。细菌纤维素的弹性模量多集中在10 MPa~130 MPa不等,而Yamanaka等最早报道了细菌纤维素干膜的弹性模量(杨氏模量)大于15 GPa[21];后来Iguchi等对细菌纤维素进行碱处理,使其干膜的弹性模量达到30 GPa[22]。细菌纤维素膜的力学性能与发酵菌株、培养基成分、发酵方式、膜的干燥方法、弹性模量测定方法等不同有关。
本研究筛选获得了一株在生产效率和产品性能等方面都较为优异的纤维素生产菌株G. xylinus 5-2。该菌株在普通摇瓶培养条件下,表现出优良的生产能力。推测后期通过进一步改造该菌株的培养方式,在生产方面还有较大的提升空间。所获得的细菌纤维素产品的拉伸强度为12.41 MPa,弹性模量为3.38 GPa,与已报道的细菌纤维素相比,具有较好的力学性能。该工作为工业化生产高性能细菌纤维素,拓展其在多个领域内的应用奠定基础。
参考文献:
[1] 王海波. 细菌纤维素耐低温生产菌株的选育及其改性的研究[M]. 山东轻工业学院硕士学位论文, 2009.
[2] 周胜虎, 薛齐佳, 刘传凤, 等. 细菌纤维素高产菌株的筛选和初步鉴定[J]. 湖北农业科学, 2013, 52(15): 3514-3517.
[3] 谭玉静, 洪枫, 邵志宇. 细菌纤维素在生物医学材料中的应用[J]. 中国生物工程杂志, 2007, 27(4): 126-131.
[4] 谢健健, 洪枫. 细菌纤维素发酵原料的研究进展[J]. 纤维素科学与技术, 2011, 19(3): 68-77.
[5] 汪丽粉, 李政, 贾士儒, 等. 细菌纤维素性质及应用的研究进展[J]. 微生物学通报, 2014, 41(8): 1675-1683.
[6] Hornung M, Ludwig M, Gerrard A M, et al. Optimizing the production of bacterial cellulose in surface culture: Evaluation of product movement influences on the bioreaction (Part 2)[J]. Engineering in Life Sciences, 2006, 6(6): 546-551.
[7] Hornung M, Ludwig M, Schmauder H P. Optimizing the productin of bacterial cellulose in surface culture: A novel aerosol bioreactor working on a fed batch principle (Part 3)[J]. Engineering in Life Sciences, 2007, 7(1): 35-41.
[8] Hwang J W, Yang Y K, Hwang J K, et al. Effects of pH and dissolved oxygen on cellulose production by Acetobacter xylinum BRC5 in agitated culture[J]. Journal of Bioscience & Bioengineering, 1999, 88(2): 183-188.
[9] Shigematsu T, Takamine K, Kitazato M, et al. Cellulose production from glucose using a glucose dehydrogenase gene (gdh)-deficient mutant of Gluconacetobacter xylinus and its use for bioconversion of sweet potato pulp[J]. Journal of Bioscience & Bioengineering, 2005, 99(4): 415-422.
[10] Melo C V D, Souza-Moreira T, Valentini S R, et al. Cloning of upstream region and cellulose synthase operon genes involved in bacterial cellulose biosynthesis by Gluconacetobacter hansenii ATCC23769[J]. BMC Proceedings, 2014, 8(4): 176.
[11] Park J K, Jung J Y, Park Y H. Cellulose production by Gluconacetobacter hansenii in a medium containing ethanol[J]. Biotechnology Letters, 2004, 25(24): 2055-2059.
[12] Bae S, Shoda M. Bacterial cellulose production by fed-batch fermentation in molasses medium[J]. Biotechnology Progress,2004, 20(5): 1366-1371.
[13] Seto A, Yu S, Matsushige M, et al. Effective cellulose production by a coculture of Gluconacetobacter xylinus andLactobacillus mali[J]. Applied Microbiology & Biotechnology, 2006, 73(4): 915-921.
[14] Hu Y, Catchmark J M. Influence of 1-methylcyclopropene (1-MCP) on the production of bacterial cellulose biosynthesized by Acetobacter xylinum under the agitated culture[J]. Letters in Applied Microbiology, 2010, 51(1): 109-113.
[15] Putra A, Kakugo A, Furukawa H, et al. Tubular bacterial cellulose gel with oriented fibrils on the curved surface[J]. Polymer,2008, 49(7): 1885-1891.
[16] 毋锐琴, 杜双奎, 李志西, 等. 细菌纤维素发酵培养基的优化及超微观结构分析[J]. 生物工程学报, 2008, 24(6): 1068-1074.
[17] Czaja W, Romanovicz D, Brown R M. Structural investigations of microbial cellulose produced in stationary and agitated culture[J]. Cellulose, 2004, 11(11): 403-411.
[18] 周伶俐, 孙东平, 吴清杭, 等. 不同培养方式对细菌纤维素产量和结构性质的影响[J]. 微生物学报, 2007, 47(5): 914-917.
[19] 张丽平, 卢红梅, 戴锐, 等. 乙醇及有机酸对木醋杆菌合成细菌纤维素的影响[J]. 食品工业科技, 2014, 35(4): 161-165.
[20] 关晓辉, 尹宗杰, 鲁敏, 等. 细菌纤维素发酵条件的优化及结构分析[J]. 中国酿造, 2010, 29(10): 68-71.
[21] Yamanaka S, Ishihara M, Sugiyama J. Structural modification of bacterial cellulose[J]. Cellulose, 2000, 7(3): 213-225.
[22] Iguchi M, Yamanaka S, Watanabe K, et al. Preparation of high-strength materials from bacterial cellulose[M]. Integration of Fundamental Polymer Science and Technology―5. Springer Netherlands, 1991.
中图分类号:Q81
文献标识码:A
文章编号:1004-8405(2016)02-0077-08
DOI:10.16561/j.cnki.xws.2016.02.15
收稿日期:2016-05-10
基金项目:国家自然科学基金(31201489);川渝中烟优质烟叶原料研究与开发(川渝中烟工业公司项目)。
作者简介:咸 赫(1999~),男,高中,研究方向:微生物学。
* 通讯作者:刘好宝(1964~),男,博士,研究员。研究方向:烟草优质高效栽培理论与技术。liuhaobao@caas.cn
Isolation and Identification of a Cellulose-Producing Bacterium-Gluconacetobacter xylinus and Analysis of Its Products
XIAN He1,2, SHI Su-juan1,3, MAO Jing-jing1, Wang Qian1, LIU Hao-bao1*
(1. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China;2. Qingdao No.9 High School, Qingdao 266012, China;3. College of Agronomy and Plant Protection, Qingdao Agricultural University, Qingdao 266109, China)
Abstract:Bacterial cellulose (BC) is widely used in food industry, biomedicine, paper making, acoustic equipment and oil production for its high purity, crystallinity, mechanical strength and elastic modulus. And the aim of this study is to obtain the cellulose-producing strain. The screened bacterium was identified through morphological and physiological characterization combined with its 16S rDNA gene sequence and data analysis. The culture conditions were optimized by single factor tests, including nitrogen, carbon source, initial pH and other factors. The fermentation products were identified with Fourier transform-infrared spectrum (FT-IR),scanning electron microscope (SEM) and X-ray diffraction spectra. A cellulose-producing strain was identified and designated to be Gluconacetobacter xylinus 5-2 strain. After optimization of culture conditions, the bacterial cellulose of this stain was purified and reached to the dried weight with 13.2 g/L. The cellulose products were identified to be cellulose I by the analysis of FT-IR, SEM and X-ray diffraction spectra, with a high elastic modulus of 3.38 GPa. G. xylinus 5-2, a bacterium which is identified to be able to efficiently produce cellulose with high elastic modulus was obtained by the screening in this study. The culture conditions were optimized and its production of cellulose was qualified. The results provide data for the industrialized production of high performance bacterial cellulose.
Key words:bacterial cellulose; Gluconacetobacter xylinus; screening; biocatalysis

