铁皮石斛组培苗多糖含量的变化规律
摘要:以组培生产的铁皮石斛原球茎、丛生芽和植株茎段为材料提取石斛,测定其多糖含量,计算多糖累积效率,以了解不同形态铁皮石斛组培苗的多糖含量及其变化规律。结果表明,不同形态的铁皮石斛组培苗多糖含量差异较大,植株茎段的多糖含量相对最高,可达26.20%,原球茎多糖含量次之,为25.26%,二者均可达到《中华药典》中对石斛中药材多糖含量要求的规定;原球茎和植株茎段的多糖含量与培养时间呈正相关;原球茎多糖的积累效率相对最高,可以成为生产石斛多糖的原料新来源。
关键词:铁皮石斛;组织培养;多糖含量;茎段;原球茎;丛生芽
中图分类号: S567.043文献标志码: A文章编号:1002-1302(2016)06-0403-03
收稿日期:2016-01-29
基金项目:滨州职业学院科研计划(编号:2013YJKT11、2013XYKT07)。
作者简介:张晓博(1980—),女,山西太原人,硕士,讲师,从事动物、植物生理学和生物化学教学与研究工作。E-mail:sdzhangxb@126.com。铁皮石斛(Dendrobium offcinale Kimura et Migo)属于兰科石斛属多年生草本植物,在自然条件下,铁皮石斛采用传统的实生苗栽培、分株、扦插等方式进行生产,产量极低,而采用组织培养技术获得铁皮石斛成为目前最常用的生产方法。石斛多糖是铁皮石斛中主要的活性成分,多糖含量是评价铁皮石斛质量高低的主要指标[1]。本试验通过比较不同形态和不同时期铁皮石斛组培苗中的多糖含量,为铁皮石斛组织培养技术代替大田生产提供理论数据。
1材料与方法
1.1仪器与试剂
仪器主要有恒温水浴锅、回流提取装置、分光光度计、离心机、电子天平、真空干燥箱、旋转蒸发仪。试剂主要有苯酚、浓硫酸、95%乙醇、葡萄糖,均为分析纯;80%乙醇。
1.2试验材料的准备
1.2.1铁皮石斛原球茎分别取在1/2 MS+0.3 mg/L NAA+0.1 mg/L 6-BA固体培养基上培养10、20、30 d的铁皮石斛原球茎,烘箱中60 ℃烘干;粉碎,干燥至恒质量;称质量,备用。
1.2.2铁皮石斛丛生芽取铁皮石斛原球茎转接于1/2 MS+0.2 mg/L NAA+0.5 mg/L 6-BA固体培养基上,经 14 d 诱导分化形成铁皮石斛丛生芽;将丛生芽在烘箱中 60 ℃ 烘干;粉碎,干燥至恒质量;称质量,备用。
1.2.3铁皮石斛组培植株茎段切取铁皮石斛丛生芽转接于MS+1.2 mg/L NAA+0.3 g/L活性炭固体培养基上,分别取培养60、90、120 d的铁皮石斛组培苗茎段部分,将其放在烘箱中60 ℃烘干;粉碎,干燥至恒质量;称质量,备用。1.3测定内容及方法
1.3.1含水量测定取培养于固体培养基的铁皮石斛原球茎、丛生芽及植株称质量,干燥箱中105 ℃烘20~30 min,再在温度60~80 ℃下烘干至恒质量,称质量。
含水量=(M0-M1)÷M0×100%。
式中:M0为烘干前质量;M1为烘干后质量。
1.3.2多糖含量测定
1.3.2.1供试样品多糖的制备取烘干待测样品,粉碎,过3号筛(50目);精确称定0.3 g粉末,加水200 mL,加热提取2 h;冷却,转移至250 mL容量瓶,加水稀释至刻度,摇匀;过滤,滤液用旋转蒸发仪减压浓缩至20 mL;将浓缩液移入 25 mL 容量瓶,定容,摇匀;精确吸取2 mL稀释液,置15 mL离心管中,加入无水乙醇10 mL,摇匀,冷藏 2 h;取出,4 000 r/min 离心20 min,弃去上清液,沉淀用80%乙醇洗涤2次,每次8 mL;4 000 r/min离心20 min,弃去上清液,沉淀加热水溶解,并转移至25 mL容量瓶;冷却,用水稀释至刻度,摇匀,即得铁皮石斛的多糖提取溶液。
1.3.2.2对照品溶液的配制以无水葡萄糖作为对照品,取适量,105 ℃干燥至恒质量,精确称量;加水溶解并定容,摇匀,制成每1 mL含糖100 μg的标准葡萄糖溶液。
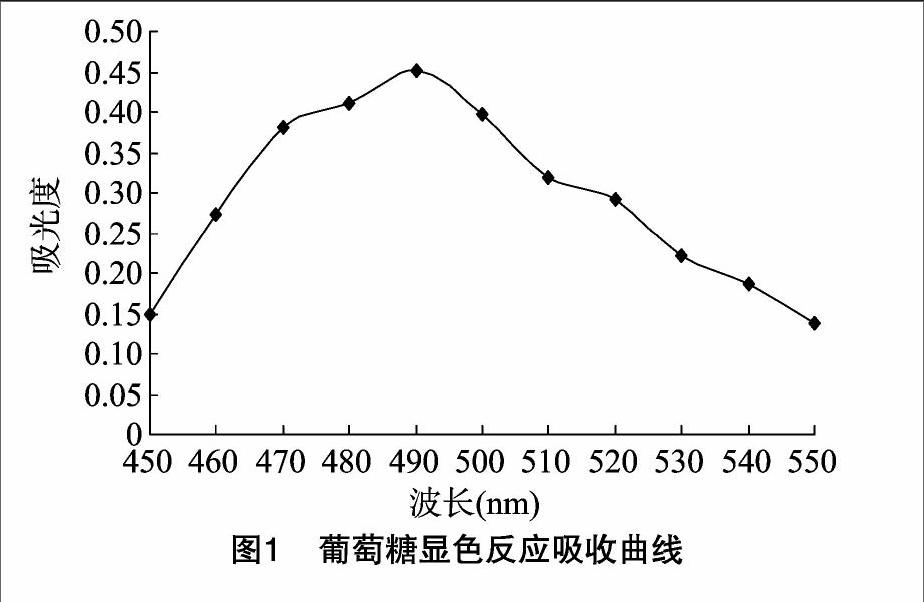
1.3.2.3检测波长的选择精确吸取标准葡萄糖溶液 0.5 mL,置于具塞比色管中,补加蒸馏水至2.0 mL;加苯酚试液1.0 mL,摇匀;迅速滴加浓硫酸5.0 mL,迅速摇匀,置沸水浴中加热20 min;取出,置冰水浴中冷却5 min;在550~650 nm 范围内对溶液进行扫描,以吸光度为纵坐标,入射光波长为横坐标作图,结果显示,波长为490 nm左右时吸光度最高(图1),故选用490 nm作为检测波长。
1.3.2.4标准曲线的制备精确量取对照品溶液0、0.2、0.4、0.6、0.8、1.0 mL,分别置于10 mL 具塞试管中,补加水至1.0 mL;加5%苯酚溶液1 mL(临用配制),摇匀;加硫酸 5 mL,摇匀,置沸水浴中加热20 min;取出,放入冰浴中冷却 5 min,波长490 nm处测定吸光度;以吸光度为纵坐标(y)、浓度为横坐标(x)绘制标准曲线,得吸光度和浓度的回归方程为:y=0.391 7x-0.008 6(r=0.999 7),这说明多糖浓度在 0~100 μg/mL 时,浓度和吸光度具有良好的线性关系。
1.3.2.5样品多糖含量的测定精确量取样品多糖提取液1.0 mL,置于10 mL具塞试管中;加5%苯酚溶液1 mL,摇匀;加硫酸5 mL,摇匀,置沸水浴中加热20 min;取出,放入冰浴中冷却5 min,测定吸光度。每个样品平行处理3次,取平均值,根据回归方程计算葡萄糖的质量浓度,进一步计算多糖的含量。
1.3.2.6精密度试验吸取0.5 mL葡萄糖对照品溶液6份,按照多糖含量测定步骤进行操作,测定吸光度,得到相对标准偏差RSD值为1.64%(n=6),这说明精密度良好。
1.3.2.7重复性试验按照多糖供试品的制备步骤,制备6份同一样品的多糖溶液,分别吸取各样品溶液1 mL至试管,按照多糖含量测定步骤进行操作,测定吸光度,得到相对标准偏差RSD值为1.86%(n=6),这说明重复性良好。
1.3.2.8显色稳定性试验精确量取某一供试样品溶液 1 mL 至试管,按照多糖含量测定步骤进行操作;室温下分别放置10、30 min和1、2、3、4 h,波长490 nm处测定吸光度,得到相对标准偏差RSD值为2.99%,这表明供试品显色在4 h内稳定。
1.3.2.9加样回收率试验取某一样品,精确加入葡萄糖标准品25 mg,按照多糖提取步骤制备供试样品溶液;吸取1 mL至试管,按照多糖含量测定步骤进行操作,测定吸光度。经6次平行测定,得平均回收率为94.75%,相对标准偏差RSD值为3.2%(n=6)。
2结果与分析
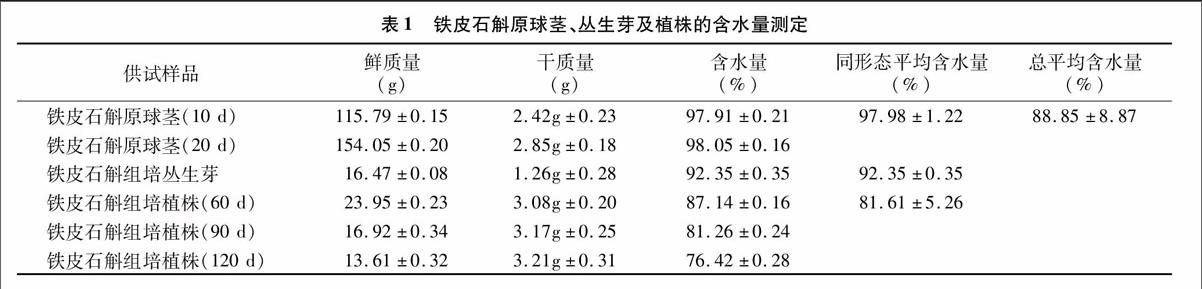
2.1铁皮石斛供试样品含水量的测定
由表1可见,供试的铁皮石斛新鲜组织含水量较大,平均质量分数达88.85%;铁皮石斛不同发育形态的含水量存在明显差异,原球茎的含水量相对最大,变幅为97.91%~98.05%,平均为97.98%,这是因为原球茎组织中含大量薄壁细胞[2],干物质较少;分化后的植株含水量相对最少,变幅为87.14%~76.42%,平均含水量为81.61%,且随着分化后培养时间的增加,含水量呈下降趋势,这是因为分化后的组织薄壁细胞减少,分化出的茎、叶等细胞不断积累纤维素和果胶质等一些干物质成分;丛生芽组织含水量为92.35%,居于中间,这与其处于前2个发育形态的过渡时期相符合。因此,实际生产中不同形态的组培苗得到石斛干粉的得率是不同的,应该分别计算产品得率。
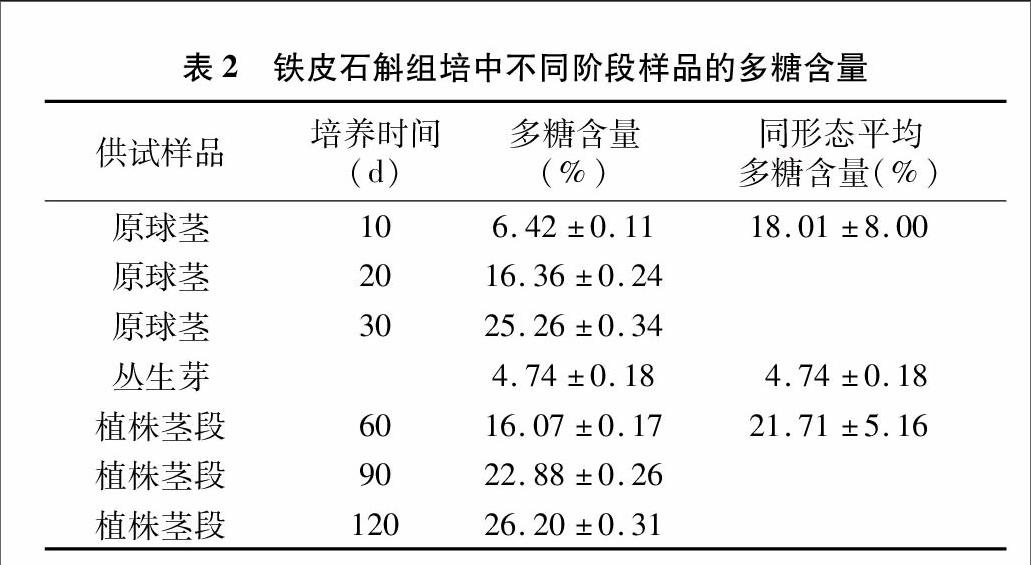
2.2培养形态与多糖含量的关系
由表2可见,不同培养阶段供试样品的多糖含量存在明显差异;植株茎段的多糖含量相对最高,平均含量达到 21.71%;其次是原球茎,平均多糖含量为18.01%;丛生芽的多糖含量相对最少,平均多糖含量仅为4.74%,经统计分析,与其他2个阶段的多糖含量相比,存在显著差异(P<0.05);培养30 d的原球茎多糖含量达25.26%,培养120 d的植株茎段多糖含量高达26.20%,这两者都达到药典规定的石斛多糖含量不低于25%的标准。丛生芽的多糖含量不但低于植株茎段,甚至比原球茎时期还要低,这种现象主要与铁皮石斛分化生长和发芽习性等有着内在联系,铁皮石斛组培苗没有分化以前,原球茎薄壁细胞的增殖和生长是有利于多糖积累的,但分化后大量产生丛生芽,出芽过程对能量的需求加大,使组织分解糖类,多糖不仅得不到积累反而会伴随出芽的过程大量消耗;分化成植株后,随着分化的完善,植株长出茎和叶,能有效利用光照和培养基中的营养物质大量积累多糖。因此,选择最佳的培养形态是提高铁皮石斛多糖含量的有效途径之一。
2.3不同培养时间对多糖含量的影响
由表2可见,相同培养形态下,铁皮石斛培养时间不同,多糖含量存在明显差异。原球茎的差异相对最大,培养10 d时多糖含量仅为6.42%,到培养30 d时增加到25.26%,增幅为18.84百分点;其次是植株茎段,培养60 d时,多糖含量为16.07%,到培养120 d时增加到26.20%,增幅为10.13百分点。这说明培养时间和多糖的含量存在一定的正相关性,培养时间越长,石斛多糖的含量就越高。
2.4不同培养形态与多糖累积效率的关系
由图2可见,原球茎的多糖含量从6.42%累积到 25.26% 需要20 d,组织多糖积累效率为9.42 mg/(g·d)。而植株茎段多糖含量从16.07%累积到26.20%却需要60 d,组织多糖积累效率为1.69 mg/(g·d),原球茎多糖积累效率明显高于植株。这与不同组织的生长特异性有关,原球茎组织中都是未分化的薄壁细胞,生长速度快,细胞分裂周期短,而已经分化为植株茎段的组织,由于基因表达选择特异性,这一阶段植物的生长除了多糖,还伴随有石斛碱、蛋白质、纤维素、果胶质等各种复杂成分统一增长和积累的过程。
3结论与讨论
铁皮石斛组培苗的培养阶段是影响石斛多糖产量的重要因素之一。本试验中,铁皮石斛原球茎培养30 d与植株茎段培养120 d时多糖的含量相对较高,分别为25.26%、26.20%,参照2010年版《中华人民共和国药典》规定:铁皮石斛按干燥品计算,以无水葡萄糖计,含铁皮石解多糖不得少于25.0%[1],铁皮石斛这2个培养阶段的多糖含量均达到规定要求。这与黄以平等的研究结论[3-4]相符。因此,组织培养技术生产的铁皮石斛原球茎和植株茎段,可以替代传统栽培和野生的石斛药材,可以解决野生药材资源少而人工栽培生产周期长、产量低的问题[5-6]。试验结果还表明,铁皮石解组织培育过程中,培养时间对多糖含量的影响呈正相关,原球茎和植物茎段随培养时间的延长,多糖含量分别从6.42%增加到25.26%、从16.07%增加到26.20%,这与苏江等的研究结论[7-8]较为吻合。
从多糖积累效率来看,铁皮石斛原球茎积累多糖的速度远高于植株茎段,再加上原球茎培养时间相对较短,积累多糖速度快,能降低生产成本,可作为石斛多糖优先选择的生产来源,这也或许可以促进铁皮石斛价格的理性回归。
需说明的是,铁皮石斛原球茎培养一定时间,培养基中的全部碳源基本消耗[2],造成培养液渗透压降低,不利于铁皮石斛的生长。另外,虽然原球茎多糖含量和植株茎段相似,但是其他营养成分如石斛碱、氨基酸、抗氧化酶活性等指标是否也能与人工栽培甚至野生植株的相同还不得而知;因此,需要从延长原球茎生长时间和其他营养成分指标比较等方面开展进一步研究。
参考文献:
[1]国家药典委员会.中华人民共和国药典:一部[M]. 北京:中国医药科技出版社,2010:265-266.
[2]张启香,付素静,方炎明,等. 铁皮石斛拟原球茎的发生过程[J]. 浙江林学院学报,2009,26(3):444-448.
[3]黄以平. 铁皮石斛快繁及多糖含量测定[J]. 福建中医药,2013,44(4):47-48.
[4]岑忠用,苏江,梁冠兴. 热水浸提法提取铁皮石斛原球茎多糖的工艺[J]. 湖北农业科学,2011,50(18):3807-3810.
[5]余乐,兰芹英,姜宗庆. 铁皮石斛离体快繁技术[J]. 江苏农业科学,2014,42(11):268-270.
[6]许奕,宋顺,王安邦,等. 不同培养基对铁皮石斛壮苗生根的影响及移栽条件优化[J]. 江苏农业科学,2015,43(8):247-249.
[7]苏江,岑忠用,何铁光. 中途添加不同浓度蔗糖对铁皮石斛原球茎多糖积累的影响[J]. 广东农业科学,2010,37(9):65-67.
[8]诸燕,斯金平,郭宝林,等. 人工栽培铁皮石斛多糖含量变异规律[J]. 中国中药杂志,2010,35(4):427-430.

