高效凝胶色谱法测定贻贝多糖含量及分子量
侯重文,朱梓昂,张金华,张天娇,刘飞Δ,凌沛学
(1.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;2.山东福瑞达医药集团公司,山东 济南 250101;3.华东理工大学 生物工程学院,上海 200237)
高效凝胶色谱法测定贻贝多糖含量及分子量
侯重文1,2,朱梓昂3,张金华1,2,张天娇1,2,刘飞1,2Δ,凌沛学1,2
(1.山东省药学科学院 山东省生物药物重点实验室 山东省多糖类药物工程实验室 多糖类药物发酵与精制国家地方联合工程实验室,山东 济南 250101;2.山东福瑞达医药集团公司,山东 济南 250101;3.华东理工大学 生物工程学院,上海 200237)
目的 建立使用凝胶色谱测定贻贝多糖含量和分子量的方法。方法 使用岛津高效液相色谱,TSK-gel GMPWXL(7.8 mm×300 mm)凝胶色谱柱,以0.05 mol/mL硝酸钠溶液(含0.05%叠氮钠)做为流动相,柱温35 ℃,流速为0.6 mL/min,RID-20AT示差折光检测器,检测池温40 ℃。结果 对所建立的分析方法进行精密度、稳定性、重复性以及回收率等方法学研究。经测定厚壳贻贝多糖平均含量88.6%,平均重均分子量为1 261 411;紫贻贝多糖平均含量87.4%,平均重均分子量为1 244 062。结论 本文所用方法各项指标均符合分析要求,且具有快速可靠、灵敏度高和重现性好等特点,可用于贻贝多糖的质量控制。
凝胶色谱法;贻贝多糖;含量测定;分子量测定
贻贝(Mussel),俗称青口、海红、淡菜,是海洋贝类养殖中的重要种类,在我国沿海以山东、辽宁、浙江、广东等地养殖规模较大,品种主要有紫贻贝(Mytilusedulis)、厚壳贻贝(Mytiluscoruscus)和翡翠贻贝等,其中紫贻贝和厚壳贻贝是我国贻贝的主要养殖种类[1-2]。贻贝营养价值很高,自古就被认为具有补肝肾、降血脂、治疗高血压等功效,是传统的滋补食品,有“海中鸡蛋”的美誉[2-8]。本课题组前期研究发现贻贝降血脂功能主要源自于体内的多糖,遂用煮沸浸提、醇沉、层析等技术对厚壳贻贝肉和紫贻贝肉进行了分离纯化,最终分别获得成分单一的贻贝多糖组分。
多糖的性质和药理作用与其分子量大小、分子量分布及其结构密切相关[9]。TSK-gel PW系列凝胶柱填料为亲水的球形多孔高聚物,常被用于分离多糖、多肽、水溶性有机聚合物和其他水溶性大分子样品[10-12]。其中GMPWXL型凝胶色谱柱在分析分子量范围在5×102~1×107葡聚糖时具有良好的线性。本研究旨在将该色谱柱用于凝胶色谱法测定贻贝多糖的含量及分子量,确保其分析结果准确有效,从而为其结构分析、质量控制提供理论依据,为贻贝多糖在医药和保健品领域的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试品:厚壳贻贝干、紫贻贝肉干购自浙江嵊泗县华利水产有限公司;贻贝多糖样品:自制。
1.1.2 色谱柱和对照品:色谱柱:TSK-gel GMPWXL(7.8 mm×300 mm凝胶色谱柱,日本TOSOH公司生产,购自北京绿百草公司;Dexrtan系列进口右旋糖酐对照品:DXT180、DXT55K、DXT102K、DXT300K、DXT530K、DXT1185K、DXT2990K,重均分子量分别为180、55 500、102 000、291 600、534 000、1 185 000、2 990 000,购自American polymer standards corp.。
1.1.3 试剂:硝酸钠、叠氮钠、氯化钠均为分析纯,乙醇为食品级,纯化水为娃哈哈纯净水;DEAE-纤维素,购自美国GE公司;碱性蛋白酶2709,购自东华强盛生物技术公司。
1.1.4 仪器:岛津LC-20AT高效液相色谱仪;RID-20AT示差折光检测器:岛津液相色谱工作站。
1.2 方法
1.2.1 贻贝多糖的纯化制备:将厚壳贻贝干粉碎成粗粉,按比例与水混合进行搅拌蒸煮;待肉渣沉降后除去废渣;滤液使用酶法除蛋白;加入1.5倍体积的95%食品级乙醇沉淀出粗多糖。粗多糖重溶后离心取上清,进行DEAE-纤维素层析,收集0.05 mol/mL氯化钠溶液洗脱组分,经透析浓缩后冷冻干燥得到白色的厚壳贻贝多糖粉末。紫贻贝干处理方式同上,同样得到白色的紫贻贝多糖粉末。
1.2.2 溶液配制
① 对照品溶液制备:精密称取干燥至恒重的右旋糖酐系列标准品各10 mg,分置2 mL量瓶中,加流动相溶解并稀释至刻度,摇匀,即得(每1 mL溶液中含各右旋糖酐对照品5 mg)。经0.22 μm滤膜滤过后备用。
② 供试品溶液制备:分别称取2种贻贝多糖粉末适量,称定,加流动相制成每1 mL中约含5 mg的溶液,振荡混匀,室温放置过夜,经0.22 μm滤膜滤过后作为供试品溶液备用。
1.2.3 色谱条件:采用检测多糖专用凝胶色谱柱,TSK-gel GMPWXL;柱温为35 ℃;流动相:0.05 mol/mL硝酸钠溶液(含0.05%叠氮钠);流速为0.6 mL/min;示差检测器温度为40 ℃;岛津GPC分析软件。
1.2.4 分子量标准曲线的建立:取右旋糖酐标准品DXT180、DXT55K、DXT102K、DXT300K、DXT530K、DXT1185K、DXT2990K溶液,分别精密移取20 μL注入高效液相色谱仪,记录保留时间。以分子量的对数值为纵坐标,以相应色谱峰的保留时间为横坐标,使用GPC软件拟合得到分子量校正曲线。
1.2.5 含量标准曲线的建立:取真空干燥至恒重的DXT1185K右旋糖酐标准品0.265 g,精密称定,置入 25 mL量瓶中,加入流动相溶解,定容至刻度,配置成浓度10.6 mg/mL的对照品储备液。精密移取储备液0.5、1、2、3、4、5 mL于5 mL容量瓶中,分别加流动相溶液稀释至刻度,依次共得6份不同浓度对照品溶液,分别精密移取各20 μL注入液相色谱仪,记录峰面积,以峰面积为纵坐标,对照品溶液浓度为横坐标,绘制标准曲线。
1.2.6 系统适应性考察
① 精密度试验:取DXT1185K右旋糖酐标准品溶液,按1.2.3色谱条件,重复进样6次,进样量20 μL,记录峰面积变化并根据GPC软件计算得到重均分子量变化来考察仪器精密度。
② 重复性试验:精密称取贻贝多糖样品6份,制得供试品溶液,按1.2.3色谱条件测得的贻贝多糖样品主峰的含量及重均分子量。
③ 稳定性试验:取适量贻贝多糖供试品溶液,分别放置0、1、2、6、9、12、18、24 h,按1.2.3色谱条件依次记录色谱图,测得多糖含量及重均分子量。
④ 加样回收率试验:精密称取DXT1185K右旋糖酐标准品252 mg,置50 mL量瓶中,加流动相溶解定容至刻度,得浓度5.04 mg/mL的储备液。精密称取6份已知含量贻贝多糖样品各约25 mg,分置于10 mL量瓶中。精密移取6份对照品储备液5 mL,加入6份样品中,再用流动相溶解并定容至刻度,摇匀,用0.22 μm滤膜滤过后按色谱条件测定多糖含量,计算回收率。
1.2.7 贻贝多糖样品含量及分子量的测定:分别称取3批2种贻贝多糖样品各125 mg,置于25 mL容量瓶中,用流动相定容。按1.2.3色谱条件分别移取20 μL注入高效液相色谱仪,记录色谱图,以右旋糖酐DXT1185K做为标准品计算多糖含量、并使用GPC软件分析多糖分子量及分子量分布情况。
2 结果
2.1 分子量检测标准曲线的建立 右旋糖酐系列标准品保留时间见表1,使用GPC软件计算得到三次回归方程,其相关系数达0.999 2,具有良好的线性关系。
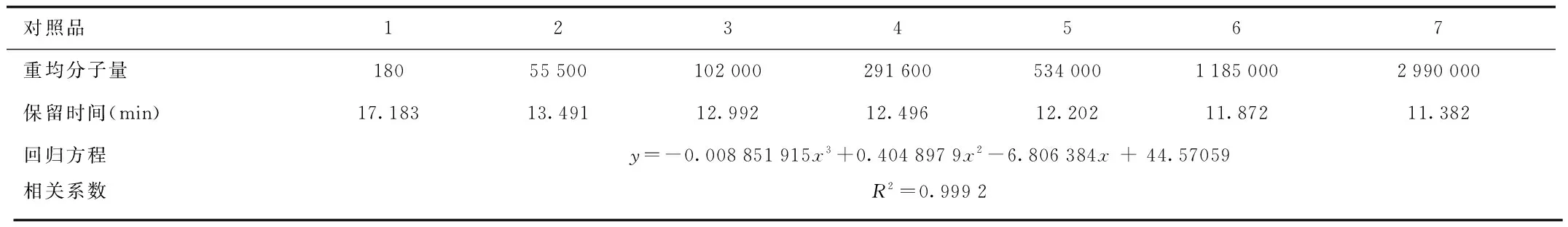
表1 右旋糖酐分子量校正曲线数据表Tab.1 Regression curve of Dextrans standard substances

图1 分子量检测标准曲线Fig.1 Calibration curves of Dextrans
2.2 多糖含量测定标准曲线 由于保留时间相近,采用DXT1185K右旋糖酐作为标准品测定贻贝多糖的含量。由图2得到线性回归方程:y=22873x-18374,R2=0.9999,说明在该范围内线性关系良好。

图2 DXT1185K标准曲线Fig.2 Calibration curve of DXT1185K
2.3 精密度试验 DXT1185K标准品峰面积分别为1 321 129、1 319 009、1 319 641、1 317 782、1 314 209、1 316 317,平均值为1 318 015,RSD=0.188%;根据GPC软件计算得到重均分子量分别为1 219 815、1 213 949、1 205 778、1 204 568、1 201 472、1 202 538,平均值为1 208 020,RSD=0.60%,说明仪器精密度良好。
2.4 重复性试验 厚壳贻贝多糖样品峰面积分别为1 088 606、1 085 059、1 083 493、1 081 114、1 079 032、1 077 086,平均值为1 082 398,RSD=0.388%;根据GPC软件计算得到重均分子量分别为1 271 294、1 273 168、1 270 181、1 269 722、1 271 659、1 270 052,平均值为1 271 012,RSD=0.102%,说明仪器重现性良好。
2.5 稳定性试验 根据GPC软件测得24 h内峰面积RSD=0.54%,重均分子量RSD=0.524%,说明仪器稳定性良好。见表2。
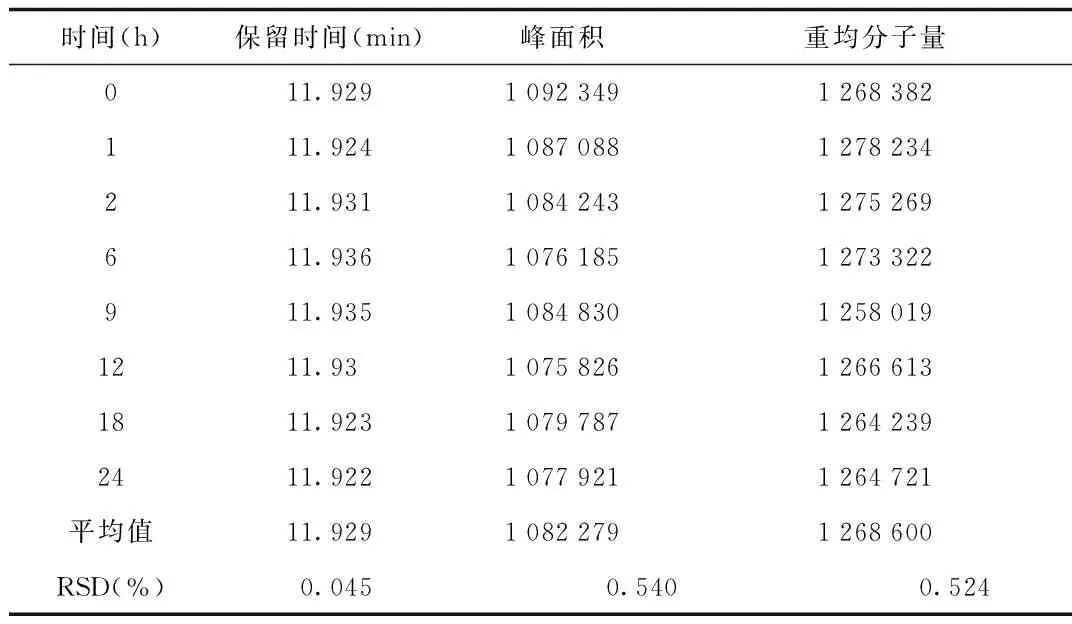
表2 稳定性试验结果Tab.2 Results of stability test
2.6 加样回收率 由表3结果可知,平均回收率为96.70%,RSD=1.32%,说明加样回收率较好,达到分析要求。

表3 加样回收率试验结果Tab.3 Results of recovery test
2.7 样品分析 厚壳贻贝多糖与紫贻贝多糖凝胶色谱图见图3。

图3 厚壳贻贝多糖(A)与紫贻贝多糖(B)凝胶色谱检测图Fig.3 HPLC chromatograms of the polysaccharide of Mytilus coruscus(A)and Mytilus edulis (B)
以右旋糖酐DXT1185K为标准品,计算得到3批次厚壳贻贝多糖平均含量88.6%,平均重均分子量为1 261 411;3批次紫贻贝多糖平均含量87.4%,平均重均分子量为1 244 062。见表4。

表4 贻贝多糖供试品含量及分子量测定结果Tab.4 Content and Molecular weight test results of the sample
3 讨论
在使用凝胶色谱法分析多糖分子量时常以盐溶液作为流动相,可以防止因糖链过度伸展而造成的多糖分子量检测值过大。本文在研究过程中参考相关文献,先后尝试使用了硫酸钠[10,13-14]、硝酸钠[15]、磷酸钠、乙酸钠[16]以及磷酸二氢钾[17]等盐溶液,通过比对保留时间、峰型等指标,最终选用了0.05 mol/mL硝酸钠溶液作为检测流动相。
但在测定贻贝多糖分子量时,由于实验条件所限,选用的是Dextran系列右旋糖酐标准品建立分子量校正曲线。同时选取了保留时间最为接近的DXT1185K作为标准品计算多糖含量。但根据分别对2种贻贝多糖分子结构的初步测定,均为含有支链的α-吡喃型葡聚糖,以Dextran系列作为标准品可能存在一定误差,而且计算出的多糖分子量也分布较宽。
综上所述,本研究通过煮沸浸提、醇沉、层析等技术,分别从厚壳贻贝和紫贻贝中分离获得结构相对单一物质贻贝多糖,并使用凝胶色谱法对其含量和相对分子质量进行了测定。根据对测定方法的精密度、重复性、稳定性以及回收率等指标进行研究,证明了该测定方法不但各项指标均符合分析要求,还具有快速简单、灵敏度高和重现性好等特点。使用该方法分别对2种贻贝多糖的3批样品进行了检测,结果显示2种贻贝多糖在含量以及重均分子量上区别不大,厚壳贻贝多糖分子量略大于紫贻贝多糖。为下一步对2种贻贝多糖的分子结构解析和药理作用分析等工作提供了理论依据,并为其在医药和保健品领域的开发提供了质量控制标准。
[1] 乐家华,刘超.世界海洋生物资源开发现状研究[J].湖南农业科学,2010,19:68-70.
[2] 李江滨,黄迪南.贻贝的药用价值研究进展[J].水产科学,2004,23(11):43-44.
[3] 苏秀榕,李太武,丁明进.紫贻贝和厚壳贻贝营养成分的研究[J].中国海洋药物,1998,17:30-32.
[4] 储智勇,毛俊琴,李铁军,等.贻贝多糖对大鼠高脂血症的影响[J].解放军药学学报,2008,24(3):213-215.
[5] Cho SH,Jung YB,Seong SC,et al.Clinical efficacy and safety of Lyprinol, a patented extract from New Zealand green-lipped mussel (PernaCanaliculus) in patients with osteoarthritis of the hip and kne: a multicenter 2-month clinical teial[J].Allerg Immunol (Paris),2003,35(6):212-216.
[6] Je JY,Park PJ,Byun HG,et al.An-giotensin I converting enzyme (ACE) inhibitory peptide de-rived from the sauce of feimented blue mussel,Mytilusedulis[J].Bioresource Technol,2005,96:1624-1629.
[7] Hernroth B.Factors influencing bactericidal activity of blue mussel (Mytilusedulis) haemocytes againstSalmonellatyphimurium[J].Fish Shellfish Immunol,2003,14:93-104.
[8] 姚滢,魏江洲,王俊,等.厚壳贻贝多糖的提取和免疫学活性研究[J].第二军医学学报,2005,26(8):896-899.
[9] 韩永萍,何江川,缪刚.姬松茸子实体多糖的分子量分布研究[J].河北农业大学学报,2006,29(3):91-94.
[10] 刘玉明,李家春,钱甜甜,等.方格星虫多糖分子量的高效凝胶渗透色谱法测定[J].时珍国医国药,2013,24(12):2857-2858.
[11] 王国佳,曹红,邢俊波,等.凝胶色谱法同时测定香菇多糖制剂中多糖分子量和含量[J].中国药事,2013,27(10):1090-1094.
[12] 赵峡,杨海,宋乐天,等.不同色谱柱和GPC软件对灰树花倍他葡萄糖相对分子量质量测定的影响[J].药物分析杂志,2007,27(8):1143-1146.
[13] 徐晓霞,李炎,刘华,等.高效凝胶色谱法测定多花黄精多糖分子量与分子量分布[J].四川生理科学杂志,2008,20(3):102-103.
[14] 赵峡,苗辉,范慧红,等.用GPC法测定硫酸多糖911的分子量和分子量分布[J].青岛海洋大学学报,2000,30(4):623-626.
[15] 李静,左雄军.芸芝多糖组分的相对分子质量的凝胶渗透色谱表征[J].分析测试学报,1999,18(4):49-51.
[16] 钦传光,黄开勋,徐碧辉.凝胶过滤色谱法测定泥鳅多糖的组成及分子量[J].分析化学研究简报,2002,30(4):411-413.
[17] 侯轩,周家容,田允波.白术多糖的提取、分离纯化及分子量的测定[J].仲恺农业工程学院学报,2009,22(2):18-21.
(编校:吴茜)
Determination of the content and the molecular weight of Mussel Polysaccharide by GPC
HOU Zhong-wen1,2, ZHU Zi-ang3, ZHANG Jin-hua1,2, ZHANG Tian-jiao1,2, LIU Fei1,2Δ, LING Pei-xue1,2
(1.Shandong Academy of Pharmaceutical Sciences, Key Laboratory of Biopharmaceuticals, Engineering Laboratory of Polysaccharide Drugs, National-Local Joint Engineering Laboratory of Polysaccharide Drugs, Ji’nan 250101, China; 2.Shandong Freda Pharmaceutical Group Company, Ji’nan 250101, China; 3.School of Biotechnology, East China University of Science and Technology,Shanghai 200237, China)
ObjectiveTo develop a gel permeation chromatography method for determination of content and molecular weight (Mw) of Mussel Polysaccharide.MethodsUsing GPC method, the sample was separated with TSK-gel GMPWXL(7.8 mm×300 mm) chromatography column which was set at 35 ℃.The mobile phase was 0.05 mol/mL NaNO3(including 0.05%Na2N3) and the flow rate was 0.6 mL/min.The detector was RID-20AT.ResultsThe average molecular weight of the polysaccharide ofMytiluscoruscuswas 1 261 411 and the average content was 88.6%by using of the calibration curves of dextrans.The average molecular weight of the polysaccharide ofMytiluseduliswas 1 244 062 and the average content was 87.4%.ConclusionThe method established in this paper is simple and rapid, accurate and reproducible, which can be used for the quality control of Mussel Polysaccharide.
GPC; Mussel Polysaccharide; content determination; molecular weight determination
国家高技术研究发展(863)计划(2014AA093603);山东省科技发展计划(2014GSF121043);山东省自主创新成果转化专项(2014CGZH1306);山东省重点研发计划(2015GSF121003);济南市重大专项(201403009)
侯重文,男,硕士,助理研究员,研究方向:微生物与生化药学,E-mail:hzw0316@163.com;刘飞,通信作者,男,硕士,助理研究员,研究方向:生物技术,E-mail:lfshwu@163.com。
10.3969/j.issn.1005-1678.2016.11.003
Q786
A

