山西黄芪根际固氮菌的分离与应用
薛智权,唐中伟,李浩,周然,梁建萍*
(1.山西农业大学 生命科学学院,山西 太谷,030801; 2.山西中医学院,山西 太原,030024)
山西黄芪根际固氮菌的分离与应用
薛智权1,唐中伟1,李浩1,周然2,梁建萍1*
(1.山西农业大学 生命科学学院,山西 太谷,030801; 2.山西中医学院,山西 太原,030024)
摘要:[目的]对黄芪道地产区山西浑源的黄芪根际固氮细菌进行了分离鉴定,并应用于黄芪栽培中以观察其固氮能力,旨在筛选并获得能够促进黄芪生长的固氮菌,为降低黄芪生产成本提供依据。[方法]采用Ashby无氮培养基初筛获得了120个自生固氮菌株;进一步用固氮培养基对初筛所得菌株进行复筛,根据固氮能力、菌落生长速度等特征,获得了2株具有较强固氮能力的菌株t16和t21;通过细菌鉴定系统和 16S rRNA 序列分析对其进行分类鉴定。另外还用全N差值法检测了t16和t21浸泡黄芪种子后的固氮活性。[结果]t16和t21分别属于Rhizobium sp.和Sinorhizobium sp.。经两株菌发酵液浸泡后,培养30 d分别能够增加黄芪幼苗含氮量14.23%~18.67%和13.10%~18.77%。其中含菌量为106个·mL-1的t16发酵液和含菌量为108个·mL-1的t21发酵液效果最好,折算每公顷30 d的固氮量达2.25 kg。[结论]山西黄芪根际固氮菌具有较大的开发利用潜力。
关键词:固氮菌; 黄芪; 根际; 分离; 鉴定
近年来,全球种植业过分依赖和大量施用化肥造成的肥料浪费、土壤和地下水污染以及生态失衡已经引起了世界各国的广泛关注。减少化肥的使用、提高氮肥利用率是当前农业生产中急需解决的重要问题。充分发挥固氮细菌的生物固氮作用是减少氮肥使用量最有效的途径,生物固氮资源的研究、开发和利用在我国农业可持续发展中占有重要地位。生物固氮是自然界中仅次于光合作用的复杂生物反应系统,为全球的植物提供了大约75%的氮素[1, 2]。空气作为最大的氮库,其含量的80%为氮气。然而氮气分子由两个氮原子以N≡N三键相连接,非常牢固,很难打断,因此不能被一般植物直接利用。许多豆科植物,例如花生、大豆、苜蓿等,可以通过与根瘤菌协作,将空气中的分子态氮转变为氨态氮,再被植物利用。在这种协作模式下,每个根瘤就是一座微型氮肥生产单位,将分子氮转变成氨氮,再输送给植株利用。根瘤中的固氮菌给植株生产的氮肥不会有环境污染,直接供给植株,免去了长途运输和施用环节,避免了氮的损失。相比较而言,人工施用化学氮肥的流失率往往大于50%。生物固氮在提高土壤肥力、增强植物抗病能力等方面也发挥着极其重要的作用[3]。
固氮细菌可分为自生固氮菌、联合固氮菌和共生固氮菌三类[4]。自生固氮菌本身具有完整的固氮能力,分布很广,但是种类较少,如圆褐固氮菌和拜叶林克氏固氮菌。联合固氮存在于植物根系周围,依靠根系分泌物生存、繁衍,并发挥固氮作用。雀稗固氮菌[5]和产脂固氮螺菌即属于此类。共生固氮菌广泛分布于土壤中,在豆科植物根系延伸时,通过根部细胞裂缝进入表皮内形成根瘤,通过与植物的共同作用将空气中的分子氮转化为氨氮并被植物利用。目前农业方面主要应用联合固氮菌和共生固氮菌,自生固氮菌由于其固氮效率低,且固氮方式特殊,不适合在农业方面广泛应用。
黄芪(Astragalus membranaceusBunge)是豆科黄芪属多年生草本植物,又名绵芪。在我国产于内蒙古、山西、甘肃、黑龙江等地。传统医学中,黄芪有2 000多年的药用历史,有补气、消肿、抗炎、生肌等功效[6]。由于临床需求量大,长期大量采挖,导致近年来野生黄芪的数量急剧减少,有趋于绝灭的危险。山西浑源县是黄芪的道地产地,所产黄芪中甲甙、多糖等活性成分的含量均居国内之首,并于2011年获批国家地理标志证明商标“正北芪”。根据浑源道地黄芪的正宗药用性和原产地有用成份这一地理标识产物,本项目以其原生地土壤根瘤菌为研究基础,对道地黄芪的固氮根瘤菌进行分离,筛选和鉴定,并对其培养条件和生理生化以及生物信息学方面进行研究,旨在为利用生物固氮在黄芪生产上实现节肥减耗、加强黄芪种植业生态系统的良性循环提供科学基础和技术支持。
1材料与方法
1.1试验材料
1.1.1供试土壤
分离固氮菌的土壤来自山西大同浑源县丽珠集团黄芪基地。采样深度为10~20cm,采样时间为2013年8月中旬。土壤样品采样时保留部分黄芪根系,从田间取得的新鲜土壤样品放入塑料样品采集袋中,封口,室温保存。
1.1.2培养基
本文所用的培养基参考相关文献配制:分离培养基为Ashby无氮培养基[7];恢复培养基为固氮培养基和马铃薯培养基;富集培养基为LB培养基和YMA培养基;鉴别培养基采用了淀粉培养基、蛋白胨水培养基、葡萄糖蛋白胨水培养基和石蕊牛奶培养基[8]。
1.2试验方法
1.2.1固氮菌的分离与初筛
称取新鲜土样10g,放入盛有90mL无菌水的三角瓶中,摇床振荡30min制成菌悬液,取上清液在试管中作梯度稀释。选取3个稀释度(10-3、10-4、10-5)的菌悬液0.1mL涂布于Ashby无氮培养基上,28 ℃恒温培养5d,统计固氮菌的菌落数量。观察菌落的形态特征,并统计不同来源样品中固氮菌的种类。选取生长速度快、菌落单一且形态完整的菌株,用无菌枪头挑取不同种类的单菌落各5个,接种到新鲜的LB培养基上28 ℃培养4d后,革兰氏染色,观察其菌体形态特征[8, 9]。连续划线纯化5次以上,筛选的菌株在-80 ℃保存备用(甘油∶菌液=2∶3)。
1.2.2固氮菌株的鉴定
(1)菌体形态学鉴定
将高效固氮菌株t16和t21菌体分别接种到Ashby无氮培养基平板上,28 ℃倒置培养5d,观察菌落形态特征。以大肠杆菌和枯草芽孢杆菌为对照涂片,进行革兰氏染色并观察菌体形态。
(2)菌株生理生化特征的测定
根据《常见细菌系统鉴定手册》[8]对筛选得到的高效固氮菌株t16和t21进行生理生化鉴定,所测定的项目包括淀粉水解实验、VP试验、接触酶试验、石蕊牛奶试验、氧化酶试验、甲基红试验和耐盐试验等。
(3)菌株的分类鉴定
本实验以菌株t16和t21的总DNA作模板扩增16SrDNA[10]。所用引物为P1 5’-CGGGATCCAGAGTTTGATCCTGGCTCAGAACGAACGCT-3’和P6 5’-CGGGATCCTACGGCTACCTTGTTACGACTTCACCCC-3’,分别对应于根瘤模式菌株16SrRNA的第8~37碱基位置和第1 479~1 506碱基位置[11]。 25μL的反应体系: 10×buffer2.5μL,dNTP2μL,DNA模板 2μL,引物P1 1μL,P6 1μL,Taq酶0.125μL(5U·μL-1),ddH2O16.5μL。PCR反应条件:95 ℃预变性5min,进入热循环:94 ℃变性1min,60 ℃退火1min,72 ℃延伸2min,共34个循环,最后在72 ℃延伸 10min。用1.5%的琼脂糖凝胶电泳检测PCR产物。然后将PCR反应产物直接测序,测序工作在英潍捷基(上海)贸易有限公司完成。通过BLAST对得到的16SrRNA序列在GenBank里面进行比对,以确定其种属。
1.2.3固氮活性测试
供试黄芪种子由山西浑源县黄芪种植基地提供。采用全N差值法测定菌株的固氮能力。将筛选得到的新菌株t16和t21接种到100mLYMA液体培养基中,28 ℃摇瓶培养后,用血球计数板计数,用去离子水稀释,获得含菌量为106个·mL-1、107个·mL-1、108个·mL-1的菌剂。将洗净灭菌的蛭石(粒径为2mm)放入直径8cm、高10cm塑料盆中,作为无氮培养场地。试验分3个处理和1个对照共4组,每组5个样品盆,重复3次,随机排列。各处理组的黄芪种子用上述3个浓度的菌液浸泡3h,对照用去离子水浸泡3h。然后将种子播种到装有蛭石的塑料盆中,并把上述菌剂各30mL倒入到相应的盆中,在山西农业大学生科院实验室内进行培养。每天浇水30mL,培养30d收获黄芪苗,每组随机采样10株幼苗全株,计量平均苗高和叶片数,洗净后置于烤箱内烘干,测定黄芪苗的含氮量[12]。
2结果与分析
2.1黄芪根际固氮菌的分离及鉴定
2.1.1细菌培养特性及理化性质
从黄芪道地种植基地收集的土壤样品中分离获得能在Ashby培养基上生长的细菌菌株120株。根据生长速度和菌斑大小,确定其固氮活性,最后筛选出两株固氮活性最高的菌株t16和t21。在YMA固体培养基上,菌株t16的菌落呈圆形,白色,半透明,湿润。菌株t21生长较快,菌落形态呈圆形,无色透明,菌落成粘稠状易流动(图1)。革兰氏染色显示菌株t16为革兰氏阴性杆菌,孔雀绿染色呈阴性,提示新菌株t16细胞内不含有芽胞(图2)。菌株t21为革兰氏阴性杆菌,无芽孢,有PHB颗粒(图3)。对它们分别作了生理生化鉴定,结果见表1。
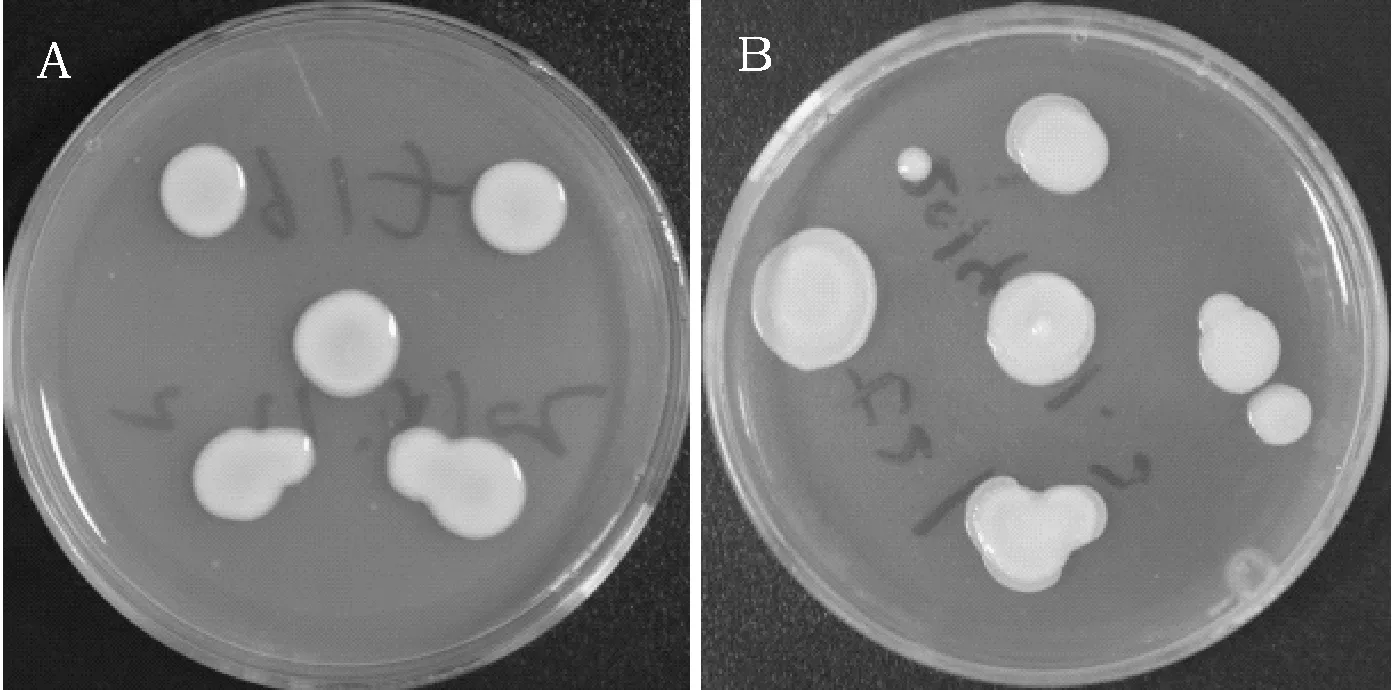
图1 菌株t16和t21的菌落形态Fig.1 The colony morphology of strains t16 and t21 注:A:t16;B:t21。在YMA平板上,t16菌落呈圆形,白色,半透明,湿润;t21菌落为乳白色,粘稠状,易流动Note:A: strain t16; B: strain t21. In YMA culture plate, t16 colonies were round, white, translucent, and moist, while t21 colonies were milky white, sticky, and easy flow.

图2 菌株t16的染色特性(100×)Fig.2 Dying properties of strain t16 注:A:革兰氏染色,结果显示菌株t16为革兰氏阴性杆菌;B:孔雀绿染色呈阴性,提示菌株t16细胞内不含有芽胞Note:A: The results of gram staining show that strain t16 is a gram-negative bacillus. B: The results of malachite green straining are negative, suggesting that strain t16 does not contain endospore
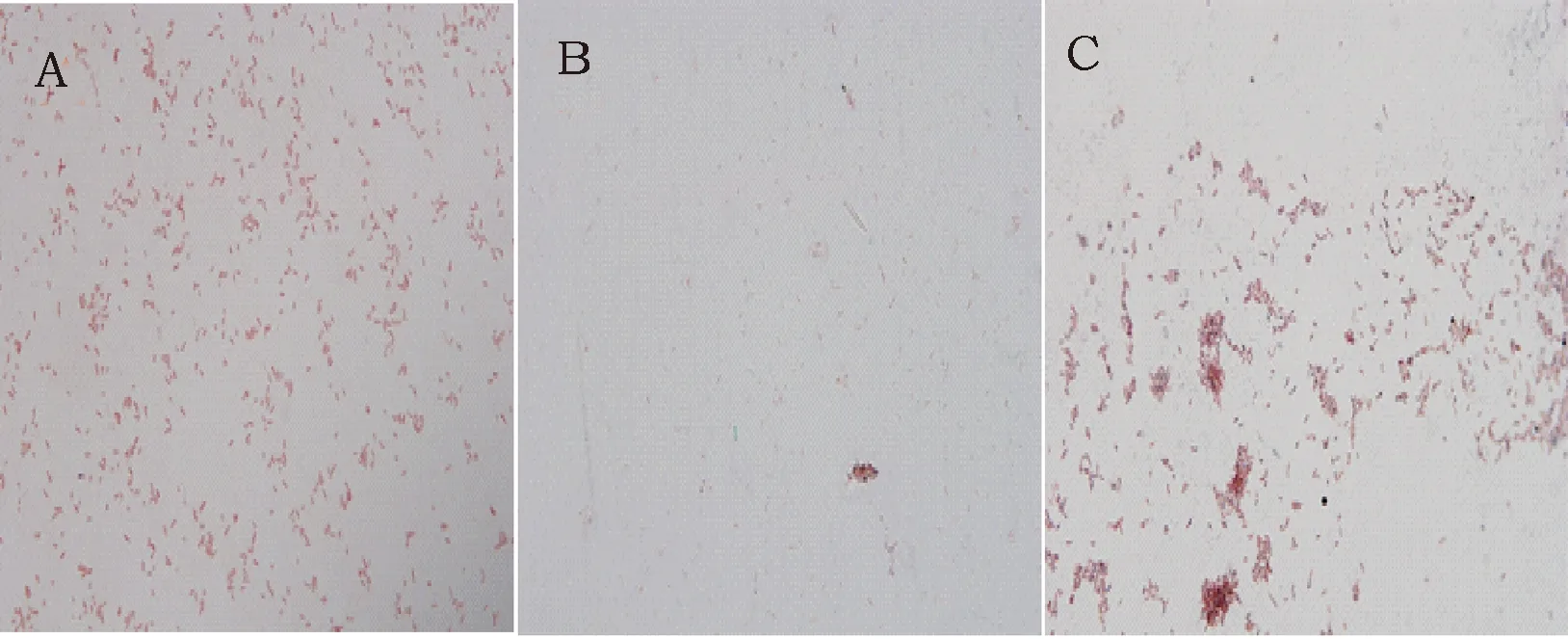
图3 菌株t21的染色特性(100×)Fig.3 Dying properties of strain t21 注:A:革兰氏染色,结果显示菌株t21为革兰氏阴性杆菌;B:孔雀绿染色呈阴性,提示菌株t21细胞内不含有芽胞;C:苏丹黑B染色呈阳性,菌体内有黑色着色点,为菌体内的PHB颗粒Note:A: The results of gram staining show that strain t21 is a gram-negative bacillus. B: The results of malachite green straining are negative, suggesting that strain t21 do not contain endospore. C: The results of sultan black B staining show that lots of black points in bacteria, which means that PHB particles in vivo
Table1Physiologicalandbiochemicalcharacteristicsofstraint16andt21

测定指标Testitemst16t21淀粉水解试验--氧化酶试验++VP试验--接触酶试验++石蕊牛奶试验暂无反应暂无反应甲基红试验--耐盐性试验++
注:“+”表示呈阳性反应,“-”表示呈阴性反应。
Note: “+”meanspositivereaction, “-”meansnegativereaction.
2.1.2菌株的分类鉴定
提取黄芪固氮菌t16和t21菌株的基因组DNA,利用PCR反应扩增其16SrRNA部分序列,得到一条长度约为1 500bp的DNA片段(图4)。测序后获得序列长度为1 311bp,序列上传到GenBank数据库,登录号分别为KP735940和KP7395941。使用BLAST在GenBank数据库中进行同源性比对,结果显示,新菌株t16与Rhizobium fabae的16SrRNA基因序列同源性为100%(KF465964.1),结合形态观察及生理生化试验,将新菌株t16确定为Rhizobiumsp.。而t21菌株与Sinorhizobiumsp.SCAUS141的16SrRNA基因序列同源性为99%(KF836038),结合形态观察及生理生化试验,将新菌株t21确定为Sinorhizobiumsp.。

图4 菌株t16和t21的16S rRNA扩增结果Fig.4 The fragments of 16S rRNA amplified by PCR 注:A:t16;B:t21。PCR扩增结果显示,在1 500 bp附近有扩增条带Note:A: strain t16; B: strain t21. The results of agarose gel electrophoresis show that there are fragments about 1 500 bp in PCR products
2.2固氮菌活性实验
2.2.1黄芪幼苗生长情况
种植于无氮基质中的黄芪,接种道地黄芪分离出的固氮菌30d后将其植株完整取出,测量黄芪幼苗连根的长度,并计数黄芪的叶片数,见图5、图6和表2、表3。
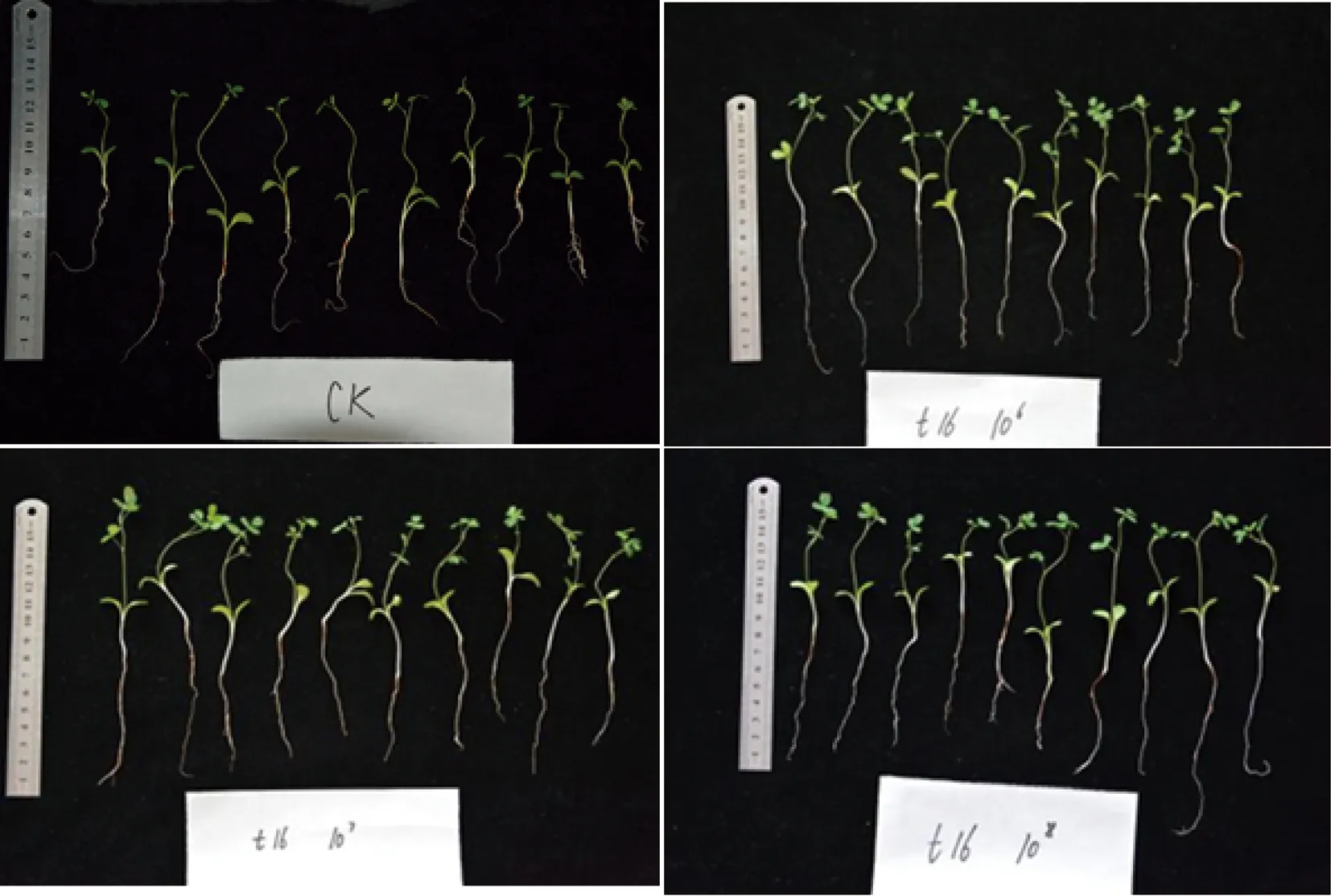
图5 菌株t16发酵液处理黄芪种子后培养30 d黄芪幼苗的生长情况Fig.5 The growth of AMB seedlings after being treated by strain t16 and cultured for 30 days
试验结果(图5)表明,用菌液处理后的幼苗长度和叶片数都要明显高于对照,其中106个·mL-1浓度处理后的效果更佳。
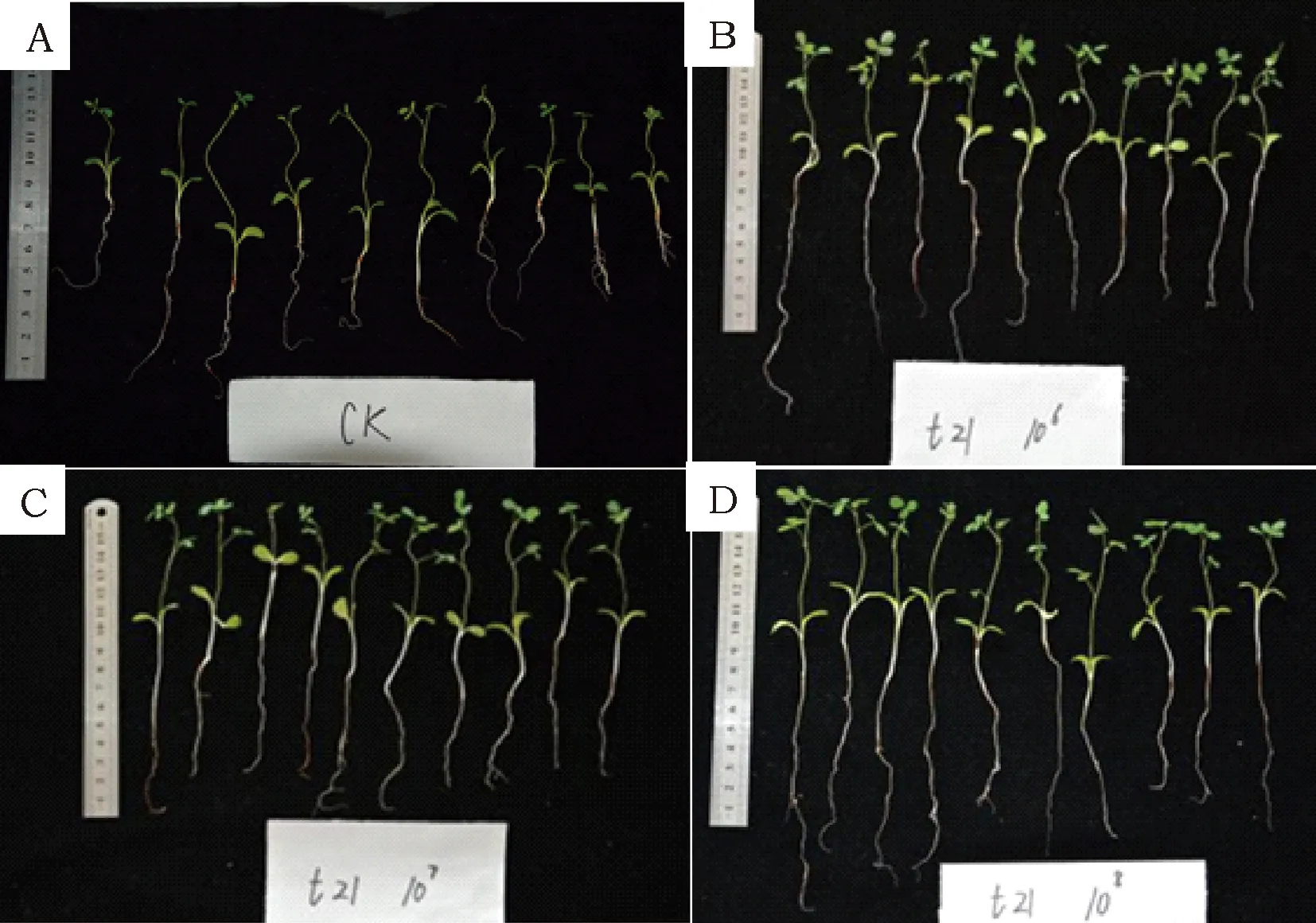
图6 菌株t21发酵液处理黄芪种子后培养30 d黄芪幼苗的生长情况Fig.6 The growth of AMB seedlings cultured for 30 days, which were come from the seeds treated by strain t21
试验结果(图6)表明,用菌液处理后的幼苗长度和叶片数都显著高于对照,其中108个·mL-1浓度处理后的效果更佳。
表2黄芪固氮新菌株t16发酵液处理黄芪种子后对黄芪苗的影响
Table2TheseedlinglengthandnumberofleavesofAMBseedlingstreatedwithstraint16

组别Group平均苗高/cmAveragehighofplants平均每株叶片数AveragenumberleaveseachplantCK11.8±1.835.7±1.42106个·mL-113.9±0.83**7.2±0.87**107个·mL-113.3±0.90*6.2±1.90108个·mL-113.1±1.04*6.9±1.51*
注:*跟CK相比较P<0.05; **跟CK相比较P<0.01
Note: *:comparedwithCK,P<0.05; **:comparedwithCK, P<0.01.
表3黄芪固氮新菌株t21发酵液处理黄芪种子后对黄芪苗的影响
Table3TheseedlinglengthandnumberofleavesofAMBseedlingstreatedwithstraint21

组别Group平均苗高/cmAveragehighofplants平均每株叶片数AveragenumberleaveseachplantCK11.8±1.835.7±1.42106个·mL-118±2.72**10.2±1.08**107个·mL-116.5±1.2**9.9±1.5**108个·mL-119.4±2.97**10.2±2.04**
注: **与CK相比较P<0.01
Note: **meanscomparedwithCK, P<0.01.
试验结果表明,采用固氮新菌株t16和t21的发酵液处理黄芪种子,以及对幼苗浇灌后,对黄芪幼苗生长速度和叶片发育速度均有显著的促进作用,培养30d后黄芪的苗高和叶片数均显著高于对照。菌株t16的发酵液在106个·mL-1这一浓度处理后的效果要优于另外两个较高浓度的效果,而菌株t21则是在108个·mL-1这一浓度的处理效果最佳。这也提示,在用菌液处理种子时,不是浓度越大越好,不同菌株要采用适当的浓度才能达到最好的效果。
2.2.2黄芪幼苗含氮量测定
对收集到的黄芪幼苗,洗净后置于烤箱内烘干,测定其含氮量,结果见表4。
试验结果表明,用固氮新菌株t16和t21的发酵液处理后,培养30d后黄芪苗含氮量极显著高于对照组,进一步说明了t16和t21都具有显著的固氮活性。其中t16对每株黄芪苗的固氮量平均为8.16~10.70mg左右,而t21对每株黄芪苗的固氮量为平均7.5~10.7mg左右。根据实际种植情况,每亩地种植15 000株幼苗,每公顷的固氮量为0.01×15 000×15≈2 250g,即2种菌剂在30d的固氮值均约为2.25kg·hm-2左右。折算为在黄芪栽培地里,每公顷每个月可以减少尿素用量4.9kg(按照尿素含氮量46%计算)。而本实验数据是根据黄芪幼苗而得的,随着黄芪根茎的延长,根瘤数量也会更多,固氮量还会增加。
3讨论与结论
黄芪作为一种药用的豆科植物,在自然状态下根际也会存在固氮菌,但是相对于庞大的根际微生物系统来说,固氮菌的种群数量相对较少,与其他微生物竞争力有限,固氮量很小。因此,将来源于黄芪根际的高效固氮菌株进行分离后扩大培养,再以微生物菌肥的形式施入根际,能够提高黄芪根际固氮菌种群数量,增强种群竞争力,增加生物固氮总量。该研究所获得的固氮菌株来源于黄芪道地产区的根际土壤,其生长速度快,固氮能力强,在实验室条件下,针对黄芪幼苗,施用30d的固氮量折合每公顷就达到了2.25kg。考虑到该研究从黄芪种子播种到检测总N含量的时间间隔只有30d,这期间黄芪幼苗根系还不发达,固氮菌发挥的效率还很低,可以推测随着黄芪根系完善后,固氮量应该还会有很大的提高。因此,该研究分离到的2种菌株都具有较强的推广价值。关于这些菌株在黄芪生长过程中的最佳使用时间和剂量、施用方式、实际促生效能和生态安全性等方面还需要进一步研究。
参考文献
[1]BurrisRH.Biologicalnitrogenfixation[J].PlantPhysiology, 1974,54(4): 443-449.
[2]乔有明,王振群,段中华.青海湖北岸土地利用方式对土壤碳氮含量的影响[J].草业学报,2009,18(6): 105-112.
[3]SprentJI,RParsons.Nitrogenfixationinlegumeandnon-legumetrees[J].FieldCropsResearch, 2000, 65(2-3): 183-196.
[4]BaldaniJ,LeonardoC,BaldaniVLD,etal.RecentadvancesinBNFwithnon-legumeplants[J].SoilBiologyandBiochemistry, 1997,29(5-6): 911-922.
[5]DöbereinerJ. Azotobacter paspalisp.n.,umabacteriafixadoradenitrogênionarizosgeradePaspalum[J].PesquidaAgropecuariaBrasileira, 1966,1: 357-365.
[6]陈阿琴,杨志刚,俞颂东,等.黄芪多糖药理作用研究进展[J].中国兽药杂志, 2005,39(9): 33-36.
[7]SenM,SPSen,InterspecifictransformationinAzotobacter[J].JournalofGeneralMicrobiology, 1965,41(1): 1-6.
[8]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京: 科学出版社,2001:353-398.
[9]郭立忠,毕建水,祝丕业.微生物菌肥中三类菌株的分离、纯化与部分性质鉴定[J].莱阳农学院学报, 2002, 19(4): 248-250.
[10]潘明洪,凌瑶,景文,等. 四川白三叶根瘤菌遗传多样性及系统发育研究[J].草业学报, 2014,23(5): 143-152.
[11]谭志远,牛天贵,陈文新.天山根瘤菌(R. tianshanense)模式菌株16SrDNA全序列测定及其系统发育[J].高技术通讯, 1997(1): 5-8.
[12]王绍华,刘胜环,王胜强,等. 水稻产量形成与叶片含氮量及叶色的关系[J].南京农业大学学报,2002, 25(4): 1-5.
(编辑:武英耀)
Isolationandapplicationofnitrogen-fixingbacteriainrhizosphereofAstragalus membranaceusBungeinShanxi
XueZhiquan1,TangZhongwei1,LiHao1,ZhouRan2,LiangJianping1*
(1.College of Life Science, Shanxi Agricultural University, Taigu 030801, China; 2.Shanxi University of Traditional Chinese medicine, Taiyuan 030024, China)
Abstract:[Objective]Astragalus membranaceus Bunge (AMB) is an important herb that has been used in traditional Chinese medicine for centuries, and Hunyuan County of Shanxi province is one of the most important planting bases for AMB. Nitrogen fertilizer input for AMB production in China is very high.It is essential to reduce nitrogen fertilizer input and thus cultivation cost while achieving a high yield for sustainable and environmentally friendly AMB production.Research on biological nitrogen fixation has increased significantly because of its potential importance to the economy and the environment.AMB plants can obtain nitrogen from biological nitrogen fixation via diazotrophs. The aim of this work was to screen and identify nitrogen-fixing bacteria from the rhizosphere of AMB cultivated in Hunyuan County, Shanxi province, and to demonstrate their potential for nitrogen fixation with AMB as well as plant growth promotion.[Methods] 120 nitrogen fixing strains were isolated from soil samples using Ashby nitrogen free medium.Two strains of them, t16 and t21, with strong ability of nitrogen fixation were screened out according to the ability of nitrogen fixation, growth speed and other characteristics in further screening with nitrogen fixing medium. To demonstrate their potential for nitrogen fixation with AMB and growth promotion activities,the bacterial liquid of the two isolates were used to soak AMB seeds and inoculate into AMB seedlings for 30 d at 28°C in a growth cabinet.[Results] Based on morphological detection, physiological and biochemical detection and 16S rRNA gene sequence analysis, the two strains of t16 and t21 were identified as Rhizobium sp. and Sinorhizobium sp., respectively. Both of the two strains significantly promoted the growth of AMB seedlings. They also increased the nitrogen contents of dry weight by 14.23% to 18.67% and 13.10% to 18.77%, respectively, compared with the uninoculated controls. The bacterial liquids of T16 with 106 mL-1and T21 with 108 mL-1have the best effect. The conversion amount of nitrogen fixing in 30 days is about 2.25 kilograms per hectare. [Conclusion] These promising nitrogen fixation bacteria isolates from the rhizosphere of AMB showed potential to promote AMB production via nitrogen fixation and other plant growth promoting functions.This will improve AMB production efficiency and reduce the environmental pollution that results from AMB production.
Key words:Nitrogen-fixing bacteria; Astragalus membranaceus; Rhizosphere; Isolation; Identification
收稿日期:2016-04-07 修回日期:2016-04-18
作者简介:薛智权(1976-),男(汉),四川仪陇人,讲师,博士后,研究方向:环境微生物 *通讯作者:梁建萍,教授,硕士生导师。Tel: 18503547979; E-mail: liangjp@sxau.edu.cn
基金项目:科技部“十二五”国家支撑计划项目(20110313002-2);山西省科技攻关项目(20110313002-2);山西农业大学博士项目(XB2008022)
中图分类号:Q93
文献标识码:A
文章编号:1671-8151(2016)07-0483-06

