鸡大肠杆菌FimH基因C端结构域克隆及特性分析
白宇琛,谢金峰,周广防,冯秀丽
(南京农业大学,动物医学院,江苏 南京 210095)
鸡大肠杆菌FimH基因C端结构域克隆及特性分析
白宇琛,谢金峰,周广防,冯秀丽*
(南京农业大学,动物医学院,江苏 南京 210095)
摘要:[目的]通过进一步研究禽大肠杆菌 I 型菌毛主要结构基因FimH的基因结构及其抗原特性 ,为深入探索鸡大肠杆菌致病机理及研制基因工程疫苗奠定必要的理论基础。[方法]本文以已发表的Fim H 基因C端核酸序列为参考序列,设计并合成引物,扩增鸡大肠杆菌JS1、JS2、JS6三个菌株的Fim H 相应基因,使用Lasergene软件对其进行序列比对、蛋白质结构预测以及进化树的绘制等。[结果]JS1、JS2、JS6三个菌株的核酸同源性分别为97.3%、97.7%和97.3%,而氨基酸序列的相似性分别为95.3%、97.6%和95.3%。此外,其抗原决定簇基本相似,但在第78和79位抗原决定簇不同,这说明本研究中的3个鸡大肠杆菌菌株的Fim H基因序列及氨基酸序列的变异可能对Fim H蛋白抗原结构产生了轻微影响。进化树分析发现,本实验室分离的3株鸡大肠杆菌菌株FimH基因与选择的国内鸡大肠杆菌菌株的Fim H基因同源性比较高,同处于一个进化分支中。[结论]本研究结果表明鸡大肠杆菌I型菌毛Fim H基因未发生明显变异,这为后续研究Fim H基因的功能及其基因工程亚单位疫苗研发提供了重要的实验基础。
关键词:鸡大肠杆菌; Fim H基因; 克隆; 特性分析
鸡致病性大肠杆菌( avian pathogenic E. coli,APEC)主要通过呼吸道感染禽类,能导致禽类发生腹膜炎、输卵管炎、气囊炎、眼炎和败血症等多种传染性疾病。随着我国养禽业的发展,禽大肠杆菌病已成为危害养禽业最严重的细菌性传染病之一[1~3]。目前APEC的致病机制尚未完全阐明,且无有效的疫苗防疫禽大肠杆菌病,故研究鸡大肠杆菌FimH基因结构及其抗原特性,对弄清大肠杆菌致病机理及研制I型菌毛基因工程疫苗均具有重要意义。据报道,黏膜表面上皮细胞表面的糖蛋白2可以特异性地与APEC表面的Fim H结合[4,5]。多数APEC具有I型菌毛,因其对机体呼吸道的粘附起着重要作用,APEC能在鸡机体内定居、增殖,进而侵袭入机体内[6~8]。因此菌毛是APEC最为重要的致病因子。I型菌毛操纵子基因由染色体基因控制,其中Fim H 是大肠杆菌I型菌毛的主要结构基因[9,10]。本研究致力于用分子生物学的方法,拟以已发表的FimH基因序列为参考序列,设计并合成引物,克隆由本实验室保存的鸡大肠杆菌JS1,JS2,JS6三个菌株的Fim H 基因,使用Lasergene软件进行序列比对、蛋白质结构预测以及进化树的绘制等。研究结果为筛选通用性的1型菌毛Fim H抗原表位提供了便利条件,也为后续分析比较不同结构Fim H及其可能的基因工程疫苗奠定必要的研究基础。
1材料与方法
1.1菌株及质粒
禽病原性大肠杆菌JS1、JS2、JS6分离株由南京农业大学动物医学院预防兽医学传染病组实验室保存。pMD18-T载体购自TakaRa公司。
1.2主要试剂
PCR体系试剂盒、胶回收试剂盒等均购自TakaRa公司,其他常规试剂均为国产分析纯。
1.3引物设计及合成
根据GenBank中发表的参考序列(JX847135.1),采用Primer5.0 软件设计一对引物后送北京六合华大基因科技股份有限公司合成。引物序列如表1所示。引物用超纯水溶解并稀释至25pmol·L-1,置于-20 ℃冻存。

表1 基因FimH的引物设计
1.4模板DNA的制备
参照文献[11]方法,提取大肠杆菌染色体DNA为模板,-20 ℃保存备用。提取方法略作改动,细菌收集时使用5倍量0.15mol·L-1NaCl-0.1mol·L-1Tis(pH8.0)-0.01%SDS溶液悬浮离心沉淀。
1.5FimH基因的 PCR扩增
以提取的模板DNA进行PCR扩增,应用上下游引物进行Fim H基因的PCR扩增。PCR反应体系为:模板DNA1.5μL;Mix12.5μL;上游、下游引物各0.5μL;ddH2O10μL。PCR反应条件为:94 ℃预变性 5min; 90 ℃变性30s, 60 ℃退火 30s, 72 ℃延伸 30s, 30个循环; 结束后 72 ℃延伸 10min。扩增产物经 1.0% 的琼脂糖凝胶电泳鉴定。使用DNA胶回收试剂盒对PCR反应产物进行纯化回收。连接pMD18-T载体送上海英骏生物有限公司进行克隆片段的DNA序列测定。
1.6Fim H基因序列及抗原决定簇分析
用生物软件DNA-STAR输入所测得的核酸序列进行分析。
2结果与分析
2.1PCR结果
各取三株菌株的Fim H 基因PCR扩增产物进行 1%琼脂糖凝胶电泳,可见单一并清晰的条带,大小与预期结果258bp相符(图1)。
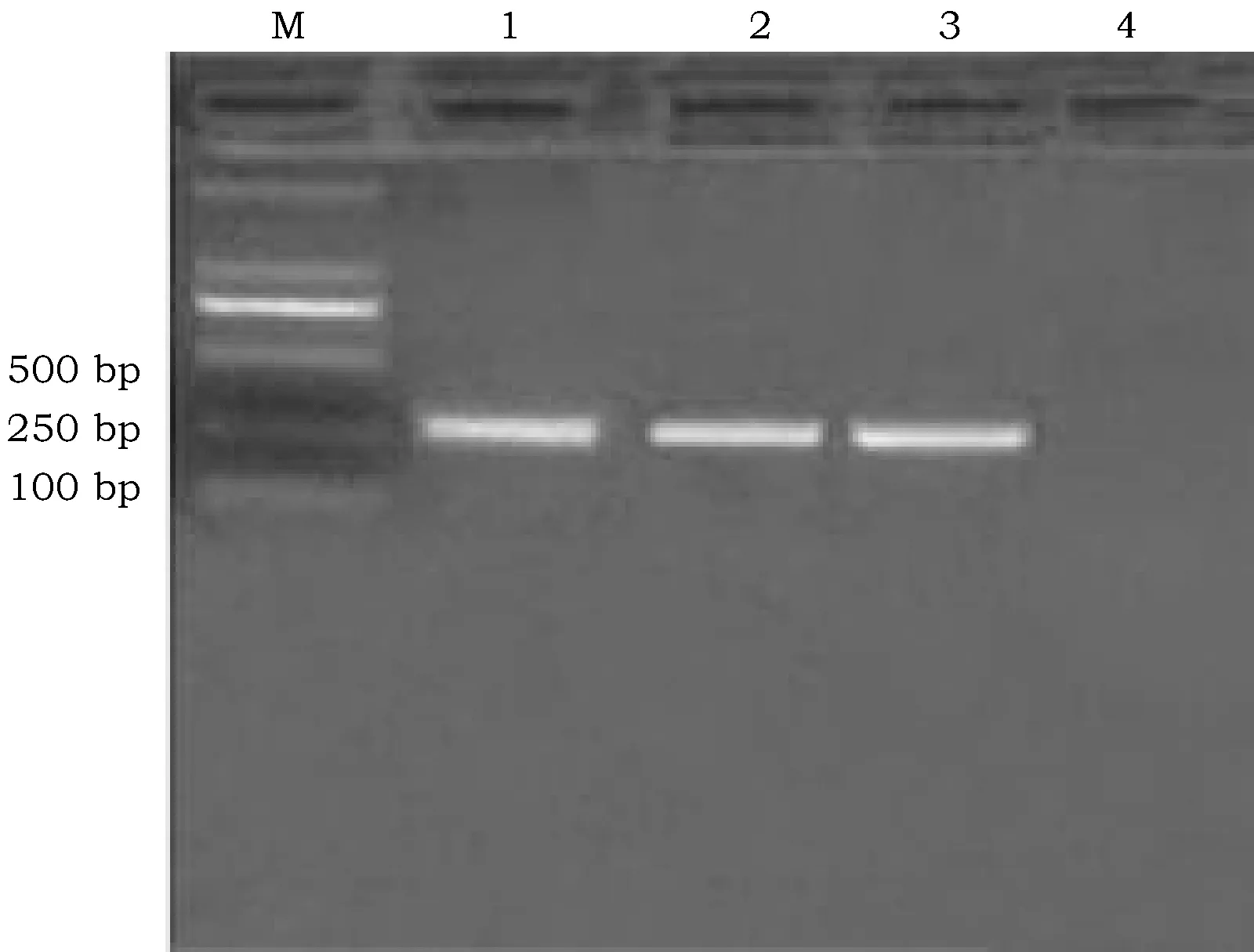
图1 三株鸡源大肠杆菌1型菌毛FimH基因PCR结果Fig.1 Cloning of C terminal domain of Fim H gene of three avian E.coli strains by PCR 注:M:DNA Maker ;1:JS1;2:JS2; 3:JS6; 4:空白对照组Note: M:DNA Maker ;1:JS1;2:JS2; 3:JS6; 4:Blank
2.2PCR产物序列测定及分析
将测定的Fim H基因PCR产物序列用Lasergene软件进行分析。如图2~图4所示,分离株JS1、JS2、JS6与GenBank所公布序列核苷酸序列(GenBank:JX847135.1)的核酸同源性分别为97.3%、97.7%和97.3%,氨基酸序列的相似性分别为95.3%、97.6%和95.3% ,其中JS1与JS6的同源性为100%。
2.3预测蛋白主要抗原特征
用Lasergene软件预测分离毒株与标准株抗原性如图5所示。结果表明分离株JS1与JS6的抗原性完全相同,而与JS2差异在73~85位氨基酸处较显著,虽然在22处,JS1和JS6菌株FimH为A,而JS2菌株FimH为V,但并不影响其蛋白抗原特性。而78和79位的氨基酸变化,对FimH蛋白抗原决定簇影响很大。如图3所示,JS1和JS6菌株FimH中,78和79位氨基酸分别为L和H,而JS2菌株FimH的该位置氨基酸分别为P和R,标准株FimH的该位置氨基酸分别为Q和R。这表明鸡大肠杆菌FimH抗原结构发生轻微改变。
2.4同源序列的进化树分析
使用Lasergene软件对分离的JS1、JS2、JS6和标准株以及在NCBI中挑选的国内已发表的其他同源株序列进行进化树的绘制,结果如图6所示。JS1株和JS6株与JN408550.1、JN408559.1的核苷酸同源性为100%,说明其进化关系最近,而与CP002291.1亲缘关系较远。JS2株处于稍微偏远的一个进化分支。从进化树图谱中可以看出,本实验室分离的3种鸡大肠杆菌菌株没有发生太大的变异,与选择的大多数大肠杆菌对照菌株的同源性比较高,处于一个进化分支中。

图2 鸡源大肠杆菌1型菌毛FimH基因与标准株FimH核酸序列比较Fig.2 Nucleotide sequences comparisons of C terminal domain of Fim H gene from three isolated and reference avian E.coli strains

图3 鸡源大肠杆菌与标准株1型菌毛FimH氨基酸序列比较Fig.3 Amino acid comparisons of C terminal domain of Fim H gene from three isolated and reference avian E.coli strains
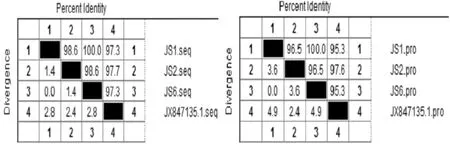
图4 鸡大肠杆菌与标准株1型菌毛FimH基因同源性比较Fig.4 Homology comparisons of C terminal domain of Fim H gene from three isolated and reference avian E.coli strains

图5 鸡大肠杆菌与标准株菌毛Fim H蛋白抗原决定簇图谱Fig.5 Antigenic determinant analysis of C terminal domain of Fim H gene from three isolated and reference avian E.coli strains
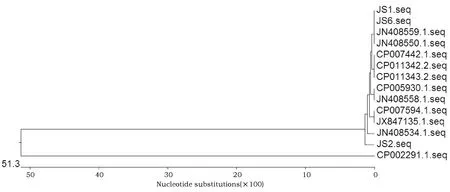
图6 同源核苷酸序列的系统进化树Fig.6 Phylogenetic tree of homologous nucleotide sequence from various avian E.coli strains
3结论与讨论
FimH蛋白是鸡大肠杆菌Ⅰ型菌毛主要的结构蛋白[9,10]。国内外研究人员对鸡大肠杆菌Ⅰ型菌毛的Fim H基因及其功能进行了深入研究。戴鼎震等[12]发现国内O11、O78和O18血清型分离株1型菌毛基因与国外同源菌株的核酸序列和氨基酸序列同源性分别在97%和98%以上。何素芬等[13]构建了禽致病性大肠杆菌型菌毛Fim H 基因缺失突变株,为进一步深入研究禽大肠杆菌I型菌毛与机体相互作用的分子机制提供了基础。尹晓琳等[14]对尿路致病性大肠杆菌临床株I型菌毛FimH基因进行了检测,发现FimH 基因存在于大多数尿路致病性大肠杆菌临床株中。据报道,FimH蛋白由两个结构域组成,其中N端具有特异性粘附宿主呼吸道上皮的能力,而C端结构域(氨基酸160~279)则将Ⅰ型菌毛中的Fim H与Fim G连接在一起[15,16]。因此,FimH蛋白的C端结构域在大肠杆菌致病作用中发挥了重要作用。鉴于此,本研究中根据国外报道的Fim H基因的C端核酸序列,设计特异引物,扩增了本实验分离的三株鸡大肠杆菌的Fim H的相应基因。根据核酸序列和氨基酸序列同源性分析结果可以看出,该三株鸡大肠杆菌JS1、JS2、JS6之间以及与国外报道菌株的Fim H基因核酸序列同源率在97.3%~100%之间,氨基酸序列同源率为95.3%~100%间,具有高度的保守性。
通过MegAlign软件对其抗原决定簇进行预测分析,发现该Fim H基因的第78和79位的氨基酸变化对其抗原决定簇影响较大,并导致了73~85位氨基酸处抗原决定簇有明显差异,暗示着该位点氨基酸的变异对FimH抗原结构产生了一定影响,提示其粘附能力和致病性也可能存在差异。此外,对JS1、JS2、JS6分离株和国外报道菌株以及在NCBI中挑选的国内已发表的其他菌株进行Fim H基因序列进化树分析,结果显示三株鸡大肠杆菌分离株没有发生太大的变异,与选择的大多数大肠杆菌菌株的同源性比较高,处于一个进化分支中。
鉴于鸡大肠杆菌I型菌毛Fim H基因未发生明显变异,这为筛选通用性的Ⅰ型菌毛Fim H抗原表位提供了便利条件。大肠杆菌表面Fim H基因的不同结构域及其功能差异,可能与其结合能力和免疫刺激活性有关。本研究扩增的3种Fim H基因为后续研究Fim H基因的功能及其基因工程亚单位疫苗研发提供了重要的实验基础。
参考文献
[1]MKoatuli,ABaruner,LKHaghihgi,etal.VirulencecharacteristicsofEscherichiacolistrainscausingacutecystitisinyoungadultsinIran[J].JournalofInfection,2005,50(4):312-321.
[2]OosterikLH,TunntufyeHN,BntayeP,etal.EffectofserogroupsurfacematerialanddisinfectantonbiofilmformationbyavianpathogenicEscherichiacoli[J]VeterinaryJournal,2014,202(3):561-565.
[3]MARMonroy,TKnöbl,JABottino,etal.VirulencecharacteristicsofEscherichiacoliisolatesobtainedfrombroilerbreederswithsalpingitis[J].ComparativeImmunology,MicrobiologyandInfectiousDiseases,2005,28(1):1-15.
[4]HaseK,KawanoK,NochiT,etal.Uptakethroughglycoprotein2ofFimH(+)bacteriabyMcellsinitiatesmucosalimmuneresponse[J].Nature,2009,462(7270):226-230.
[5]Sakarya,Serhan,Ertem,etal.Escherichiacolibindtourinarybladderepitheliumthroughnonspecificsialicacidmediatedadherence[J].FEMSImmunologyandMedicalMicrobiology,2003,39(1)4:5-50.
[6]MCVidotto,HRNavarro,LCJGaziri.Adherencepiliofpathogenicstrainsof:avianEscherichiacoli[J].Veterinarymicrobiology,1997,59 (1):79-87.
[7]RamirezRM,AlmanzaY,GarciaS,etal.AdherenceandinvasionofavianpathogenicEscherichiacolitoaviantrachealepithelialcells[J].WorldJournalofMicrobiologyandBotechnology,2009,25(6):1019-1023.
[8]SNAbraham,DSun,JBDale,etal.ConservationoftheD-mannose-adhesionproteinamongtypeIfimbriatedmembersofthefamilyEnterobacteriaceae[J].Nature,1988,336(6200):682-684.
[9]PKlemm,BJJrgensen,IvanDie,etal.Thefimgenesresponsibleforsynthesisoftype1fimbriaseinEscherichiacoli[J].MolGenGenet,1985,199(3):10-414.
[10]DavidARosen,JeromeSPinkner,JenniferNWalker,etal.MolecularVariationsinKlebsiellaPneumoniaeandEscherichiacoliFimHAffectFunctionandPathogenesisintheUrinaryTract[J].InfectionandImmunity,2008,76(7):3346-3356.
[11]SambrookJ,FritschEF,ManitisT. 分子克隆实验指南[M].北京:北京科学出版社,1995(2):11-49.
[12]戴鼎震,崔生玲,蒋加进,等. 鸡大肠杆菌I型菌毛FimH蛋白结构基因克隆及序列测定 [J].金陵科技学院学报,2011,27(4):69-74.
[13]何素芬,原志伟,朱国强. 禽致病性大肠杆菌I型菌毛FimH基因缺失突变株的构建及部分生物学特性的分析[J].微生物学报,2008,48(2):252-256.
[14]尹晓琳,王秀荣,胡洁,等. 尿路致病性大肠杆菌临床株I型菌毛FimH基因检测及分析 [J].河北医科大学学报,2003,24(3):136-137.
[15]DChoudhury,AThompson,VStojanoff,etal.X-raystructureoftheFimC-FimHchaperone-adhesincomplexfromuropathogenicEscherichiacoli[J].Science, 1999,285(5430):1061-1066.
[16]CapitaniG,EidamO,GlockshuberR,etal.Structuralandfunctionalinsightsintotheassemblyoftype1pilifromEscherichiacoli[J].MicrobesandInfection,2006,8(8):2284-2290.
(编辑:马荣博)
Cloning and characterization of C terminal domain ofavianE.coli’FimHgene
Bai Yuchen, Xie Jinfeng, Zhou Guangfang, Feng Xiuli*
(CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China)
Abstract:[Objective]Through further study of Fim H, the the main structure gene of avian Escherichia coli type I, the research aimed to provide necessary theoretical foundation for pathogenic mechanism of avian E.coli and development of gene engineering vaccinE.[Methods] Based on the published C terminal domain nucleotide sequence of Fim H gene for reference, this research designed and synthesized primers, amplified three strains of the relevant Fim H genes in avian E.coli including JS1, JS2 and JS6, used Lasergene software for sequence alignment and protein structure prediction, and the evolutionary tree was drew, etc. [Results] The results showed that the homology of gene nucleotide sequences between Reference strain and JS1, JS2 or JS6 were 97.3%, 97.7% and 97.3%, and their amino acid sequences was 95.3%, 97.6% and 95.3%, respectively. Although their Fim H antigenic nucleotide sequences between Reference strain and JS1, JS2 or JS6 were 97.3%, 97.7% and 97.3%, and their amino acid sequences was 95.3%, 97.6% and 95.3%, respectively. Although their Fim H antigenic determinants are basically similar, amino acids changes at 78thand 79thcaused the different antigenic determinant at C terminal domain of Fim H, which indicated that amino acid variation of Fim H sequences might have the minor effect on the antigenic property of Fim H. Furthermore, the evolutionary tree analysis showed the close evolutionary relationship among three isolated strains and the domestic avian E.coli strains. [Conclusion] The results indicated that the Fim H gene of avian E.coli had no significant variation, which makes important foundation for further research on molecular mechanism of avian E.coli and the control strategies against pathogenic avian E.coli.
Key words:Avian E.coli; Fim H gene; Gene clone; Characterization analysis
收稿日期:2016-03-02 修回日期:2016-04-12
作者简介:白宇琛(1995-),女(汉),山西吕梁人,研究方向:畜禽传染病防治、动物病毒分子免疫学 *通讯作者:冯秀丽,副教授,博士,硕士生导师。Tel:13605199873;E-mail:xiulifeng@njau.edu.cn
基金项目:江苏省自然科学基金青年基金项目(BK20130682);江苏省高校优势学科建设工程资助项目(PAPD)
中图分类号:S852.61
文献标识码:A
文章编号:1671-8151(2016)07-0467-05

