2株山西IBV分离株的生物学特性研究
高诗敏,邓瑞林,2,闫芳,马海利,化丽珍,田文霞,高文伟
(1.山西农业大学 动物科技学院,山西 太谷 030801; 2.南皮温氏畜牧有限公司,河北 南皮 061500)
2株山西IBV分离株的生物学特性研究
高诗敏1,邓瑞林1,2,闫芳1,马海利1,化丽珍1,田文霞1,高文伟1
(1.山西农业大学 动物科技学院,山西 太谷 030801; 2.南皮温氏畜牧有限公司,河北 南皮 061500)
摘要:[目的]控制地方鸡传染性支气管炎病的流行。[方法]通过IBV-21、IBV-22半数感染量(EID50)试验,鸡胚矮小化试验,干扰NDV LaSota复制试验,鸡胚气管环试验测定2毒株生物学特性。[结果]试验结果显示IBV-21的EID50为5×10-4.616·mL-1、IBV-22为5×10-6.5·mL-1;接毒胚明显病变,2株毒对鸡胚均有矮小化作用,对NDV LaSota有明显干扰,对鸡胚气管环试验病变明显,RT-PCR的方法扩增2分离株的S1基因的特异条带大小约为293 bp。[结论]该生物学特性显示分离的2株病毒对鸡胚有明显致病作用且2毒株不是现存疫苗毒,为地方IBV疫苗研发奠定基础。
关键词:IBV; 生物学特性; RT-PCR; 分离鉴定
鸡传染性支气管炎(AvianInfectiousBronchitis,IB) ,由传染性支气管炎病毒(IBVirus,IBV)引起鸡的一种高度接触性、急性呼吸道传染病。主要侵害雏鸡和产蛋鸡,雏鸡通常表现为喘气、咳嗽等呼吸道症状,产蛋鸡表现为产蛋量和蛋品质下降,导致鸡免疫力下降而继发其他疾病,给养鸡业带来巨大经济损失。IBV由4种主要结构蛋白包括纤突(S)蛋白、 膜(M)蛋白、核衣壳(N)蛋白和小膜蛋白组成,S蛋白可以裂解为S1 和S2 蛋白,其中S1 蛋白与IBV的致病性和血清型有密切关系[1,2]。
IB于1930年春首次在美国北达科他州发现。1936年Beach和Schalm通过鸡的交叉免疫试验证实发病病原IBV与传染性喉气管炎病毒不同,再次确定病原IBV[3]。1937年Hudson首次利用鸡胚培养该病毒获得成功,并发现IBV可使鸡胚致死,且Beaudette随病毒连续传代而致死性增强。在我国,华南农业大学邝荣禄教授于1982年首次报道肾型IB在全国各地广泛流行[4]。由于IBV的血清型较多,其血清型间没有或者仅有部分交叉保护力,而且有变异株和新血清型的出现,导致临床免疫复杂化,常出现免疫失败现象[5]。
本文为了研究IBV地方毒株的特点,选取山西农业大学传染病试验室保存的IBV分离株IBV-21、IBV-22测定生物学特性,并通过RT-PCR验证,为IB的防治奠定理论基础。
1试验材料和方法
1.1试验材料
1.1.1毒株和鸡胚
2株IBV山西分离株:IBV-21、IBV-22,NDVLaSota由华南农业大学传染病试验室馈赠,IBV标准阳性抗原、IBV阳性血清由山西省畜牧所馈赠。
9~11日龄SPF鸡胚购自梅里亚。
1.1.2试剂
TrizolLSReagen购自Invitrogen公司,RNA抽提试剂盒购自大连宝生物工程有限公司,胎牛血清、胰酶、M199培养基。
1.2试验方法
1.2.1病毒的增殖
将IBV-21、IBV-22分别接种于10日龄SPF鸡胚,37 ℃培养并弃去24h内死亡的鸡胚,无菌收集72h尿囊液,按以上鸡胚尿囊腔接种病毒传代的方法,收取第三代病毒(F3)尿囊液,-20 ℃保存备用。
1.2.2半数感染量(EID50)测定
IBV-21、IBV-22病毒液用灭菌生理盐水稀释,设取10-2、10-3、10-4、10-5、10-6、10-7和10-8,7个稀释度,分别接种于10日龄SPF鸡胚,每个稀释度接种 5个10日龄SPF鸡胚,接种量为每枚0.2mL,同时做生理盐水空白对照,置于 37 ℃生化培养箱继续孵育,弃去24h内死亡胚,每8h照胚一次,观察至144h,观察并记录鸡胚发育、病变及死亡情况,按照Reed-Muench方法,其计算公式为:
距离比例=(高于50%的感染百分数-50%)/(高于50%的感染百分数-低于50%的感染百分数)
LogEID50=高于50%的病毒稀释度+距离比例×稀释系数的对数。
1.2.3矮小化试验
将2株分离株病毒IBV-21、IBV-22病毒液用灭菌生理盐水做 1∶10 倍稀释。经绒毛尿囊腔接种10日龄SPF鸡胚,每个毒株接种5枚,接种量为每枚0.2mL,设生理盐水为空白对照,置于37 ℃生化培养箱孵育,弃去24h内死亡胚,逐日观察,并测接毒后1周内胚体重量。
1.2.4干扰NDVLaSota试验
将IBV-21、IBV-22病毒液、NDVLaSota病毒液稀释后经绒毛尿囊腔接种于10日龄SPF鸡胚,试验分为3组,每组5枚SPF鸡胚:第一组接种IBV-21尿囊液,每枚0.2mL,37 ℃生化培养箱孵育12h后,在同一部位复种NDVLaSota病毒液,每枚0.2mL;第二组按同样方法接种IBV-22病毒液后复种NDVLaSota病毒液;第三组为先接种生理盐水然后复种NDVLaSota病毒液作为对照组。孵育3组鸡胚,弃去24h内死亡胚,无菌收取接种后36h尿囊液,按照常规微量法测定方法分组逐胚测定血凝价并计算平均血凝效价。
1.2.5IBV的血凝特性
将IBVIBV-21、IBV-22病毒液以50 000r·min-1离心20min后,分别取其上清,于37 ℃水浴3h,两样品分为2份,一份经1%的胰蛋白酶处理,另一份为无处理上清作为空白对照,按照常规微量法测定方法测四份红细胞凝集价[6,7]。
1.2.6IBV分离株TOC试验
制备鸡胚气管环并观察接毒后气管环病理变化,采用等倍比稀释病毒法测定TOC-ID50。在24孔细胞培养板中加入10-1~10-8倍比稀释的病毒尿囊液,每孔加0.5mL,然后将培养好的鸡胚气管环放入各孔中,于5%CO2的37 ℃培养箱中作用30min后,去除病毒液并加入M199培养液,其中含有2%的胎牛血清。每隔24h观察并记录气管环活纤毛运动情况,直至144h。以气管环纤毛运动停止和上皮细胞脱落作为病毒感染的指标。按照上述Reed-Muench方法计算各毒株的TOC-ID50,每个毒株测4次,取平均值。
1.2.7PCR测定
根据GenBank已公布的IBV基因组和基因序列,应用软件PrimerPremier5.0设计扩增IBV的S1片段的引物,如下:
上游引物:5’-CTAACTCTATACTAGCCTAT-3’;
下游引物:5’-GGAAGATAGGCATGTAGCTT-3’,
引物合成由上海生工生物工程有限公司完成。
按Invitrogen公司TrizolLS试剂说明书进行病毒RNA抽提,其RNA直接用于反转录或 -20 ℃冻存备用。PCR反应条件为循环参数为95℃变性3min,然后扩增循环30次,其程序为:94 ℃ 30s,52 ℃ 30s,72 ℃ 2min,最后72 ℃保持延伸7min,通过凝胶电泳方式分析扩增效果。
2试验结果
2.1半数感染量(EID50)测定
IBV-21、IBV-22病毒稀释液经尿囊液接种10日龄非免疫鸡胚,结果显示均对鸡胚致病且致死,鸡胚接毒后144h,IBV-21按10-2~10-8稀释度接种的阳性胚所占比例分别为 5/5、5/5、4/5、2/5、1/5、0/5、0/5,EID50为5×10-4.616·mL-1;IBV-22按10-2~10-8稀释度接种的阳性胚比例为5/5、5/5、5/5、5/5、3/5、2/5、0/5,EID50 为5×10-6.5·mL-1;生理盐水对照组阳性胚所占比例为0/5。
2.2矮小化试验
分别对 10日龄SPF鸡胚接种IBV-21、IBV-22孵育168h后,接种鸡胚羊膜增厚并紧贴鸡胚,胚体部分出现轻度出血,胚体明显小于对照组的胚体,体重减轻,趾爪变形并抱紧头部,胚体卷曲成球形,呈现侏儒胚,出现矮脚症状,羽毛发育不良。感染IBV-21、IBV-22病毒后,接种鸡胚卷曲情况如图1示;展开卷曲的胚体后,部分鸡胚矮脚情况如图2示。对照组鸡胚发育正常,无明显病变。
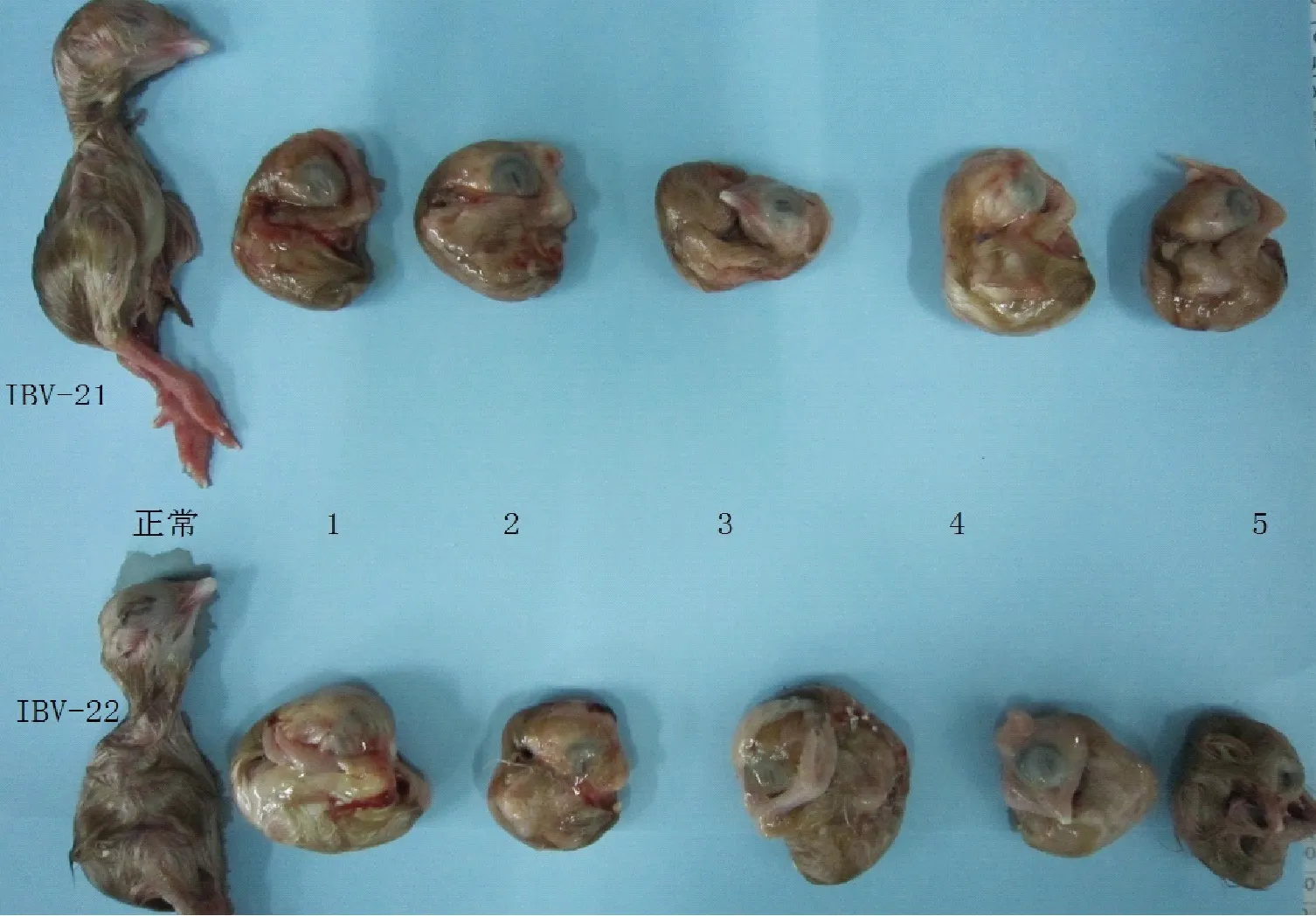
图1 接种IBV-21、 IBV-22接种168 h的侏儒胚和正常对照胚的比较Fig.1 Vaccination IBV-21, IBV-22 inoculation of 168 h comparison of embryo dwarf embryo and normal controls 注:正常为对照组,1~5为接毒后病变卷曲胚。Note: The normal was control group, 1~5 were pathological groups.
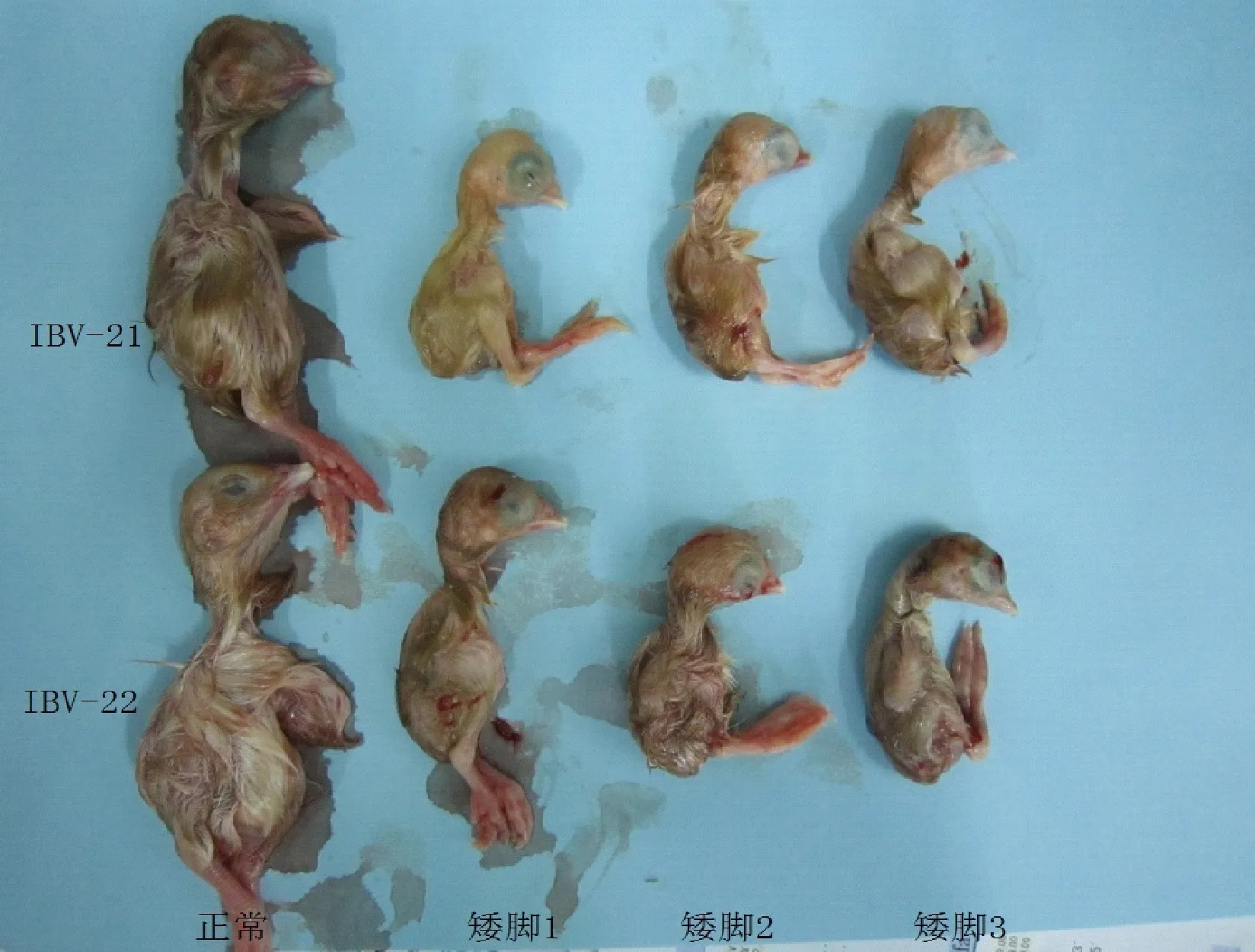
图2 接种IBV-21、IBV-22接种168 h的鸡胚的矮脚和正常对照胚的比较Fig.2 Comparison of 168 h and normal control embryos of chicken embryo inoculated with IBV-21 and IBV-22 注:正常为对照组,矮脚1~3为接毒后病变卷曲胚。Note: The normal was control group, 1~3 were pathological groups.
鸡胚体重变化如表1所示。与对照组比较,接IBV-21的5枚鸡胚的胚体重量平均减轻13g,接种病毒IBV-22的5枚鸡胚的胚体重量平均减轻11g,与接种生理盐水的对照组相比,试验组鸡胚体重明显降低。
2.3对鸡新城疫病毒(LaSota株)的干扰试验
IBV-21和IBV-22分别接种鸡胚后,复种NDVLaSota株,接种IBV-21的鸡胚尿囊液直接血凝价为2log2~4log2,平均值为2.8log2;接种IBV-22的鸡胚尿囊液直接血凝价为 1log2~5log2,平均值为 3.2log2;而NDVLaSota对照组鸡胚尿囊液血凝价为10log2。结果差异显著 (P<0.01),表明了分离株IBV-21和IBV-22均对NDVLaSota株在鸡胚上的增殖有抑制,结果如表2所示。
2.4血凝特性试验
IBV-21、IBV-22病毒液对鸡红细胞无凝集作用;但经1%胰酶处理后,凝集价在5log2~7log2之间。
2.5TOC试验测定结果
正常气管环有清晰的轮廓,且管腔内干净透明,管壁上皮细胞完整,纤毛运动;攻毒后的气管环表现出轮廓模糊,管腔内有杂质和气泡,纤毛运动停止,见图3。IBV-21、IBV-22的TOC-ID50值分别为2×10-5.6·mL-1,2×10-5.1·mL-1。

表1 接毒后第168 h鸡胚胚体量/g

表2 IBV-21、IBV-21对NDV LaSota株干扰后的血凝价结果

图3 鸡胚气管环感染试验Fig.3 Infection of TOCs
2.6RT-PCR验证结果
对IBV-21和IBV-22株毒进行基因S1的RT-PCR扩增鉴定,成功地扩增出一条约293bp的特异条带,大小与预计的相吻合,阴性NDVLaSota没有扩增产物出现。如图4所示。

图4 IBV-21和IBV-22的S1 基因RT-PCR扩增产物电泳图Fig.4 RT-PCR amplification product electrophoresis of IBV-21 and IBV-22 S1 gene 注:1. IBV-21的S1基因RT-PCR扩增结果;2. IBV-22的S1基因RT-PCR扩增结果;3. NDV LaSota株的RT-PCR扩增结果Note:1. RT-PCR amplification in S1 gene of IBV-21; 2.RT-PCR amplification in S1 gene of IBV-22; 3. RT-PCR amplification of NDV LaSota
3讨论与结论
IB是对我国甚至全世界养禽行业造成严重危害的重大禽病之一。为了有效防治IB,首先要对其进行及时、准确的诊断和流行病学分析,分离鉴定病毒是常用手段。近年来随着交通运输和世界贸易的频繁进行,导致IBV的地方毒株也有扩大流行的趋势[8]。掌握IBV流行毒株的地方流行特点及其生物学特征,为正确及时防治疾病、疫苗研发奠定基础。因此,快速分离、鉴定新变异毒株在鸡传染性支气管炎的防治工作中十分重要[9]。
本试验中测定IBV毒株生物学方法有重要意义。主要体现在:
(1)将病毒经10日龄非免疫鸡胚连续传代且有明显的致鸡胚矮小化作用,说明病毒适应鸡胚培养且生长稳定,IBV病毒分离和鉴定可以使用9~11日龄的鸡胚、单层鸡胚肾细胞和20日龄鸡胚气管环等宿主系统,其中以鸡胚分离法更为简便易行,该方法为测定其生物学特性奠定基础;EID50测定试验中IBV-21稀释10-6倍、IBV-22稀释10-7倍后,对鸡胚仍有致死作用,由此推断这2株毒为强毒,需要做动物试验进一步证实。
(2)IBV对NDVLaSota毒株有干扰现象,用这一方法可简便、快速诊断和鉴定IBV分离株,结果容易判定,而且具有较好的特异性干扰作用[10]。本试验中的2株IBV对NDV-LaSota株的繁殖产生明显的干扰作用,该方法可直接应用病料的初次分离物。
(3)鸡胚矮小化试验鉴定IBV特异性强且操作简单,但耗时长,初次分离病原需要在鸡胚上盲传4至5代以上,才能能观察到矮小化特征;使用适应鸡胚的传代病毒接种鸡胚判定结果,也需要1周左右的时间,不宜作为鉴定IBV的首选方法。本试验种接毒166小时后才观察到鸡胚矮小化现象。
(4)采取HA试验可以排除具有凝血活性的病毒污染,本研究中对2株毒株测定HA值发现毒株对未处理鸡红细胞无凝集活性,鸡红细胞经1%胰酶处理后,病毒对其有凝集活性,表明2株IBV中无NDV、AIV等凝集及红细胞的病毒污染。IBV表面没有凝集原,1%胰蛋白酶能使其产生血凝活性[11]。
(5)鸡胚气管环试验代替试验动物测定血清型,经济方便,但与动物体内的反应还是有较大的差异,因为当病毒侵入动物机体后,机体会启动整个免疫系统发挥作用,而在TOC中的作用仅显示部分。
(6)由于血清学方法不能区别疫苗株和野毒株,也不能确定新变异株的血清型,所以S1基因的RT-PCR和核苷酸序列测定就成了目前鉴定所有IBV血清型的唯一手段。
参考文献
[1]卡尔尼克BW.高福,苏敬良,译.禽病学[M].北京:中国农业出版社,1999(10):653-673.
[2]殷震,刘景华.动物病毒学[M].北京:科学技术出版社,1997(2):675-680.
[3]SchalmOW,BeachJR.CulturalRequirementsoftheFowl-CoryzaBacillus[J].JBacteriol,1936, 31(2): 161-169.
[4]邝荣禄,林绍仪.鸡传染性支气管炎——肾病变型 [J]. 养禽与禽病防治,1982(3):27-28.
[5]代金芳. 鸡传染性支气管炎疫苗使用概况[J]. 畜禽业, 2014(12): 14-15.
[6]朱国强,庄国宏,周继宏,等.鸡腺胃型IBV分离株血凝性初探[J].中国畜禽传染病,1997(6):30-31.
[7]SongCS,KimJH,LeeYJ,etal.DetectionandclassificationofinfectiousbronchitisvirusesisolatedinKoreabydot-immunoblottingassayusingmonoclonalantibodies[J].AvianDis,1998, 42(1): 92-100.
[8]SjaakdeWitJJ,CookJK,VanderHHM.Infectiousbronchitisvirusvariants:areviewofthehistory,currentsituationandcontrolmeasures[J].AvianPathology,2011,40(3):223-235.
[9]王宪文,王岩,刘兴友,等.鸡传染性支气管炎病毒豫北株的分离与鉴定[J].安徽农业科学,2008(35): 15500-15502.
[10]RaggiLG,PignattelliP.IdentificationofinfectiousbronchitisvirusbyinterferencewiththeB-1isolantofNewcastlediseasevirus.Waxingandwaningofinterference[J].AvianDis,1975, 19(2): 334-342.
[11]SchultzBD,Cavanagn,GHerroer.Neuraminidasetreatmentofavianinfectiousbronchitiscoronavirusrevealsahemagglutinatingactivitythatisdependentonsialicacid_containningreceptorsonerythrocytes[J].Virology,1992,189(2):792-794.
(编辑:武英耀)
BiologicalcharacteristicsoftwostrainsofShanxiIBVisolates
GaoShimin1,DengRuilin1,2,YanFang1,MaHaili1,HuaLizhen1,TianWenxia1,GaoWenwei1
(1.College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801,China; 2.Nanpi Wens Animal Husbandry co., LTD,Nanpi 061500,China)
Abstract:[Objective]The aim was to control the epidemic of infectious bronchitis.[Methods]The biological characteristics of IBV-21 and IBV-22 were tested by infection of half quantity (EID50), chicken embryos small test and interference NDV LaSota copy test and chicken embryo TOCs experiment. We verified by RT-PCR amplification. [Results]The results showed that the EID50 of IBV-21 was 5×10-4.616·mL-1, IBV-22 was 5×10-6.5·mL-1. Two strains had poison to chicken embryos that to be a little change as a result, the NDV LaSota interfered markedly, and chicken embryo TOCs was showed the lesions. The RT-PCR amplified S1 gene of 2 isolates, and stripe size was about 293 bp. [Conclusion]The biological characteristics showed that the separation of two viruses which was not existing vaccines had obvious pathogenic role in chicken embryos, and laid the foundation in local IBV vaccine development.
Key words:IBV; Biological Characteristics; RT-PCR;Separation Identification
收稿日期:2016-04-17 修回日期:2016-04-30
作者简介:高诗敏(1985-),女(汉),山西太谷人,讲师,博士,研究方向:兽医传染病学
基金项目:山西农业大学科技创新基金(412579)
中图分类号:S855.3
文献标识码:A
文章编号:1671-8151(2016)07-0472-05

