基于荧光检测的糜子Genic-SSR PCR体系优化
李耀深,曹鑫,段明,王俊杰,张彬,李红英,侯思宇,2,韩渊怀,2,3*
(1.山西农业大学 农学院,山西 太谷,030801; 2.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷,030801;3.农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原,030031)
基于荧光检测的糜子Genic-SSR PCR体系优化
李耀深1,曹鑫1,段明1,王俊杰1,张彬1,李红英1,侯思宇1,2,韩渊怀1,2,3*
(1.山西农业大学 农学院,山西 太谷,030801; 2.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷,030801;3.农业部黄土高原作物基因资源与种质创制重点实验室,山西 太原,030031)
摘要:[目的]本研究基于Fragment Analyzer全自动毛细管电泳荧光检测系统,以期建立一个最优的糜子Genic-SSR分子标记PCR反应体系。[方法]试验采用L16(44)正交设计,设计了Taq DNA聚合酶、Mg2+、dNTPs和引物的不同浓度组合,并用Pragment Analyzer全自动毛细管电泳荧光检测系统检测PCR产物。[结果]Taq DNA聚合酶、Mg2+、dNTPs、引物浓度对PCR反应效应为:Mg2+>引物> dNTPs > Taq DNA聚合酶。通过正交实验设计确立了糜子Genic-SSR荧光 PCR检测体系的最佳反应组分:20μL的反应体系中包含0.2 mmol·L-1的dNTPs,0.2μmol·L-1引物,1.5 mmol·L-1的Mg2+和0.5 U的Taq DNA聚合酶。[结论]本研究建立了糜子的Genic-SSR分子标记的最佳荧光PCR反应体系,为糜子种质资源遗传多样性分析中分子标记开发、验证和辅助育种奠定了基础。
关键词:糜子; Genic-SSR; 体系优化; 正交试验设计
糜子(Panicum miliaceumL.)是一年生禾本科黍属作物,民间又称黍、稷和糜,主要种植在干旱半干旱的山区,生育期短。糜子是我国主要米类作物之一,其脱壳之后称为黄米[1]。黄米脂肪含量3.6%左右,蛋白质含量12%左右,必需氨基酸构成比例比较平衡,是很好的辅助食物[2]。同时,黄米蛋白对小鼠的动脉粥样硬化和肝损伤有预防作用[3,4]。糜子籽粒中富含食用纤维,此外还含有多种维生素,如维生素E、维生素B6、B1、B2、β-胡萝卜素等和丰富的多种矿物质元素,如钙、镁、磷、铁及锌等[5]。在当前食物多样化的需求下,糜子丰富的营养价值吸引了俄罗斯、印度、中国和美国等国家的科学家和市场的广泛关注。尽管已有一些分子标记已用于相关杂粮作物的遗传种质鉴定、遗传多样性以及遗传图谱构建,但是糜子的分子标记开发仍然严重滞后。目前,中国收集在册的糜子品种资源已超8 500份[6],对这些品种的遗传多样性研究主要是通过表型鉴定[7~9],现今已不能满足实践需求。
近年来,快速增长的EST数据已成为SSR的重要来源,狗牙根、刺槐、菊花、光皮桦、荔枝、大白菜、萝卜、马铃薯等多种植物都开展了EST-SSR标记的开发与利用[10~17]。Genic-SSR标记是一种基于EST或者RNA序列的标记系统,其原理依托测序技术,即EST文库测序或目前较为先进的高通量RNA-Seq技术获得的植物、动物或微生物的mRNA拼接序列而开发的SSR标记。EST-SSR标记大多重复基序位于基因编码区5’端和3’端的非翻译区,重复序列的缺失和插入都可直接引起基因表达和功能的改变,可直接鉴定重要生物表型性状所关联的等位基因[18];而RNA-seq获得的编码序列较EST更长(EST序列大多为3’端和5’端序列);基因注释更为准确。糜子属于小杂粮作物,其关注程度相比主栽作物低,基因序列公开报道较少,在一定程度上制约了糜子分子标记的开发与利用。精确的Genic-SSR标记具有信息量大、通用性好的特点,更易分辨出不同基因型之间的亲缘关系以及筛选关联生物性状的功能基因[19]。本文基于RNA-seq技术,开发相关的Genic-SSR标记,除具有本身SSR标记优点外,还具有高通量引物开发、物种特异性强、条带分辨率高等优点[20],不仅能从分子水平划分糜子的群体结构,分析遗传多样性,而且可以直接发掘功能标记基因,用于分子辅助选择(Marker-assistedselection,MAS)和杂交育种[11]。但Genic-SSR分子标记技术也是基于PCR扩增技术,其受到PCR反应各种因素的影响,因此本试验采用L16(44)正交设计,设置了不同浓度的TaqDNA聚合酶、Mg2+、dNTPs和引物作为影响糜子Genic-SSR分子标记PCR反应中的4个主要因素筛选优化组合。通过分析TaqDNA聚合酶、Mg2+、dNTPs和引物浓度对PCR反应的效应,筛选出糜子Genic-SSR标记的最佳PCR反应体系。
目前SSR分子标记扩增条带的分析方法主要是采用聚丙烯酰胺凝胶电泳,但其分辨率较毛细管电泳低,费时费力。本文采用了FragmentAnalyzer全自动毛细管电泳系统进行糜子Genic-SSR位点检测,该系统基于荧光检测技术和毛细管电泳技术发展而来的新型DNA/RNA片段分离仪器,它采用敏感的嵌入染料以及强大的LED光源,避免了传统方法中对荧光标记引物的依赖,电驱动原理对dsDNA片段和RNA样品进行分离并定性和定量检测,分辨率高、运行速度快,具备高通量检测优势,大大减少分析所需时间[11]。为应用全自动毛细管电泳结合Genic-SSR标记技术研究糜子遗传多样性奠定基础。
1试验材料和方法
1.1试验材料
试验选用的糜子品种为“雁黍7号”,取生长18天的幼嫩叶片提取DNA。引物由生工生物工程(上海)股份有限公司合成。DNF-900-K0500试剂盒购自AATI公司。DL500DNAMarker,Mg2+,dNTPs,TaqDNA聚合酶及其他常规试剂均购自宝生物工程(大连)有限公司。
1.2方法
1.2.1DNA提取
糜子叶片总DNA的提取采用CTAB法,并经去RNA,去蛋白处理。用1%的琼脂糖凝胶电泳检测DNA质量的完整性。经过检测DNA的OD值为1.91,DNA可用于Genic-SSR反应。
1.2.2正交试验的设计
试验采用L16(44)正交设计表[15],重复3次,对影响PCR扩增反应的Mg2+浓度,引物浓度,dNTPs和TaqDNA聚合酶浓度4个因素进行了4个水平的正交试验设计(表1),模板DNA浓度为50mg·L-1。
1.2.3PCR扩增程序
该反应采用递减PCR扩增技术,反应体系为20μL,程序如下:
94 ℃预变性5min
表1糜子Genic-SSR分子标记PCR正交试验设计表
Table1BroomcornmilletGenic-SSRmarkersPCRorthogonalexperimentaldesign
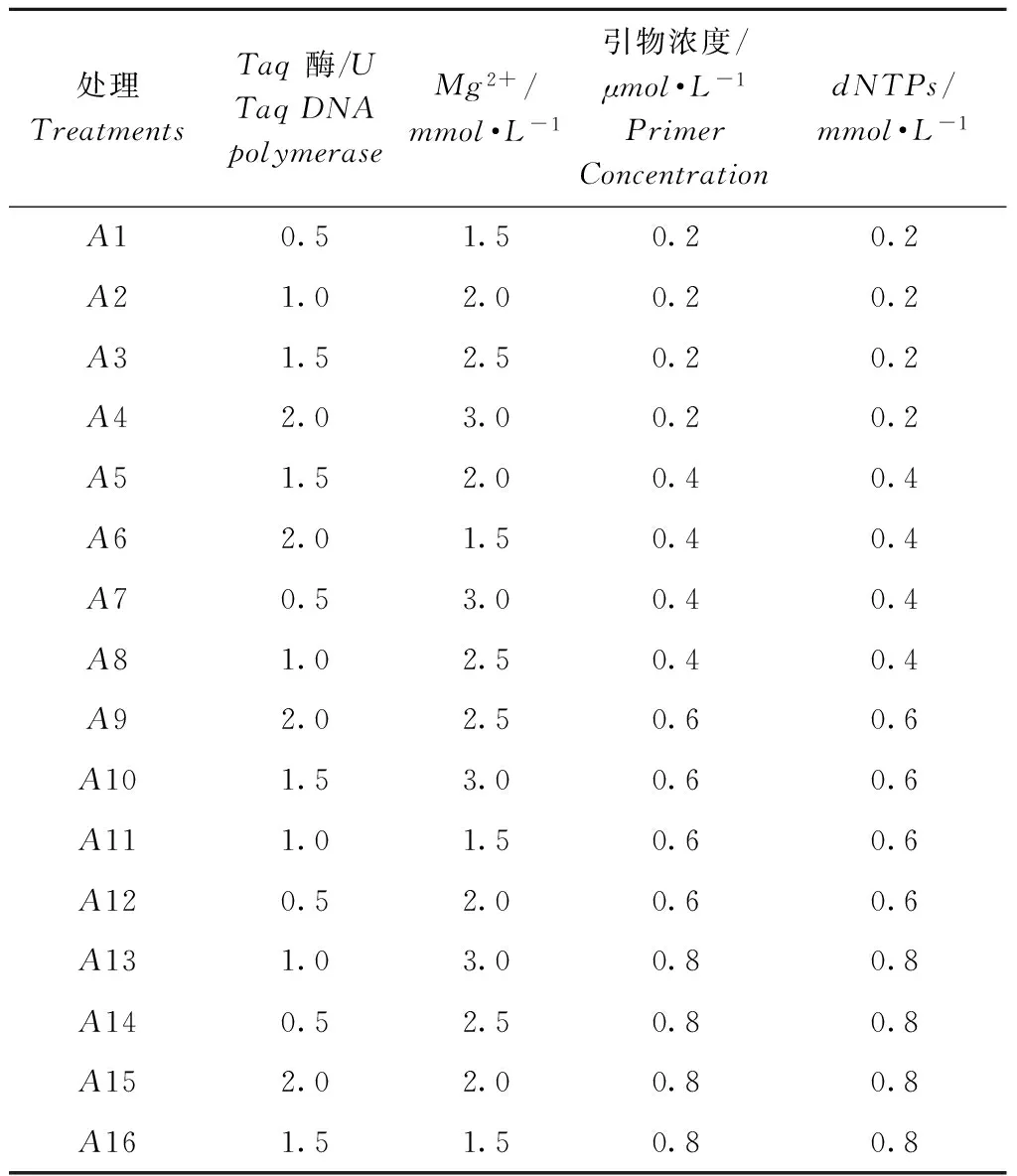
处理TreatmentsTaq酶/UTaqDNApolymeraseMg2+/mmol·L-1引物浓度/μmol·L-1PrimerConcentrationdNTPs/mmol·L-1A10.51.50.20.2A21.02.00.20.2A31.52.50.20.2A42.03.00.20.2A51.52.00.40.4A62.01.50.40.4A70.53.00.40.4A81.02.50.40.4A92.02.50.60.6A101.53.00.60.6A111.01.50.60.6A120.52.00.60.6A131.03.00.80.8A140.52.50.80.8A152.02.00.80.8A161.51.50.80.8


循环完成后72 ℃延伸5min,4 ℃保存。扩增产物首先在2%琼脂糖凝胶电泳上检测,然后用FragmentAnalyzer全自动毛细管电泳检测。
1.2.4FragmentAnalyzer全自动毛细管电泳检测
将PCR产物按AATI公司生产的DNF-900-K0500试剂盒步骤说明加入到样品槽中,按标准操作程序运行FragmentAnalyzer全自动毛细管电泳检测仪,分析结果。
2结果与分析
2.1正交试验PCR扩增结果分析
正交设计琼脂糖凝胶电泳结果如图1所示,可以看出,以100ng·μL-1模板进行PCR扩增,各个反应体系均可以扩增出目标条带。
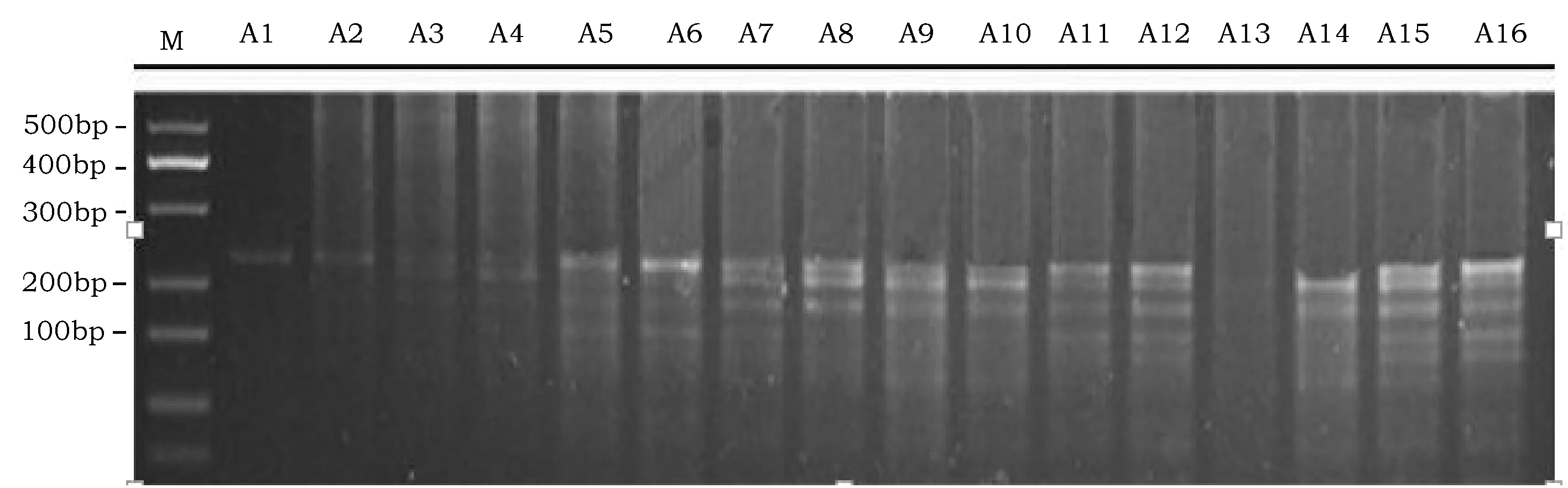
图1 “雁黍7号”Genic-SSR分子标记PCR反应体系优化扩增产物琼脂糖凝胶电泳检测Fig.1 Electrophoresis detection by agarose gel of the PCR products from the Genic-SSR optimization in “Yanshu 7”
其中A3、A4和A13扩增条带不清晰,无有效PCR产物可供检测;A6、A7、A8、A9、A10、A11、A12、A14、A15、A16均有清晰明显的扩增条带,但是非特异性扩增条带较多,干扰了有效扩增条带的统计。而A1、A2条带都比较清晰,无非特异性扩增,且A1相较于A2特异性更强,因此在该反应体系下扩增结果较为可靠,可作为后续大规模扩增反应体系。
2.2FragmentAnalyzer全自动毛细管电泳检测结果分析
FragmentAnalyzer全自动毛细管电泳结果如图2所示,可以观察出各反应体系扩增产物条带深浅不同。本次研究主要筛选200~300bp的目标产物,可以发现A2、A3、A5、A7、A9、A11、A12、A13、A15、A16条带颜色较浅,说明PCR反应扩增产物浓度比较低;A4、A6、A8、A10、A14条带颜色比较深,但是杂带比较多;A1条带颜色深并且目标区域特异性较高。
2.3PCR试验结果直观分析
在16个组合中,3个处理组合(A3、A4、A13)几乎没有扩增条带,其他组合均有明显扩增条带,其中处理A1、A6、A7目标条带清晰,背景色相对较少,且条带内多态性较好。据此参考何正文等[22]和穆立蔷等[23]的方法,进行三次独立打分,得分依次如下:16、15、6、9、7、14、13、12、2、3、8、11、4、1、5、10;16、10、5、7、8、15、14、13、3、4、11、12、1、2、6、9;16、7、4、9、11、15、14、10、1、2、8、13、3、6、5、12;将三次处理得分取平均数,根据平均得分情况进行直观分析和方差分析。本次试验首先根据结果得分研究各个因素在各个水平的均值Ki,依值反映各个因素对反应的影响,最后求出各个因素在各个水平的极值差R (R=Kmax-Kmin,Kmax为单个试验因素中的最大Ki,Kmin为单个试验因素中最小的Ki),R越大,说明该因素对于试验影响越大[21]。由表2可以发现Mg2+浓度的R值为5.57,说明该因子对试验结果影响最大;TaqDNA聚合酶R值为5.3,其影响最小。各个水平对于糜子Genic-SSRPCR反应影响依次为Mg2+>引物浓度>TaqDNA聚合酶=dNTPs浓度。

图2 糜子Genic-SSR分子标记PCR反应体系优化扩增产物毛细管电泳图Fig.2 Capillary electrophoresis of optimization PCR products by Genic-SSR markers in broomcorn millet
2.4Genic-SSR PCR反应正交设计方差分析
本研究利用正交设计助手软件对结果进行方差分析(表3)。结果发现引物浓度对试验结果影响高于dNTPs的影响,而Mg2+对试验结果影响最大。其他因素影响的主次也与直观分析基本一致的影响,表明试验结果误差较小,其结果可信。
2.5Mg2+浓度对PCR产物毛细管电泳的影响
经上述分析,Mg2+对试验结果影响最大,从毛细管电泳的RFU值图上也可反应出此点。不同浓度的Mg2+反应体系对PCR产物毛细管电泳的相对荧光强度(RFU)如图3所示。RFU越大,表明目标扩增产物浓度越大;RFU峰值(相对荧光强度)越多,说明不同浓度的DNA片段越多。图3中各条带A1、A6、A11、A16分别代表1.5mmol·L-1、2mmol·L-1、2.5mmol·L-1、3mmol·L-1Mg2+浓度对应各个反应体系的RFU及目标产物随时间变化图,可知1.5mmol·L-1Mg2+对应条带目标产物RFU(目标扩增产物浓度)最大,且波峰(不同浓度目标产物)最少;2mmol·L-1Mg2+的条带RFU有所降低,且杂带有所增加;3mmol·L-1Mg2+的条带RFU最小,且波峰较多,即杂带较多。因此得出1.5mmol·L-1Mg2+为最佳反应体系。
表2糜子Genic-SSR分子标记PCR正交试验直观分析表
Table2TableofBroomcornmilletGenic-SSRmarkersPCRorthogonalexperimentalvisualanalysis
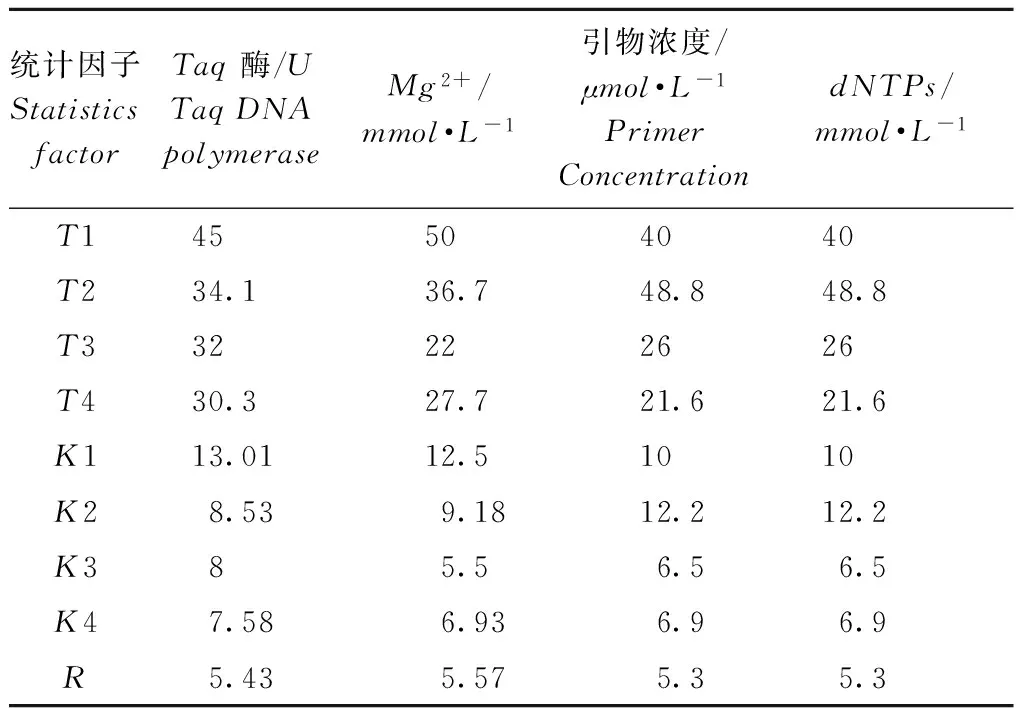
统计因子StatisticsfactorTaq酶/UTaqDNApolymeraseMg2+/mmol·L-1引物浓度/μmol·L-1PrimerConcentrationdNTPs/mmol·L-1T145504040T234.136.748.848.8T332222626T430.327.721.621.6K113.0112.51010K28.539.1812.212.2K385.56.56.5K47.586.936.96.9R5.435.575.35.3
注:Ti为任一列上水平号为i(本试验中i=1,2,3,4)时,所对应的试验之和;Ki为任一列上因素取水平i时所得试验结果之和;Ki=Ti/s,s为任一列上各水平出现的次数;R是极差
Note:Ti(i=1, 2,3,4inthisexperiment)isanyofacolumnsaretakenastheresultsofsumtothecorrespondingtest.Kiisthesumofthetestresultsobtainedwheniistakenasafactorinanyofacolumn.Ki=Ti/s,sforthenumberofappearstimesineverylevelforanyofacolumn.
表3糜子Genic-SSRPCR反应正交设计方差分析表
Table3TheorthogonaldesignanalysisofvariancetableofBroomcornmilletGenic-SSRPCRreaction
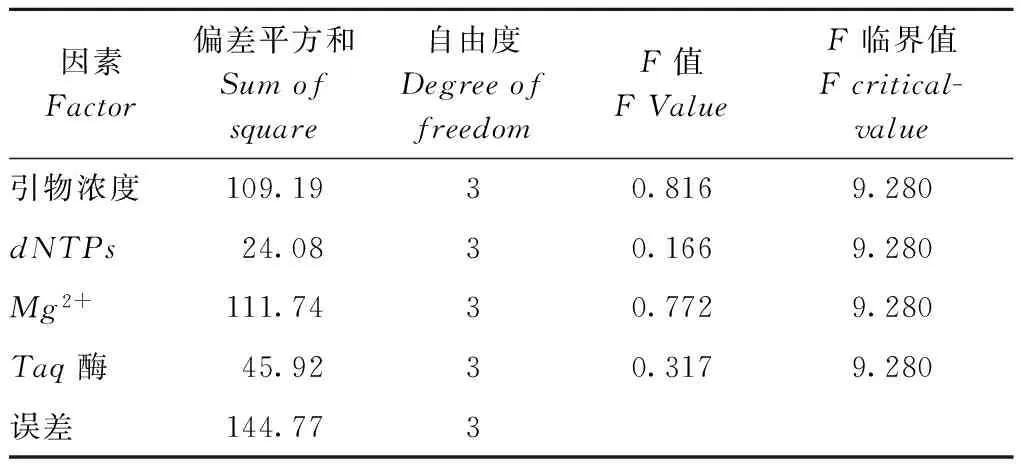
因素Factor偏差平方和Sumofsquare自由度DegreeoffreedomF值FValueF临界值Fcritical-value引物浓度109.1930.8169.280dNTPs24.0830.1669.280Mg2+111.7430.7729.280Taq酶45.9230.3179.280误差144.773

图3 不同浓度Mg2+的PCR扩增产物RFU随时间变化图Fig.3 Changes of PCR amplification products (RFU) with time in different concentration of Mg2+ 注:A1、A6、A11、A16分别代表1.5 mmol·L-1、2 mmol·L-1、2.5 mmol·L-1、3 mmol·L-1 Mg2+浓度对应各个反应体系的RFU(纵轴)及目标产物随时间变化(横轴)Note: A1, A6, A11, A16 respectively represent 1.5 mmol·L-1, 2 mmol·L-1, 2.5 mmol·L-1 and 3 mmol·L-1 Mg2+ concentration corresponding to each of the reaction system of the target product for RFU (vertical axis) change with time (x-axis)
3讨论
目前,SSR体系优化试验主要采用单因素试验、完全试验或正交试验。完全随机试验由于试验组合较大,工作量大、费时费力而多选用单因素和正交试验。单因素试验的一种组分发生变化,其他组分的浓度往往靠经验来确定,忽略各种组分的相互影响,难以确定最佳组合。而正交设计是利用一套规格化的正交表将各个因素、各个水平之间组合均匀搭配、合理安排,大大减少试验次数,并提供较多的信息,是研究多因素、各个水平之间组合均匀搭配、合理安排,大大减少试验次数,并提供较多的信息,可以又快又好的筛选最优组合。
本试验采用了FragmentAnalyzer全自动毛细管电泳检测,目前大部分SSR分子标记试验的扩增条带的分析方法采用聚丙烯酰胺凝胶电泳,但其工作量大,相较于毛细管电泳分辨率低,所需时间较长。毛细管电泳操作简单、工作量少、并且精确度较高、效率高。毛细管检测可以通过荧光相应强度与目标产物在毛细管电泳中与时间的关系反映目标产物片段的大小以及目标产物浓度的大小。全自动毛细管电泳基于荧光检测系统,RFU(相对荧光强度越大),表明PCR目标产物浓度越大;波峰越多,表明不同大小的目标产物越多。通过图三可以看出,随着Mg2+浓度增大,目标产物的RFU(荧光响应强度)越来越小,表明目标产物浓度越来越小;随着时间边长,波峰逐渐增多,非目标产物片段变多。
试验采用试验室设计的Genic-SSR引物,通过正交设计对糜子Genic-SSR反应体系进行优化,得到糜子Genic-SSR最佳PCR反应体系:20μL的反应体系中有1.5mmol·L-1Mg2+、0.5UTaqDNA聚合酶、0.2μMSSR引物和0.2mmol·L-1dNTPs。经过试验验证该反应体系可以获得清晰的多态性条带,为今后糜子Genic-SSR反应奠定基础。
根据正交设计直观分析和方差分析以及RFU随时间的变化可以看出影响反应的4个因素对于试验结果的影响有相辅相成的作用,但试验结果表明各个因素有主次之分,各个因素对于糜子Genic-SSRPCR反应影响结果如下:Mg2+>引物浓度>dNTPs>TaqDNA聚合酶。Mg2+通过影响引物与模板的结合效率、产物特异性及引物二聚体的形成,继而成为影响PCR产量和扩增特异性的最重要因素。此外,引物浓度作为影响PCR反应的另一个重要因素,浓度过高容易发生非特异性扩增,使得引物二聚体含量增加且还易引起碱基错配。引物浓度过低,则易产生拖尾现象并导致扩增产量下降[19]。在本次试验中模板DNA浓度为100mg·L-1的固定浓度,对于PCR扩增的稳定性几乎无影响。DNA纯度对于Genic-SSR分子标记PCR扩增有较大的影响,本次试验采用的DNA经去RNA、去蛋白处理,纯度较高(OD值为1.91)有效的提高了琼脂糖凝胶和毛细管电泳的效果。
参考文献
[1]徐晓艺,刘敏,郝明远,等. 糜子高产栽培技术及用途[J].农业科技通讯,2010,1(10):171-172.
[2]冯佰利,蒋纪芸,曾盛名,等.生态高度对糜子籽粒蛋白质及氨基酸含量的影响[J].西北农业大学学报,1996,24(5):80-84.
[3]NishizawaN,SatoD,ItoY,etal.EffectsofdietaryproteinofprosomilletonliverinjuryinducedbyD-galactosamineinrats[J].BiosciBiotechBiochem,2002,66(1):92-96.
[4]NaoyukiN,MihokoO,ShinichiH.Effectsofdietaryproteinofprosomilletontheplasmacholesterolmetabolisminrats[J].JAgrFoodChem,1990,54(1):229-230.
[5]贺利兵,淡振荣,李建军. 府谷县糜子优质丰产栽培技术[J]. 陕西农业科学,2014,60(1):118-119.
[6]HuaXY,WangJF,LuP,eta1.Assessmentofgeneticdiversityinbroomcornmillet(Panicum miliaceumL.)usingSSRmarkers[J].JournalofGeneticsandGenomics, 2009,36(8):491-500.
[7]张志芬,高小丽,冯佰利,等.糜子籽粒贮藏蛋白的组分分析[J].西北农林科技大学学报(自然科学版),2009,37(4):81-85.
[8]董孔军,杨天育,何继红.甘肃省糜子地方资源农艺性状遗传多样性分析[J].河北农业科学,2012,16(2):1-3+14.
[9]胡兴雨,王纶,张宗文,等.中国黍稷核心种质的构建[J].中国农业科学,2008,41(11):3489-3502.
[10]帕提古丽·麦麦提敏,张延辉,李培英,等.狗牙根EST-SSR反应体系优化及其遗传多样性初步分析[J].新疆农业大学学报,2014,37(2):112-118.
[11]赵克奇,董黎,王少明,等.刺槐EST-SSR标记PCR反应体系的优化[J].中国农学通报,2014,30(22):45-52.
[12]张运兴,李卫国,申亚琳,等.菊花EST-SSR标记的开发与应用[J].武汉大学学报,2013,59(4):357-362.
[13]陈争,姜小凤,童再康.光皮桦EST-SSRPCR反应体系的优化[J].浙江农林大学学报,2012,29(6):960-965.
[14]孙清明,马文朝,马帅鹏,等.荔枝EST资源的SSR信息分析及EST-SSR标记开发[J].中国农业科学,2011,44(19):4037-4049.
[15]佟海申,宋琳,张志刚,等.大白菜EST-SSR反应体系优化及引物筛选[J].科技导报,2010,28(3):76-81.
[16]付卫民,王淑芬,王秀峰,等.萝卜EST-SSR标记PCR反应体系的建立与优化[J].长江蔬菜,2012(22):6-8.
[17]王佳楠,吕文河,金光辉,等.马铃薯致病疫霉EST-SSRPCR反应体系的优化[J].东北农业大学学报,2009,40(6):11-16.
[18]BérubéY,ZhuangJ,RungisD,etal.CharacterizationofEST-SSRsinloblollypineandspruce[J].TreeGenetGenomes, 2007, 3(3):251-259.
[19]李小白,金凤,金亮,等. 利用建兰转录数据开发genic-SSR标记[J].农业生物技术学报,2014,22(8):1046-1056.
[20]ChenQQ,ZhanXJ,LanJY,etal.StudyprogressindevelopmentofEST(expressedsequencetags)[J].ChinaAgriSciBull, 2008, 24 (9):72-77.
[21]于志贤,侯建华. 油葵SRAP-PCR反应体系的建立与优化[J].中国农学通报,2013,29(33):296-301.
[22]何正文,刘运生,陈立华,等.正交设计直观分析法优化PCR条件[J].湖南医科大学学报,1998,23(4):403-404.
[23]穆立蔷,刘赢男,冯富娟,等.紫椴ISSR-PCR反应体系的建立与优化[J].林业科学,2006,42(6):26-31.
(编辑:邢国芳)
TheoptimizationofPCRreactionsystemforGenic-SSRanalysisinbroomcornmillet
LiYaoshen1,CaoXin1,DuanMing1,WangJunjie1,ZhangBin1,LiHongying1,HouSiyu1,2,HanYuanhuai1,2,3*
(1.College of Agriculture, Shanxi Agricultural University, Taigu 030801, China; 2.Shanxi Key Laboratory of Genetic Resources and Breeding in Minor Crops,Shanxi Agricultural University, Taigu 030801, China; 3.Key Laboratory of Crop Gene Resources and Germplasm Enhancement on Loess Plateau, Ministry of Agriculture, Taiyuan 030031, China)
Abstract:[Objective] The fluorescent PCR reaction system for Genic-SSR analysis was optimized by using the Fragment Analyzer Automatic Capillary Electrophoresis detection system in broomcorn millet. [Methods]Optimization was based on L16 (44) orthogonal design, with different concentrations of Taq DNA Polymerase, Mg2+, dNTPs and primers. [Results] The order of the effects for the system was: Mg2+>primer>dNTPs>Taq DNA Polymerase. Through the orthogonal experimental design, a 20 μL reaction system was established, which contained a 0.2 mol·L-1dNTPs, 0.2 μmmol·L-1SSR primer, 1.5 mmol·L-1Mg2+, and 0.5 U Taq DNA Polymerase. [Conclusion]This optimal PCR reaction system could be used for genetic clustering analysis of germplasm with Genic-SSR markers and for further development of molecular markers for marker-assisted breeding in broomcorn millet.
Key words:Broomcorn millet; Genic-SSR; PCR reaction system; Orthogonal design
收稿日期:2016-01-29 修回日期:2016-03-22
作者简介:李耀深(1991-),男(汉),广西贵港人,硕士研究生,研究方向:糜子遗传多样性 *通讯作者:韩渊怀,教授,博士生导师。Tel:03546287239;E-mail:swgctd@163.com
基金项目:山西农业大学科技创新育种基金 (2013-2016);山西特色植物基因资源开发与利用平台项目(2012091004-0103)
中图分类号:S516
文献标识码:A
文章编号:1671-8151(2016)07-0477-06

