亳菊试管嫁接苗褐变生理机制研究
纪薇,王瑞,狄娟,刘榕晨,罗尧幸,茹慧玲,杨忠义*
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.山西省农科院 果树研究所,山西 太谷 030800)
亳菊试管嫁接苗褐变生理机制研究
纪薇1,王瑞1,狄娟1,刘榕晨1,罗尧幸1,茹慧玲2,杨忠义1*
(1.山西农业大学 园艺学院,山西 太谷 030801; 2.山西省农科院 果树研究所,山西 太谷 030800)
摘要:[目的]揭示亳菊试管微嫁接过程中组培苗发生褐变的生理机制。[方法]本研究以亳菊外植体为研究材料,使用福林酚法和多酚氧化酶活性测定法,对发生褐变的亳菊微嫁接苗总酚含量、多酚氧化酶活性以及褐变指数进行测定。[结果]亳菊微嫁接苗褐变级数越高,发生褐变的情况越严重,4级褐变率(89.7%)显著高于其他褐变级数;随着褐变级数的增大,亳菊试管微嫁接苗组织内总酚含量降低,多酚氧化酶活性增强,即褐变级数与外植体总酚含量成负相关,与多酚氧化酶活性成正相关。[结论]本研究为提高亳菊试管微嫁接效率提供了理论依据。
关键词:菊花; 菊试管微嫁接; 褐变
亳菊(Dendranthema morifolium (Ramat.)Tzve.l‘Boju’cv.nov.) 为多年生草本植物,菊科菊属,是药用菊花中重要的一种,主要产于安徽亳州,为四大名菊之一,观赏价值高,有疏风散热、解暑明目等药用价值[1,2]。由于亳菊生活范围逐渐缩小,并且农民为获得更高利润而更换种植种类,使得亳菊种质资源急剧减少。为了缓解土地压力以及快速改良品种性状,组培成为植物快速繁殖的重要手段,并且采用试管微嫁接技术达到大量生产优质脱毒苗的目的。然而,亳菊同其他植物外植体一样,在组培过程中,自身组织会从外表向培养基释放褐色物质,使培养基逐渐变为褐色,外植体也逐渐枯萎死亡[3]。
组织培养过程中亳菊试管微嫁接苗培养过程中因褐变导致植株死亡情况严重。本试验以不同褐变程度的亳菊微嫁接苗为材料,对其总酚含量、多酚氧化酶活性及褐变指数进行测定并进行相关性分析,旨在为优化亳菊试管微嫁接技术体系提供理论依据和实践指导。
1材料与方法
1.1试验材料
山西农业大学园艺站位于山西省晋中市太谷县山西农业大学(37°43′N,112°59′E),土壤以褐土为主,为温带大陆性气候。本试验选取亳菊的幼嫩茎段与茎尖为试验材料,对发生褐变嫁接苗进行动态观察和指标测定。
1.2仪器和试剂
仪器:台式冷冻离心机(型号:PRIMOR;产地:德国),双人单面垂直洁净工作台(型号:SW-CJ-2FD;产地:上海),紫外分光光度计(型号:UV-7504;产地:上海),恒温水浴锅(型号:HH-2:产地:常州)。
试剂:福林酚(购自北京华迈科生物技术有限责任公司),邻苯二酚、丙酮、无水乙醇、没食子酸、磷酸、柠檬酸、碳酸钠(均购自徐州索通生物科技有限公司)。
1.3试验方法
1.3.1试管微嫁接
将试验材料放入大烧杯中,纱布封口后用流水冲洗2h左右,然后将外植体在超净工作台上用75%酒精消毒30s,蒸馏水清洗3遍后,用10%次氯酸钠消毒10min,再用蒸馏水清洗3遍,在滤纸上吸干外植体表面水分。用剪刀将植物材料分为茎段与茎尖两个部分,去除植物较大的叶片,留1~2片小叶片[4~6]。将茎段的上端平切,下端斜切。沿砧木顶部纵切,长度约0.5cm,选粗度与砧木相近的接穗,留顶部1~2片叶子, 并将其基部成楔形(长约0.5cm)。将接穗插入砧木中,用锡铂纸将接口部位绑紧。最后把嫁接好的试管苗接入ER培养基中进行培养[7~9]。
1.3.2多酚氧化酶活性的测定
多酚氧化酶活性测定试验采用印芳等[10]的方法,稍作改良。基本步骤如下:将混合的材料称取0.5g,在预冷后的研钵中加入磷酸-柠檬酸缓冲液冷冻研磨提取,待充分研磨后定容至10mL(低温操作),用低温离心机离心15min,转速与温度分别为3 000r·min-1、0~4 ℃,离心后所得的上清液即为多酚氧化酶待测液。量取待测液5mL,再加入5mL反应体系(4.0mL0.1mol·L-1磷酸—柠檬酸缓冲液,1.0mL1%邻苯二酚),充分反应2min后,将混合液在30 ℃的水浴上保温30min。取出液体4min后在波长为460nm处测定吸光度值[10]。
测量多酚氧化酶活性试验,试验重复3次,测量吸光值时以每分钟A460变化 0.01为一个多酚氧化酶活性单位(U)。
多酚氧化酶活性/U·(g·min)-1=(A460×VT)/(W×VS×0.01×t)
式中:A460:反应时间内吸光度的变化;W:样品鲜重/g;t:反应时间/min;VT:提取酶液总体积/mL;VS:测定时取用酶液体积/mL。
1.3.3总酚含量的测定(没食子酸为标准曲线)
试验采用Folin-Ciocalteu试剂法,总酚含量的测定采用徐辉艳等[11]的方法,并有一定的改进。基本步骤如下:称取0.5g的混合材料冷冻保存,研磨,定容,量取制备好的液体0.5mL于50mL容量瓶中, 加30mL蒸馏水摇匀,再加入2.5mL福林酚试剂和7.5mL20%碳酸钠溶液,定容,水浴10min,温度为75 ℃,待冷却后于760nm波长下比色测定吸光度值。试验重复3次[11]。
标准液的配置:称取0.005g没食子酸标准样,用蒸馏水溶解并定容至50mL。量取制备好的溶液0、0.5、1、1.5、2、2.5、3mL于50mL容量瓶中,各加30mL蒸馏水摇匀,再加2.5mL福林酚试剂,充分摇匀,待反应1min后再加入20%碳酸钠溶液7.5mL,摇匀定容。75 ℃水浴10min,冷却后于760nm波长下比色测定吸光度,建立标准曲线[11]。
1.3.4总酚含量的测定(邻苯二酚为标准曲线)
试验采用Folin-Ciocalteu试剂法,总酚含量的测定采用Bonilla等[12]的方法,并有一定的改进。基本步骤如下:取0.5g材料,加入3mL95%乙醇研磨成匀浆状,过滤,用95%乙醇定容至25mL。取2mL待测液于10mL离心管中,先加入2mL福林试剂,摇匀静置3min后加入10%碳酸钠2mL震荡。避光处理1h后在765nm处比色测定[12]。试验重复3次。
标准曲线的制定:称取10mg邻苯二酚样品溶解于100mL蒸馏水中,分别量取0、0.1、0.2、0.3、0.4、0.5mL的邻苯二酚溶液于10mL离心管中,再分别加入2mL福林酚试剂和2mL10%碳酸钠溶液,最后加入2、1.9、1.8、1.7、1.6和1.5mL蒸馏水,黑暗静置1h后在波长765nm处测量吸光度值[12]。
1.3.5褐变指数的测定
褐变指数=∑(褐变级数×该病级株数)/(总株数×4)×100%[13]

表1 褐变分级方法[13]
1.4数据处理
试验采用单因素随机处理,设3个处理,每个处理重复3次。数据处理使用WordprocesssystemOffice软件进行平均值、误差分析,各处理的平均值采用TheSASSystemforWindowsV8进行多重比较检验与显著性分析,采用Excel整理多重比较检验与显著性分析的结果,并用Excel作图。
2结果与分析
2.1亳菊试管微嫁接苗褐变动态观测
2.1.1亳菊试管微嫁接苗的不同发生部位褐变动态观测
亳菊微嫁接苗在组培的过程中发生的褐变位置不同,可分为3种情况。第一种为嫁接苗的接穗先发生褐变,外植体由上而下逐渐变为褐色。第二种为嫁接苗的接穗与砧木嫁接处先发生褐变,然后逐渐向嫁接苗的两端蔓延。第三种为嫁接苗的砧木先发生褐变,然后由下而上褐变逐渐蔓延。分析原因,这可能是由于选取的外植体本身的生理状态、取材时间不同以及外植体受到各种机械损伤(如流水冲洗、砧木和接穗的处理等),使得嫁接苗褐变的位置不同。如图1所示。

图1 亳菊试管嫁接苗在不同部位发生褐变(嫁接于2015-09-25)Fig.1 Grafting of Chrysanthemum Plantlets from different parts of Chrysanthemum(grafted on 2015-09-25) 注:A :嫁接后4 d后接穗先发生褐变;B:嫁接后6 d后嫁接切口处先发生褐变;C:嫁接后6 d砧木先发生褐变。Note: A: grafting after 4 days after scion to browning; B: after grafting 6 days after grafting the incision to browning; C: after grafting 6 d rootstock first browning.
2.1.2亳菊试管微嫁接苗生长发育动态观测
亳菊嫁接苗于2015年9月21日嫁接接种,组织培养9d后外植体表面较少部分变为棕褐色;培养14d后外植体整体颜色变淡,呈棕褐色,培养基开始变色;培养21d后,外植体开始枯萎,培养基颜色加深,基部有黄色菌落。如图2所示。

图2 亳菊试管嫁接苗褐变情况(于2015-09-21嫁接)Fig.2 The browning situation of chrysanthemum tube grafted culture (in 2015-09-21 grafting) 注:A为培养9 d后亳菊试管嫁接苗褐变情况,B为培养14 d后亳菊试管嫁接苗褐变情况,C为培养21 d后亳试管嫁接苗褐变情况Note: A.Browning of test tube grafted seedlings cultured in vitro after 9 days. B.Browning of test tube grafted seedlings cultured in vitro after 14 days. C.Browning of test tube grafted seedlings cultured in vitro after 21 days
2.2亳菊试管微嫁接苗褐变指数分析
在亳菊组培的过程中,外植体常常在接种后发生褐变,情况轻时仅会使培养基变为棕褐色,严重时会阻碍植株的生长、分化,甚至使植株死亡。在试验过程中,当嫁接苗组培到第1d时,各个组培苗开始出现不同程度的褐变情况,大部分嫁接苗褐变速度极快,平均6d左右达到4级褐变,外植体生长受到阻碍,不分化,嫁接苗全部变为褐色并且死亡。极少数褐变级数为1级。由表2可见,在亳菊经试管微嫁接后,通过30d左右的培养后,亳菊嫁接苗褐变情况严重,嫁接苗的正常生长受到严重的阻碍,并且有些嫁接苗已经死亡,极少数嫁接苗发生分化,4级褐变显著高于0、1、2、3级(P<0.01),褐变指数为0.95。

表2 亳菊试管微嫁接苗褐变情况
注:表中为平均值 ±标准误差,同列不同大写字母表示差异显著(α=0.01),P<0.01
Note:Valuesrepresentthemeans±SE,Differentcapitallettersinsamecolumnmeansignificantdifference(α=0.01), P<0.01
2.3亳菊试管嫁接苗多酚氧化酶活性的变化
亳菊试管嫁接苗组培1d后外植体不同部位开始出现褐变,并逐渐蔓延。从图3可以看出,亳菊嫁接苗的褐变级数与多酚氧化酶(PPO)的活性呈正相关。形状、大小基本一致的试管嫁接苗褐变级数分别为2、3、4时,亳菊嫁接苗的多酚氧化酶(PPO)活性差异显著,显著性P值为0.0005。当褐变级数为4级时,褐变情况最为严重,亳菊嫁接苗的多酚氧化酶活性最高。
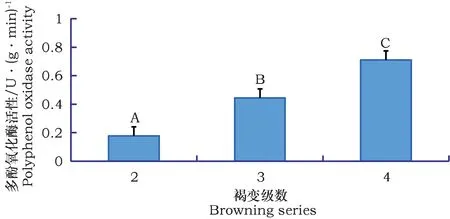
图3 褐变级数不同的亳菊嫁接苗多酚氧化酶活性变化Fig.3 Browning different stages daisy grafted polyphenol oxidase activity changes
2.4不同测定方法对亳菊微嫁接苗总酚含量的影响
图4为邻二苯酚标准曲线,通过处理数据,得到线性关系式:C邻苯二酚=0.866 87+4.514 08A吸光值(R2=0.962 6),回归模型的P值为0.000 5,决定系数为0.96。结果表明回归模型有较高的拟合精度,邻苯二酚总酚含量的标准曲线图具有良好的线性相关。通过此公式与相关的试验数据得出不同程度褐变的亳菊嫁接苗的总酚含量。
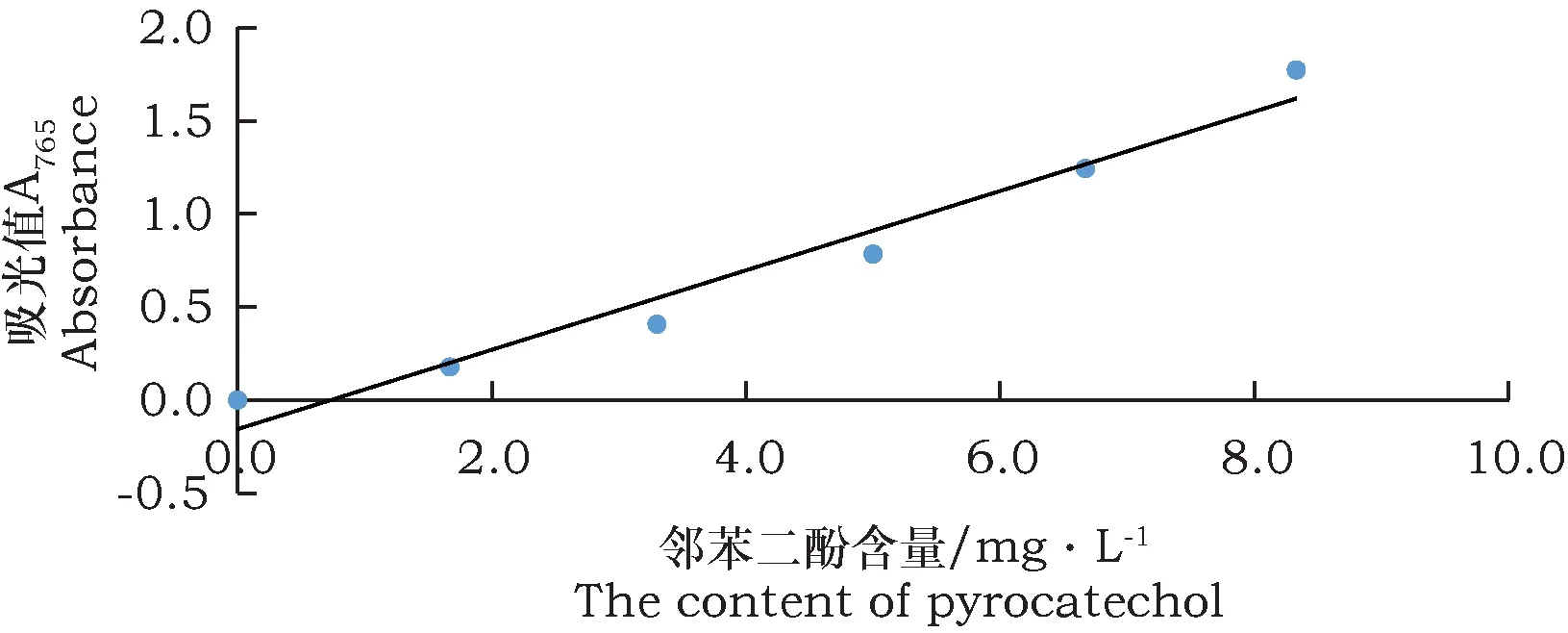
图4 邻苯二酚标准曲线Fig.4 Catechol standard curve
图5为没食子酸标准曲线,通过数据处理,得到线性关系式:C没食子酸=0.014 17+8.809 78A吸光值(R2=0.962 6),回归模型的P值为小于0.000 1,决定系数为0.993 0。结果表明回归模型有较高的拟合精度,没食子酸总酚含量的标准曲线图具有良好的线性相关,通过此公式与相关的实验数据得出不同程度褐变的亳菊嫁接苗总酚含量。
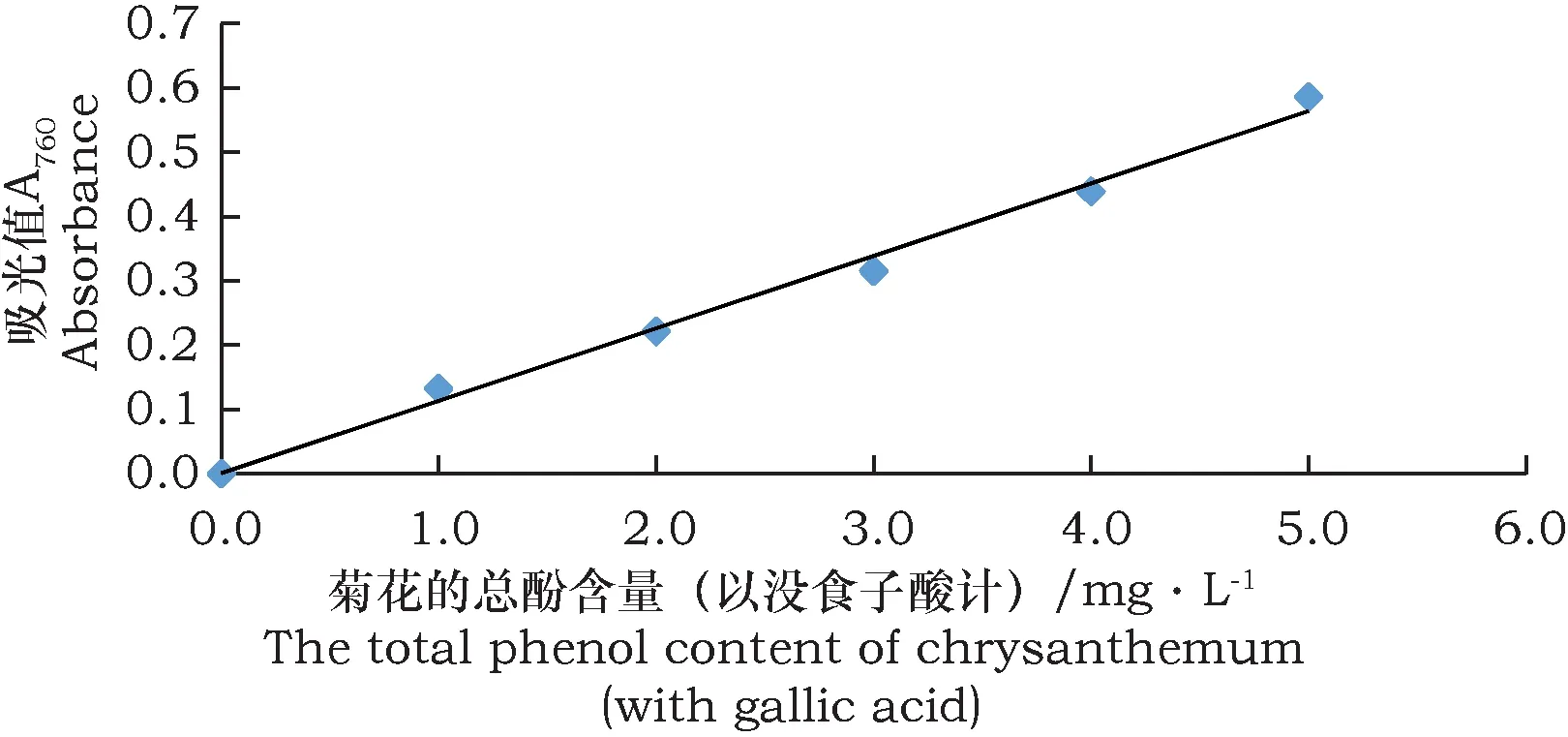
图5 没食子酸标准曲线(亳菊)Fig.5 Gallic acid standard curve (Daisy)
由图6可以看出,亳菊组培苗褐变级数与总酚含量呈负相关。当褐变级数低时,亳菊总酚含量较高,当组培苗的褐变级数增大时,褐变越加严重,总酚含量降低。经检验,总酚含量差异显著,显著性P值为0.000 3。用不同的方法测定亳菊组培苗的总酚含量时,测得的总酚含量都呈下降趋势,但测出的结果略有差异。用没食子酸测出的总酚含量总体偏高,并且下降趋势快于以邻苯二酚为标准曲线测得的总酚含量,当组培苗的褐变级数逐渐增大时,两种方法测得的总酚含量差值逐渐减小,但两种方法测得的总酚含量都呈下降趋势。

图6 以不同标准曲线测得亳菊总酚含量比较图Fig.6 In different standard curve measured chrysanthemum total phenol content comparison chart
3讨论
试管微嫁接技术不仅可以消除植物本身所带病毒,还可以优化品种性状,是优良品种快速繁殖的重要手段。目前为止,试管微嫁接技术已经广泛应用于葡萄、龙眼、香梨等植物的快速繁殖,并积累了大量的参考依据。付宏岐等[14]为了解决转基因红花植物生根困难的问题,通过不同茎尖微嫁接方式获得成活嫁接苗,建立了红花离体微试管嫁接的方法,为红花生根提供了新的途径以及为提高嫁接苗成活率奠定理论基础。
在组培试验过程中,褐变问题是普遍存在的,研究至今,众多科学家对植物组织培养过程中外植体发生褐变的现象已有大量研究[15~17]。总结原因主要有非酶促褐变与酶促褐变两大主要因素,非酶促褐变是由外界条件引起的,酶促褐变是内在因素引起的[17]。本试验中,酚类物质与多酚氧化酶在亳菊完整的植物体细胞中以稳定状态分隔存在,当外植体在处理时组织的完整性受到破坏,打破酚类化合物与多酚氧化酶的存放状态,二者相遇后酚类化合物在多酚氧化酶的催化下氧化形成醌类物质和水,进一步导致其他酶系失活,造成组织代谢活动紊乱,外植体生在代谢停滞,最后衰老死亡[13]。
大量的研究结果表明,褐变的发生与外植体的种类、年龄、取材部位、取材时间、外植体大小以及受伤害程度密切相关,很多因素都会影响植物体内的酚类物质的含量从而造成不同程度的褐变。这与本试验研究结果一致,分析原因可能是由于亳菊中含有大量的黄酮、多酚、绿原酸等活性物质,并且在温暖多雨的秋季取材,材料本身较老,体内酚类含量高[3]。
本试验中不同褐变程度亳菊嫁接苗中总酚与多酚氧化酶活性的变化结果表明,在亳菊嫁接苗培养一定天数以后,测得外植体总酚含量与多酚氧化酶各不相同,亳菊嫁接苗褐变级数增大时,酚类物质在多酚氧化酶的作用下氧化为醌类物质形成聚合物,总酚含量逐渐降低,多酚氧化酶活性逐渐增强,褐变级数与总酚含量成负相关,与多酚氧化酶活性成正相关,多酚氧化酶活性越高,外植体褐变越严重。符真珠等提出,在离体培养后,随着褐变加重,PPO的活性增强,而总酚的含量下降[18]。许传俊等研究成果显示褐变的产生可能不但因为酚的氧化,在褐变过程中酚类化合物的增多为主要原因,有待进一步研究[19]。
4结论
因褐变与外植体内总酚含量关系密切,使用总酚含量较低的植物进行微试管嫁接组培更加容易。亳菊微试管嫁接苗组培时出现不同程度褐变,由于褐变严重程度不同,嫁接苗的多酚氧化酶(PPO)活性与总酚含量相应变化。随着组培时间的延长,亳菊嫁接苗的褐变级数增大,多酚氧化酶(PPO)活性升高,总酚含量降低。
参考文献
[1]中华人民共和国药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2010: 292.
[2]国家中医药管理局《中华本草》编委会.中华本草[M].上海:上海科学技术出版社.1998:929.
[3]付影,荣俊冬,陈礼光,等.植物组织培养中褐变问题研究进展[J].亚热带农业研究,2007,3(3):191-195.
[4]周瑞金,杜国强,师校欣,等.影响转基因苹果试管微嫁接苗成活的因子[J].果树学报,2007,24(3):215-217.
[5]周瑞金,杜国强,师校欣.标记基因nptⅡ在转基因苹果嫁接砧穂间无相互传导[J].园艺学报,2006,33(3):1329-1330
[6]梁称福,易诚,范适,等.菊花组培快繁技术研究[J].湖南环境生物职业技术学院学报,2006,12(3):242-244.
[7]陈佳灜,杜秀达,陈军,等.黄花蒿和菊花的组培嫁接成苗[J].植物生理学通讯,1999,35(5):206.
[8]薛建平,张爱明,盛玮,等.安徽药菊茎尖组织培养技术的研究[J].中国中药杂志,2002,27(5):350-360.
[9]董高峰,黄涛,李耿光,等.成年沙田树试管嫁接及微繁殖的研究[J].生态科学,2001,20(3):20-25.
[10]印芳,葛红,彭克勤,等.蝴蝶兰组培褐变与酚酸类物质及相关酶活性的关系[J]. 中国农业科学, 2008, 41(7): 2197-2203.
[11]徐辉艳,孙晓东,张佩君,等.红枣汁中总酚含量的福林法测定[J]. 食品研究与开发, 2009, 30(3): 126-128.
[12]Pastrana-BonillaE,AkohCC,SellappanS,etal.PhenoliccontentandantioxidantcapacityofMuscadinegrapes[J].JournalofAgriculturalandFoodChemistry, 2003, 51(18): 5497-5503.
[13]赵滢,杨树华,葛维亚,等.蝴蝶兰外植体酚类物质和活性氧代谢与组培褐变的关系[J].园艺学报,2010,37(6):963-970.
[14]付宏岐,辛梅,宋金东,等.红花茎尖微嫁接技术研究[J].人参研究,2012(4):29-31.
[15]姚洪军,罗晓芳,田砚亭.植物组织培养外植体褐变的研究进展[J].北京林业大学学报,1999, 21(3): 78-84.
[16]程双,胡文忠,马跃,等.鲜切果蔬酶促褐变发生机理的研究[J].食品工业科技,2010,31(1):74-80.
[17]刘玲玲.植物组织培养中外植体发生褐变的原因及防止措施[J].喀什师范学院学报,2011,32(3):44-46.
[18]符真珠,陈静,徐盼盼,等.牡丹组培褐变与总酚含量及相关酶活性的关系[J].西北林学院,2011,26(6):66-69.
[19]许传俊,李玲.蝴蝶兰外植体褐变发生与总酚含量、PPO、POD和PAL的关系[J].园艺学报,2006,33(3):671-674.
[20]陈健敏,黄玉凤,祝柳琴,等.四种易褐变果蔬多酚氧化酶的性质比较[J].莆田学院学报,2015, 22(5):23-27.
[21]张锐,郎春田,陈玉成,等.沙棘复合饮料在贮藏中非酶褐变机理研究[J].食品研究与开发, 2015,36(6):105-109.
[22]魏敏.鲜切苹果酶促褐变底物研究[J].现代园艺,2015, 8(15):5-6.
(编辑:马荣博)
Studyonphysiologicalmechanismofbrowningin vitrograftingofDendranthema morifolium (Ramat.)Tzvel‘Boju’cv.Nov.
JiWei1,WangRui1,DiJuan1,LiuRongchen1,LuoYaoxing1,RuHuiling2,YangZhongyi1*
(1. College of Horticulture, Shanxi Agricultural University, Taigu 030801, China; 2.Shanxi Academy of Agricultural Science Institute of fruit trees, Taigu 030800, China)
Abstract:[Objective]To reveal the mechanism of browning in the process of micro-graft in vitro in Dendranthema morifolium (Ramat.) Tzvel ‘Boju’cv.Nov. [Methods]The Dendranthema morifolium (Ramat.) Tzvel ‘Boju’cv.Nov. was used as explant, and the total phenolic content, polyphenol oxidase activity and browning index of in vitro browned grafts were detected by Folin Method and Polyphenol oxidase Method. [Results]The results showed that with the increasing of browning series, the browning situation was more serious. The browning ratio of series 4(89.7%) was significantly greater than other browning series. The greater the browning series was, the total phenolic content was decreasing, meanwhile the polyphenol oxidase activity in the in vitro grafts was increased. There was a linear negative correlation between the browning series and the explant total phenolic content, and there was a linear positive correlation between the browning series and the polyphenol oxidase activity. [Conclusion]This study providing the theory basis for increasing the efficiency of Dendranthema morifolium (Ramat.) Tzvel ‘Boju’cv.Nov. in vitro grafts.
Key words:Chrysanthemum; Micro-graft in vitro; Browning
收稿日期:2016-05-12 修回日期:2016-06-05
作者简介:纪薇(1983-),女(汉),陕西三原人,博士,副教授,研究方向:植物组织培养与生物技术育种 *通讯作者:杨忠义,副教授,博士,硕士生导师。Tel:13935406903;E-mail:yang_zhongyi092@163.com
基金项目:山西省科技基础条件平台建设项目(201509016);国家自然科学基金(31401834);山西农业大学青年拔尖创新人才支持计划(TYIT201401)
中图分类号:S682.31
文献标识码:A
文章编号:1671-8151(2016)07-0489-06

