非高血压人群维生素D和甲状旁腺激素与血压的关系
朱德才,马龙洲,麦一峰
·论著·
非高血压人群维生素D和甲状旁腺激素与血压的关系
朱德才,马龙洲,麦一峰
315000 浙江省宁波市,宁波大学医学院附属医院心内科
【摘要】目的探讨非高血压人群维生素D和甲状旁腺激素与血压的关系。方法选择2011年3月—2012年8月宁波大学医学院附属医院体检中心参加健康体检的非高血压成年人271例为研究对象。采用酶联免疫吸附试验(ELISA)法测定血清25羟维生素D〔25(OH)D〕水平,电化学发光免疫测定(ECLIA)法测定血清全段甲状房腺激素(iPTH)水平。按照血清25(OH)D水平四分位数将受试者分为4组,即1~16 μg/L组(65例)、17~25 μg/L组(68例)、26~34 μg/L组(66例)、35~65 μg/L组(72例)。按照血清iPTH水平四分位数将受试者分为4组,即7.8~34.1 ng/L组(65例)、34.2~48.4 ng/L组(70例)、48.5~60.2 ng/L组(65例)、60.3~109.2 ng/L组(71例)。比较各组受试者年龄、性别、收缩压(SBP)、舒张压(DBP)、高血压前期患病率(preHBP)、生化常规〔包含总胆红素(TBIL)、清蛋白(ALB)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(γGT)、血尿素氮(BUN)、肌酐(Cr)、血尿酸(BUA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)〕和25(OH)D或iPTH。结果不同25(OH)D水平组间年龄、SBP、DBP、preHBP、ALB、ALT、Cr、TC、LDL-C、iPTH比较,差异有统计学意义(P<0.05)。不同iPTH水平组间年龄、DBP、ALB、25(OH)D比较,差异有统计学意义(P<0.05)。25(OH)D水平与年龄、SBP、DBP、preHBP、γGT、BUA、TC、LDL-C、iPTH呈负相关(P<0.05)。iPTH水平与年龄、DBP、preHBP 、TC呈正相关(P<0.05)。简单线性回归分析结果显示,25(OH)D水平与SBP、DBP之间存在线性依存关系(P<0.05);iPTH水平与DBP之间存在线性依存关系(P<0.05)。多元线性回归分析结果显示,在逐渐调整并增加混杂因素后,25(OH)D与血压水平之间依存程度并无明显变化,随着25(OH)D水平的升高,SBP、DBP水平逐渐降低,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响(P<0.05);在逐渐调整并增加混杂因素后,iPTH水平与DBP之间依存程度并无明显变化,随着iPTH水平的升高,DBP水平亦逐渐升高,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响(P<0.05)。结论低25(OH)D水平和高iPTH水平可能是高血压的危险因素。
【关键词】维生素D;甲状旁腺素;血压
朱德才,马龙洲,麦一峰 .非高血压人群维生素D和甲状旁腺激素与血压的关系[J].中国全科医学,2016,19(18):2162-2168.[www.chinagp.net]
Zhu DC,Ma LZ,Mai YF.Relationship between vitamin D,parathyroid hormone and blood pressure of non-hypertensive population[J].Chinese General Practice,2016,19(18):2162-2168.
甲状旁腺激素(parathyroid hormone,PTH)是甲状旁腺主细胞合成和分泌的碱性单链多肽类激素,由84个氨基酸残基组成,其主要功能是调节体内钙和磷的代谢。维生素D不足可以通过升高PTH水平和扰乱钙离子稳态来促进高血压的发病[1],其甚至还涉及胰岛素抵抗、系统性炎性反应、肾素-血管紧张素系统的调节[2]。许多组织均表达维生素D受体,包括心肌组织、内皮组织、巨噬细胞等,研究已经证实,维生素D可以通过自分泌和旁分泌影响心血管健康[3]。但是,到目前为止,维生素D对人类高血压和心血管疾病的作用机制还不清楚。
从20世纪80年代至今,已经有大约30个有关维生素D、PTH与血压关系的横断面调查研究,其中包括第3次美国国家健康与营养调查(NHNES),虽然其结论不一致,但多数结论显示,低维生素D状态和高PTH状态可能成为高血压的独立危险因素[4]。但是,这些研究主要是针对白种人,针对黄种人尤其是中国人群的资料极少。本研究旨在通过测定中国非高血压人群的血清维生素D、PTH水平,分析其与血压的相关性,并探讨肝肾功能、血脂、血糖等生化状态对此相关性的影响,为高血压的防治提供新的思路。
1对象与方法
1.1研究对象选择2011年3月—2012年8月宁波大学医学院附属医院体检中心参加健康体检的非高血压成年人为研究对象。入选标准:(1)年龄20~49周岁;(2)从未接受过降糖、调脂、降压的药物治疗;(3)收缩压(SBP)<140 mm Hg(1 mm Hg=0.133 kPa)且舒张压(DBP)<90 mm Hg;(4)体检项目中包含生化常规(肝功能、肾功能、血脂、空腹血糖)。对于符合入选标准的300例受试者,将其年龄、性别、血压、生化常规结果资料录入数据库。在最后进行的血清维生素D和PTH检测中,发现有29例血清样本不符合检测要求,予以剔除,最终共纳入271例受试者。其中男130例(48.0%),女141例(52.0%);平均年龄34.3岁,其中20~29周岁96例(35.4%),30~39周岁94例(34.7%),40~49周岁81例(29.9%)。
1.2方法
1.2.125羟维生素D〔25(OH)D〕和全段甲状旁腺激素(iPTH)的测定采集受试者清晨7:00~8:00空腹肘静脉血5 ml,2 000 r/min离心20 min(离心半径3 cm),取上清液,放入-50 ℃低温冰箱保存。25(OH)D采用酶联免疫吸附试验(ELISA)法,由美国伯乐680酶标仪测定;iPTH采用电化学发光免疫测定(ECLIA)法,由罗氏Cobas e601模块式免疫分析仪测定。批间变异系数10%~12%。全套仪器、试剂、实验室均由宁波美康医学检验中心提供。
1.2.2分组及观察指标按照血清25(OH)D水平四分位数将受试者分为4组,即1~16 μg/L组(65例)、17~25 μg/L组(68例)、26~34 μg/L组(66例)、35~65 μg/L组(72例)。按照血清iPTH水平四分位数将受试者分为4组,即7.8~34.1 ng/L组(65例)、34.2~48.4 ng/L组(70例)、48.5~60.2 ng/L组(65例)、60.3~109.2 ng/L组(71例)。比较各组受试者年龄、性别、SBP、DBP、高血压前期患病率(preHBP)、生化常规〔包含总胆红素(TBIL)、清蛋白(ALB)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰转移酶(γGT)、血尿素氮(BUN)、肌酐(Cr)、血尿酸(BUA)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、空腹血糖(FPG)〕和25(OH)D或iPTH。

2结果
2.1观察指标比较
2.1.1不同25(OH)D水平组间观察指标比较受试者血清25(OH)D水平为1~65 μg/L,平均(26.8±11.9)μg/L。不同25(OH)D水平组间年龄、SBP、DBP、preHBP、ALB、ALT、Cr、TC、LDL-C、iPTH比较,差异有统计学意义(P<0.05);不同25(OH)D水平组间性别、TBIL、γGT、BUN、BUA、TG、HDL-C、FPG比较,差异无统计学意义(P>0.05,见表1)。
2.1.2不同iPTH水平组间观察指标比较受试者血清iPTH水平为7.8~109.2 ng/L,平均(48.5±21.0)ng/L,根据P-P图可认为符合正态分布。不同iPTH水平组间年龄、DBP、ALB、25(OH)D比较,差异有统计学意义(P<0.05);不同iPTH水平组间性别、SBP、preHBP、TBIL、ALT、γGT、BUN、Cr、BUA、TC、TG、HDL-C、LDL-C、FPG比较,差异无统计学意义(P>0.05,见表2)。
2.2相关性分析25(OH)D水平与年龄、SBP、DBP、preHBP、γGT、BUA、TC、LDL-C、iPTH呈负相关(P<0.05),与性别、TBIL、ALB、ALT、BUN、Cr、TG、HDL-C、FPG无直线相关关系(P>0.05,见表3)。iPTH水平与年龄、DBP、preHBP 、TC呈正相关(P<0.05),与性别、SBP、TBIL、ALB、ALT、γGT、BUN、Cr、BUA、TG、HDL-C、LDL-C、FPG无直线相关关系(P>0.05,见表4)。
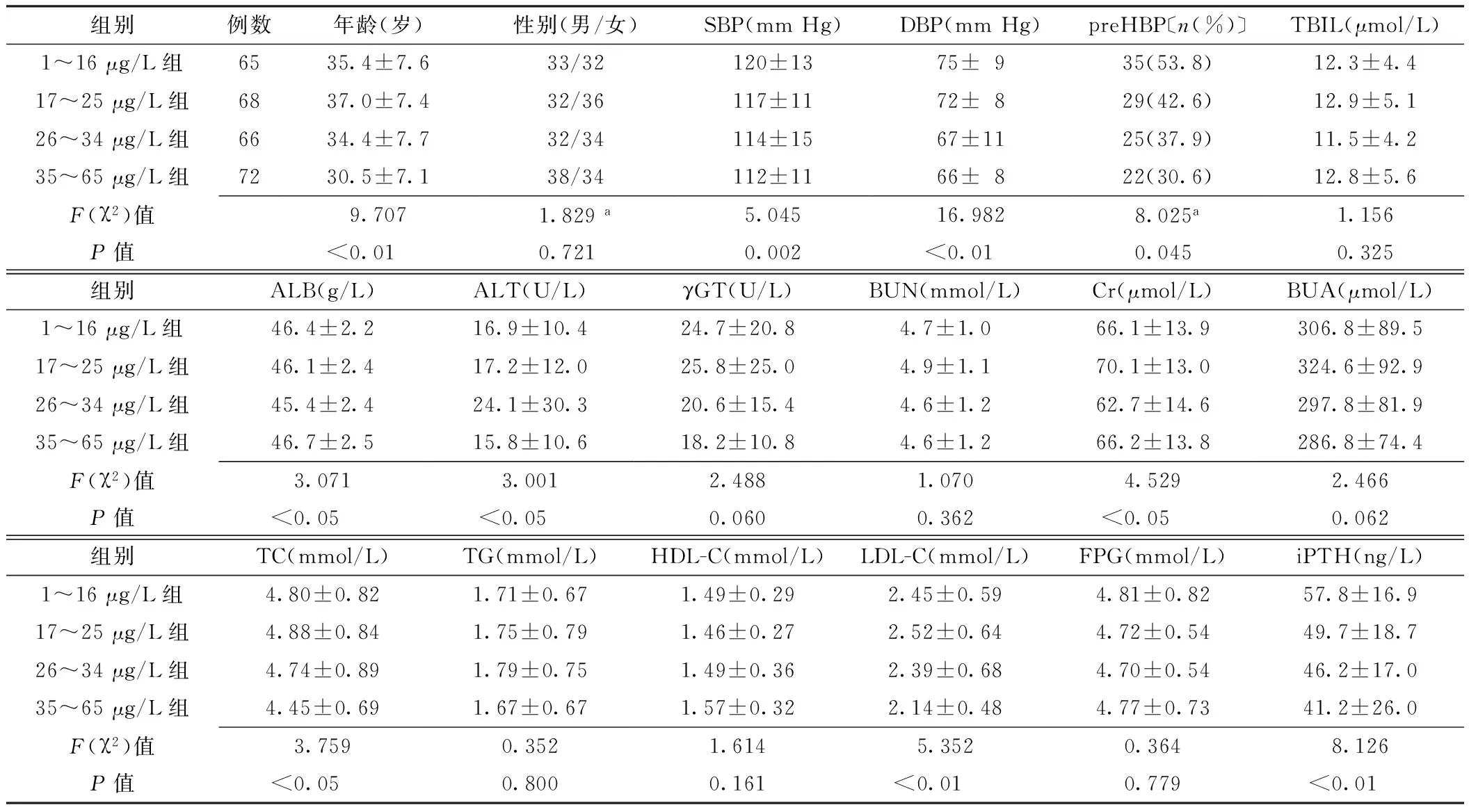
表1 不同25(OH)D水平组间观察指标比较
注:a为χ2值;SBP=收缩压,DBP=舒张压,preHBP=高血压前期患病率,TBIL=总胆红素,ALB= 清蛋白,ALT=丙氨酸氨基转移酶,γGT=γ-谷氨酰转移酶,BUN=血尿素氮,Cr=肌酐,BUA=血尿酸,TC=总胆固醇,TG=三酰甘油,HDL-C=高密度脂蛋白胆固醇,LDL-C=低密度脂蛋白胆固醇,FPG=空腹血糖,iPTH=全段甲状旁腺激素
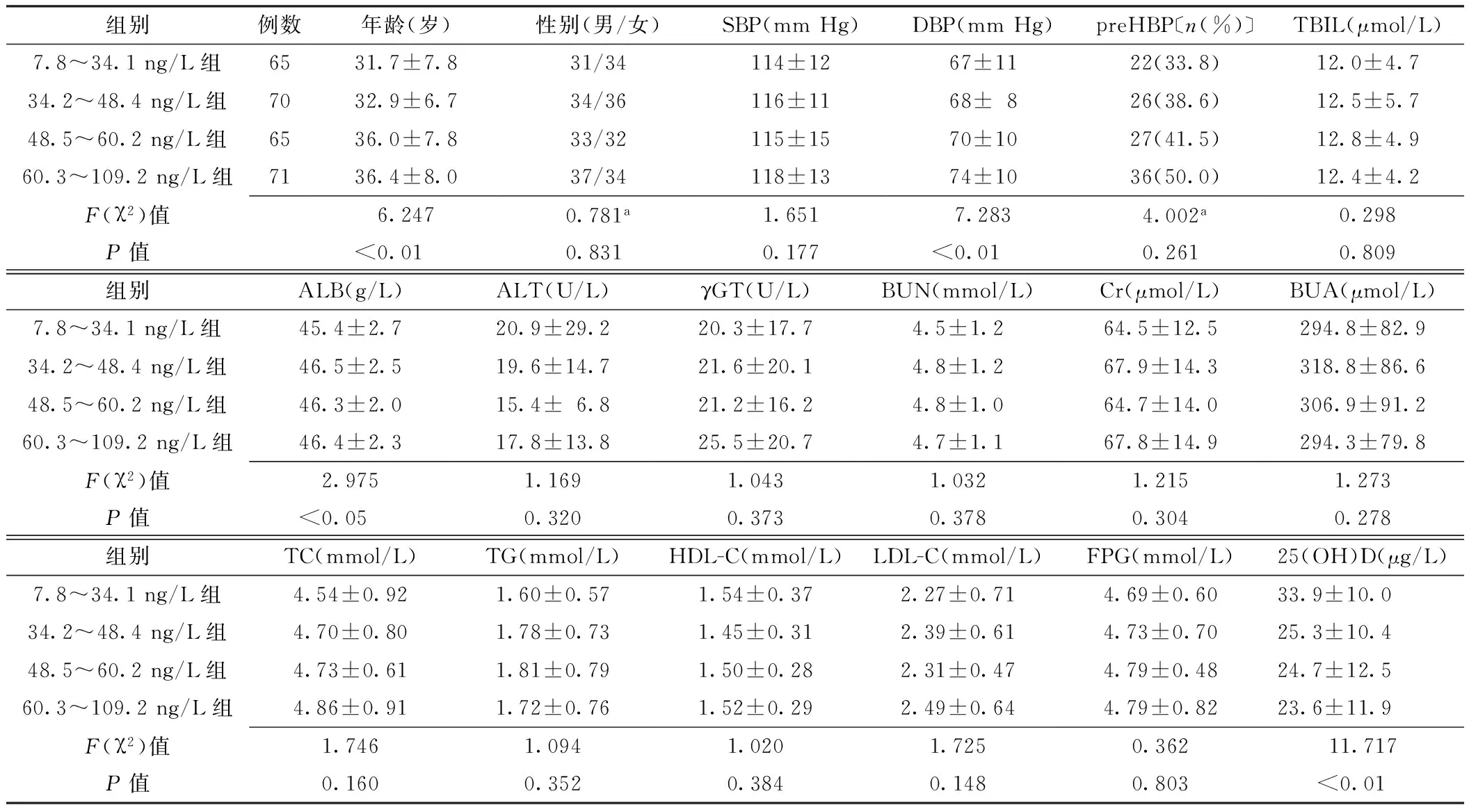
表2 不同iPTH水平组间观察指标比较
注:a为χ2值;25(OH)D=25羟维生素D
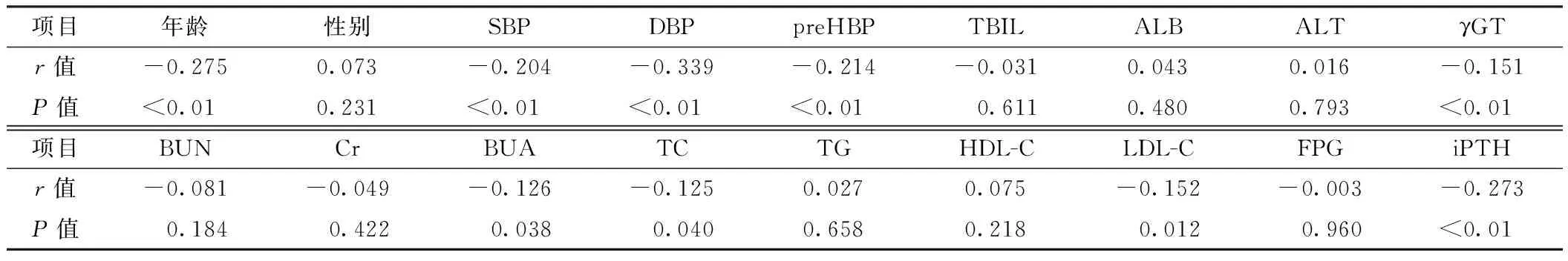
表3 25(OH)D水平与各指标之间的相关性

表4 iPTH水平与各指标之间的相关性
2.3回归分析
2.3.125(OH)D水平与血压的回归分析以25(OH)D水平为因变量,SBP、DBP为自变量,进行简单线性回归分析,结果显示,25(OH)D水平与SBP、DBP之间存在线性依存关系(P<0.05)。为研究各混杂因素对25(OH)D水平与SBP、DBP之间依存关系的影响,在简单线性回归模型中依次逐渐加入肝功能(TBIL、ALB、ALT、γGT)、肾功能(BUN、Cr、BUA)、血脂(TC、TG、HDL-C、LDL-C)、血糖(FPG)、年龄及性别等混杂因素,共6个线性回归模型。结果显示,在逐渐调整并增加混杂因素后,25(OH)D水平与血压之间依存程度并无明显变化,随着25(OH)D水平的升高,SBP、DBP逐渐降低,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响(P<0.05,见表5、6)。
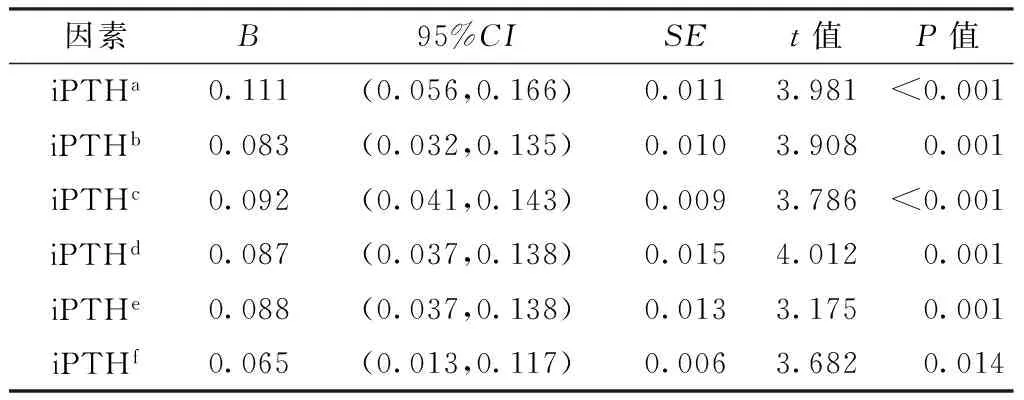
2.3.2iPTH水平与血压的回归分析以iPTH水平为因变量,SBP、DBP为自变量,进行简单线性回归分析,结果显示,iPTH水平与SBP之间无线性依存关系(P>0.05,见表7),iPTH水平与DBP之间存在线性依存关系(P<0.05,见表8)。为研究各混杂因素对iPTH水平与SBP、DBP之间依存关系的影响,在简单线性回归模型中依次逐渐加入肝功能、肾功能、血脂、血糖、年龄及性别等混杂因素,共6个线性回归模型。结果显示,在逐渐调整并增加混杂因素后,iPTH水平与DBP之间依存程度并无明显变化,随着iPTH水平的升高,DBP水平亦逐渐升高,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响(P<0.05,见表8)。
表525(OH)D水平与SBP的线性回归模型
Table 5Linear regression model of the relation between 25(OH)D level and SBP

因素B95%CISEt值P值25(OH)Da-0.220(-0.347,-0.093)0.0123.3270.00125(OH)Db-0.176(-0.293,-0.059)0.0152.9950.00325(OH)Dc-0.167(-0.282,-0.052)0.0182.8300.00525(OH)Dd-0.181(-0.299,-0.064)0.0192.9270.00325(OH)De-0.186(-0.303,-0.068)0.0293.1200.00225(OH)Df-0.163(-0.283,-0.044)0.0362.6720.008
注:a表示模型1,其自变量为25(OH)D;b表示模型2,其自变量为25(OH)D+肝功能;c为模型3,其自变量为25(OH)D+肝功能+肾功能;d表示模型4,其自变量为25(OH)D+肝功能+肾功能+血脂;e表示模型5,其自变量为25(OH)D+肝功能+肾功能+血脂+血糖;f表示模型6,其自变量为25(OH)D+肝功能+肾功能+血脂+血糖+年龄及性别
表625(OH)D水平与DBP的线性回归模型
Table 6Linear regression model of the relation between 25(OH)D level and DBP
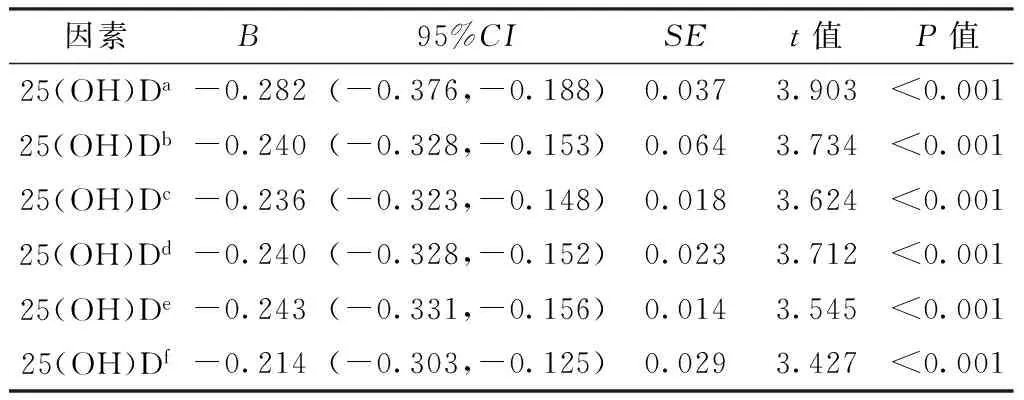
因素B95%CISEt值P值25(OH)Da-0.282(-0.376,-0.188)0.0373.903<0.00125(OH)Db-0.240(-0.328,-0.153)0.0643.734<0.00125(OH)Dc-0.236(-0.323,-0.148)0.0183.624<0.00125(OH)Dd-0.240(-0.328,-0.152)0.0233.712<0.00125(OH)De-0.243(-0.331,-0.156)0.0143.545<0.00125(OH)Df-0.214(-0.303,-0.125)0.0293.427<0.001
注:a表示模型1,其自变量为25(OH)D;b表示模型2,其自变量为25(OH)D+肝功能;c为模型3,其自变量为25(OH)D+肝功能+肾功能;d表示模型4,其自变量为25(OH)D+肝功能+肾功能+血脂;e表示模型5,其自变量为25(OH)D+肝功能+肾功能+血脂+血糖;f表示模型6,其自变量为25(OH)D+肝功能+肾功能+血脂+血糖+年龄及性别
表7iPTH水平与SBP的线性回归模型
Table 7Linear regression model of the relation between iPTH level and SBP

因素B95%CISEt值P值iPTHa0.060(0.104,0.134)0.0391.7680.109iPTHb0.027(0.040,0.095)0.0241.6530.420iPTHc0.040(0.026,0.106)0.0391.5620.238iPTHd0.042(0.025,0.108)0.0271.7810.218iPTHe0.043(0.024,0.109)0.0120.9810.207iPTHf0.021(0.047,0.090)0.0321.2130.543
注:a表示模型1,其自变量为iPTH;b表示模型2,其自变量为iPTH+肝功能;c为模型3,其自变量为iPTH+肝功能+肾功能;d表示模型4,其自变量为iPTH+肝功能+肾功能+血脂;e表示模型5,其自变量为iPTH+肝功能+肾功能+血脂+血糖;f表示模型6,其自变量为iPTH+肝功能+肾功能+血脂+血糖+年龄及性别
表8iPTH水平与DBP的线性回归模型
Table 8Linear regression model of the relation between iPTH level and DBP
因素B95%CISEt值P值iPTHa0.111(0.056,0.166)0.0113.981<0.001iPTHb0.083(0.032,0.135)0.0103.9080.001iPTHc0.092(0.041,0.143)0.0093.786<0.001iPTHd0.087(0.037,0.138)0.0154.0120.001iPTHe0.088(0.037,0.138)0.0133.1750.001iPTHf0.065(0.013,0.117)0.0063.6820.014
注:a表示模型1,其自变量为iPTH;b表示模型2,其自变量为iPTH+肝功能;c为模型3,其自变量为iPTH+肝功能+肾功能;d表示模型4,其自变量为iPTH+肝功能+肾功能+血脂;e表示模型5,其自变量为iPTH+肝功能+肾功能+血脂+血糖;f表示模型6,其自变量为iPTH+肝功能+肾功能+血脂+血糖+年龄及性别
3讨论
原发性高血压是一种典型的多因素、多基因疾病。近年来,不断有证据指出维生素D对血压有重要影响[4]。动物实验证实,循环中的活性维生素D可以抑制球旁细胞的肾素表达和血管平滑肌细胞的增殖[5]。而经喂食补充维生素D可以降低高血压大鼠的血压[6-7]。在临床研究中,横断面调查显示,低维生素D摄取(<400 U/d)和血压升高有关[8]。一项针对老年女性群体进行的干预研究发现,同时补充钙和维生素D的降压效果比单独补充钙强[9]。维生素D也被认为是肾素合成的强力抑制因子,从而对肾素-血管紧张素系统起到负性调节作用[10]。维生素D是通过与维生素D受体(VDR)结合而发挥下游效应的。维生素D与VDR结合后,又与环磷酸腺苷(cAMP)反应元件结合蛋白(CREB)结合,从而抑制肾素表达[11]。因为CREB无法再与肾素转录基因上的位于启动子区域的cAMP反应元件结合,
所以无法刺激肾素基因转录。VDR是类固醇受体家族的成员,通过调控一系列不同的核内基因,介导了1,25-二羟维生素D的生理效应。动脉内皮和血管平滑肌细胞中亦存在VDR,VDR的基因多态性影响了心血管疾病的易感性[12]。编码VDR的基因组位于12号染色体短臂[13],包含11个外显子[14],跨度约75 000个碱基对[15]。从VDR基因组中已经鉴定出很多存在多态性的基因,其中包括FOK Ⅰ基因。FOK Ⅰ基因是目前为止唯一得到证实的可以产生2种不同蛋白质产物的VDR基因型[16]。FOK Ⅰ基因型位于2号外显子5′端编码区,其通过用胸腺嘧啶(T)代替转录起始密码子中的胞嘧啶(C)来修改转录起始位点,从而产生2种长度不同的VDR,即VDR ff和VDR FF。VDR ff的转录起始位点位于第1个ATG,产生由427个氨基酸残基组成的全长VDR。而VDR FF的转录起始位点是第2个ATG,产生的VDR就少了3个氨基酸残基[17]。已有研究发现,FF基因型与高血压密切相关[18]。综合以上信息可以推断,若维生素D缺乏,与VDR结合的维生素D减少,被竞争性结合的CREB减少,对肾素转录的抑制作用就会减弱,进而肾素-血管紧张素系统激活,导致血压水平上升。本研究结果显示,25(OH)D水平与SBP、DBP呈负相关,随着25(OH)D水平的升高,SBP、DBP水平逐渐降低,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响。
PTH的经典作用是维持内环境中钙和磷的稳态。但是PTH受体基因的mRNA广泛分布于各种器官组织,包括脑、肾上腺、血管平滑肌细胞和血管内皮[19]。有研究提示,PTH在高血压的发展中起到重要作用[20]。静脉注射PTH对人血压的影响还不明确,有部分研究报道,其可以升高血压[21]。已有研究报道,PTH可以刺激人体和大鼠离体肾脏的肾素释放,这增加了PTH通过激活肾素-血管紧张素系统升高血压的可能性[22]。也有可能是PTH直接作用于血管而升高血压。虽然对血管平滑肌细胞上PTH/PTH相关肽受体的急性激活可以导致血管舒张[23-27],但是PTH可以刺激血管平滑肌细胞产生参与硬化的因子(包括胶原和β1整合素)[28]。此外,PTH诱导内皮细胞表达导致内皮细胞功能障碍的因子,如内皮素1和白介素6。在一项研究中,对4例健康志愿者连续静脉注射PTH1-34(PTH氨基末端片段,有生物活性)12 d造成持续性高血压,但是经过4~8 d后血压又恢复到原来水平[20]。短期注射PTH对血压的影响结果不一。在一项纳入10例研究对象的双盲交叉研究中,静脉注射PTH 2 h组与注射安慰剂的对照组相比,平均动脉压从84 mm Hg升高到88 mm Hg[20]。而在另一项研究中,观察者同时对20例研究对象注射PTH1-34,同时使用膜片钳技术使钙离子浓度保持在一个恒定的水平,没有发现血压升高[21]。研究数据提示,PTH刺激肾素释放,PTH1-34和PTH相关蛋白均能增加大鼠离体肾的肾素分泌[23]。另一项研究中,对10例健康志愿者静脉注射PTH1-34维持2 h,血浆肾素活性升高26%,血浆醛固酮活性升高48%[24]。现今的实验可以使钙离子浓度保持在一恒定的水平,那么PTH也有可能长期直接作用于血管壁本身导致血压升高[29]。一项针对1 205例阿姆斯特丹人的横断面调查研究发现,较高的PTH水平与较高的SBP和DBP密切相关,在调整了性别、年龄、体力活动量、吸烟、饮酒、腰围之后,最高PTH水平四分位组相对于最低水平PTH四分位组的高血压患病优势比为2.00〔95%CI=(1.31,3.06)〕[22]。一项针对1 784例挪威人进行的调查研究也发现,最高PTH水平四分位组相对于最低PTH水平四分位组的SBP平均高出3.5 mm Hg[1]。本研究结果显示,iPTH水平与DBP呈正相关,随着iPTH水平的升高,DBP水平亦逐渐升高,并且这一趋势不受肝功能、肾功能、血脂、血糖、年龄及性别的影响,与上述研究结果基本一致。
本研究存在一些不足,如样本量有限,其他混杂因素对血清25(OH)D、iPTH水平和SBP、DBP之间相关性的影响尚存在不确定性,需要进一步探讨。
综上所述,在非高血压人群中,25(OH)D水平和iPTH水平均和血压密切相关。低25(OH)D水平和高iPTH水平可能是高血压的危险因素。
作者贡献:朱德才、马龙洲进行试验设计与实施、资料收集整理、撰写论文、成文并对文章负责;麦一峰进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Jorde R,Svartberg J,Sundsfjord J.Serum parathyroid hormone as a predictor of increase in systolic blood pressure in men[J].J Hypertens,2005,23(9):1639-1644.
[2]Lee JH,O′Keefe JH,Bell D,et al.Vitamin D deficiency an important,common,and easily treatable cardiovascular risk factor?[J].J Am Coll Cardiol,2008,52(24):1949-1956.
[3]Prentice A,Goldberg GR,Schoenmakers I.Vitamin D across the lifecycle:physiology and biomarkers[J].Am J Clin Nutr,2008,88(2):500S-506S.
[4]胡文革,肖艳敏.维生素D水平与高血压病的相关性探讨[J].中国医药指南,2014,12(24):256-257.
[5]Carthy EP,Yamashita W,Hsu A,et al.1,25-Dihydroxyvitamin D3and rat vascular smooth muscle cell growth[J].Hypertension,1989,13(6 Pt 2):954-959.
[6]Borges AC,Feres T,Vianna LM,et al.Recovery of impaired K+channels in mesenteric arteries from spontaneously hypertensive rats by prolonged treatment with cholecalciferol[J].Br J Pharmacol,1999,127(3):772-778.
[7]Feres T,Vianna LM,Paiva AC,et al.Effect of treatment with vitamin D3on the responses of the duodenum of spontaneously hypertensive rats to bradykinin and to potassium[J].Br J Pharmacol,1992,105(4):881-884.
[8]Sowers MR,Wallace RB,Lemke JH.The association of intakes of vitamin D and calcium with blood pressure among women[J].Am J Clin Nutr,1985,42(1):135-142.
[9]Pfeifer M,Begerow B,Minne HW,et al.Effects of a short-term vitamin D(3) and calcium supplementation on blood pressure and parathyroid hormone levels in elderly women[J].J Clin Endocrinol Metab,2001,86(4):1633-1637.
[10]Li YC,Qiao G,Uskokovic M,et al.Vitamin D:a negative endocrine regulator of the renin-angiotensin system and blood pressure[J].J Steroid Biochem Mol Biol,2004,89-90(1/5):387-392.
[11]Yuan W,Pan W,Kong J,et al.1,25-dihydroxyvitamin D3suppresses renin gene transcription by blocking the activity of the cyclic AMP response element in the renin gene promoter[J].J Biol Chem,2007,282(41):29821-29830.
[12]Van Schooten FJ,Hirvonen A,Maas LM,et al.Putative susceptibility markers of coronary artery disease:association between VDR genotype,smoking,and aromatic DNA adduct levels in human right atrial tissue[J].FASEB J,1998,12(13):1409-1417.
[13]Taymans SE,Pack S,Pak E,et al.The human vitamin D receptor gene(VDR) is localized to region 12cen-q12 by fluorescent in situ hybridization and radiation hybrid mapping:genetic and physical VDR map[J].J Bone Miner Res,1999,14(7):1163-1166.
[14]Crofts LA,Hancock MS,Morrison NA,et al.Multiple promoters direct the tissue-specific expression of novel N-terminal variant human vitamin D receptor gene transcripts[J].Proc Natl Acad Sci USA,1998,95(18):10529-10534.
[15]Miyamoto K,Kesterson RA,Yamamoto H,et al.Structural organization of the human vitamin D receptor chromosomal gene and its promoter[J].Mol Endocrinol,1997,11(8):1165-1179.
[16]Xia Z,Hu YZ,Zhang HH,et al.Association of vitamin D receptor Fok I and Bsm I polymorphisms with dyslipidemias in elderly male patients with type 2 diabetes[J].Journal of Southern Medical University,2014,34(11):1562-1568.(in Chinese)
夏征,胡亚卓,张红红,等.维生素D受体基因FokⅠ及BsmⅠ多态性与老年男性2型糖尿病脂代谢异常的相关性[J].南方医科大学学报,2014,34(11):1562-1568.
[17]Whitfield GK,Remus LS,Jurutka PW,et al.Functionally relevant polymorphisms in the human nuclear vitamin D receptor gene[J].Mol Cell Endocrinol,2001,177(1/2):145-159.
[18]Swapna N,Vamsi UM,Usha G,et al.Risk conferred by FokI polymorphism of vitamin D receptor(VDR) gene for essential hypertension[J].Indian J Hum Genet,2011,17(3):201-206.
[19]Isales CM,Sumpio B,Bollag RJ,et al.Functional parathyroid hormone receptors are present in an umbilical vein endothelial cell line[J].Am J Physiol Endocrinol Metab,2000,279(3):E654-662.
[21]Oshima T,Young EW.Systemic and cellular calcium metabolism and hypertension[J].Semin Nephrol,1995,15(6):496-503.
[22]Fliser D,Franek E,Fode P,et al.Subacute infusion of physiological doses of parathyroid hormone raises blood pressure in humans[J].Nephrol Dial Transplant,1997,12(5):933-938.
[23]Grant FD,Mandel SJ,Brown EM,et al.Interrelationships between the renin-angiotensin-aldosterone and calcium homeostatic systems[J].J Clin Endocrinol Metab,1992,75(4):988-992.
[24]Helwig JJ,Musso MJ,Judes C,et al.Parathyroid hormone and calcium:interactions in the control of renin secretion in the isolated,nonfiltering rat kidney[J].Endocrinology,1991,129(3):1233-1242.
[25]Saussine C,Judes C,Massfelder T,et al.Stimulatory action of parathyroid hormone on renin secretion in vitro:a study using isolated rat kidney,isolated rabbit glomeruli and superfused dispersed rat juxtaglomerular cells[J].Clin Sci(Lond),1993,84(1):11-19.
[26]Crass MF 3rd,Brewer KS.Vasorelaxant effect of parathyroid hormone on isolated segments of porcine coronary artery[J].Artery,1988,15(2):61-70.
[27]Nickols GA,Metz MA,Cline WH Jr.Endothelium-independent linkage of parathyroid hormone receptors of rat vascular tissue with increased adenosine 3′,5′-monophosphate and relaxation of vascular smooth muscle[J].Endocrinology,1986,119(1):349-356.
[28]Pang PK,Yang MC,Sham JS.Parathyroid hormone and calcium entry blockade in a vascular tissue[J].Life Sci,1988,42(14):1395-1400.
[29]Wu S,Nie L,Xu R,et al.Serum level of parathyroid hormone in elderly isolated systolic hypertension and its relationship with blood pressure and aortic stiffness[J].Chinese Journal of Hypertension,2014,22(4):360-364.(in Chinese)
邬甦,聂磊,徐荣,等.老年单纯收缩期高血压患者血清甲状旁腺激素水平及其与血压、大动脉僵硬度的相关性[J].中华高血压杂志,2014,22(4):360-364.
(本文编辑:崔丽红)
Relationship Between Vitamin D,Parathyroid Hormone and Blood Pressure of Non-hypertensive Population
ZHUDe-cai,MALong-zhou,MAIYi-feng.
DepartmetnofCardiology,theAffiliatedHospitalofSchoolofMedicineofNingboUniversity,Ningbo315000,China
【Abstract】ObjectiveTo explore the relationship between vitamin D,parathyroid hormone and blood pressure of non-hypertensive population.Methods271 non-hypertensive adults who received physical examination in the physical examination center of the Affiliated Hospital of School of Medicine of Ningbo University from March 2011 to August 2012 were enrolled in the study.ELISA method was used to determine serum 25(OH)D level and ECLIA method was used to examine serum iPTH level.According to the quartiles of serum 25(OH)D level,the subjects were divided into four groups:1-16 μg/L group(n=65),17-25 μg/L group(n=68),26-34 μg/L group(n=66) and 35-65 μg/L group(n=72).According to the quartiles of serum iPTH level,the subjects were divided into four groups:7.8-34.1 ng/L group(n=65),34.2-48.4 ng/L group(n=70),48.5-60.2 ng/L group(n=65) and 60.3-109.2 ng/L group(n=71).Comparison was made among the groups in age,gender,SBP,DBP,preHBP,biochemical indicators(TBIL,ALB,ALT,γGT,BUN,Cr,BUA,TC,TG,HDL-C,LDL-C and FPG) and 25(OH)D or iPTH.ResultsGroups with different 25(OH)D levels were significantly different in age,SBP,DBP,preHBP,ALB,ALT,Cr,TC,LDL-C and iPTH (P<0.05).Groups with different iPTH levels were significantly different in age,DBP,ALB and 25(OH)D(P<0.05).There was negative correlation between 25(OH)D and age, SBP, DBP, preHBP, γGT, BUA, TC, LDL-C, iPTH(P<0.05).There was positive correlation between iPTH level and age,DBP,preHBP and TC(P<0.05).Simple linear regression analyses showed that with 25(OH)D level had linear dependence relation SBP and DBP(P<0.05) and iPTH level had linear dependence relation with DBP(P<0.05).Multiple linear regression analyses showed that,after the adjustment and the addition of confounding factors,there was no evident change in the linear dependence relation between 25(OH)D level and blood pressure,and with the rising of 25(OH)D level,SBP and DBP decreased,a trend which was not influenced by liver function,renal function,blood lipid,blood glucose,age and gender(P<0.05);after the adjustment and the addition of confounding factors,there was no evident change in the linear dependence relation between iPTH level and DBP,and with the rising of iPTH level,DBP decreased,a trend which was not influenced by liver function,renal function,blood lipid,blood glucose,age and gender(P<0.05).ConclusionLow 25(OH)D level and high iPTH level are potentially risk factors for hypertension.
【Key words】Vitamin D;Parathyroid hormone;Blood pressure
通信作者:朱德才,315000 浙江省宁波市,宁波大学医学院附属医院心内科;E-mail:ntzdc008@126.com
【中图分类号】R 346.5 R 347.3 R 443.5
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.18.010
(收稿日期:2015-01-30;修回日期:2015-05-13)

