基于抗体-适配子建立的高尔基体蛋白73检测方法的研究
洪建明,冼中任,曾林玉,徐 霞
(广州医科大学金域检验学院 510182)
基于抗体-适配子建立的高尔基体蛋白73检测方法的研究
洪建明,冼中任,曾林玉,徐霞
(广州医科大学金域检验学院510182)
目的建立基于抗体-适配子双夹心的高尔基体蛋白73(GP73)ELISA检测方法,并用于血清GP73的检测。方法以抗体-适配子双夹心的模式,通过正交试验和方阵滴定试验确定GP73特异性抗体和适配子最佳工作水平、反应的温度和时间等。以GP73 重组蛋白建立标准曲线并评价该方法灵敏度、精确度、线性及准确度等。利用该方法对59例对照组患者及77 例肝癌患者血清进行GP73水平检测,并同步进行电化学发光定量测定甲胎蛋白(AFP)水平。结果该方法标准曲线的批内变异系数(CV)为3.87%,批间CV平均为4.44%;平均回收率为95.8%,灵敏度达12.0 ng/mL。肝癌患者血清GP73水平均明显高于对照组、肝炎组和肝硬化组(P<0.05)。GP73对原发性肝癌诊断灵敏度为85.7%,而AFP为62.3%;而早期肝癌中GP73和AFP灵敏度分别为76.7%、36.7%。结论成功建立基于抗体-适配子夹心的GP73 ELISA 检测方法,该方法可用于临床检测GP73水平。
高尔基体蛋白73;适配子;酶联免疫吸附试验;肝癌
高尔基体蛋白73(GP73)是相对分子质量约为73×103的Ⅱ型跨膜糖蛋白,在健康人肝脏中表达甚微或不表达[1];但研究发现其在肝癌细胞中表达明显升高,GP73被认为是肝癌诊断的新型标志物[2]。近年来的研究更是表明,GP73诊断原发性肝癌的灵敏度可达77.0%~88.6%,明显优于甲胎蛋白(AFP)的40.0%~62.9%;特别是在AFP阴性原发性肝癌的诊断中GP73更具优势[3-5]。在以往的研究中,免疫印迹试验和ELISA两种方法最常用于GP73蛋白水平的检测。其中免疫印迹试验由于操作步骤繁多,且仅用蛋白水平半定量,无法在临床应用推广;ELISA中的单抗、多抗的制备时间周期长,过程复杂,纯度要求高,难以控制,且抗体的修饰困难,长期保存难等限制了其临床应用。适配子是指经筛选后得到能与靶分子特异性结合的核酸片段,适配子能够分辨出靶分子结构上细微的差别,甚至可以区分1个甲基或1个羟基的差别,具有高度特异性。而与抗体相比,适配子具有筛选周期短、可人工合成、方便修饰和保存、可重复利用等优势;迄今筛选到的凝血酶、茶碱、抗血管内皮因子等适配子已在诊断中彰显出广阔的应用前景[6]。因此本研究将获得的适配子用生物素标记作为检测分子,并以GP73 的特异性多克隆抗体为捕获分子,建立抗体-适配子双夹心 ELISA 方法,并应用于临床血清标本GP73 水平的检测。
1资料与方法
1.1一般资料选取广州医学院第一附属医院2011年3~11月的住院患者177 例为研究对象,其中肝癌患者77例,男59例,女18例,年龄23~82 岁,诊断以组织病理学为依据,肿瘤分期根据美国器官分配联合网络(UNOS)改良的TNM 分期进行,其中早期肝癌30例,包括T1期(单个肿块小于2 cm)和T2期(单个肿块直径为2~5 cm;或少于3个肿块,但每个肿块直径小于3 cm);肝硬化患者21例,其中男14例,女7例,年龄35~84 岁;肝炎患者20例,其中男15例,女5例,年龄0.3~80.0岁。另选择同期健康体检者59 例纳入对照组,排除消化道疾病及肿瘤患者,年龄24~87岁。
1.2仪器与试剂纯化的GP73 重组蛋白、GP73 特异性多克隆抗体由本课题组制备;生物素标记的GP73 适配子由本课题组前期制备与验证[7],并交上海Invitrogen公司合成和修饰(适配子序列专列号:ZL201210235952.2);辣根过氧化物酶标记的链霉亲和素购自美国Sigma公司;酶标板购自Greiner Bio-one Cellstar公司;全自动洗板机购自Bio Rad 公司;Elx800酶标仪为美国宝特公司产品;E170 电化学发光仪购自罗氏公司。
1.3方法
1.3.1抗体-适配子双夹心ELISA基本操作过程以0.05 mol/L pH9.6 Na2CO3-NaHCO3缓冲液稀释GP73 特异性多抗按试验设定浓度包被酶标板,4 ℃过夜;用含有 0.05%(v/v)吐温-20(Tween-20)的 PBS(PBST)洗涤3 次,拍干后加封闭液[2%牛血清清蛋白溶液(BSA)的PBST]封闭,4 ℃过夜;然后用PBST洗涤3次,按设定浓度每孔加入100 μL GP73 重组蛋白,均作复孔,酶标板在37 ℃孵育1 h后用PBST 洗涤3次,并拍干。按设计的方案在酶标孔中加入生物素标记的GP73适配子100 μL每孔,酶标板在37 ℃作用1 h 后用PBST洗涤3次,并拍干。加辣根过氧化物酶标记的链霉亲和素100 μL每孔,37 ℃作用1 h;PBST洗涤4次后,加底物四甲基联苯胺(TMB)100 μL每孔,37 ℃ 30 min;之后终止反应并在450 nm波长测定吸光度(OD)值。
1.3.2抗体-适配子双夹心ELISA法检测GP73 蛋白最适工作条件的确定(1)主要试剂工作浓度确立:将GP73 特异性多抗(5 mg/mL)包板设立了1∶500、1∶1 000、1∶2 000三个稀释度,GP73 蛋白稀释成200、100、50 ng/mL,Biotin 标志的GP73 适配子(30 μg/mL)及辣根过氧化物酶标记的链霉亲和素则设立了 1∶1 000、1∶2 000、1∶5 000三个工作浓度。选用四因素三水平的正交表设计各因素的交叉试验方案,筛选确定最佳工作浓度。(2)最适封闭液的选择:最佳工作浓度确定后,固定蛋白标准品的浓度,采用方阵试验测试不同封闭液(pH7.4 的含1%BSA 的PBST、pH7.4 的1% 脱脂奶粉及pH7.4 的含2%BSA的PBST)与稀释条件对结果的影响,根据标本与空白对照的差值,最终确定最适封闭液。
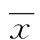
1.3.4精确度以标准曲线批内误差和批间误差来表示该方法的精确度。(1)批内误差:每一标准样品浓度做10次重复,以其批内变异系数(CV)表示批内误差。(2)批间误差:将GP73标准品各浓度平行测定10次,以其批间CV表示批间误差。
1.3.5回收试验于已知GP73浓度的正常混合血清标本(n=10)内各加入系列浓度的GP73(500、400、200 ng/mL),重复测定3次测定,计算回收率。
1.3.6血清标本GP73和AFP水平测定对59 例对照者、77 例肝癌患者、21 例肝硬化患者、20例肝炎患者进行血清GP73的测定(参照1.3.1中步骤),同时对59 例对照组患者及77 例肝癌患者血清用E170全自动电化学发光分析仪测定AFP水平。
2结果
2.1抗体-适配子双夹心ELISA检测GP73最佳工作浓度的确定经测试和对正交实验结果比较分析后发现,在检测系统中,采用5 μg/mL(稀释度为1∶1 000)浓度的GP73 特异性抗体包板、生物素标记的GP73 特异性适配子工作浓度为15 ng/mL(稀释度为1∶2 000),辣根过氧化物酶标记的链霉亲和素工作浓度为1∶2 000,获得的标本与空白对照之间的OD差值最大,见表1,因此初步确定了包板的GP73特异性抗体浓度为5 μg/mL(稀释度为1∶1 000)、生物素标记的GP73特异性适配子工作浓度为15 ng/mL(稀释度为1∶2 000),辣根过氧化物酶标记的链亲和素工作浓度为 1∶2 000。
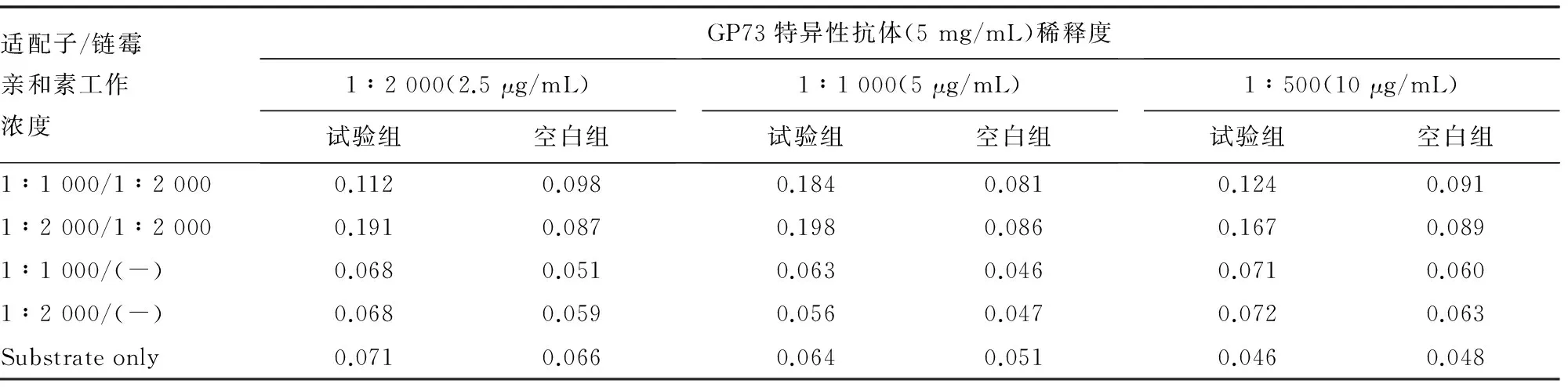
表1 GP73 夹心ELISA 检测系统的正交试验
注:试验组为在检测系统中加有 50 ng /mLGP73 蛋白,空白组未加蛋白标准品,其他条件同试验组。(-)表示未加链霉亲和素,Substrate only 表示仅加有底物而未加适配体和链霉亲和素。
2.2最佳封闭条件的确定在最适工作浓度下,采用方阵滴定试验,分别测试3种封闭液,结果发现含2%BSA的PBST作封闭液能明显减低系统的本底OD值而对蛋白标准品的影响不大,所产生的标本与空白对照之间的差值最大,见表1。因此,最终确定 GP73 双抗体夹心ELISA检测系统的最佳封闭液条件为pH7.4含2%BSA的PBST。
2.4抗体-适配子双夹心ELISA检测GP73方法的系统评价批内CV为3.87%(2.70%~4.90%),批间CV均值为4.44%(2.30%~6.40%);3个浓度点的回收率均值为95.8%(92.6%~102.1%),见表3。
2.5血清标本GP73和AFP水平测定77例肝癌患者GP73水平为(178.2±89.6)ng/mL,明显高于肝硬化患者的(68.7±18.5)ng/mL,肝炎患者的(33.8±10.3)ng/mL,以及对照组的(18.7±6.7)ng/mL(P<0.05)。肝癌患者血清AFP水平为(142.6±56.4)ng/mL,比对照组的(4.3±0.9)ng/mL,肝炎患者的(12.2±13.8)ng/mL及肝硬化患者的(16.9±22.3)ng/mL都明显升高(P<0.05)。但早期肝癌患者血清AFP水平为(13.8±9.3)ng/mL,与其他3组比较,差异均无统计学意义(P>0.05);而早期肝癌组血清GP73水平为(124.3±38.9)ng/mL,比肝硬化、肝炎患者,以及对照组都明显升高(P<0.05)。见表4。

表2 抗体-适配子双夹心 ELISA检测GP73方法的批内
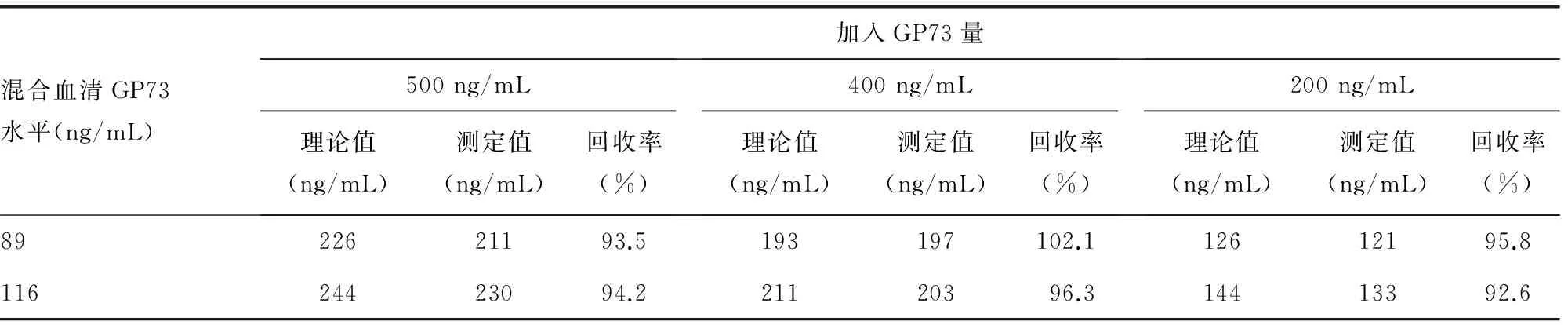
表3 回收率的测定
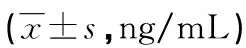
表4 各组受试者GP73、AFP表达水平
注:与肝癌组比较,*P<0.05;与早期肝癌组比较,#P<0.05。
2.6AFP与GP73的ROC曲线由ROC曲线计算GP73和AFP用于诊断肝细胞肝癌的临界值(Cut-off值)分别为59.6、18.2 μg/L;AFP对肝细胞肝癌的诊断灵敏度明显低于GP73(62.3%低于85.7%,P<0.05);早期原发性肝癌GP73的灵敏度为76.7%,AFP的灵敏度仅为36.7%。GP73曲线下面积为0.884,95%置信区间为0.834~0.934。AFP曲线下面积为0.776,95%置信区间为0.706~0.845。
3讨论
GP73又称Ⅱ型高尔基体膜蛋白,少量表达于人胆管上皮细胞,在肝细胞中几乎不表达,但在肝炎、肝硬化等疾病中GP73表达明显上调,特别是在原发性肝癌中[8-9]。目前,众多研究表明GP73作为新型原发性肝癌肿瘤标志物,其诊断特异度与灵敏度优于AFP,特别是在早期原发性肝癌中[10]。Shi等[11]研究显示原发性肝癌诊断中GP73灵敏度为68.5%,而AFP则仅为28.8%。2010年一项超过4 000例的大样本、多中心、多种族GP73系列相关研究结果显示,GP73诊断原发性肝癌的灵敏度及特异度分别达到了75%和97%,而AFP仅为58%和85%[12]。但Brker等[13]研究中GP73的灵敏度与特异度为60%和77%,均不及AFP的77%和96%。综合以上研究,除了各研究入选病例不同的影响外,主要由于目前并没有统一的GP73检测方法与严格精确的临界值,导致各研究间GP73灵敏度差异很大。
本试验利用GP73特异性多抗和适配子建立了检测GP73水平的方法,精密度与准确性均符合临床应用要求,灵敏度可达12.5 ng/mL,检测肝癌患者血清标本的GP73水平明显高于其他组(P<0.05),也验证了本方法的实用性。此外本试验中GP73用于原发性肝癌的诊断的灵敏度为85.7%,优于AFP的62.3%;两者ROC曲线下面积分别为0.884和0.776,据此推断GP73可考虑为原发性肝癌诊断指标。而在早期肝癌组(包括T1、T2期)血清GP73平均水平明显高于肝硬化组(P<0.05),而血清AFP在两组中差异无统计学意义(P>0.05);早期原发性肝癌患者检测GP73的灵敏度为76.7%,AFP灵敏度仅为36.7%;显示了GP73在早期诊断原发性肝癌中的优越性。此结果与Zhao等[14]研究在AFP阴性病例中GP73灵敏度达72%的结果相符。此后还需要开展肝癌患者的大样本研究,才能进一步明确肝癌患者各分期与阶段血清GP73水平的变化,以明确GP73在肝癌诊断中的应用价值。
本研究中建立了基于抗体-适配子检测GP73的方法,具有方便、快速、灵敏度和精确度高等特点,为GP73更广泛的应用于临床诊断奠定了基础;同时为适配子进一步用于临床诊断检测提供了依据。
[1]Kladney RD,Cui X,Bulla GA,et al.Expression of GP73,a resident Golgi membrane protein,in viral and nonviral liver disease[J].Hepatology,2002,35(6):1431-1440.
[2]Ba MC,Long H,Tang YQ,et al.GP73 expression and its significance in the diagnosis of hepatocellular carcinoma:a review[J].Int J Clin Exp Pathol,2012,5(9):874-881.
[3]XuWJ,GuoBL,HanYG,etal.Diagnostic
value of alpha-fetoprotein-L3 and Golgi protein 73 in hepatocellular carcinomas with low AFP levels[J].Tumour Biol,2014,35(12):12069-12074.
[4]Yang J,Li J,Dai W,et al.Golgi protein 73 as a biomarker for hepatocellular carcinoma:A diagnostic meta-analysis[J].Exp Ther Med,2015,9(4):1413-1420.
[5]Morota K,Nakagawa M,Sekiya R,et al.A comparative evaluation of Golgi protein-73,fucosylated hemopexin,alphafetoprotein,and PIVKA-Ⅱ in the serum of patients with chronic hepatitis,cirrhosis,and hepatocellular carcinoma[J].Clin Chem Lab Med,2011,49(4):711-718.
[6]Mingzhe L,Hiroshi J,Hiroshi A,et.al.In vitro selection of a photoresponsive RNA aptamer to hemin[J].Bioorg Med Chem Lett,2010,20(9):2964-2967.
[7]Du JC,Hong JM,Xu C,et al.Screening and identification of ssDNA aptamer for human GP73[J].Bio Med Res Int,2015,2015:610281.
[8]Iftikhar R,Kladney RD,Havlioglu N,et al.Disease-and cell-specific expression of GP73 in human liver disease[J].Am J Gastroenterol,2004,99(3):1087-1095.
[9]Block TM,Comunale MA,Lowman M,et al.Use of targeted glycoproteins to identify serum glycoproteins that correlated with liver cancer in woodchucks and humans[J].Proc Natl Acad Sci USA,2005,102(1):779-784.
[10]Hu JS,Wu DW,Liang S,et al.GP73,a resident Golgi glycoprotein,is sensibility and specificity for hepatocellular carcinoma of diagnosis in a hepatitis B-endemic Asian population[J].Med Oncol,2010,27(2):339-345.
[11]Shi Y,Chen J,Li L,et al.A study of diagnostic value of golgi protein GP73 and its genetic assay in primary hepatic carcinoma[J].Technol Cancer Res Treat,2011,10(3):287-294.
[12]Mao Y,Yang H,Xu H,et al.Golgi protein 73(GOLPH2)is a valuable serum marker for hepatocellular carcinoma[J].Gut Dec,2010,59(12):1687-1693.
[14]Zhao Y,Wang M,Cui C,et al.Significance of combined tests of serum golgi glycoprotein 73 and other biomarkers in diagnosis of small primary hepatocellular carcinoma[J].Cancer Biomark,2015,15(5):677-683.
Establishment of measuring GP73 by union of antibody and aptamer
HONGJianming,XIANZhongren,ZENGLinyu,XUXia
(KingMedCollegeofGuangzhouMedicalUniversity,Guangzhou,Guangdong510182,China)
ObjectiveTo establish and evaluate the method of measuring protein-GP73 by union of the specific polyclonal antibody and aptamer against GP73.MethodsBased on the model of antibody-sandwich,the optimal working concentration,reaction temperature and time were determined by orthogonal test and square titration test.The precision,linearity and accuracy of method were assessed.The levels of serum GP73 and alpha fetal protein(AFP)of 59 patients in control group and 77 patients with hepatocarcinoma were measured by antibody-aptamer ELISA and Electrochemical luminescence.ResultsThe standard curves(CV)of intra-assay and inter-assay were 3.87% and 4.44% respectively.The mean rate of callback was 95.8%,sensitive threshold was 12.0 ng/mL.The serum level of GP73 in hepatocarcinoma was significant higher than those in cirrhosis,hepatitis and control group(P<0.05).The level of GP73 in early hepatocarcinoma was significant higher than that in control group(P<0.05).The sensitivity of GP73 on diagnosis for hepatocarcinoma were 85.7%,while those of AFP were 62.3%.The sensitivity of GP73 and AFP on diagnosis for early liver cancer were 76.7% and 36.7%.ConclusionAntibody-aptamer sandwich GP73 ELISA detection method could be used for clinical detection of GP73 level.
GP73;aptamer;enzyme linked immunosorbent assay;liver cancer
2016-01-21修回日期:2016-03-23)
洪建明,男,检验主管技师,主要从事免疫检验研究。
10.3969/j.issn.1673-4130.2016.12.013
A
1673-4130(2016)12-1627-04
·论著·

