聚已内酯表面磷酸胆碱仿生改性的血液相容性研究*
何 浏,马宇皓,黄 磊,张松柏,陈元维,罗祥林,2
(1.四川大学 高分子科学与工程学院,成都 610065;2.四川大学 高分子材料工程国家重点实验室,成都 610065)
聚已内酯表面磷酸胆碱仿生改性的血液相容性研究*
何浏1,马宇皓1,黄磊1,张松柏1,陈元维1,罗祥林1,2
(1.四川大学 高分子科学与工程学院,成都 610065;2.四川大学 高分子材料工程国家重点实验室,成都 610065)
摘要:通过表面原子转移自由基聚合法(SI-ATRP)得到具有不同接枝密度的聚2-甲基丙烯酰氧乙基磷酰胆碱改性的聚己内酯薄片(PCL-g-PMPC)。用衰减全反射红外、扫描电镜及接触角直接或间接地证明表面接枝反应成功;并通过蛋白吸附、血小板粘附及凝血时间对其血液相容性进行了评价。结果表明,利用SI-ATRP法在PCL表面接枝一层具有仿细胞外层膜结构的PMPC能不同程度地提高PCL薄片的血液相容性。
关键词:聚己内酯;表面原子转移自由基聚合;磷酰胆碱;血液相容性
0引言
血液相容性表面在植入生物材料和组织工程支架等方面受到广泛的关注[1]。材料表面是最开始接触血液、组织器官的部分[2],因此,提高材料表面的血液相容性是生物材料学领域的重要课题[3]。聚己内酯(PCL)有良好的热塑性、生物相容性及缓慢的降解速率,已经应用于生物医学工程的各个方面[4-6]。然而,PCL的一些性质如疏水性较强、缺乏可进一步修饰的基团,限制了它的广泛应用。表面改性是改善材料性能的有效方法之一[7],例如,将PEG接枝到多孔PCL膜表面可以提高防污性能[8]。磷酰胆碱基团(PC)是细胞膜基本单元卵磷脂的亲水端基,材料表面接枝含有PC的分子是获得与细胞膜表面化学组成、形貌相似的途径之一[9]。近年来的研究表明,用PC基团及其共聚物修饰的表面可显著提高材料的血液相容性[10-11]。本文通过表面原子转移自由基聚合法(SI-ATRP)在PCL膜表面接枝含有仿生结构PC的2-甲基丙烯酰氧乙基磷酰胆碱(MPC),用衰减全反射红外、扫描电镜和水接触角对表面基团、表面形貌及亲疏水性进行了表征;并通过蛋白吸附、血小板粘附、凝血时间对膜的血液相容性进行了评价。
1实验
1.1主要试剂与仪器
聚己内酯(PCL, Mw=80 000),易生有限公司;ε-己内酯,美国Sigma;2-溴-异丁酰溴,Sigma;双季戊四醇,Aldrich;2-甲基丙烯酰氧乙基磷酸胆碱(MPC);甲醇(AR),成都科龙试剂有限公司;1,4-二氧六环(AR),成都科龙试剂有限公司;MicroBCA试剂盒,赛默飞世尔科技有限公司。
衰减全反射红外光谱:ATR-FT-IR,Nicolet公司,型号Magna560;视频光学接触测量仪:DSA100,德国KRUSS;扫描电子显微镜:FEI/荷兰,型号InspectF;自动化凝血分析仪:CA-50,日本Sysmex公司。
1.2PCL膜片制备及ATRP引发剂的固定
采用热压成型的方法制备10cm×10cm的PCL膜片。将PCL片裁剪为1cm×1cm大小,用乙醇和水的混合溶剂(1/1,体积比)超声清洗3遍,真空干燥备用。星型PCL(4sPCL20和4sPCL75)与大分子引发剂4sPCL20-Br的合成参照文献[12]所述的方法进行。以1,4-二氧六环为溶剂配置浓度为50mg/mL的聚合物溶液(控制4sPCL20/4sPCL75的质量比为10%,30%和50%),取30μL滴加在PCL片上,待溶剂自然挥发干后用于表面引发反应。
1.3SI-ATRP法引发MPC
在特制的反应器中,称取MPC单体1.2g(4.06μmol),CuSO4·5H2O和D-异抗坏血酸钠各0.051g(0.203μmol)、0.0487g(0.244μmol),抽真空、通氮气循环3次后在氮气的保护下加入水和甲醇的混合溶剂(1/4, 体积比)15mL和55μL的Me6TREN配体,通氮气鼓泡30min后,放入涂覆有不同含量引发剂的PCL片,最后加入D-异抗坏血酸钠水溶液1mL,控制反应在25 ℃下反应24h。反应结束后用甲醇和水的混合溶液多次清洗膜片,真空干燥。将最终反应得到的薄片记为PCL;PCL1-g-PMPC[4sPCL20/4sPCL75=1∶9(质量比)];PCL2-g-PMPC[4sPCL20/4sPCL75=3∶7];PCL3-g-PMPC[4sPCL20/4sPCL75=1∶1]。整个反应中控制投料摩尔比为n[MPC]∶n[CuSO4·5H2O]∶n[D-异抗坏血酸钠]∶n[Me6TREN]=20∶1∶1.2∶1,单体浓度为0.07mg/mL。
1.4改性前后膜表面蛋白吸附
将反应得到的薄片放入24孔板中,用0.1mol/L的磷酸盐缓冲液(PBS,pH值=7.4)浸泡平衡过夜,吸去PBS;之后每孔加入1mL浓度为 1mg/mL的牛血清白蛋白(BSA)的磷酸缓冲液,37 ℃恒温水浴培养2h,之后用浓度为0.1%(质量分数)的SDS溶液将紧密结合在PCL片上的蛋白洗下,精确移取相同体积的SDS蛋白溶液于96孔板中,加入适量体积的BCA工作液,37 ℃显色2h后用酶标仪测定其562nm处的吸光度,根据标准曲线求出膜上的蛋白吸附量。每个样品测4个平行样取平均值。
1.5改性前后PCL膜片的血液相容性
1.5.1血小板粘附
用装有柠檬酸钠的真空采血管收集新鲜的兔血(柠檬酸钠与血的比例为1∶9),于1 500r/min的速度下离心15min,取上层清液即为富血小板血浆(PRP)。取25μLPRP滴加到经过PBS平衡浸渍的PCL薄片上,37 ℃培养2h,吸弃PRP,用PBS溶液清洗薄片3次,2.5%(质量分数)的戊二醛溶液4 ℃固定过夜。吸出固定液,PBS漂洗3次,经30%,50%,70%,80%,90%,95%和100%的乙醇水溶液梯度脱水,自然风干,喷金后扫描电镜观察血小板粘附情况。
1.5.2凝血时间(APTT和TT)
用装有柠檬酸钠的真空采血管收集新鲜的人血(柠檬酸钠与血的比例为1∶9),于4 000r/min下离心15min,取上清液即为贫血小板血浆(PPP)。将0.5cm×0.5cm的样品放于含有PBS的48孔板中平衡过夜,吸弃PBS,每孔加入100μL新鲜的PPP,37 ℃培养30min后,取50μL的PPP于测试杯中,随后加入50μL的APTT试剂,37 ℃孵育3min后加入50μL浓度为0.025mol/L的CaCl2溶液,测试APTT。对于TT测试,加入100μL的PP试剂于50μL的经过与材料共孵育的PPP中,测试TT值。
2结果与讨论
2.1改性前后膜衰减全反射红外光谱分析
利用衰减全反射红外光谱仪(ATR-FT-IR)对改性前后的PCL膜表面进行分析,结果如图1所示。
医院发展因面临形势、政策、自身所处阶段和员工的需求而出现变化。秦环龙表示,首先,根据申康中心“转方式、调结构、转机制”的要求,他提出五个转型,但这个五个转型是有前提、有基础的,就是学科的基本实力、医院软硬件的程度、内部运行管理水平等条件成熟,转型方可开始。“如果基础很差,就转型不过去;如果拖延,就耽误时机。就是要恰到好处、恰逢其时才能顺利转型发展。”其次,“申康绩效考核就像是一个指挥棒,让院长有抓手,进而推动医院的建设和发展,绩效考核的主要内涵,落地的就是我们五个转型的内容。”再次,医院自身由原来的粗犷型发展逐步转向内涵建设发展需求。

图1 PCL膜改性前后的ATR-FT-IR光谱图Fig1ATR-FT-IRspectraofpristinePCL,PCL1-g-PMPC,PCL2-g-PMPCandPCL3-g-PMPCmembrane
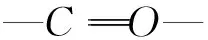
2.2扫描电子显微镜表征膜形貌
图2为PCL膜改性前后的SEM图。

图2 PCL膜改性前后的SEM图
Fig2SEMimagesofthesurfaceofthepristinePCLandMPCpolymer-graftedmembranesafterSI-ATRP,PCL1-g-PMPC,PCL2-g-PMPC,PCL3-g-PMPC
用扫描电子显微镜(SEM)观察改性前后膜表面形貌,可以看到,未改性的PCL膜与接枝了PMPC的膜形貌差异较大。图2(a)显示,未改性的PCL膜片表面有球晶结构,这是因为PCL玻璃化转变温度低并具有一定的结晶能力[15]造成的。表面接枝PMPC后形貌发生了变化(图2(b)-(d)),PCL1-g-PMPC膜表面不再有球晶结构; 随着表面引发剂含量的增加,PCL2-g-PMPC和PCL3-g-PMPC表面变得粗糙不平。表面形貌的变化,间接证明了表面接枝反应成功。
2.3改性前后膜的亲水性
静态水接触角及动态水接触角是反映材料表面与水接触时的可润湿性的重要指标,水接触角受到膜表面亲/疏水性、粗糙度、孔隙率、孔径大小及分布等因素的影响[7]。从图3(a)中可以看出,静态接触角、前进角和后退角经PMPC改性后都比改性前降低(20~30°),表明改性后表面亲水性增加[16];同时滞后角明显增加,说明改性后表面粗糙度增加,这与SEM观察到的结果一致。从接触角随时间变化(图3(b))可以看出,改性膜的接触角随时间呈现直线下降趋势,而纯PCL膜接触角降低到一定程度后出现平台,表明PMPC链段随着时间的推移会迁移到表面,间接证明PMPC成功接枝到了PCL膜表面。

图3PCL膜改性前后的动态接触角及接触角随时间的变化
Fig3DynamicwatercontactanglesandcontactanglesvaryingwithtimeofpristineandPMPC-graftedPCLmembranes
2.4改性前后膜的蛋白吸附
研究表明,含PC基团的表面能强烈吸附血液中的磷脂分子,形成类似生物体表面的磷脂层,从而减弱蛋白质与材料表面的相互作用[17]。在本研究中,以BSA为模型蛋白考察膜表面蛋白的吸附情况。从图4中可以看出,表面接枝PMPC后能降低蛋白吸附;同时,涂覆有不同含量引发剂的薄片在接枝后表现出不同程度的抗蛋白吸附能力,其中PCL2-g-PMPC的抗蛋白吸附能力最佳,为0.065μg/cm2。MPC接枝后蛋白吸附能力降低可能是由于SI-ATRP法能获得高接枝率的PMPC[18],表面密集堆积的PC基团吸引水分子而在表面形成了强烈的水合层,该水合层能减弱蛋白与表面的相互作用,最终使得膜呈现出低的蛋白吸附性能[19]。然而3种涂覆比例引发得到的膜呈现出不同的蛋白吸附量可能是由膜表面形貌的不同所导致的,因为蛋白吸附不仅受表面化学组成的影响,还与表面形貌、拓扑结构等有关[20]。
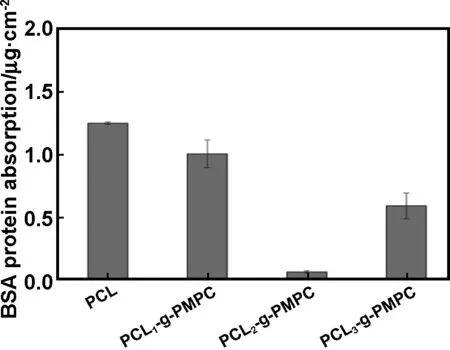
图4 BSA蛋白在膜表面吸附
Fig4BSAproteinabsorptionsbythemodifiedmembranes
2.5改性前后膜的血液相容性
2.5.1血小板粘附
对比考察改性前后的PCL膜片粘附血小板的情况(图5)可以看出,未经PMPC改性的PCL表面有大量的血小板粘附,且被严重激活;而经过PMPC改性的PCL1-g-PMPC虽然血小板粘附较多,但激活程度很轻;PCL2-g-PMPC表面血小板吸附量最少,且血小板基本上未被激活;PCL3-g-PMPC膜表面吸附大量的血小板,且被严重激活。上述结果表明,MPC改性可提高PCL的抗血小板粘附性能,然而需要有合适的MPC接枝密度,密度过大或过小均不利。表面涂覆引发剂含量为30%而引发得到的PCL2-g-PMPC膜片抗血小板粘附效果最好,这与蛋白吸附的结果相吻合。
2.5.2凝血时间测试
活化部分凝血活酶时间(APTT)及凝血酶时间(TT)一直被广泛应用于监测血液成分的变化和筛选抗凝血药物,近来也用于评价生物材料在体内的抗凝血性能。图6给出了PCL表面改性前后凝血时间的变化。从图中可以看出,表面经PMPC改性后,APTT和TT有不同程度的增加。也就是说,PMPC改性延缓了内源性凝血系统的激活过程,进一步提高了PCL膜片的抗凝血性。

图5 改性前后膜片表面血小板粘附扫描电镜图
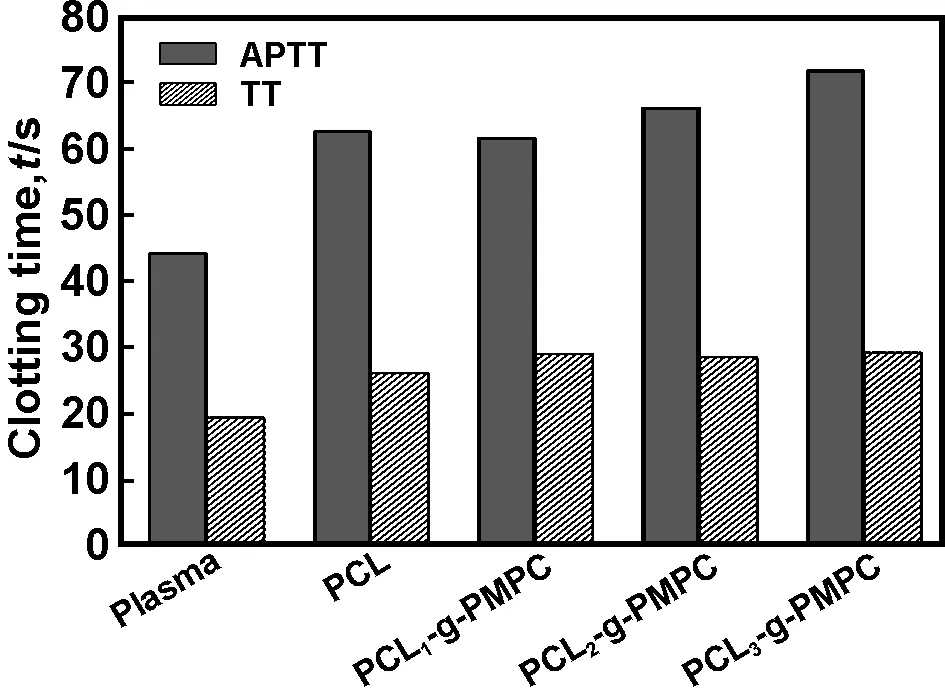
图6PCL表面改性前后活化部分凝血活酶时间(APTTs)及凝血酶时间(TTs)
Fig6Activatedpartialthromboplastintimes(APTTs)andthrombintimes(TTs)forthepristinePCLandmodifiedmembranes
3结论
利用SI-ATRP法获得了具有不同接枝密度的仿生改性的PCL-g-PMPC。ATR-FT-IR、扫描电镜及水接触角证明PMPC成功接枝到PCL表面。BSA蛋白吸附、血小板粘附及APTT测试结果表明PMPC的引入能在一定程度上提高PCL膜的血液相容性,其中表面涂覆引发剂比例为30%的改性膜(PCL2-g-PMPC)的抗凝血性能最好。
参考文献:
[1]RatnerBD.Thecatastropherevisited:bloodcompatibilityinthe21stcentury[J].Biomaterials, 2007,28(34):5144-5147.
[2]JiangH,WangXB,LiCY,etal.Improvementofhemocompatibilityofpolycaprolactonefilmsurfaceswithzwitterionicpolymerbrushes[J].Langmuir, 2011,27(18):11575-11581.
[3]YvetteBJ,AldenhoffRBTL.Photo-immobilizationofdipyridamole(persantin)atthesurfaceofpolyurethanebiomaterials:reductionofinvitrothrombogenicity[J].Biomaterials, 1997,18(2):167-172.
[4]WoodruffMA,HutmacherDW.Thereturnofaforgottenpolymer-polycaprolactoneinthe21stcentury[J].ProgressinPolymerScience, 2010,35(10):1217-1256.
[5]DashTK,KonkimallaVB.Poly-ε-caprolactonebasedformulationsfordrugdeliveryandtissueengineering:areview[J].JournalofControlledRelease, 2012,158(1):15-33.
[6]LuoMiao,FengTingting,CaiMengtan,etal.Synthesisandmicellizationofpoly(ε-caprolactone)-b-poly(ethyleneglycol)-b-poly(2-hdroxyethylmethacrylate)triblockpolymers[J].JournalofFunctionalMaterials,2014,45(5):5027-5036.
罗淼, 冯婷婷, 蔡孟锬, 等. 两亲性聚己内酯-b-聚乙二醇-b-聚甲基丙烯酸(2-羟乙酯)三嵌段共聚物的合成及成胶束化研究[J]. 功能材料, 2014,45(5):5027-5036.
[7]RanaD,MatsuuraT.Surfacemodificationsforantifoulingmembranes[J].ChemicalReviews, 2010,110(4):2448-2471.
[8]ChiYenHHZF.Surfacemodificationofnanoporouspoly(ε-caprolactone)membranewithpoly(ethyleneglycol)topreventbiofouling:partⅠ.Effectsofplasmapowerandtreatmenttime[J].InternationalJournalofPolymericMaterials, 2010,59(11):923-942.
[9]YuHongfei.Researchofphosphorylchline(PC)bionicmodifiedmedicaldacronmaterialsandanticoagulantproperty[D].Chengdu:SouthwestJiaotongUniversity,2011.
俞洪飞. 医用涤纶材料表面磷酸胆碱仿生改性及其抗凝血性能研究[D]. 成都: 西南交大, 2011.
[10]SchlenoffJB.Zwitteration:coatingsurfaceswithzwitterionicfunctionalitytoreducenonspecificadsorption[J].Langmuir, 2014,30(32):9625-9636.
[11]IshiharaYIAK.Cellmembrane-inspiredphospholipidpolymersfordevelopingmedicaldeviceswithexcellentbiointerfaces[J].ScienceandTechnologyofAdvancedMaterials, 2012,13:64101.
[12]ZhaiS,MaY,ChenY,etal.SynthesisofanamphiphilicblockcopolymercontainingzwitterionicsulfobetaineasanovelpH-sensitivedrugcarrier[J].PolymerChemistry, 2014,5(4):1285.
[13]TuS,ChenY,QiuY,etal.Enhancementofcellularuptakeandantitumorefficienciesofmicelleswithphosphorylcholine[J].MacromolecularBioscience, 2011,11(10):1416-1425.
[14]SaekiD,TanimotoT,MatsuyamaH.Anti-biofoulingofpolyamidereverseosmosismembranesusingphosphorylcholinepolymergraftedbysurface-initiatedatomtransferradicalpolymerization[J].Desalination, 2014,350:21-27.
[15]TingtingChenTCQJ.Designandfabricationoffunctionalpolycaprolactone[J].E-Polymers, 2015,15(1):3-13.
[16]GongMing,GuoPeipei,DaiWei,etal.Surfacemodificationofchitosanbyelectrostaticadsorptionwithpolyanionbearingphosphorylchlinegroups[J].JournalofFunctionalMaterials,2014,45(23)::2028-23042
铭宫, 郭培培, 代 威, 等. 壳聚糖静电吸附羧基磷酰胆碱聚合物的研究[J]. 功能材料, 2014,45(23):23028-23042.
[17]KazuhikoIshiharaHOYE.Hemocompatibilityofhumanwholebloodonpolymerswithaphospholipidpolargroupanditsmechanism[J].JournalofBiomedicalMaterialsResearch, 1992,26:1543-1552.
[18]AmirKhabibullinEMKM.Surface-initiatedatomtransferradicalpolymerization[M].Switzerland:SpringerInternationalPublishing, 2015.
[19]MaQ,ZhangH,ZhaoJ,etal.FabricationofcelloutermembranemimeticpolymerbrushonpolysulfonesurfaceviaRAFTtechnique[J].AppliedSurfaceScience, 2012,258(24):9711-9717.
[20]LiuL,LiW,LiuQ.Recentdevelopmentofantifoulingpolymers:structure,evaluation,andbiomedicalapplicationsinnano/micro-structures[J].WileyInterdiscipRevNanomedNanobiotechnol, 2014,6(6):599-614.
Hemocompatibilitystudiesofpolycaproactonesurfacegraftedwithbiomimetic(2-methacryloyloxyethylphosphorylcholine)
HELiu1,MAYuhao1,HUANGLei1,ZHANGSongbai1,CHENYuanwei1,LUOXianglin1,2
(1.CollegeofPolymerScienceandEngineering,SichuanUniversity,Chengdu610065,China;2.StateKeyLaboratoryofPolymerMaterialsandEngineering,SichuanUniversity,Chengdu610065,China)
Abstract:Biomimeticpoly(2-methacryloyloxyethylphosphorylcholine) (poly(MPC))brusheswithvariousdensityweregraftedtoPCLmembranesbysurface-initiatedatomtransferradicalpolymerization(SI-ATRP).Attenuatedtotalreflection-Fouriertransforminfrared(ATR-FT-IR),scanningelectronmicroscopyandwatercontactanglewereusedtocharacterizethemodifiedmembranes.ComparedwiththepristinePCLmembrane,thePMPC-graftedPCLmembranesshowedlowerproteinadsorptionandsuppressedplateletadhesioninsomedegree.Atthesametime,theactivatedpartialthromboplastintime(APTT)forthemodifiedmembraneswasslightlyincreased.TheseresultsindicatedthatthesurfacebiomimeticmodificationbygraftingPMPCbrushesrenderedthePCLmembraneswithgoodbloodcompatibility.
Keywords:poly(ε-caprolactone);surface-initiatedatomtransferradicalpolymerization;phosphorylcholine;hemocompatibility
文章编号:1001-9731(2016)06-06098-05
* 基金项目:国家自然科学基金资助项目(51473099, 51273125)
作者简介:何浏(1989-),女,四川眉山人,在读硕士,师承罗祥林教授、陈元维副教授,从事生物医用高分子研究。
中图分类号:R318.08
文献标识码:A
DOI:10.3969/j.issn.1001-9731.2016.06.017
收到初稿日期:2015-07-31 收到修改稿日期:2016-03-02 通讯作者:罗祥林,E-mail:luoxl_scu@126.com

