广西马尾松第一代育种群体遗传多样性1)
冯源恒 杨章旗 李火根 黄永利
(广西壮族自治区林业科学研究院,南宁,530002) (南京林业大学) (南宁市林业科学研究所)
广西马尾松第一代育种群体遗传多样性1)
冯源恒杨章旗李火根黄永利
(广西壮族自治区林业科学研究院,南宁,530002)(南京林业大学)(南宁市林业科学研究所)
摘要利用SSR分子标记技术构建了广西马尾松第一代育种群体464个无性系的指纹图谱,并分析了该育种群体的遗传多样性。研究结果表明,广西马尾松第一代群体的平均等位基因数为3.19,多态率为100%;平均有效等位基因数为1.79;Shannon多样性指数平均为0.65,平均观测杂合度为0.40,表明该育种群体具有较高的遗传多样性。同时发现,来源于人工林优树无性系的平均等位基因数高于来源于天然林优树无性系,而天然林优树无性系的近交系数低于人工林优树无性系。
关键词马尾松;育种群体;遗传多样性;SSR;指纹图谱
马尾松(PinusmassonianaLamb.)是我国分布最广的针叶树种,也是我国南方地区重要的用材、荒山造林和工业原料树种,其木材和松脂是许多森林工业、林产工业和造纸工业的支柱,而其花粉则营养丰富,是新一代的食疗珍品。马尾松在我国亚热带地区约占国土1/5范围内的山地均有其分布;林分总面积居全国针叶树种首位;蓄积量仅次于云杉、冷杉和落叶松,居全国针叶树种第4位[1]。广西是马尾松主要分布区,也是马尾松最重要的优良种源区,马尾松遗传育种资源极其丰富。目前,广西马尾松的育种研究正步入高世代改良阶段。为了实现可持续的多世代改良,在对马尾松的育种群体进行管理与研究时不但要关注其生长性状在改良过程中所能获得的增益,还需要对群体的遗传多样性状况、个体间近交程度等遗传信息进行深入了解。本研究以SSR分子标记为技术手段为广西马尾松第一代育种群体建立遗传位点信息库,并将之应用于育种群体遗传多样性、指纹图谱建立问题等研究,为马尾松高世代育种研究提供重要的基础数据。
1材料与方法
广西马尾松第一代育种群体构建于20世纪80年代,以生长量为主要改良性状。材料源自1976年、1977年及1984年对广西全境的马尾松人工林和优良种源的天然优良林分进行优树选择所得的优良单株[2-3]。目前所有材料均以无性系的形式保存在南宁市林科所广西松类种质资源库,共有464个无性系。其中有153个选自广西桐棉、古蓬、容县3大优良种源区的马尾松天然林,有311个选自广西境内30个国有林场的人工林。目前,所有育种群体材料均以无性系形式(每个无性系8个分株)保存在南宁市林科所马尾松国家级良种基地2010年新建的马尾松基因库中。2012年6月采集每个无性系的新鲜针叶并冷冻保存。
1.1DNA的提取
松树针叶DNA提取采用CTAB裂解—硅珠吸附法[4]。纯化后DNA经分光光度计检测纯度后置于冰箱4 ℃保存备用。
1.2引物来源及SSR-PCR反应条件
本研究所使用的SSR引物根据广西林科院对马尾松基因组DNA测序所得基因组DNA序列设计开发,共计506对[5]。筛选16对多态性高的SSR引物用于遗传位点信息平台库。所设计引物由上海捷瑞基因技术有限公司合成,Taq酶、dNTPs购自捷瑞生物工程公司。PCR反应体系为10 μL:Tris-HCl 10 mmol/L pH 8.0,KCl 50 mmol/L,Mg2+2.5 mmol/L,dNTP(dATP、dCTP、dGTP、dTTP各0.2 mmol/L),引物2.5×10-12mol,Taq聚合酶0.08 U,DNA 10~20 ng。扩增反应程序采用Touch-down PCR:94 ℃ 15 s,60 ℃ 15 s(Δ℃=-0.5),72 ℃ 30 s,16次循环;在进入94 ℃ 15 s,52 ℃ 15 s,72 ℃ 30 s,10次循环;最后72 ℃延伸15 min。
1.3PCR产物的银染检测
SSR-PCR产物在8%的聚丙烯酰胺凝胶上电泳,银染检测。银染检测步骤为:PCR产物加等体积上样缓冲液,8%聚丙烯酰胺凝胶(100 mL凝胶包括42 g尿素,20 mL 40%丙烯酰胺和N,N’-亚甲双丙烯酰胺,0.5 mL 10%过硫酸铵,50 μL TEMED,10 mL 10×TBE电泳缓冲液)240 V稳压电泳1 h后固定染色;固定10 min(固定液10%乙醇,0.5%乙酸),ddH2O漂洗2次,每次2 min;再用0.15% AgNO3染色7 min,ddH2O漂洗2次,每次2 min,最后显影(1.5% NaOH,0.007 56% NaBO4,1%甲醛)至条带清晰,照相记录。
1.4遗传多样性分析
SSR是共显性标记,同一引物扩增产物中电泳迁移率一致的条带被认为具有同源性。采用凝胶成像系统,对所得的图片进行判读,然后根据所读的数据用A,B,C,D,E…按条带长度大小从大到小进行编号。采用POPGENE32软件[6]计算下列遗传参数:(1)多态位点百分率(Percentage of polymorphic loci,PPB);(2)观测等位基因数目(Observed number of alleles);(3)有效等位基因数目(Effective number of alleles)[7];(4)Shannon’s多样性指数(Shannon’s information index)[8];(5)观测杂合度(Observed heterozygosity)。采用Coancestry Version 1.0软件[9]计算群体内的共祖系数[10-13]。
2结果与分析
2.1第一代育种群体指纹图谱建立
采用16对SSR引物对464个样本进行PCR扩增,建立起一个464×16规模的遗传位点信息库。根据所获得的遗传位点信息,对464个无性系构建了指纹图谱。图谱中每一列数据(前两列除外)是某一SSR标记在各份材料中检测出的带型的数字化代号,一个代号代表一对等位基因型。每一行中的数字按从左到右的顺序构成一条字符串(前两列除外),字符串的位数为32位(每个SSR位点两位)。如无性系桂GC900A的指纹数字条码是02020508080802050206060504010503。在本研究中16对标记可以全部区分464个无性系,鉴别成功率为100%。
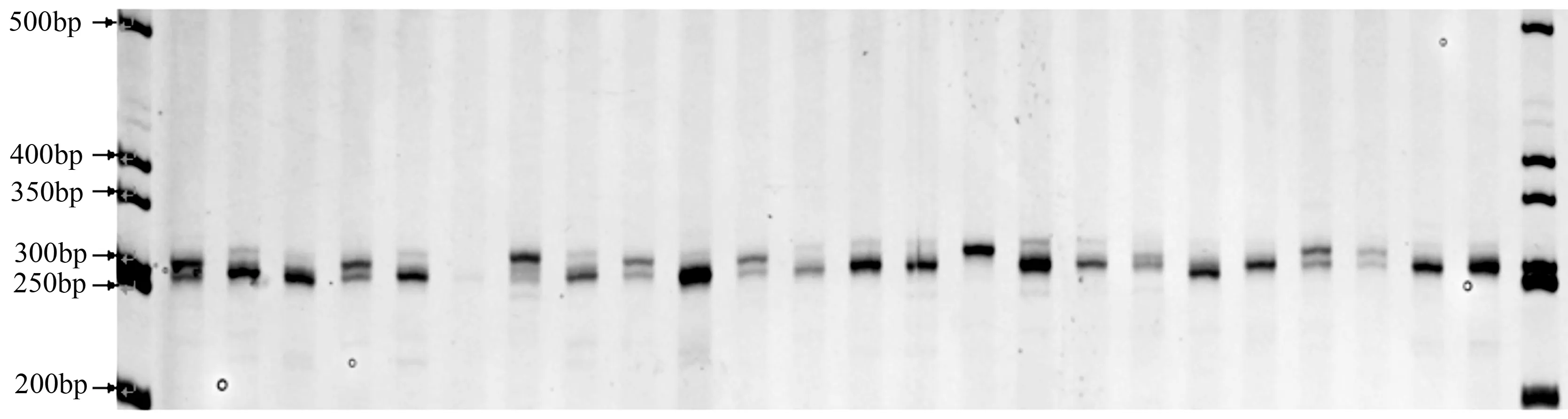
图1 引物PF463扩增SSR产物电泳图
2.2广西马尾松第一代育种群体遗传多样性
采用16对SSR引物在464个样本中共检测到16个位点51个等位基因,多态率为100%。每个位点平均观察等位基因数为3.19,平均有效等位基因数1.79。表1列出了马尾松第一代育种群体不同位点的遗传多样度参数。不同位点的多样性参数差别很大,PF402位点的Shannon多样性指数最高为1.08,PF569、PF615位点的多样性指数值最低为0.30,平均为0.65。平均观测杂合度为0.40。
采用Coancestry Version 1.0软件计算得到第一代育种群体465个无性系在16个位点的平均共祖系数为0.079,育种群体状态数为6.33。
2.3不同来源的育种材料的遗传多样性
在马尾松第一代育种群体的464个无性系中,有153个选自广西桐棉、古蓬、容县3个优良种源区的马尾松天然林,有311个选自广西境内30个国有林场的人工林。为了研究天然林选优材料与人工林选优材料的遗传多样性差异,本研究对二者进行了单独分析。
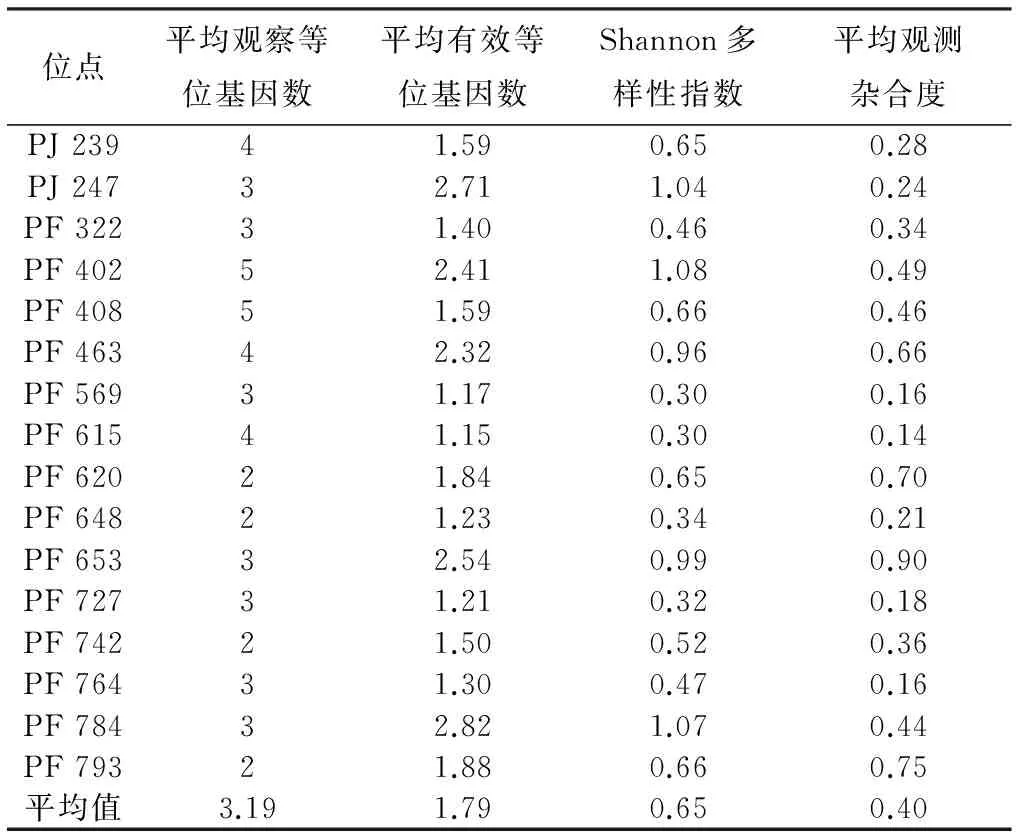
表1 马尾松第一代育种群体在16个遗传位点的遗传多样度
天然林选优材料在16个位点上共扩增到45个等位基因。每个位点平均观察等位基因数为2.85,平均有效等位基因数1.73,Shannon多样性指数平均为0.61,平均观测杂合度为0.40,近交系数为0.063。
人工林选优材料在16个位点上共扩增到50个等位基因。每个位点平均观察等位基因数为3.1,平均有效等位基因数1.68。Shannon多样性指数平均为0.59。平均观测杂合度为0.37,近交系数为0.087(表2)。

表2 不同来源育种材料的遗传多样性差异
3结论与讨论
广西马尾松第一代育种群体选自3个种源区的天然林和30个林场的人工林,是国内规模较大的马尾松育种群体之一。以其为材料建立的初级种子园对照本区马尾松材积增益为127.43%,对照外省(粤、黔)马尾松材积增益为203.02%,对照本区湿地松材积增益为124.63%,表现出很明显改良效果。经本研究发现该群体的平均等位基因数为3.19,多态率为100%;平均有效等位基因数为1.79;Shannon多样性指数(I)平均为0.65,平均观测杂合度为0.40。高于湖北京山马尾松无性系种子园(I=0.48)[14]、广东韶关马尾松无性系种子园(I=0.36)[15]及浙江淳安马尾松第一代育种群体(I=0.55)[16]。这说明广西马尾松第一代育种群体不论是在改良增益上还是在遗传基础的宽度上都处于较高水平。
马尾松具有悠久的人工栽培史,在分布区内有大量的人工林。由于历史原因许多人工林的种源、产地等遗传背景信息已经丢失。在进行育种材料选择时往往一方面不忍放弃人工林中大量的优良个体,一方面又担心在遗传背景不明的情况下从中选择育种材料会影响育种群体的遗传多样性水平。从本研究结果可知人工林选优材料的平均等位基因数要高于天然林选优材料,这说明几乎覆盖广西全境的国有林场的马尾松人工林所具有的基因型要比3个优良种源区更为丰富。但天然林选优材料的近交系数低于人工林。这可能是由于人工林在造林种子采集时往往选择数量较少的几个优良林分或优良单株造成了林分的近交情况上升。同时人工林的平均有效等位基因数、遗传多样性指数及观测杂合度都低于天然林,这也与人工林种子来源范围有限有关。
育种群体作为进行遗传改良研究的核心材料,利用各类分子标记对之进行遗传多样性研究的报道已有很多[16-18]。但由于育种群体规模较大,相关研究往往采用抽样方法进行取样。这样得到的数据虽可以在一定程度上反映出群体在该研究方向上的遗传信息,但由于不是全部取样,所得到的数据难以被关于该育种群体其它方面的遗传研究再次利用。因此针对育种群体全部材料建立一定规模的遗传位点信息平台,相当于为所有个体建立一份遗传信息档案,所得到的遗传信息可以为与之相关各类研究共用,既避免了重复取样造成的科研资源浪费又方便对今后更高世代育种材料进行遗传谱系管理。这项具有重要应用价值的基础科研工作应成为林木改良研究系统中必要的环节。
参考文献
[1]周政贤.中国马尾松[M].北京:中国林业出版社,2001.
[2]杨章旗,覃开展.马尾松种质基因资源选择、保存和利用研究[J].广西林业科学,2001,30(1):19-22.
[3]杨章旗.马尾松种子园优良家系选择研究[J].广西科学,2006,13(3):232-235.
[4]DOYLE J J, DOYLE J L. Isolation of plant DNA from fresh tissue[J]. Focus,1990,12:13-15.
[5]FENG Y H, YANG Z Q, WANG J, et al. Development and characterization of SSR markers fromPinusmassonianaand their transferability toP.elliottii,P.caribaeaandP.yunnanensis[J]. GMR,2014,13(1):1508-1513.
[6]YEH F C, YANG R C, BOYLE T B, et al. POPGENE, the user-friendly shareware for population genetic analysis[EB/OL].[2012-03-27]. Molecular biology and biotechnology centre.http://www.ualberta.ca/fyeh/.
[7]HARTL D L, CLARK A G. Principles of population genetics[M]. Sunderland: Sinauer Associates,1989.
[8]SHANNON C E, WEAVER W, WIENER N. The mathematical theory of communication[J]. Urbana University of Illinois Press,1949,85(2):24-30.
[9]WANG J L. COANCESTRY: a program for simulating, estimating and analysing relatedness and inbreeding coefficients[J]. Molecular Ecology Resources,2011,11(1):141-145
[10]WANG J L. Triadic IBD coefficients and applications to estimating pair wise relatedness[J]. Genet Res,2007,89(3):135-153.
[11]LYNCH M, RITLAND K. Estimation of pairwise relatedness with molecular markers[J]. Genetics,1999,152(4):1753-1766.
[12]RITLAND K. Estimators for pairwise relatedness and inbreeding coefficients[J]. Genet Res,2009,67(2):175-185.
[13]MILLIGAN B G. Maximum-likelihood estimation of relatedness[J]. Genetics,2003,163(3):1153-1167.
[14]万爱华,徐有明,管兰华,等.马尾松无性系种子园遗传结构的RAPD分析[J].东北林业大学学报,2008,36(1):18-22.
[15]朱必凤,陈德学,陈虞禄,等.广东韶关马尾松种子园遗传多样性分析[J].福建林业科技,2007,34(3):1-5.
[16]张一,储德裕,金国庆,等.马尾松1代育种群体遗传多样性的ISSR分析[J].林业科学研究,2009,22(6):772-778.
[17]张振,张含国,张磊,等.兴安落叶松基本群体与育种群体RAPD多样性分析[J].浙江农林大学学报,2012,29(1):130-136.
[18]李梅,施季森,李发根,等.杉木第2代育种群体优良基因型的RAPD遗传变异[J].林业科学,2007,43(12):50-55.
Genetic Diversity ofPinusmassonianain the First Generation Breeding Population in Guangxi
Feng Yuanheng, Yang Zhangqi
(Guangxi Institute of Forestry Science, Nanning 530002, P. R. China); Li Huogen(Nanjing Forestry University); Huang Yongli(Nanning Forestry Division)//Journal of Northeast Forestry University,2016,44(6):1-3.
We used the genomic SSR markers ofPinusmassonianato construct fingerprints with the size of 464 clones for the first generation of breeding population ofP.massonianain Guangxi, and analyzed the genetic diversity of the breeding population. The mean number of alleles (Na) per locus was 3.19, the polymorphism rate was 100%, the mean number of effective alleles (Ne) per locus was 1.79, the Shannon’s information index (I) was 0.65 and the average observed heterozygosity (Ho) was 0.40, indicating that the breeding population maintains high levels of genetic variation. In the first generation of the breeding population, the clones from plantations were higher than those from natural forests in the average number of alleles and inbreeding coefficient.
KeywordsPinusmassoniana; Breeding population; Genetic diversity; SSR; fingerprints
第一作者简介:冯源恒,男,1981年6月生,广西壮族自治区林业科学研究院,工程师。E-mail:nanyuan05@163.com。 通信作者:杨章旗,广西壮族自治区林业科学研究院,教授级高级工程师。E-mail:yangzhangqi@163.com。
收稿日期:2015年11月12日。
分类号S759.3
1)国家自然科学基金项目(31560216);广西自然科学基金(2014GXNSFBA118078);广西优良用材林资源培育重点实验室自主研究课题(12B0102)。
责任编辑:潘华。

