柴胡皂苷d联合黄芩苷对大鼠脑缺血/再灌注损伤中PARP-1表达的影响*
董利平 崔玉环 赵宝民 连晶晶 魏玉磊 颜 娟 郑茂东 刘占矿
河北北方学院附属第一医院(张家口 075000)
柴胡皂苷d联合黄芩苷对大鼠脑缺血/再灌注损伤中PARP-1表达的影响*
董利平崔玉环赵宝民连晶晶魏玉磊颜娟郑茂东刘占矿△
河北北方学院附属第一医院(张家口 075000)
摘要目的:探讨柴胡皂苷d联合黄芩苷对二磷酸腺苷核糖多聚酶-1(Poly(ADP-ribose)polymerase-1,PARP-1)表达的影响。方法:将健康雄性SD大鼠随机分为正常对照组、假手术组、模型组、PARP-1抑制剂PJ34组、柴胡皂苷d组、黄芩苷组、柴胡皂苷d+黄芩苷组,按再灌注时间点不同分为6h、12h、24h、48h、72h五个亚组;应用修饰酶循环法检测NAD+浓度,定量RT-PCR技术检测PARP-1 mRNA表达。结果:模型组NAD+浓度较假手术组明显降低(P<0.01),PARP mRNA表达显著增加(P<0.01),于再灌注24 h达高峰;药物干预组NAD+浓度较模型组显著增加(P<0.01),PARP mRNA表达显著降低(P<0.01),并于24h表达最低(P<0.01,P<0.05),且柴胡皂苷d+黄芩苷组效果最为显著(P<0.01)。结论:我们推测柴胡皂苷d联合黄芩苷可能是通过抑制MCAO大鼠PARP-1表达,降低NAD+消耗,实现其对大鼠脑缺血/再灌注损伤的神经保护作用。
主题词脑缺血/中医药疗法动物,实验大鼠
脑缺血/再灌注损伤中PARP-1过度激活可导致NAD+大量耗竭、ATP减少,最终细胞能量耗竭,细胞死亡[1]。文献报道早期给予PARP-1抑制剂可阻断PARP-1酶活性,减轻缺血/再灌注中神经元的损伤[2]。因此本研究选取柴胡皂苷d和黄芩苷,通过建立大鼠脑缺血/再灌注损伤模型,检测药物对脑缺血/再灌注病灶中PARP-1及NAD+的表达情况,探讨其在脑缺血/再灌注损伤中的神经保护机制。
1材料与方法
1.1实验动物与分组SD(Sprague-Dawley)大鼠420只,健康雄性,体质量(240±5)g,购自北京大学实验动物科学部,随机将大鼠分成正常组、假手术组、模型组、PARP-1抑制剂PJ34组、柴胡皂苷d组、黄芩苷组、柴胡皂苷d+黄芩苷组7组,每组60只,按再灌注时间点不同分为6h、12h、24h、48h、72h五个亚组。
1.2药物与试剂PARP-1抑制剂PJ34(美国Santa Cruz公司);柴胡皂苷d(Sigma-Aldrich公司);黄芩苷(Sigma-Aldrich公司);栓线(北京沙东生物技术有限公司),试剂盒(北京中杉金桥生物技术有限公司);NAD+浓度检测酶循环法检测试剂盒(Sigma-Aldrich公司);Trizol裂解液(Invitrogen 公司);实时荧光定量PCR试(Fermentas公司);PARP-1聚合体蛋白一抗(北京博奥森公司)。
1.3制备脑缺血/再灌注损伤大鼠模型大鼠称重,腹腔注射麻醉7%水合氯醛(5mL·kg-1),采用改进Longa线栓法,右侧颈外动脉暴露并剪开,推栓线至大脑中动脉开口处,阻断其血流,导致脑缺血,固定栓线,2h后拉出栓线,恢复血液供应,完成脑缺血再灌注损伤模型;假手术组不实施缺血再灌注只进行手术。
1.4用药方法脑缺血/再灌注手术后2h 腹腔注射药物:PJ34组(25mg·kg-1)、柴胡皂苷d组(70mg·kg-1)、黄芩苷组(30mg·kg-1)、柴胡皂苷d(70mg·kg-1)+黄芩苷(30mg·kg-1)组;正常对照组、假手术组及模型组腹腔注射等量生理盐水;各组均每天早晨给药1次。
1.5神经功能损伤评分Longa评分标准于动物清醒后进行评分:0分:行为正常;1分:对侧前爪伸展不充分,轻微不对称;2分:行走时向外侧转圈;3分:行走时向对侧倾斜,颤抖不稳、跌倒;4分:不能行走,意识丧失;符合1-3分者大鼠纳入实验,其余剔除。
1.6修饰酶循环法检测病灶中NAD+浓度将脑缺血/再灌注病灶组织分别置HEPES-NaOH液中研磨,将匀浆4℃15000r·rain-1离心20min,上清液即为组织总蛋白溶解液。组织总蛋白溶解液中NAD+浓度检测按酶循环法检测试剂盒内附说明书操作。
1.7定量RT-PCR方法检测病灶中PARP-1 mRNA表达严格按照Trizol试剂盒说明书提取各组脑组织总RNA,测定总RNA量以及其纯度,逆转录合成cDNA后,放置于-20℃备测。PARP-1的上游引物5′-CCCAGGGTCTTCGGATAG-3′,下游引物5′-AGCGTGCTTCAGTTCATACA-3′,扩增片段长度为185bp;β-actin的上游引物5′-TCCGTGGAGAAGAGCTACGA-3′,下游引物5′-GTACTTGCGCTCAGAAGGAG-3′,扩增片段长度为309bp,以β-actin为内参对照。25μL反应体系为:SYBR Green Mix 12.5μL,上下游引物各1.0μL(5μmol/L),ROX 0.5 μL,cDNA 1.0μL及9.0μL ddH2O;反应条件:95℃变性10min,然后按95℃×30s,55℃×1min,72℃×42s,进行40个循环,对结果进行分析。
1.8统计学方法数据分析釆用SPSS13.0统计软件,数据以均数±标准差表示,组间比较采用t检验,P<0.05为有统计学差异。
2结果
2.1神经功能行为学评分与模型组相比,药物干预组神经功能行为学评分有统计学意义(P<0.01),柴胡皂苷d+黄芩苷组效果最为显著(P<0.01)。见表1。
2.2脑组织NAD+浓度水平与正常组及假手术组相比,模型组NAD+浓度下降(P<0.01);与模型组相比,药物干预组则浓度增加(P<0.01,P<0.05),且柴胡皂苷d+黄芩苷组效果最为显著(P<0.01)。见表2。
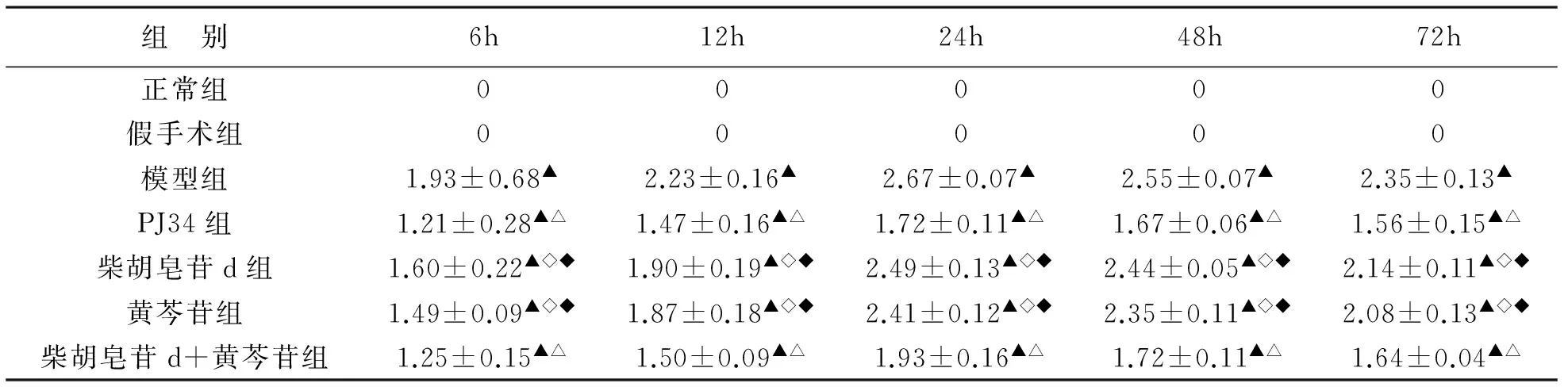
表1 脑缺血/再灌注后不同时间神经功能行为学评分(n=6)
注:▲P< 0. 01,与假手术组和正常对照组比较;△P< 0. 01,◇P< 0. 05,与模型组各对应时间点比较;◆P<0. 01,与PJ34组各对应时间点比较

表2 脑缺血/再灌注后不同时间脑组织的NAD+浓度(mg·g-1wet tissue,n=6)
注:▲P< 0. 01,与假手术组和正常对照组比较;△P< 0. 01,◇P< 0. 05,与模型组各对应时间点比较;◆P<0. 01,与PJ34组各对应时间点比较
2.3PARP-1 mRNA的表达情况与正常组及假手术组相比,模型组PARP mRNA表达增加(P<0.01);并随缺血/再灌注时间延长呈动态变化,于24h时达最高峰,给予药物干预后PARP mRNA表达降低,并于24h表达最低(P<0.01,P<0.05),且柴胡皂苷d+黄芩苷组效果最为显著(P<0.01);而正常对照组和假手术组均无明显变化。见表3。

表3 脑缺血/再灌注后不同时间脑组织的PARP-1 mRNA表达(%,n=6)
注:▲P< 0. 01,与假手术组和正常对照组比较;△P< 0. 01,◇P< 0. 05,与模型组各对应时间点比较;◆P<0. 01,□P<0. 05,与PJ34组各对应时间点比较
3讨论
PARP-1作为结合蛋白酶,其生物学效应包括识别及结合DNA缺口,修复损伤DNA,保证基因组完整性,进而催化多聚ADP核糖化,转送NAD+核糖至受体蛋白,形成核糖链,通过改变受体蛋白结构,而影响受体蛋白生物学活性。目前有大量证据表明 PARP-1在脑缺血/再灌注损伤发展过程中起重要作用。Kauppinen等人[3]在大鼠双侧颈动脉结扎再灌注治疗中发现,PARP-1抑制剂PJ34可抑制肿瘤坏死因子表达及小胶质细胞激活和星形胶质细胞增生,证实其可通过减少炎症,增强缺血后神经元的存活和再生长期;短暂性大脑中动脉梗塞的动物模型(MCAO)中,PARP-1小鼠较野生型基因小鼠的梗塞面积明显减小,将野生型PARP-1小鼠基因再转移至PARP-1小鼠后其保护缺血/再灌注的作用消失[4],证实梗塞面积的减小是因PARP-1基因缺陷所致,给予PARP-1抑制剂后梗塞面积亦减小,PARP-1缺陷在脑缺血/再灌注中的保护作用被多种酶抑制剂所重复,包括苯酰胺类、异喹啉酮化合物、phenanthridinones及多种经典PARP-1抑制剂[5],充分证实PARP途径在脑梗塞损伤中的病生理过程中的重要性,及PARP-1抑制剂的神经保护作用。
柴胡皂苷d是柴胡主要有效成分,具有抗病毒、抗菌、抗炎、抗肿瘤,调解免疫及内分泌系统,抑制NF-κB、NF-AT激活的T淋巴细胞和AP-1信号对抗增殖作用[6]。黄芩的主要活性成分黄芩苷,具有抗凋亡、抗炎、免疫调节的作用[7]。
本研究结果表明大鼠短暂局灶性脑缺血/再灌注后缺血脑组织中PARP-1 mRNA表达明显增加,NAD+过度消耗,而给予PARP-1抑制剂PJ34及柴胡皂苷d+黄芩苷干预后,PARP-1 mRNA表达明显减少,二者统计学上无差异,证实柴胡皂苷d及黄芩苷同时给药可减轻脑梗塞的缺血/再灌注损伤,其机制可能与其抑制PARP-1表达、NAD+消耗减少有关。为拓宽柴胡皂苷d联合黄芩苷在脑缺血/再灌注中的临床应用提供了理论依据。
参考文献
[1]Ma Y, Nie H, Chen H, Li J, et al. NAD(+)/NADH metabolism and NAD(+)-depen- dent enzymes in cell deathand ischemic brain injury: current advances and therapeutic implications[J]. Curr Med Chem. 2015, 22(10): 1239-47.
[2]Zhang R, Tang S, Huang W, et al. Protection of the brain following cerebral ischemia through the attenuation of PARP-1-induced neurovascular unit damage in rats[J]. Brain Res. 2015,93(15):552-553.
[3]Kauppinen TM, Suh SW, Berman AE, et al. inhibition of poly(adp-ribose) polymerase suppresses inflammation and promotes recovery after ischemic injury[J]. J Cereb Blood Flow Metab. 2009, 29(4): 820-9.
[4]Goto S, Xue R, Sugo N, et al. Poly(ADP-ribose) merase impairs early and long-term experimental stroke recovery[J]. Stroke,2002, 33: 1101-1106.
[5]F Moroni, A Cozzi, A Chiarugi, L Formentini, et al. Long-lasting neuroprotection and neurological improvement in stroke models with new, potent and brain permeable inhibitors of poly(ADP-ribose) polymerase[J]. British Journal of Pharmacology,2012, 165: 1487-1500.
[6]Wong VK, Zhang MM, Zhou H, et al. saikosaponin-d enhances the anticancer potency of tnf-alpha viaovercoming its undesirable response of activating nf-kappa bsignalling in cancer cells[J]. Evid Based Complement Alternat Med,2013, 2013: 745295.
[7]Lee W, Ku SK, Bae JS, et al. Anti-inflammatory effects of Baicalin, Baicalein, and Wogonin in vitro and in vivo[J]. Inflammation,2015, 38(1): 110-125.
(收稿2016-01-08;修回2016-02-21)
通讯作者△
【中图分类号】R743.31
【文献标识码】A
doi:10.3969/j.issn.1000-7369.2016.07.082
*河北省卫计委科研基金项目(ZL20140035)

