孕晚期七氟烷暴露对子代大鼠脑组织单胺类神经递质含量的影响
王 雷, 关 怀, 李秋娟, 李双月, 朱丽丽,袁利刚,吴冬梅
(1.大连医科大学附属第一医院 麻醉科,辽宁 大连 116011;2. 解放军第210医院 妇产科,辽宁 大连 116021;3. 大连医科大学 劳动卫生与环境卫生教研室,辽宁 大连 116044;4. 大连医科大学附属第一医院 妇产科,辽宁 大连 116011;5.辽河油田总医院 手术麻醉科,辽宁 盘锦 124012;6.北京61786部队门诊部 检验科,北京 100094)
孕晚期七氟烷暴露对子代大鼠脑组织单胺类神经递质含量的影响
王雷1, 关怀2, 李秋娟3, 李双月3, 朱丽丽4,袁利刚5,吴冬梅6
(1.大连医科大学附属第一医院 麻醉科,辽宁 大连 116011;2. 解放军第210医院 妇产科,辽宁 大连 116021;3. 大连医科大学 劳动卫生与环境卫生教研室,辽宁 大连 116044;4. 大连医科大学附属第一医院 妇产科,辽宁 大连 116011;5.辽河油田总医院 手术麻醉科,辽宁 盘锦 124012;6.北京61786部队门诊部 检验科,北京 100094)
[摘要]目的探讨孕晚期七氟烷暴露对子代大鼠脑组织单胺类神经递质含量的影响。 方法18只SD孕大鼠,随机分为3组,对照组、低浓度暴露组和高浓度暴露组,每组6只。孕14 d行麻醉干预,低浓度和高浓度暴露组孕鼠于麻醉箱内分别吸入混有2.5%和4.5%七氟烷的空气2 h,对照组吸入空气2 h。测定5周龄子鼠体重、脑重,计算脑脏器系数;水迷宫测试5周龄子鼠学习记忆能力;高效液相色谱-荧光检测法测定5周龄子鼠大脑皮质和海马去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)和五羟色胺(5-hydroxytryptamine,5-HT)含量。结果高浓度暴露组子鼠脑脏器系数(1.51±0.08)显著低于对照组(1.63±0.12),P<0.05;定向航行实验训练第1天,各组子鼠游泳速度无明显差异(P>0.05);从训练第2天起,随暴露浓度增加,子鼠逃避潜伏期逐渐延长(P<0.05);空间探索实验中,子鼠在目标象限停留时间随暴露浓度增加逐渐缩短(P<0.05);子鼠大脑皮层NE和5-HT含量随染毒剂量增加逐渐下降(P<0.05);高浓度暴露组子鼠大脑皮层DA含量也显著低于对照组和低浓度暴露组(P<0.05);子鼠海马NE和DA含量随染毒剂量增加逐渐下降(P<0.05);高浓度暴露组子鼠海马5-HT含量也显著低于对照组(P<0.05)。结论孕晚期七氟烷暴露可导致子代生后成年早期学习记忆能力下降;对脑形态和不同脑区单胺类神经递质含量的影响可能参与其导致的神经发育毒性过程。
[关键词]七氟烷;孕期;子代;去甲肾上腺素;多巴胺;五羟色胺
[引用本文]王雷, 关怀, 李秋娟,等:孕晚期七氟烷暴露对子代大鼠脑组织单胺类神经递质含量的影响[J].大连医科大学学报,2016,38(2):121-125.
哺乳动物的快速脑发育期为孕中晚期和生后早期,此期神经元处于快速生长和分化阶段,血脑屏障不完善,加之机体对毒物的清除能力差,一旦受到毒物攻击,可影响神经发育,甚至造成永久性损害[1]。研究表明,多种外源性毒物(如乙醇、丙戊酸和麻醉剂异氟醚等)胚胎期暴露均能导致出生后远期神经行为异常[2-3]。七氟烷是临床广泛应用的吸入麻醉剂,因其脂溶性特点,容易通过实验动物的胎盘和血脑屏障[4]。已证实,七氟烷对幼年和成年机体具有神经毒性,但孕期暴露于七氟烷对子代生后远期的神经毒性研究较少[4]。本研究建立孕晚期七氟烷吸入导致子代成年早期(生后5周)认知功能障碍的大鼠模型,检测子代大脑皮层和海马组织3种主要的单胺类神经递质去甲肾上腺素(norepinephrine,NE)、多巴胺(dopamine,DA)和五羟色胺(5-hydroxytryptamine,5-HT)含量,为阐明七氟烷的神经发育毒作用机制提供依据。
1材料和方法
1.1实验动物
无特定病原体级(SPF)9周龄SD孕大鼠18只,由大连医科大学动物中心提供[许可证号:SCXK(辽)2008-0002,20130715],体重196~218 g(孕0 d体重)。饲养环境温度20~25 ℃,湿度50%~60%,自然节律采光,标准饲料,自由进食水。
1.2主要试剂和仪器
七氟烷(上海恒瑞医药有限公司);NE、DA和5-HT测定试剂盒(Sigma,美国);色谱级甲醇(国药集团化学试剂有限公司,中国);乙酸钠(上海化学试剂有限公司,中国);高氯酸(天津市鑫源化工有限公司,中国);高效液相色谱(1525)-荧光检测器(474)(waters公司,美国);HC-2518R高速冷冻离心机(科大创新股份有限公司中佳分公司,中国);Morris水迷宫(DMS-2,中国医学科学院药物研究所)。
1.3分组与处理
将18只孕鼠随机分为3组,分别为对照组、低浓度暴露组和高浓度暴露组,每组6只。孕14 d行麻醉干预,低浓度和高浓度暴露组孕鼠分别于麻醉箱内吸入混有2.5%和4.5%七氟烷的空气2 h,自主呼吸,连续测定箱内氧气和麻醉剂浓度,麻醉结束后,中断七氟烷,动物继续留置麻醉箱内吸空气20 min,再转回饲养笼中。对照组以相同流速在同样的麻醉箱内吸入空气2 h[4]。实验于上午8:00-12:00进行。各组孕鼠自然分娩,自由哺乳。子鼠出生3 d时调整每窝子鼠数为8~10只,雌雄比例为4∶6或5∶5或6∶4,以保证各窝子鼠数均衡。生后23 d断乳,子鼠按性别及组别重新分笼,每笼4~5只,自由进食水。
1.4指标与方法
1.4.1体重、脑重、脑脏器系数
5周龄时,每组取子鼠6只,雌雄各半,称重后拉颈处死。迅速分离脑组织,生理盐水冲洗,滤纸拭干,天平称重,计算脑脏器系数。脏器系数 =(脏器质量/体重)×100。
1.4.2Morris水迷宫检测空间学习记忆能力
5周龄时,每组取子鼠12只,雌雄各半,Morris水迷宫检测空间学习记忆能力。设备为直径150 cm、高50 cm的圆形水池,水深40 cm,水温(25 ± 2)℃。按方位分成4个象限(东、南、西、北)。其内放置一圆形透明的逃避平台,高度39 cm、直径10 cm,固定于北象限。实验在光线昏暗的室内进行,墙壁挂不同画面作为指示,水池上方安置带有显示系统的摄像机,计算机自动跟踪并记录游泳轨迹。实验分两个阶段,于生后36~41 d每日下午13:00-16:00进行。
定向航行实验:记录子鼠分别从4个象限不同入水点找到平台所需要的时间(即逃避潜伏期)。每天训练4次,间隔10 min;如果60 s内未找到平台,潜伏期按60 s计算,再将子鼠引导至平台,让其在平台上停留15 s;4次平均成绩计为当日成绩进入统计。连续训练5 d(生后36~40 d)。
空间探索实验:生后41 d,撤除平台,子鼠从南象限入水,自由航行60 s,记录其在目标象限(曾经放置平台的象限)停留的时间。
1.4.3高效液相色谱-荧光检测法测定单胺类神经递质含量
1.4.1实验用鼠分离脑组织后继续显微分离大脑皮层和海马(冰上操作),-80 ℃冻存。测定时,取冰冻组织称重,加入0.1 g/mL预冷高氯酸溶液,冰上匀浆,离心,取20 μL上清液。按照张璇等[5]报道的高效液相色谱-荧光检测法测定NE、DA和5-HT含量。
1.5统计学方法
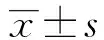
2结果
2.1各组子鼠体重、脑重及脑脏器系数比较
3组子鼠脑重和脑脏器系数比较,差异明显(P<0.05)。其中,高浓度暴露组子鼠脑重显著低于对照组和低浓度暴露组(P<0.05);高浓度暴露组子鼠脑脏器系数显著低于对照组(P<0.05)。见表1。
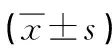
表1 各组子鼠体重、脑重及脑脏器系数比较
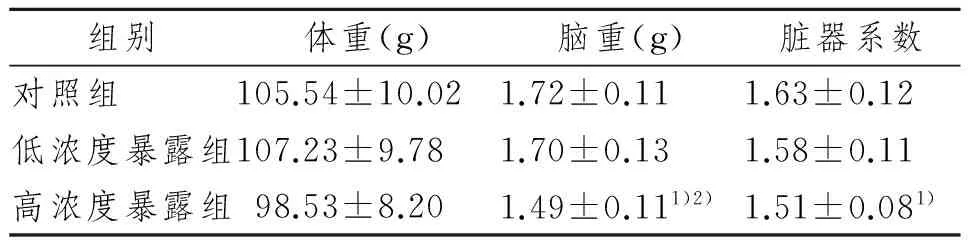
组别体重(g)脑重(g)脏器系数对照组105.54±10.021.72±0.111.63±0.12低浓度暴露组107.23±9.781.70±0.131.58±0.11高浓度暴露组98.53±8.201.49±0.111)2)1.51±0.081)
1)与对照组比较,P<0.05;2)与低浓度暴露组比较,P<0.05
2.2各组子鼠水迷宫成绩比较
定向航行实验训练第1天,各组子鼠游泳速度比较,差异无显著性意义(P>0.05)(图1A)。各组子鼠在训练第1天均不能找到隐蔽平台,逃避潜伏期为60 s,组间比较无差异(P>0.05);随训练天数增加,各组子鼠逃避潜伏期均逐渐缩短,但从训练第2天起,任意一天子鼠逃避潜伏期组间比较均有明显差异,且随暴露浓度增加,逃避潜伏期逐渐延长,呈剂量-效应关系(P<0.05)(图1B)。空间探索实验中,子鼠在目标象限停留时间随暴露浓度增加逐渐缩短,呈剂量-效应关系(P<0.05)(图1C)。
2.3各组子鼠大脑皮层NE、DA和5-HT含量
子鼠大脑皮层NE和5-HT含量随染毒剂量增加逐渐下降,呈剂量-效应关系(P<0.05)。高浓度暴露组子鼠大脑皮层DA含量显著低于对照组和低浓度暴露组(P<0.05),而对照组与低浓度暴露组比较,差异无显著性意义(P>0.05)。见表2。
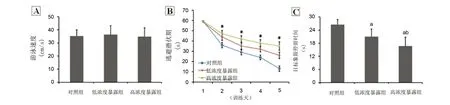
图1 各组子鼠水迷宫成绩比较Fig 1 The comparison of water maze test scores in 3 groups
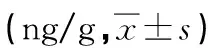
表2 各组子鼠大脑皮层NE、DA和5-HT含量比较
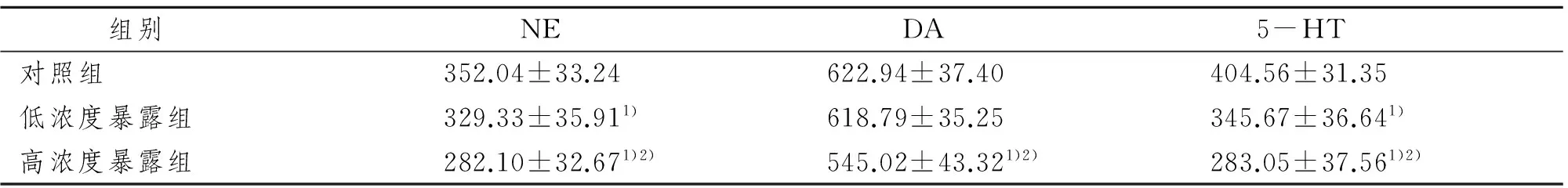
组别 NE DA 5-HT对照组352.04±33.24622.94±37.40404.56±31.35低浓度暴露组329.33±35.911)618.79±35.25345.67±36.641)高浓度暴露组282.10±32.671)2)545.02±43.321)2)283.05±37.561)2)
1)与对照组比较,P<0.05;2)与低浓度暴露组比较,P<0.05
2.4各组子鼠海马NE、DA和5-HT含量比较
子鼠海马NE和DA含量随染毒剂量增加逐渐下降,并呈剂量-效应关系(P<0.05)。高浓度暴露组子鼠海马5-HT含量明显低于对照组(P<0.05),而对照组与低浓度暴露组、低浓度与高浓度暴露组比较,差异无显著性意义(P>0.05)。见表3。
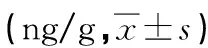
表3 各组子鼠海马NE、DA和5-HT含量比较

组别 NE DA 5-HT对照组340.36±26.21582.23±37.20330.01±28.52低浓度暴露组313.47±38.261)462.86±44.271)314.78±36.64高浓度暴露组284.52±37.141)2)374.92±34.641)2)293.44±35.731)
1)与对照组比较,P<0.05;2)与低浓度暴露组比较,P<0.05
3讨论
随着人类对疾病诊治能力的提高和手术技术的进步,麻醉剂在临床的使用越来越广泛。在美国,每年有超过7万的孕妇在麻醉下进行非产科手术和胎儿外科手术[6]。因此,孕期麻醉剂暴露对子代发育的影响备受关注。七氟烷因麻醉诱导迅速,深度容易控制,恢复苏醒快而完全,成为临床常用的吸入麻醉剂。动物实验表明,七氟烷可影响老年大鼠学习记忆能力,还可对发育期动物产生神经毒性并损伤成年后认知功能[7-9]。但有关孕期暴露七氟烷对子代生后远期的神经毒性影响研究较少。
本研究中,对孕14 d大鼠行七氟烷吸入麻醉干预,为大鼠的快速脑发育期开始于孕晚期;实验中采用七氟烷吸入浓度为2.5%和4.5%,连续2 h,为参照国外研究结果,浓度为2.5%的七氟烷,连续吸入2 h,对成年实验动物的血压和血气没有显著影响,故认为可能能够模拟人类手术用量[4]。经过上述干预,于成年早期(生后5周)采用水迷宫实验测试子鼠学习记忆能力。结果表明,孕晚期七氟烷暴露未对子鼠游泳速度造成显著影响,提示其对运动神经和肌肉的毒性作用较小;随染毒剂量增加,子鼠在定向航行实验中逃避潜伏期逐渐延长,在空间探索实验中目标象限停留时间逐渐缩短,提示子鼠学习记忆能力受损。因此,本研究采用的暴露剂量合理,模型成立。
在此基础上,本研究进一步探讨孕期七氟烷暴露致子代神经发育毒作用机制。结果表明,高浓度暴露组子鼠脑重显著低于对照组和低浓度暴露组,高浓度暴露组子鼠脑脏器系数显著低于对照组,提示,孕期七氟烷暴露可能对子代生后远期脑形态造成明显影响。
神经递质是神经元信号传递的物质基础。单胺类神经递质参与许多神经生理过程。痴呆患者常伴有此类神经递质的明显减少[10],环境毒物砷、氟、酒精、六溴环十二烷等引起的学习、记忆障碍均被证实与干扰单胺类神经递质释放有关[5, 11-13],提示其与认知功能密切相关。大脑皮层和海马是认知形成的主要脑区。本研究结果提示,孕期七氟烷染毒导致子鼠成年早期大脑皮层和海马三种主要的单胺类神经递质NE、DA和5-HT含量出现不同程度降低,提示七氟烷的神经发育毒性可能与影响单胺类神经递质释放有关。进一步分析显示,大脑皮层NE和5-HT含量受七氟烷毒性影响较大,而海马组织NE和DA含量受影响较大,呈剂量-效应关系。虽然上述两个脑区均与学习记忆密切相关,但大脑皮层还司管感觉、运动等多种功能[14],海马也参与对情绪、成瘾性等多种生物学过程的控制。因此,七氟烷对不同脑区单胺类神经递质含量的影响不尽相同。当然,七氟烷的神经发育毒性可能不仅局限于学习记忆受损,还可能包括对其他神经功能的影响,其毒性表现和机制仍需更多、更深入的研究阐明。
参考文献:
[1] Grandjean P, Landrigan PJ. Neurobehavioural effects of developmental toxicity[J]. Lancet Neurol, 2014, 13(3):330-338.
[2] Palanisamy A, Baxter MG, Keel PK, et al. Rats exposed to isoflurane in utero during early gestation are behaviorally abnormal as adults[J] .Anesthesiology, 2011, 114(3):521-528.
[3] Reitman E, Flood P. Anaesthetic considerations for non-obstetric surgery during pregnancy[J].Br J Anaesth, 2011, 107(Suppl 1):i72-i78.
[4] Zheng H, Dong Y, Xu Z, et al. Sevoflurane anesthesia in pregnant mice induces neurotoxicity in fetal and offspring mice[J].Anesthesiology, 2013, 118(3): 516-526.
[5] 张璇, 朴丰源, 刘鹏. 砷对小鼠脑单胺类神经递质浓度影响及牛磺酸、维生素C的保护作用 [J].大连医科大学学报, 2011, 33(2):102-106.
[6] Kuczkowski KM. Nonobstetric surgery during pregnancy: What are the risks of anesthesia? [J].Obstet Gynecol Surv, 2004, 59:52-56.
[7] Otsubo T, Maekawa M, Nagai T, et al. Facilitatory effects of subanesthetic sevoflurane on excitatory synaptic transmission and synaptic plasticity in the mouse hippocampal CA1 area[J].Brain Res, 2008, 1197:32-39.
[8] 马欢欢, 张超, 郑淑文, 等. 新生大鼠重复吸入七氟烷对其成年期Aβ、Tau蛋白的影响[J].遵义医学院学报, 2015, 38(1): 60-63.
[9] 斯小龙, 李国政, 刘小南, 等.七氟烷、异氟烷对幼鼠脑细胞凋亡和远期学习记忆功能的影响[J].中国临床药理学与治疗学, 2013, 18(5): 495-499.
[10] 李生菊. 老年性痴呆患者单胺类神经递质水平及与记忆力的关系[J].中国老年学杂志, 2014, 34(5): 1374-1375.
[11] 朱玉龙, 郑玉建, 吕小敏, 等. 氟对大鼠水迷宫学习记忆及脑内单胺类神经递质浓度的影响[J].新疆医科大学学报, 2012, 35(3):331-333.
[12] 毛健, 苏旸, 陈薛钗, 等. 酒精处理后鼠脑内单胺氧化酶活性及单胺神经递质代谢变化的测定[J].化学通报, 2010, 8:761-764.
[13] 刘芳, 冀秀玲, 赵文娟, 等. 六溴环十二烷对发育期大鼠脑单胺类神经递质质量比及单胺氧化酶活性的影响[J].安全与环境学报, 2012, 12(2):6-9.
[14] 杨天亮, 辛斐, 雷旭. 人类大脑结构和功能的性别差异:来自脑成像研究的证据[J].心理科学进展, 2015, 23(4): 571-581.
Effects of gestational exposure to sevoflurane on expression levels of monoamine neurotransmitters in various brain areas of rat offspring
WANG Lei1, GUAN Huai2, LI Qiu-juan3, LI Shuang-yue3, ZHU Li-li4,YUAN Li-gang5, WU Dong-mei6
(1.DepartmentofAnesthesiology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China; 2.DepartmentofObstetricsandGynecology,No. 210thHospitalofPLA,Dalian116021,China; 3.DepartmentofOccupationalandEnvironmentalHealth,DalianMedicalUniversity,Dalian116044,China; 4.DepartmentofObstetricsandGynecology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China; 5.DepartmentofAnesthesiology,theGeneralHospitalofLiaoheOil,Panjin124012,China; 6.DepartmentofClinicLabrotary, 61786Regiment,Beijing100094,China)
[Abstract]Objective To investigate the effects on levels of monoamine neurotransmitters in various brain regions of rat offspring under exposure to sevoflurane during pregnancy. Methods Eighteen pregnant SD rats were randomly divided into 3 groups and treated with 0%, 1.5% and 2.5% sevoflurane for 2 h on 14th gestational day. After delivery, at the age of 5 weeks, body and brain weight of offspring were measured and brain organ coefficient was calculated; learning and memory ability was tested by the Morris water maze (MWM) tests; the levels of norepinephrine (NE), dopamine (DA) and 5-hydroxytryptamine (5-HT) in cerebral cortex and hippocampus of offspring were detected. Results The brain organ coefficient in high-level exposed group (1.51±0.08) was significantly lower than that of the control(1.63±0.12) (P<0.05). On the first day of training, there was no significant difference in swimming velocity among the 3 groups (P>0.05). From the second day, the escape latency was longer consistently in two exposed groups than the control (P<0.05). In the probe test, the time spent in target quadrant where the platform had been located during training was decreased with sevoflurane-treatment level in a dose-dependent manner (P<0.05). The levels of NE and 5-HT in offspring cerebral cortex decreased with sevoflurane-treatment level in a dose-dependent manner (P<0.05). The level of DA in offspring cerebral cortex of the high-level exposed group was significantly lower than that of other groups (P<0.05). The levels of NE and DA in offspring hippocampus decreased with sevoflurane-treatment level in a dose-dependent manner (P<0.05) The levels of 5-HT in offspring hippocampus of the high-level exposed group was significantly lower than that of the control (P<0.05). Conclusion Gestational exposure to sevoflurane resulted in learning and memory impairment at early adulthood. Damaging brain morphology and disturbing levels of monoamine neurotransmitters in brain tissues could occur during the neurodevelopmental toxicity.
[Key words]sevoflurane; gestation; offspring; norepinephrine; dopamine; 5-hydroxytryptamine
作者简介:王 雷(1976-),男,陕西咸阳人,副教授。E-mail:dayiwanglei@sohu.com 通信作者:朱丽丽,副教授。E-mail:ruochen7750@sina.com
doi:论著10.11724/jdmu.2016.02.05
[中图分类号]R99
[文献标志码]A
文章编号:1671-7295(2016)02-0121-05
(收稿日期:2015-11-19;修回日期:2016-03-17)

