水通道蛋白-9在能量代谢中的作用
郑 博 综述,王建伯 审校
(大连医科大学附属第一医院 泌尿外科,辽宁 大连 116011)
水通道蛋白-9在能量代谢中的作用
郑博 综述,王建伯 审校
(大连医科大学附属第一医院 泌尿外科,辽宁 大连 116011)
[摘要]近来研究发现水通道家族成员之一AQP9在甘油、乳酸盐、丙酮酸等能量物质跨膜转运中发挥着重要作用。机体内环境稳态的维持需要多个生化过程协调有序参与,而水分子及能量物质几乎伴随着细胞生化代谢的所有过程。本文结合近几年国内外研究进展,对AQP9在哺乳动物多个系统及器官组织的能量物质代谢中所发挥的作用作一综述。
[关键词]水通道蛋白-9;能量代谢;基因治疗
[引用本文]郑博,王建伯.水通道蛋白-9在能量代谢中的作用[J].大连医科大学学报,2016,38(2):184-188.
水分子几乎参与活细胞生化代谢的所有过程,过去一直认为水分子以单纯扩散的方式自由通过细胞膜,直至第一个水通道蛋白(Aquaporin 1,AQP1)于1988年被美国生物学家Agre发现,这种认识才被重新审视。迄今为止,在哺乳动物体内已发现13种水通道蛋白(AQP0~12),并且它们在分子结构和功能特性上表现出很大的同源性,共属于水-甘油通道大家族[1]。但不同的亚型及器官组织定位以及在细胞内的分布差异,使每种水通道蛋白在不同部位发挥着特异的生理功能。从最初的单纯水通道至水-甘油通道,AQPs家族成员不断扩大,同时对其家族中各成员的化学结构及生理功能的研究也逐渐深入,这给临床上与水-甘油分子代谢异常相关疾病的诊疗提供了新的思路。
1AQP9的发现和分子结构
AQP9是水通道蛋白家族中的一员, 1997年由Kuriyama H等在进行人类脂肪组织基因序列系统分析过程中发现。人类AQP9基因包含6个外显子和5个内含子,片段大小约25 bp,荧光原位杂交的结果显示其定位于15号染色体q22.1-22.2区,并且在启动子序列中含有公认的紧张性和类固醇激素反应原件,表明AQP9基因表达受渗透压及代谢状态调节[2]。随着人类基因组计划的完成,科学家们对这些AQPs基因及氨基酸序列分析也逐渐清晰,通过比较原始序列及化学性质的差异将AQPs分为三大家族,即单纯水通道家族:AQP0、1、2、4、5、6、8;水-甘油通道家族:AQP3、7、9、10;水通道超家族:AQP11、12[3]。
AQP9属于水-甘油通道家族中一员,作为一种“混杂性”通道其对水分子及多种中性溶质分子表现出较广泛通透性,如水、甘油、尿素、多元醇(甘露醇、山梨芦醇)、嘌呤(腺嘌呤)、嘧啶(尿嘧啶、5-氟尿嘧啶)、单羧酸酯(乳酸盐、β-羟丁酸)、氨以及亚砷酸盐。根皮素和HgCl2能有效阻滞山梨醇、腺嘌呤、5-氟尿嘧啶、β- 羟丁酸透过,透过率下降70%~90%[4]。对AQP9蛋白分子化学结构分析研究发现,AQP9蛋白同家族中其他成员一样是由4个单链肽非共价结合形成的同源四聚体(图1A),每个单链肽(图1B)都是由295个氨基酸残基构成的分子量约30 kDa的单体结构,其中每个单体都是一个独立的水通道并形成由5个环行结构(loop A-E)连接的6次跨膜单链,其中B环和E环含有水通道蛋白特征性结构天冬酰胺-脯氨酸-丙氨酸(Asn-Pro-Ala,NPA)基序,两个NPA基序在空间上相互靠近形成“沙漏”状的水通道,单肽链的氨基末端和羧基末端均位于细胞内,并且在氨基末端的11-13(S-F-K)和26-29(T-L-S-E)位点存在蛋白激酶C和酪氨酸激酶II磷酸化结构,提示AQP9蛋白功能活化部位可能在氨基末端[5]。
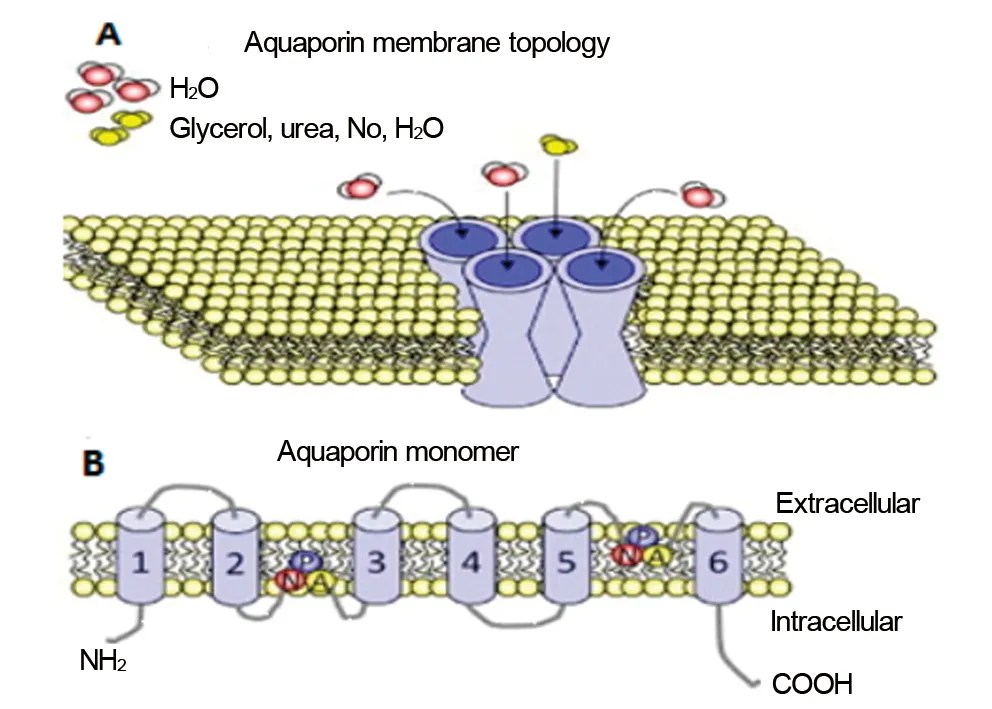
图1 AQPs 单体及四聚体空间结构示意图Fig 1 The structure of AQPs monomer and tetramerA:AQPs四聚体;B:AQPs单体
2AQP9分布及功能
2.1AQP9在肝脏和脂肪的分布及表达调控机制
AQP9基因最初从脂肪组织克隆得到,其主要功能是易化甘油进出脂肪细胞,参与甘油三酯的合成及分解,维持脂肪代谢平衡。而肝脏作为体内能量及物质代谢枢纽,AQP9表达水平最高,并且进一步研究发现作为水-甘油通道其在肝脏糖异生中发挥重要作用并参与调节血糖平衡。
生理条件下,机体70%~90%甘油在肝细胞内最终氧化分解,AQP9作为最基本的转运通道参与肝细胞对甘油的摄取,免疫荧光显示AQP9蛋白主要定位于肝细胞血窦面,转运至肝细胞胞浆内的甘油在甘油激酶的作用下形成3-磷酸甘油,后者是多种能量物质代谢中间产物,所以在不同的激素调节下,其可彻底氧化供能,也可以通过糖异生途径生成葡萄糖或再次合成甘油三酯。通过基因敲除AQP9的肥胖型糖尿病db/db小鼠实验发现,由于肝脏AQP9表达下调,肝细胞转运甘油能力下降,导致肝内糖异生过程减弱,循环血糖水平下降10%~40%。胰岛素抵抗最常见特征就是非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD),甚至进展为非酒精性脂肪肝炎(non-alcoholic fatty steatohepatitis, NAFS),2型糖尿病患者肝细胞AQP9表达下调水平以及对甘油的通透性下降水平与肝细胞脂肪变性程度呈负相关,这可能是肝细胞为防止自身进一步脂肪变性而发生的代偿机制,因为2型糖尿病或肥胖患者体内激素水平有利于脂肪合成,肝细胞通过下调AQP9的表达减少对甘油的摄取,进而减少胞浆内甘油三酯的合成和沉积,减轻自身的脂肪变性。NAFS患者肝细胞AQP9下调程度与肝小叶因炎症导致的损伤程度相一致,提示正常肝细胞功能的发挥与AQP9表达水平相关[6]。
AQP9在肝组织中表达水平除与机体的代谢状态有关外,还与性别相关。Nicchia等[7]发现在相同饲养条件下雌性大鼠肝组织AQP9表达量低于雄性大鼠约20%。研究发现AQP9在肝癌组织中表达低于正常及癌旁组织,并且与肿瘤的恶性程度有关,可能原因是AQP9表达下调增加了癌细胞免遭凋亡程序攻击的潜能,因为所有细胞在经历凋亡过程中首先都会发生体积皱缩伴大量水分子跨膜转运,这一过程被称为凋亡性容积减小(apoptotic volume decrease,AVD),肿瘤细胞AQP9表达下调后可逃避AVD攻击进而继续生存[8]。
2.2AQP9在雄性生殖管道的分布及表达调控机制
雄性生殖系统具有活跃的水分子跨膜运动,精子的生成、运输、储存等各生理过程与水分子代谢密切相关,有研究者通过免疫荧光技术发现AQP9在雄性生殖管道全程表达,在睾丸定位于非纤毛细胞游离缘的微绒毛及睾丸间质细胞,而在连接性的纤毛细胞不表达,在附睾及输精管定位于主细胞的微绒毛并且附睾部位荧光信号最强。大鼠出生后生殖管道AQP9表达水平与体内雄激素水平呈正相关,至出生后3~4周达到最高峰与成年大鼠相当,进一步的研究发现AQP9在雄性大鼠生殖管道中表达受雄激素调节,去势或注释雄激素受体阻断剂后AQP9表达水平明显下降,去势后再次注射睾酮可恢复AQP9表达至去势前水平[9-10]。相似地,Wang等[11]发现AQP9在大鼠前列腺组织内的表达受雄激素调节,这可能与AQP9基因启动子含有公认的类固醇受体反应原件有关。
Pietrement C等[12]发现AQP9在雄性生殖管道内稳定表达与功能活化受Na+-H+交换调节因子-1(Na/H exchanger regulatory factor-1,NHERF-1)、纤维囊性跨膜通道调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)共同调控,并通过依赖cAMP途径激活AQP9通道功能,因为在附睾尾部睾丸分泌的液体50%~80%被重吸收,此时管腔内液体环境的维持主要通过依赖CFTR途径的氯离子通道的激活来带动水分子的转运,所以CFTR在调节AQP9功能上发挥重要作用,在附睾和输精管如果发生水分子转运障碍会导致局部阻塞性病理改变,最终导致睾丸功能萎缩和不育,这种情况已经在患有附睾或/和输精管纤维囊肿的病人身上得到验证。
2.3AQP9在脑组织的分布及表达调控机制
Badaut J等[13-14]发现AQP9在人脑组织主要分布于星形胶质细胞和儿茶酚胺能神经元,并且存在两种亚型,分子量分别为26 kDa和30 kDa,前者分布于神经细胞线粒体内膜,后者分布于细胞膜。AQP9在星形胶质细胞的分布主要定位于大脑渗透压调节敏感区,如脑室周围器官、下丘脑室上核及室旁核的大神经细胞等,参与水分子的快速跨膜转运。对于非渗透压敏感的儿茶酚胺能神经元,其主要功能是易化能量物质如甘油、乳酸等跨膜转运参与能量代谢,分布定位主要在孤束核与蓝斑核。同时他们在构建大鼠大脑中动脉局部缺血性脑水肿模型中发现,最初的24 h AQP9在梗死灶边缘随时间推移表达逐渐上调,但与脑水肿程度并不一致,进而他们推测AQP9在缺血后脑水肿发生中发挥一定的作用,但不是脑水肿形成的始动因素,更多地认为其作为能量物质通道在局部代谢压力(应激)的作用下表达上调。因为在局部脑缺血形成后,缺血灶内无氧糖酵解加速,乳酸生成增多,形成局部乳酸性酸中毒,pH下降,AQP9在pH 5.5时对乳酸盐的转运能力提高4倍,从而加速胶质细胞对乳酸的摄取,利于清除细胞外间隙内的乳酸盐和甘油,在随后的恢复血供再灌注期间,AQP9可协助乳酸盐在胶质细胞和神经元之间传递,进而作为能量物质恢复缺血对神经元造成的损伤[15]。冉建华等[16]研究AQP9在大鼠缺血性脑水肿形成中的作用和表达调控机制时发现,PKA、PKC信号转导途径对AQP9的表达调控具有重要意义,认为在缺血性脑水肿形成早期,外界有害刺激因素可以激活细胞膜上腺苷酸环化酶(adenylate cyclase, AC),后者催化胞内cAMP合成增多。作为第二信使的cAMP含量增加可以发挥以下几方面的作用:一是激活糖酵解过程中的关键酶使糖酵解作用增强产生大量乳酸;二是通过激活碳酸酐酶催化CO2生成碳酸,后者再分解释放出H+,使细胞pH值降低;三是cAMP还可以通过激活蛋白激酶PKA来调节多种酶活性和基因表达。其中依赖cAMP的PKA活化可以通过p38 MAPK通路来上调AQP9的表达。
Warth等[17]在大鼠脑肿瘤模型中发现AQP9免疫反应在肿瘤边缘明显强化,肿瘤实质内却未见明显信号,而在人脑恶性胶质细胞瘤中表现为整个肿瘤实体部分免疫荧光信号明显增强,并一直蔓延至大脑皮层神经元。Tan G等[18]发现AQP9表达程度与肿瘤分级呈正相关,这可能是肿瘤细胞高代谢状态对能量物质如甘油、乳酸等需求较大有关,同时AQP9可能在降低颅内压药物如甘露醇、山梨芦醇等快速进入神经元过程中发挥重要作用。近来研究发现AQP9基因启动子区含有缺氧诱导因子(hypoxia induced factor, HIF)结合序列,与正常组织相比,肿瘤组织通常氧供不足或存在相对乏氧区域,尤其是处于进展期恶性程度较高的肿瘤,这归因于以下两点:一是因为肿瘤细胞生长速度较快超过内皮细胞生长速度,二是因为肿瘤新生血管功能尚未完善,无法提供充足的氧供,所以对于快速增长的中晚期肿瘤通常都会处于相对氧供不足的状态,上述资料提示肿瘤部位AQP9表达可能受局部缺氧调节[19]。早在1927年,Warberg等就发现癌细胞较正常细胞在能量代谢方面的差异,即在有氧条件下,癌细胞也优先进行糖酵解产生大量乳酸,而不是彻底的氧化磷酸化,有氧糖酵解被认为是癌细胞所具有的普遍或显著特征。并且研究发现肿瘤组织内似乎存在两种类型细胞,一种细胞通过糖酵解途径产生大量乳酸,而另外一种细胞利用前者产生的乳酸进行彻底的氧化磷酸化,这两种细胞互相帮助,和谐共处,共同维系肿瘤组织的生长,推测乳酸在这两种细胞之间的快速传递,很大程度上可能依赖AQP9来实现[20]。Loitto VM等[21]发现AQP9通过易化水分子进入白细胞丝状伪足加速细胞跨越血管壁障碍向周围迁移,进而推测AQP9在恶性肿瘤局部浸润和远处转移过程中扮演重要角色。
Amiry M等[22]研究发现人类Parkinson病与脑细胞线粒体AQP9表达异常有关,线粒体内膜表达AQP9的脑细胞有全部的星形胶质细胞、中脑黑质、腹侧被盖区及孤束核的部分神经元,这些细胞线粒体表达AQP9赋予其特殊功能,生理条件下乳酸盐及代谢物经过AQP9转运实现线粒体内外能量物质平衡,同时维持线粒体内膜轻度去极化状态,减少自由基的生成。而对于Parkinson病患者来说常由于胰岛素受体的缺失引起AQP9在上述脑细胞线粒体中表达上调,AQP9除了对水和能量物质具有转运功能外,其对金属物质也表现出一定的通透性。中脑多巴胺能神经元AQP9表达上调可增加其对金属物质毒害的敏感性,实验显示在亚砷酸盐诱导的大鼠多巴胺能神经元反应中,大鼠自主活动逐渐减弱。关于Parkinson病的新认识是由于长期固定暴露于环境中有毒金属物质如铜和铁离子引发的,而线粒体是主要的攻击目标,这也解释Parkinson病患者主要的病理改变发生在中脑多巴胺能神经元,从另一方面也说明多巴胺能神经元对短暂缺血的耐受力较高。
2.4AQP9在其他系统或组织中的分布及与疾病的关系
Aharon R等[23]发现AQP9参与破骨细胞分化过程,当单核前体细胞逐渐融合形成多核破骨细胞时伴随着细胞膜AQP9表达的上调,因为成熟的多核破骨细胞其体积明显增大,这种细胞容积在短时间内的骤增主要是由AQP9介导的大量水分子内流引起,并且证实AQP9表达上调在细胞融合之前就已经发生,后来他们通过使用根皮素抑制AQP9对水的转运后发现,与对照组相比,成熟的多核破骨细胞其细胞核数量不变,但细胞体积明显缩小,提示AQP9参与破骨细胞的分化和融合过程。但Liu等[24]通过基因敲除AQP9小鼠实验并未发现骨质有异常表现,所以可能存在其他代偿途径来弥补液体的转运。
Akiko M等[25]下调AQP9在视网膜神经节细胞表达后,证实细胞凋亡增加、胞内活性氧自由基(ROS)增多、氧化型辅酶/还原型辅酶(NAD+/NADH) 比例增高。因为其发现AQP9作为能量物质通道在线粒体内膜也有表达,并且参与乳酸从胞浆向线粒体基质的转运进而彻底氧化分解产生能量,当AQP9表达下调后,一方面是细胞能量物质供应不足,细胞最终死亡;另一方面是线粒体膜上由于转运乳酸和丙酮酸过程产生的还原型辅酶(NADH)减少,而NADH可以发挥胞内活性氧自由基(ROS)清道夫的作用,并且由于细胞能量产生不足会引起NADH过度消耗,从而导致ROS在胞浆内大量聚集并形成恶性循环,最终导致细胞死亡。Charles I等[26]报告不含血清培养液培养视网膜神经节细胞引起的细胞凋亡是由于细胞线粒体功能丧失而导致的,可通过检测细胞色素c浓度及线粒体膜电位变化加以验证。
Hiranmoy B等[27]在研究白血病细胞对化疗药物三氧化二砷及锑摄取率的实验中发现,诱导人白血病细胞株K562(慢性髓细胞白血病)过表达AQP9可增加其对化疗药物三氧化二砷及三价锑的敏感性,这归因于细胞内较高的类金属物质积聚,HL60(早幼粒细胞白血病)细胞株表现出相似的生物特性。因此可通过监测白血病患者化疗前及化疗过程中AQP9表达水平来调整化疗药物的浓度,因为三价砷和锑的毒性作用具有剂量依赖性,所以最小治疗剂量对身体的损害最小。如果可以人为的诱导AQP9在白血病细胞表达水平,就能尽量降低类金属化疗药物的使用量和(或)缩短持续用药时间,进而减少化疗药物的毒副作用,为白血病的治疗提供了新思路。
3展望
目前对于AQP9的研究越来越深入,多个系统及器官、组织、细胞、亚细胞水平的定位及调控机制逐渐被阐释,有助于从分子学水平认识疾病的发生发展过程,从而为疾病的诊断和治疗带来新的希望,也为临床药物的研发提供新思路和新靶点。但现在的研究多限于基础实验,还没有真正应用于临床,并且AQP9与疾病之间的因果关系还有待于进一步的研究。
参考文献:
[1] Verkman AS, Anderson MO, Papadopoulos MC. Aquaporins: important but elusive drug targets[J]. Nat Rev Drug Discov, 2014, 13(4):259-277.
[2] Tsukaguchi H, Weremowicz S, Morton CC, et al. Functional and molecular characterization of the human neutral solute channel aquaporin-9[J]. Am J Physiol, 1999, 277(5 Pt 2):F685-F696.
[3] Ishibashi K, Hara S, Kondo S. Aquaporin water channels in mammals[J]. Clin Exp Nephrol, 2009, 13(2):107-117.
[4] Tsukaguchi H, Shayakul C, Berger UV, et al. Molecular characterization of a broad selectivity neutral solute channel[J]. J Biol Chem, 1998, 273(38):24737-24743.
[5] Méndez-Giménez L, Rodríguez A, Balaguer I, et al. Role of aquaglyceroporins and caveolins in energy andmetabolic homeostasis[J]. Mol Cell Endocrinol, 2014, 397(1-2):78-92.
[6] Rodríguez A, Gena P, Méndez-Giménez L, et al. Reduced hepatic aquaporin-9 and glycerol permeability are related to insulin resistance in non-alcoholic fatty liver disease[J]. Int J Obes (Lond), 2014, 38(9):1213-1220.
[7] Nicchia GP, Frigeri A, Nico B, et al. Tissue distribution and membrane localization of aquaporin-9 water channel: evidence for sex-linked differences in liver[J]. J Histochem Cytochem, 2001, 49(12):1547-1556.
[8] Zheng YJ, Miao XY. Effect of aquaporin-9 expression on migratory ability of liver cancer cells [J]. Chin J Gen Surg, 2014, 23(7): 921-925.
[9] Pastor-Soler NM, Fisher JS, Sharpe R, et al. Aquaporin 9 expression in the developing rat epididymis is modulated by steroid hormones[J]. Reproduction, 2010, 139(3):613-621.
[10] Pastor-Soler N, Bagnis C, Sabolic I, et al. Aquaporin 9 expression along the male reproductive tract[J]. Biol Reprod, 2001, 65(2):384-393.
[11] Wang J, Tanji N, Sasaki T, et al. Androgens upregulate aquaporin 9 expression in the prostate[J]. Int J Urol, 2008, 15(10):936-941.
[12] Pietrement C, Da Silva N, Silberstein C, et al. Role of NHERF1, cystic fibrosis transmembrane conductanceregulator, and cAMP in the regulation of aquaporin 9[J]. J Biol Chem, 2008, 283(5):2986-2996.
[13] Badaut J. Aquaglyceroporin 9 in brain pathologies[J]. Neuroscience, 2010, 168(4):1047-1057.
[14] Badaut J, Regli L. Distribution and possible roles of aquaporin 9 in the brain[J]. Neuroscience, 2004,129(4):971-981.
[15] Schurr A. Lactate, glucose and energy metabolism in the ischemic brain (Review)[J]. Int J Mol Med, 2002,10(2):131-136.
[16] 冉建华,孙善全,汪克建,等. 水通道蛋白9表达与大鼠缺血性脑水肿形成的关系[J]. 重庆医科大学学报, 2007, 32(9): 901-906.
[17] Warth A, Mittelbronn M, Hülper P, et al. Expression of the water channel protein aquaporin-9 in malignant brain tumors[J]. Appl Immunohistochem Mol Morphol, 2007, 15(2):193-198.
[18] Tan G, Sun SQ, Yuan DL. Expression of the water channel protein aquaporin-9 in human astrocytic tumours: correlation with pathological grade[J]. J Int Med Res, 2008, 36(4):777-782.
[19] Tie L, Lu N, Pan XY, et al. Hypoxia-induced up-regulation of aquaporin-1 protein in prostate cancer cells in a p38-dependent manner[J]. Cell Physiol Biochem, 2012, 29(1-2):269-280.
[20]Kennedy KM, Dewhirst MW. Tumor metabolism of lactate: the influence and therapeutic potential for MCT and CD147 regulation[J]. Future Oncol, 2010, 6(1):127-148.
[21] Loitto VM, Huang C, Sigal YJ, et al. Filopodia are induced by aquaporin-9 expression[J]. Exp Cell Res, 2007, 313(7):1295-1306.
[22] Amiry-Moghaddam M, Lindland H, Zelenin S, et al. Brain mitochondria contain aquaporin water channels: evidence for the expression of a short AQP9 isoform in the inner mitochondrial membrane[J]. FASEB J, 2005, 19(11):1459-1467.
[23] Aharon R. Involvement of Aquaporin 9 in Osteoclast Differentiation[J]. Journal of Biological Chemistry, 2006, 281(28):19305-19309.
[24] Liu Y, Song L, Wang Y, et al. Osteoclast differentiation and function in aquaglyceroporin AQP9-null mice[J].Biol Cell, 2009, 101(3):133-140.
[25] Miki A, Kanamori A, Negi A, et al. Loss of aquaporin 9 expression adversely affects the survival of retinalganglion cells[J]. Am J Pathol, 2013, 182(5):1727-1739.
[26] Charles I, Khalyfa A, Kumar DM, et al. Serum deprivation induces apoptotic cell death of transformed rat retinal ganglion cells via mitochondrial signaling pathways[J]. Invest Ophthalmol Vis Sci, 2005, 46(4):1330-1338.
[27] Bhattacharjee H, Carbrey J, Rosen BP, et al. Drug uptake and pharmacological modulation of drug sensitivity in leukemia by AQP9[J]. Biochem Biophys Res Commun, 2004, 322(3):836-841.
Function of Aquaporin 9 in energy metabolism
ZHENG Bo, WANG Jian-bo
(DepartmentofUrology,theFirstAffiliatedHospitalofDalianMedicalUniversity,Dalian116011,China)
[Abstract]Recently, it has been known that Aquaporin 9 (AQP9), one of the members of AQPs, plays an important role in transportation of energy substrates across the plasma membrane,such as glycerol,actate,pyruvate. Coordinated biochemical processes are crucial for maintaining homeostasis, while water molecules and energy substrates almost entail biochemical processes all the way. Combined with recent studies in this field, this review focuses on the roles of AQP9 in energy metabolism,which sited on multiple mammalian systems and tissues, thereby to provide novel ideas for disease diagnosis and treatment in gene level.
[Key words]Aquporin 9; energy metabolism;gene therapy
(收稿日期:2015-04-17; 2015-08-04;修回日期:2016-03-04) 2016-03-22)
基金项目:国家自然科学基金项目(81372761)
作者简介:郑 博 (1988-), 男,安徽蚌埠人, 硕士研究生。 E-mail:994094198@qq.com 通信作者:王建伯,教授。 E-mail:w0919@sina.com
doi:综述10.11724/jdmu.2016.02.20
[中图分类号]R34
[文献标志码]A
文章编号:1671-7295(2016)02-0184-05

