C1236T、G2677T/A和C3435T基因多态性与乳腺癌分子分型的关系及意义
刘新兰,张海霞,刘尧邦,姜敏
C1236T、G2677T/A和C3435T基因多态性与乳腺癌分子分型的关系及意义
刘新兰1,张海霞2,刘尧邦2,姜敏3
摘要:目的观察多药耐药基因1(MDR1)第12、21及26外显子C1236T、G2677T/A和C3435T基因多态性在乳腺癌患者外周血中的分布,分析其与分子分型的关系。方法应用高分辨熔解曲线(HRM)技术检测400例乳腺癌患者C1236T、G2677T/A及C3435T基因多态性。采用Hardy-Weinberg遗传平衡检验进行基因型分布遗传平衡吻合度检验。参照2013年St.Gallen国际专家乳腺癌分子分型共识。分析乳腺癌患者中C1236T、G2677T/A和C3435T基因型分布特点,并探讨其与分子分型的关系。结果 (1)400例乳腺癌患者中C1236T、G2677T/A和C3435T中分别有2例、3例和2例标本未得出基因分型结果,C1236T位点CC、CT和TT基因型分别占16.08%(64/398)、44.22% (176/398)和39.70%(158/398);G2677T/A位点GG、GT、GA、TT和AT基因型分别占16.62%(66/397)、44.33%(176/ 397)、7.05%(28/397)、27.46%(109/397)和4.54%(18/397);C3435T位点CC、CT和TT基因型分别占21.11%(84/ 398)、56.03%(223/398)和22.86%(91/398)。经Hardy-Weinberg遗传平衡检验,认为C1236T、G2677T/A和C3435T基因多态性具有群体代表性(P>0.05)。(2)分子分型显示,11例人类表皮生长因子受体2(HER-2,2+)患者未行荧光原位杂交(FISH)检测予以剔除,其中Luminal A型占41.90%(163/389),Luminal B型占32.65%(127/389),HER-2过表达型占13.62%(53/389),三阴型占11.83%(46/389)。(3)C3435T位点CT/TT基因型在Luminal A型患者中的频率高于其在HER-2过表达型和三阴型患者中的频率(Χ2=12.011,P=0.001;Χ2=13.976,P<0.001),C1236T和G2677T/A基因多态性在不同分子分型中的分布差异无统计学意义(P>0.05)。结论MDR1基因C3435T位点多态性可以为乳腺癌异质性提供更合理的补充,不同乳腺癌分子分型患者中CT/TT基因表型可能对药物治疗更敏感。
关键词:乳腺肿瘤;多态性,单核苷酸;高分辨熔解曲线技术;分子分型;C1236T;G2677T/A;C3435T
单核苷酸多态性(single nucleotide polymorphism,SNP)由同一位点的不同等位基因之间个别核苷酸碱基变异引起,是人类基因多态性最常见的形式。体外细胞学研究证实多药耐药基因1(Multidrug resistance gene-1,MDR1)相关位点的SNPs可以通过改变其编码的P-糖蛋白(P-glycoprotein,P-gp)诱导其活性发生改变[1]。多项研究表明MDR1基因型与乳腺癌化疗疗效及毒性作用密切相关[2-3],但其与乳腺癌分子分型之间关系的报道国内外尚少见。本研究用高分辨熔解曲线(High resolution melting,HRM)技术检测乳腺癌患者外周血中MDR1基因C1236T、G2677T/A和C3435T位点基因型,并进行分子分型,分析乳腺癌患者MDR1基因3个位点基因型分布差异及其与分子分型之间的关系,初步探讨MDR1基因多态性作为分子分型指导下乳腺癌患者药物治疗的有效生物学标志物的临床价值。
1 资料与方法
1.1临床资料收集2011年1月—2014年12月于宁夏医科大学总医院肿瘤医院就诊并经病理学确诊、病历资料和免疫组织化学(IHC)结果中雌激素受体(ER)、孕激素受体(PR)、人类表皮生长因子受体2(HER-2)及肿瘤增殖指数(Ki-67)完整的原发性乳腺癌患者400例,年龄26~72岁,中位年龄44岁。临床分期Ⅰ期91例、Ⅱ期84例、Ⅲ期79例、Ⅳ期146例。
1.2乳腺癌分子分型判定
1.2.12013年St.Gallen国际专家乳腺癌分子分型共识 (1)Luminal A型:ER与PR均阳性、HER-2阴性、Ki-67<14%。(2)Luminal B型分2种亚型:①Luminal B型(HER-2阳性)。ER阳性,HER-2阳性,Ki-67及PR表达水平不限;②Luminal B型(HER-2阴性)。ER阳性,HER-2阴性,并同时满足下列其中一条:Ki-67≥14%、PR阴性或小于20%。(3)HER-2过表达型:HER-2阳性,ER与PR阴性。(4)三阴型:ER、PR及HER-2均阴性。
1.2.2ER、PR、HER-2及Ki-67阳性定义根据IHC测定结果,ER和PR以癌细胞核阳性染色>1%判定为阳性。Ki-67的高低判定采用临界值14%,Ki-67≥14%为高表达,<14%为低表达。HER-2阴性定义为IHC检测(-~+),或荧光原位杂交(FISH)检测阴性;HER-2阳性定义为IHC(3+),或FISH检测阳性,IHC(2+)的患者需要行FISH检测HER-2基因是否扩增。
1.3主要试剂DNA Blood Kit D3392-02试剂盒购自美国OMEGA公司;50 bp DNA Ladder CW2195购自康为世纪生物科技有限公司;PCR Master Mix(2Tap含染料)购自北京百泰克生物技术有限公司;Eva荧光素、96孔板封膜购自美国Biotium公司;引物合成及基因测序由上海生工生物工程技术服务有限公司完成。所有试剂均严格按要求保存并在有效期内使用。
1.4实验方法
1.4.1标本采集与DNA提取所有患者化疗前24 h采集外周静脉血5 mL,乙二胺四乙酸(EDTA)抗凝,抽提全血基因组DNA,并统一标定DNA样本浓度为50~100 mg/L,分装置于-20℃冰箱保存备用。
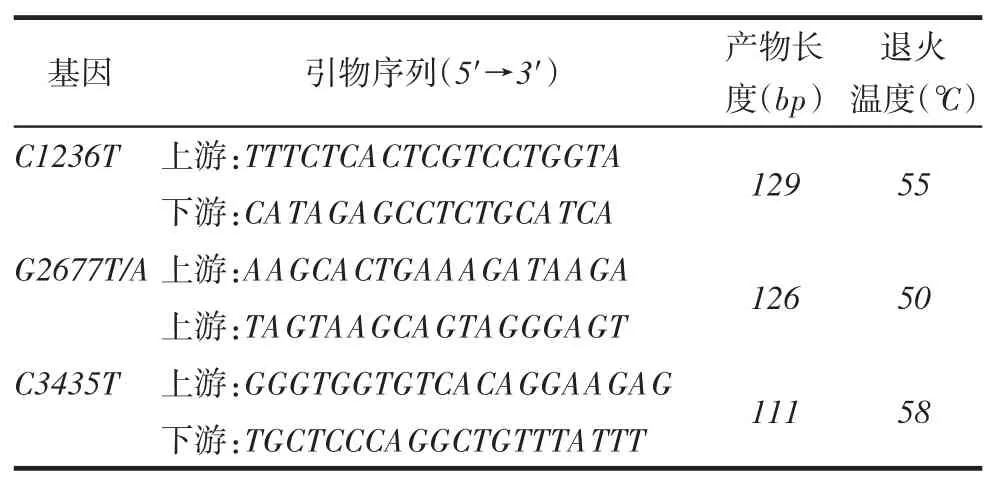
Tab.1 Primer sequences and annealing conditions for PCR-HRM of C1236T,G2677T/A and C3435T表1 C1236T、G2677T/A和C3435T引物序列及退火条件
1.4.2PCR-HRM检测MDR1基因型采用Primer Premier 5根据GenBank已知基因序列设计引物,序列见表1。HRM总反应体系为10 μL,含0.1 μmol/L上、下游引物各0.25 μL,荧光素0.5 μL,ddH2O 3 μL,TaqPCR MasterMix 5 μL,DNA模板 1 μL。采用 Roche LightCycler480检测 MDR1exon12 (C1236T)、exon21(G2677T/A)和exon26(C3435T)基因分型,HRM扩增阶段循环参数:95℃预变性2 min,95℃变性10 s,退火条件见表1,共计30个循环;72℃延伸5 min。根据PCR-HRM基因分型结果,随机抽取10%的C1236T、C3435T各基因型样本及所有G2677T/A突变基因型样本测序验证,利用Chromas软件进行终点分析。
1.5统计学方法应用SPSS 17.0软件进行数据分析,检验水准α=0.05,基因型分布遗传平衡采用Hardy-Weinberg遗传平衡检验,MDR1各位点不同基因型频率差异及其在不同分子分型中的分布差异采用Χ2检验,多个样本率的两两比较采用Χ2分割法(校正检验水准α′=α/k=0.008 3,k为比较次数,k=6)。
2 结果
2.1乳腺癌MDR1基因型分布及Hardy-Weinberg检验MDR1基因C1236T和C3435T位点分别有CC、CT和TT基因型3种曲线。G2677T/A位点,由于GT与GA,TT、AA与AT之间Tm值差异微小,初步仅得出GG基因型、GT/GA基因型和TT/AA/AT基因型3种曲线,见图1。G2677T/A位点GT与GA基因型,TT、AA与AT基因型通过基因测序区别,得出GT、GA、TT和AT 4种基因型,无AA基因型。随机抽取的样本(C3435T)测序结果与PCR-HRM结果相符,见图2。400例乳腺癌患者,C1236T基因检测中2例标本未得出分型结果,CC基因型占16.08%(64/398)、CT基因型占44.22%(176/398)、TT基因型占39.70%(158/398);G2677T/A基因检测时有3例标本未得到分型结果,GG基因型占16.62% (66/397)、GT基因型占44.33%(176/397)、GA基因型占 7.05%(28/397)、TT基因型占 27.46%(109/ 397)、AT基因型占4.54%(18/397);C3435T基因检测时有2例标本未得到分型结果,CC基因型占21.11%(84/398)、CT基因型占56.03%(223/398)、TT基因型占22.86%(91/398)。经Hardy-Weinberg检验,C1236T、G2677T/A和C3435T基因型分布符合遗传平衡定律(Χ2C1236T=1.041,P=0.594;Χ2G2677T/A= 1.099,P=0.579;Χ2C3435T=4.545,P=0.103),提示本研究入组病例具有群体代表性。

Fig.2 Gene sequencingresults of MDR1 C3435T图2 MDR1 C3435T基因测序结果
2.2不同乳腺癌分子分型中MDR1基因多态性分布
2.2.1乳腺癌分子分型400例乳腺癌患者,HER-2 IHC(2+)46例,其中11例未行FISH检测予以剔除,其余35例患者中,21例HER-2基因有扩增,14例无扩增。参照2013年St.Gallen国际专家乳腺癌分子分型共识,Luminal A型占41.90%(163/389),Luminal B型占32.65%(127/389),HER-2过表达型占13.62%(53/389),三阴型占11.83%(46/389)。
2.2.2C1236T、G2677T/A及C3435T基因多态性与乳腺癌分子分型间的关系C3435T基因多态性在不同分子分型乳腺癌患者中的分布差异有统计学意义(P<0.001),CT/TT基因型在Luminal A型患者中的频率高于其在HER-2过表达型和三阴型(Χ2= 12.011,P=0.001;Χ2=13.976,P<0.001),CT/TT基因型在Luminal A型与Luminal B型患者(Χ2=3.027,P= 0.082)、Luminal B型与HER-2过表达型患者(Χ2= 3.684,P=0.055)、Luminal B型与三阴型患者(Χ2= 4.913,P=0.027)、HER-2过表达型和三阴型患者(Χ2= 0.097,P=0.756)中的分布差异均无统计学意义。C1236T和G2677T/A基因多态性在不同分子分型中的分布差异无统计学意义(P>0.05),见表2。
3 讨论
3.1分子分型在乳腺癌临床治疗中的应用及意义乳腺癌是由多种因素协同作用的一组分子水平上高度异质性的恶性肿瘤,经常在生物学行为、分子免疫表型、对治疗的反应以及预后转归方面均存在明显的个体差异。近年来,随着乳腺癌个体化治疗观念在临床中的不断深入,以基因表达谱为基础构建乳腺癌分子水平分型的研究逐渐开展。Perou等[4]在2000年首次提出了以分子生物学为特征的乳腺癌分子分型概念。2011年St.Gallen国际乳腺癌会议上正式确立了分子分型在乳腺癌临床应用中的实际价值[5]。乳腺癌分子分型能更确切有效地反映其特殊的生物学行为和高度的肿瘤异质性,在指导乳腺癌个体化治疗方案的实施和判断预后方面发挥了不可估量的临床价值。

Tab.2 Distribution of gene polymorphisms of C1236T,2677T/A and C3435T in different molecular subtypes in breast cancer表2 C1236T、G2677T/A和C3435T基因型在乳腺癌不同分子分型中的分布 例(%)
分子分型被越来越多的临床医生作为指导乳腺癌药物治疗的参考标准。Luminal A型是临床中最常见的内分泌治疗敏感亚型,该亚型部分高危(组织学分级3级、淋巴结转移>4枚、有脉管癌栓及年龄<35岁)患者,需考虑行术后辅助化疗并且行规范内分泌治疗[6]。Luminal B型也属于内分泌治疗敏感亚型,但因Ki-67比例高,部分患者HER-2阳性,对于原发肿瘤>0.6 cm、淋巴结阳性、组织学分级≥2级且存在复发风险的患者,美国国家综合癌症网络(NCCN)指南推荐术后辅助化疗并且行规范内分泌治疗,HER-2阳性患者还需行靶向治疗。HER-2过表达型因ER、PR低表达或无表达,对内分泌治疗不敏感,但其对化疗及抗HER-2靶向治疗均反应良好。三阴型乳腺癌因ER、PR及HER-2均为阴性,无法从内分泌治疗与曲妥珠单抗靶向治疗中获益,化疗是其目前唯一的药物治疗途径。化疗在不同分子分型乳腺癌中均发挥着重要作用。关于不同分子分型乳腺癌化疗敏感性的研究,Carey等[7]对4种亚型乳腺癌进行新辅助化疗后比较发现,HER-2过表达型和三阴型患者化疗敏感性优于Luminal型。吕民豪等[8]对国内乳腺癌患者进行了相同的研究,结果显示HER-2过表达型及三阴型乳腺癌的病理完全缓解(pCR)率明显高于Luminal A型和Luminal B型患者。本研究中乳腺癌4种分子分型频率与文献报道一致[9]。
3.2MDR1基因多态性及其与乳腺癌药物治疗的关系MDR1基因位于人类cDNA第7号染色体q21.12,编码分子质量为170 ku的P-gp膜蛋白。P-gp属于ATP依赖性的膜转运体,可直接通过增加药物外排效应介导肿瘤细胞耐药。遗传药理学研究显示,MDR1具有高度的遗传多态性,迄今为止,发现其存在50多个SNPs和3种插入/缺失多态[10]。相关研究显示,C1236T、G2677T/A及C3435T位点基因多态性会影响不同组织中P-gp的表达及其活性,从而影响抗肿瘤药物、心血管药物等多种P-gp底物在人体内的代谢[11-12]。本研究C1236T、G2677T/ A及C3435T基因型分布频率与王健等[13]研究结果相似,但与在欧美人群中的研究报道[14]相比,本研究MDR1基因3个位点中突变基因型频率较高,表明该基因3个位点遗传多态性受种族、地域及环境因素差异的影响。
Kafka等[15]在晚期乳腺癌患者接受蒽环联合紫杉醇化疗的研究中发现,C3435位点TT基因型患者的化疗反应率更高。Ji等[16]通过聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术探讨MDR1基因多态性与乳腺癌患者接受蒽环联合紫杉类药物化疗应答的关系发现,C3435T位点TT基因型与CC 和CT基因型相比化疗疗效更差(P=0.003),C1236T 和G2677T/A基因多态性与化疗疗效无明显关联性。Zhou等[3]通过Meta分析探讨C1236T基因多态性与恶性肿瘤化疗反应率的关系,结果显示亚洲人群中TT基因型乳腺癌患者对化疗更敏感。
3.3乳腺癌患者MDR1基因多态性与分子分型之间的关系本课题组前期研究谷胱甘肽转硫酶T1 (GSTT1)基因分型与乳腺癌分子分型间的关系显示,在非三阴型乳腺癌(Luminal A型+Luminal B 型+HER-2过表达型)组GSTT1缺失率高于三阴型乳腺癌组[17]。推测或许MDR1基因多态性与分子分型间也存在一定关联性,本研究结果显示C3435T基因多态性在不同分子分型患者中的分布差异有统计学意义,认为Luminal A型患者C3435T基因更容易发生由碱基C→T的同义突变,引起P-gp表达水平下降或活性降低,导致癌细胞内药物外排能力下降,最终增加癌细胞内血药浓度,削弱乳腺癌耐药的程度。HER-2过表达型和三阴型患者C3435T位点CT/TT基因型分布频率低。Siegsmund等[18]报道C3435位点CC基因型个体编码P-gp量是TT基因型个体的1.5倍,提示HER-2过表达型和三阴型乳腺癌患者可能更容易发生耐药。
综上所述,本研究认为MDR1基因C3435T位点多态性可以为乳腺癌异质性提供更有效的补充,不同乳腺癌分子分型患者中CT/TT基因表型可能对药物治疗更敏感。本研究的不足之处是单用HRM一种技术检测乳腺癌患者MDR1 C1236T、G2677T/A 及C3435T基因多态性,样本量偏少,检测位点较少,未来需开展多项平行实验检测大样本中MDR1基因多个位点基因多态性,以提高基因多态性检测水平的稳定性,为MDR1基因多态性更准确地解释乳腺癌分子分型内部之间的异质性提供更可靠的理论依据。
(图1见插页)
参考文献
[1]Fung KL,Pan J,Ohnuma S,et al.MDR1 synonymous polymorphisms alter transporter specificity and protein stability in a stable epithelial monolayer[J].Cancer Res,2014,74(2):598-608.doi:10.1158/0008-5472.CAN-13-2064.
[2]Bray J,Sludden J,Griffin MJ,et al.Influence of pharmacogenetics on response and toxicity in breast cancer patients treated with doxorubicin and cyclophosphamide[J].Br J Cancer,2010,102(6):1003-1009.doi:10.1038/sj.bjc.6605587.
[3]Zhou Z,Chen Q,Zuo D,et al.ABCB1(rs1128503)polymorphism and response to chemotherapy in patients with malignant tumors-evidences from a meta-analysis[J].Int J Clin Exp Med,2015,8(1):265-272.
[4]Perou CM,Sorlie T,Eisen MB,et al.Molecular portraits of human breast tumors[J].Nature,2000,406(6797):747-752.doi:10.1038/ 35021093.
[5]Hu XC,Wang BY,Shao ZM.The Comparison between“International expert consensus of St.Gallen on The initial treatment of early breast cancer”and Chinese Anti-Cancer Association Professional Committee of Breast Cancer Guide in 2011[J/CD].Chin J Breast Dis (Electronic Edition),2011,5(4):404-407.[胡夕春,王碧芸,邵志敏.2011年《St.Gallen早期乳腺癌初始治疗国际专家共识》与中国抗癌协会乳腺癌专业委员会指南之比较[J/CD].中华乳腺病杂志(电子版),2011,5(4):404-407].
[6]Goldhirsch A,Wood WC,Coates AS,et al.Strategies for subtypesdealing with the diversity of breast cancer:highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J].Ann Oncol,2011,22(8):1736-1747.doi:10.1093/annonc/mdr304.
[7]Carey LA,Dees EC,Sawyer L,et al.The triple negative paradox:primary tumor chemosensitivity of breast cancer subtypes[J].Clin Cancer Res,2007,13(8):2329-2334.doi:10.1158/1078-0432. CCR-06-1109.
[8]Lyu MH,Qin L,Li JT,et al.Relationship of molecular subtypes with responses and ooutcome of primary breast cancer patients treated with neoadjuvant chemotherapy[J].Cancer Res Prev Treat,2015,42(8):782-788.[吕民豪,秦丽,李军涛,等.原发性乳腺癌分子分型与新辅助化疗疗效及预后的相关性[J].肿瘤防治研究,2015,42(8):782-788].doi:10.3971/j.issn.1000-8578.2015.08.007.
[9]Widodo I,Dwianingsih EK,Triningsih E,et al.Clinicopathological features of indonesian breast cancers with different molecular subtypes[J].Asian Pac JCancer Prev,2014,15(15):6109-6113.
[10]Ekhart C,Rodenhuis S,Smits PH,et al.An overview of the relations between polymorphisms in drug metabolizing enzymes and drug transporters and survival after cancer drug treatment[J].Cancer Treat Rev,2009,35(1):18-31.doi:10.1016/j.ctrv.2008.07.003.
[11]Guo C,Pei QI,Tan H,et al.Effects of genetic factors on the pharmacokinetics and pharmacodynamics of amlodipine in primary hypertensive patients[J].Biomed Rep,2015,3(2):195-200.doi:10.3892/ br.2014.395.
[12]Cizmarikova M,Wagnerova M,Schonova L,et al.MDR1(C3435T)polymorphism:relation to the risk of breast cancer and therapeutic outcome[J].Pharmacogenomics J,2010,10(1):62-69.doi:10.1038/ tpj.2009.41.
[13]Wang J,Tang JH,Zhao JH,et al.Association between MDR1 gene polymorphisms and curative effect of taxane-anthracycline chemotherapy in breast cancer[J].Chinese Journal of Clinical Oncology,2011,38(1):15-19.[王健,唐金海,赵建华,等.MDR1基因多态性与乳腺癌紫杉醇联合蒽环类药物化疗疗效的关系[J].中国肿瘤临床,2011,38(1):15-19].doi:10.3969/j.issn.1000-8179.2011.01.004.
[14]Gutierrez-rubio SA,Quintero-ramos A,Duran-cardenas A,et al. 1236 C/T and 3435 C/T polymorphisms of the ABCB1 gene in Mexican breast cancer patients[J].Genet Mol Res,2015,14(1):1250-1259.doi:10.4238/2015.February.13.3.
[15]Kafka A,Sauer G,Jaeger C,et al.Polymorphism C3435T of the MDR-1 gene predicts response to preoperative chemotherapy in locally advanced breast cancer[J].Int J Oncol,2003,22(5):1117-1121.doi:10.3892/ijo.22.5.1117.
[16]Ji M,Tang J,Zhao J,et al.Polymorphisms in genes involved in drug detoxification and clinical outcomes of anthracycline-based neoadjuvant chemotherapy in Chinese Han breast cancer patients[J].Cancer Biol Ther,2012,13(5):264-271.doi:10.4161/cbt.18920.
[17]Liu XL,Zhao YJ,Huang Y,et al.The correlationship and its clinical significance between gene polymorphisms of GSTM1,GSTT1 and GSTP1 with molecular classification in breast cancer[J].Ningxia Med J,2014,36(4):301-304.[刘新兰,赵艳娇,黄英,等.乳腺癌分子分型与GSTM1和GSTP1(rs1695)基因多态性的关系及意义[J].宁夏医学杂志,2014,36(4):301-304].doi:10.13621/ j.1001-5949.2104.04.0301.
[18]Siegsmund M,Brinkmann U,Schaffeler E,et al.Association of the P-glycoprotein transporter MDR1 C3435T polymorphism with the susceptibility to renal epithelial tumors[J].JAmSoc Nephrol,2002,13(7):1847-1854.doi:10.1097/01.ASN.0000019412.87412.
(2015-10-23收稿2016-03-18修回)
(本文编辑李鹏)
The correlation and significance of gene polymorphisms of C1236T,G2677T/A and C3435T with molecular subtypes of breast cancer
LIU Xinlan1,ZHANG Haixia2,LIU Yaobang2,JIANG Min3
1 General Hospital of Ningxia Medical University,Yinchuan 750004,China;2 School of Clinical Medicine,Ningxia Medical University;3 Department of Biochip Center,General Hospital of Ningxia Medical University
Abstract:ObjectiveTo investigate the distribution of the MDR1 exon12(C1236T),exon21(G2677T/A)and exon 26 (C3435T)gene polymorphisms in breast cancer patients,and to analyse their relationship with molecular subtypes of breast cancer.MethodsThe genotyping of C1236T,G2677T/A and C3435T were detected by polymerase chain reaction(PCR)-high resolution melting(HRM)method in 400 cases of breast cancer.The Hardy-Weinberg equilibrium test was used for genetic equilibrium distribution of genotype.The molecular subtypes of breast cancer were classified based on St.Gallen Consensus 2013.The genotype distributions of C1236T,G2677T/A and C3435T in breast cancer were analyzed.Their relationship with molecular subtypes in breast cancer was analyzed as well.Results①In 400 cases of breast cancer,there were 2,3 and 2 specimens did not get genotyping results in C1236T,G2677T/A and C3435T genotype detection.The CC,CT and TT genotypes of C1236T accounted for 16.08%(64/398),44.22%(176/398)and 39.70%(176/398).GG,GT,GA,TT and AT genotypes of G2677T/A accounted for 16.62%(66/397),44.33%(176/397),7.05%(28/397),27.46%(109/397)and 4.54% (18/397).CC,CT and TT genotypes of C3435T accounted for 21.11%(84/398),56.03%(223/398)and 22.86%(91/398)respectively.Hardy-Weinberg genetic equilibrium testing showed that polymorphisms of C1236T,G2677T/A and C3435T had group representation(P<0.05).②Eleven cases of HER-2(2+)were excluded because they were not verified by FISH de-tection when performed molecular subtype of breast cancer.Luminal A subtype accounted for 41.90%(163/389),Luminal B subtype accounted for 32.65%(127/389),HER-2 over-expression subtype accounted for 13.62%(53/389)and triple negative subtype accounted for 11.83%(46/389).③CT/TT genotype frequency of C3435T was significantly higher in breast cancer patients with Luminal A subtype than that in breast cancer patients with HER-2 over-expression subtype and triple negative subtype(Χ2=12.011,P=0.001;Χ2=13.976,P<0.001),while there was no statistical difference in C1236T and G2677T/ A gene polymorphism between different molecular subtypes of breast cancer(P>0.05).ConclusionC3435T gene polymorphism can explain more accurately heterogeneity of breast cancer.CT/TT genotype in different molecular subtypes of breast cancer may be more sensitive to drugtreatment.
Key words:breast neoplasms;polymorphism,single nucleotide;high resolution melting;molecular subtype;C1236T;G2677T/A;C3435T
中图分类号:R737.9
文献标志码:A
DOI:10.11958/20150238
基金项目:宁夏回族自治区高等学校科学研究项目(NJ201050)
作者单位:1宁夏医科大学总医院肿瘤医院肿瘤内科(邮编750004);2宁夏医科大学临床医学院;3宁夏医科大学总医院生物芯片中心
作者简介:刘新兰(1964),女,硕士研究生,主任医师,教授,主要从事肿瘤化疗相关研究

