诊断用耐热尿酸氧化酶菌株的筛选及条件优化
张玉然,纪楠楠
(济宁医学院 生物科学学院,山东 日照 276826)
诊断用耐热尿酸氧化酶菌株的筛选及条件优化
张玉然Δ,纪楠楠
(济宁医学院 生物科学学院,山东 日照 276826)
目的 分离筛选及鉴定产耐热尿酸氧化酶的菌株,优化发酵条件并研究酶学性质。方法 利用透明圈法从高温酒曲中筛选产耐热尿酸氧化酶的菌株,扩增菌株16S rDNA序列并构建系统发育进化树进行鉴定,优化菌株产尿酸氧化酶的发酵条件并研究该酶的酶学性质。结果 筛选获得一株产耐热尿酸氧化酶的菌株,经分子鉴定命名为BacillussubtilisZX-6。于优化后的最佳发酵产酶条件下(30 ℃、初始pH 8.1、4 mL/L玉米浆)尿酸氧化酶水平达135.9 U/L,比优化前提高了133.7%。该酶最适反应温度及pH分别为45 ℃和7.6,于37 ℃保温48 h后,其剩余酶活仍为17.2%,具备良好的热稳定性。结论 产耐热尿酸氧化酶菌株筛选及发酵条件优化的成功为进一步的研究奠定了良好的基础。
尿酸氧化酶;BacillussubtilisZX-6;筛选;鉴定;条件优化;酶学性质
尿酸氧化酶(Urate oxidase,EC 1.7.3.3,UOD)是嘌呤降解代谢途径中的关键酶,它以分子氧为电子受体,催化氧化尿酸为尿囊素,其分子结构依来源不同而有所差异。该酶在生物界中分布广泛,细菌、真菌、植物、两栖动物和大多数非灵长类动物体内均含此酶,而在人类及部分高等灵长目动物体内,由于UOD基因被提前终止,无法合成该酶。当人体嘌呤代谢异常时,尿酸在血液中过量积累,将引发高尿酸血症、痛风病及肾病等[1-3],开发有效治疗此类疾病的药物已成为当今研究的热点难点,UOD则是治疗该类疾病的有效药物之一[4-6]。由于高尿酸血症的发生与人们的生活方式、疾病因素密切相关,亦可定期对人体血清尿酸进行监测,及时控制尿酸水平,以预防高尿酸血症的发生[7]。目前临床多采用UOD-过氧化物酶偶联法测定人体血清尿酸的含量[8],开发一种热稳定性好、成本低廉的UOD十分必要。
早在1974年,UOD就已在黄曲霉中发现,后经提纯应用于医疗[9]。目前,研究者对UOD的研究主要集中于其临床药效,对酶热稳定性、发酵条件等方面的研究则较少。已报道的可产UOD的微生物有黄曲霉、微杆菌、坚强芽孢杆菌、铜绿假单胞菌等[10-12],且部分生物的UOD基因已在大肠杆菌及酵母中成功表达[13-14]。
本研究旨在对高温酒曲进行富集培养,涂布于筛选培养基,利用透明圈法筛选产耐热UOD的菌株。而后,对菌株的16S rDNA序列进行扩增,利用软件MEGA 7.0进行同源比对分析,构建系统进化树。同时优化菌株发酵产UOD的条件,并进行酶学性质研究,为优质廉价尿酸检测剂盒和高尿酸血证治疗药物的开发奠定基础。
1 材料与方法
1.1 材料
1.1.1 富集培养基(g/L):葡萄糖6.0,NaCl 5.0,K2HPO4·3H2O 0.8,CaCl20.1,MgCl2·6H2O 0.2,黄嘌呤2.3,FeSO4·7H2O 1.0 mg/L,Na2MoO4·2H2O 15.0 μg/L,调节pH 7.8。
1.1.2 种子培养基(g/L):NaCl 5.0,酵母粉1.0,K2HPO4·3H2O 0.8,玉米浆4.0 mL/L,葡萄糖3.0,调节pH 7.5。
1.1.3 发酵基础培养基(g/L):NaCl 5.0,葡萄糖13.0,酵母粉1.0,玉米浆4.0 mL/L,K2HPO4·3H2O 0.8,CaCl20.1,MgCl2·6H2O 0.2,FeSO4·7H2O 1.0 mg/L,Na2MoO4·2H2O 15.0 μg/L,次黄嘌呤3.0。
1.1.4 主要试剂及仪器:PCR仪(英国Fedbio公司);核酸电泳仪(北京市六一仪器厂);凝胶成像分析仪(北京市六一仪器厂);高速冷冻离心机(德国艾本德公司);超声波细胞粉碎机(宁波新芝生物科技股份有限公司);酵母粉(英国Oxoid公司);尿酸(生工生物工程股份有限公司);细菌基因组DNA提取试剂盒(天根生化科技有限公司);高温酒曲(山东徐旭酒曲有限公司)。
1.2 方法
1.2.1 富集培养及筛选:吸取10 mL制备好的高温酒曲菌悬液接入50 mL富集培养基中,于37 ℃180 r/min振荡培养1~2 d,后将菌液稀释涂布于固体筛选培养基,37℃培养5~7 d,观察菌落长势及透明圈大小。
1.2.2 发酵培养基优化:采用发酵基础培养基,60 mL发酵液(500 mL三角瓶),接种量为3%,30 ℃ 200 r/min培养,优化条件如下:
“这些纯正粮食酒绝无勾兑,案上各樽不仅酒精度不同,而且酿造年份也不同,按烈度由低到高、年份由短到长依次排列。想必您已品出差别,先是淡雅清香,渐次沁脾芬芳,继而浓郁醇厚,终于回甘无穷。”
① 温度:种子培养12 h后转接,分别于不同温度下(30 ℃、37 ℃、45 ℃)发酵培养。
② 初始pH:种子培养12 h后,转接至初始pH分别为7.1、7.6、8.1、8.6、9.1的发酵培养基中培养。
③ 玉米浆浓度:种子培养12 h后,转接到含不同浓度玉米浆(0、2.0、4.0、6.0 mL/L)的发酵培养基中培养。
④ 酵母粉浓度:种子培养12 h后,转接到含不同浓度酵母粉(0、0.6、1.2、1.8、2.4 g/L)的发酵培养基中培养。
1.2.3 菌株16S rDNA序列的扩增与分析:以提取的基因组DNA为模板,以通用引物1492R及27F为引物,进行PCR扩增。PCR设定程序如下:94 ℃预变性5 min;94 ℃变性1 min,54 ℃退火1 min,72 ℃延伸1 min,35个循环;72 ℃再延伸10 min。琼脂糖凝胶电泳检测其纯度,后将扩增产物送至生工生物工程(上海)股份有限公司进行序列的测定。使用NCBI数据库分析测序获得的菌株16S rDNA序列,并与库中已存在种属的16S rDNA序列进行比对分析,同时利用MEGA 7.0软件进行同源比对,并构建系统进化树。
1.2.4 酶学性质初探
① 最适反应温度及pH:于30 ℃、37 ℃、45 ℃、52 ℃水浴条件下进行酶活力的测定,以酶活力最高者为100%,计算不同温度下的相对酶活(%)。于45℃,分别在pH 6.4、7.0、7.6、8.2的条件下进行酶活力测定,以酶活力最高者为100%,计算不同pH下的相对酶活(%)。
② 热稳定性实验:将酶液于37 ℃保温,定时取样进行酶活力测定,以未水浴时的酶活力为100%,计算不同水浴时间下的相对酶活(%)。
① 菌体干重测定:利用细胞干重法(DCW),取150 mL发酵液,7 500 r/min离心10 min,置于105 ℃烘箱烘干至恒重,称重后计算菌体浓度(g/L)。
② 酶偶联分光光度法测定UOD酶活力:以尿酸为底物,参照文献方法进行[15-16]。
2 结果
2.1 产耐热UOD菌株的筛选 将富集培养的高温酒曲菌悬液涂布于筛选平板,37 ℃培养,根据透明圈大小进行初筛,初筛获得的菌株进行摇瓶发酵复筛,测定各菌株产UOD的水平,结果如图1所示。可知,菌株ZX-6产UOD的能力相对较高,达58.2 U/L。

图1 产耐热UOD菌株的筛选Fig.1 Screening of high thermostable UOD-producing strain
2.2 产耐热UOD菌株的分子鉴定
2.2.1 菌株16S rDNA序列的扩增:利用通用引物1492R及27F对菌株ZX-6的全基因组进行扩增,扩增产物的琼脂糖凝胶电泳分析结果如图2所示。将扩增产物进行测序,确定该菌株的16S rDNA序列片段大小为1436 bp。

图2 菌株ZX-6 16S rDNA序列扩增的凝胶电泳条带Fig.2 Agarose gel electrophoresis of 16S rDNA sequence from strain ZX-6
2.2.2 菌株系统发育进化树的构建:将菌株ZX-6 16S rDNA序列导入NCBI数据库进行比对分析,同时利用软件MEGA 7.0进行同源比对,构建系统进化树,结果如图3和表1所示。与不同种属菌株的模式菌株进行比对分析后,发现菌株ZX-6与B.subtilisstrain ATCC 6051亲缘关系较近而聚成一支。通过NCBI数据库中的BLAST程序进一步同源比对,发现菌株ZX-6与B.subtilisstrain BAB-448、B.subtilisstrain J2和B.subtilissubsp.subtilisstrain I35的同源性最高,亲缘关系最近,相似度达100%。结合构建的系统发育进化树,可知菌株ZX-6为B.subtilis下的菌株,由此将菌株ZX-6命名为B. subtilis ZX-6。

图3 基于16S rDNA序列分析构建的系统发育进化树Fig.3 The phylogenetic tree based on the analysis of 16S rDNA gene sequences

图3 基于16S rDNA序列分析构建的系统发育进化树Fig.3 The phylogenetic tree based on the analysis of 16S rDNA gene sequences

菌株名称相似度(%)ZX⁃6100B subtilisstrainBAB⁃448100B subtilisstrainJ2100B subtilissubsp subtilisstrainI35100B subtilisstrainB1199
2.3 发酵产UOD的条件优化
2.3.1 温度及pH对UOD发酵合成的影响:将菌株B.subtilisZX-6于不同温度下进行发酵培养,结果如图4所示。可知最佳发酵产酶温度为30 ℃,达84.3 U/L,产酶水平比37 ℃发酵时提高了57.0%。

图4 发酵温度对菌株B. subtilis ZX-6合成UOD的影响Fig.4 Effect of fermentation temperature on UOD biosynthesis from B. subtilis ZX-6
分析不同初始pH值条件下B.subtilisZX-6 UOD的发酵合成情况(见图5),确定最佳发酵初始pH值为8.1,达113.9 U/L,产酶水平比pH 7.1时提高了25.4%。
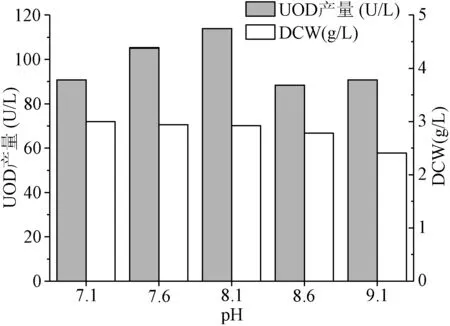
图5 发酵初始pH值对菌株B. subtilis ZX-6合成UOD的影响Fig.5 Effect of initial culture pH on UOD biosynthesis from B. subtilis ZX-6
2.3.2 氮源对UOD发酵合成的影响:大多数微生物嘌呤降解代谢的终产物为NH3、CO2和H2O等,参与此过程的降解酶的发酵合成与培养基中氮源的供给息息相关[17],UOD参与嘌呤降解代谢中间产物尿酸的降解。图6展示了添加不同浓度的玉米浆对B.subtilisZX-6生长及产UOD的影响,确定玉米浆最佳添加浓度为4 mL/L,产酶水平达114.5 U/L,比未添加时提高了170倍。

图6 添加玉米浆对菌株B. subtilis ZX-6合成UOD的影响Fig.6 Effect of corn steep liquor on UOD biosynthesis from B. subtilis ZX-6
添加不同浓度的酵母粉对B.subtilisZX-6长势及产酶的影响如图7所示。可知,最佳酵母粉添加浓度为0 g/L,这可能是由于酵母粉添加后会导致培养基中氮源富足,氮源消耗后产生的大量NH3将反馈抑制嘌呤的降解代谢,从而抑制相关降解酶的合成,后续发酵不再添加。
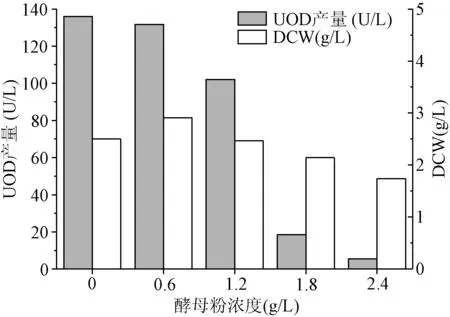
图7 添加酵母粉对菌株B. subtilis ZX-6合成UOD的影响Fig.7 Effect of yeast extract on UOD biosynthesis from B. subtilis ZX-6
2.4 酶学性质初探
2.4.1 UOD的最适反应温度及pH :酶分子只在一定pH和温度范围内表现出活性,对B.subtilisZX-6 UOD的最适反应温度及pH进行分析,结果如图8所示。由图可知,该酶最适反应温度为45℃,最适反应pH为7.6。

图8 温度(A)及pH(B)对UOD酶活力测定的影响Fig.8 Effect of temperature (A) and pH (B) on determination of UOD activity
2.4.2 UOD热稳定性分析:为考察B.subtilisUOD的热稳定性,将UOD酶液于37 ℃保温,测定不同时间处的剩余酶活,结果如图9所示。发现,水浴10 h后的剩余相对酶活为52.0%,水浴48 h后剩余相对酶活仍保留17.2%,表明所筛选的B.subtilisUOD热稳定良好。

图9 37 ℃下UOD的热失活曲线Fig.9 Thermal inactivation of UOD from B. subtilis at 37 ℃
3 讨论
UOD是生物体内嘌呤降解途径中的一种酶,可催化尿酸降解为尿囊素、CO2和H2O2。该酶作为一种重要的医药用酶,在临床上广泛用于尿酸含量的测定[18],又可作为药物缓解痛风以及尿酸水平过高引发的其他并发症[4-6],这就要求UOD必须具备良好的热稳定性。目前,研究者对来自于酵母菌和黄曲霉的UOD研究较多,并通过多种方法筛选获得了产UOD的菌株。
高温酒曲是在50 ℃~60 ℃的高温下制备而成,其中富含多种耐热微生物。本研究利用透明圈法从高温酒曲的菌悬液中筛选获得了一株产耐热UOD的菌株,扩增其16S rDNA序列并构建系统发育进化树,将该菌株命名为BacillussubtilisZX-6。发酵条件优化是提高菌株发酵产酶能力的重要手段[19-20],对影响菌株BacillussubtilisZX-6发酵产UOD的关键因素进行优化,最佳产酶条件下(30 ℃、初始pH 8.1、4 mL/L玉米浆)UOD水平达135.9 U/L,比优化前提高了133.7%。进一步研究表明,该酶最适反应温度及pH分别为45 ℃和7.6,于37 ℃保温48 h后,其剩余酶活仍为17.2%,具备良好的热稳定性。本研究可为优质廉价尿酸检测剂盒和高尿酸血证治疗药物的开发奠定基础。
[1] Richette P,Bardin T.Gout[J].Lancet,2010,375(9711):318-328.
[2]Xiong R,Umar S,Chen J.Process for production of recombinant baboon uricase in Escherichia Coli Rosetta (DE3)[J].Biotechnol Biotec Eq,2013,27(5):4141-4144.
[3]Shaaban MI,Abdelmegeed E,Ali YM.Cloning,expression,and purification of recombinant uricase enzyme from Pseudomonas aeruginosa Ps43 using Escherichia coli[J].J Microbiol Biotech,2015,25(6):887-892.
[4]黄琳秋,江筠,楼觉人.尿酸氧化酶临床疗效和安全性评价[J].国际生物制品学杂志,2016,39(2):92-96.
[5]Sherman MR,Saifer MG,Perez-Ruiz F.PEG-uricase in the management of treatment-resistant gout and hyperuricemia[J].Adv Drug Deliv Rev,2008,60(1):59-68.
[6]Release FN.FDA approves new drug for gout[J].Mol Cell Pharmacol,2010,2(4):169-171.
[7]Miao Z,Li CY,Zhao S,et al.Dietary and lifestyle changes associated with high prevalence of hyperuricemia and gout in the Shandong coastal cities of Eastern China[J].J Rheumatol,2008,35(9):1859-1864.
[8]Hibi T,Hayashi Y,Fukada H,et al.Intersubunit salt bridges with a sulfate anion control subunit dissociation and thermal stabilization of Bacillus sp.TB-90 urate oxidase[J].Biochemistry,2014,53(24):3879-3888.
[9]Fam AG.Difficlut gout and new approaches for control of hyperuricemia in the allopurinal-allergic patient[J].Curr Rheumatol Rep,2005,3(1):29-35.
[10]Zhang PC,Lu XF,Li Q,et al.Cloning and characterization of a thermostable urate oxidase from Microbacterium sp.strain ZZJ4-1[J].Chin J Biotechnol,2012,28(7):813-822.
[11]Fazel R,Zarei N,Ghaemi N,et al.Cloning and expression of Aspergillus flavus urate oxidase in Pichia pastoris[J].Springerplus,2014,3(1):1-7.
[12]Kotb E.Characterization of a thermostable uricase isolated from Bacillus firmus DWD-33 and its application for uric acid quantification in human serum[J].Protein Peptide Lett,2015,22(5):402-409.
[13]Wu SL,Chen B,Liu CQ,et al.Expression in Escherichia coli,purification and enzymatic properties of porcine urate oxidase[J].Chin J Biotechnol,2009,25(11):1664-1670.
[14]何秀萍,陈志禹,王肇悦,等.一种重组多型汉逊酵母菌及其专用重组表达载体与应用[P].中国专利,CN101255440A.公开日:2008-09-03.
[15]Hongoh Y,Sasaki T,Ishikawa H.Cloning,sequence analysis and expression in Escherichia coli of the gene encoding a uricase from the yeast-like symbiont of the brown planthopper,Nilaparvata lugens[J].Insect Biochem Mol Biol,2000,30(2):173-182.
[16]Goldman SC,Holcenberg JS,Finklestein JZ,et al.A randomized comparison between rasburicase and allopurinol in children with lymphoma or leukemia at high risk for tumor lysis[J].Blood,2001,97(10):2998-3003.
[17]张玉然,杨海麟,辛瑜,等.添加辅酶前体及流加诱导物提高黄嘌呤氧化酶发酵产率[J].食品与生物技术学报,2014,33(4):349-354.
[18]开雷,岳珂,马晓航.尿酸氧化酶的研究及其应用[J].科技通报,2008,24(2):183-187.
[19]倪志坚,王绍花,刘飞,等.乳链菌肽生物合成及高产菌株选育的研究进展[J].中国生化药物杂志,2015,35(6):171-175.
[20]马娇颖,章成昌,仇黎鹏,等.重组毕赤酵母胸腺肽α1-人血清白蛋白基因工程菌高密度发酵及分离纯化[J].中国生化药物杂志,2012,33(6):720-724.
(编校:吴茜)
Screening of the diagnostic and thermostable urate oxidase-producing strain and optimization of the fermentation conditions
ZHANG Yu-ranΔ, JI Nan-nan
(College of Life Sciences, Ji’ning Medical University, Rizhao 276826, China)
ObjectiveTo screen a thermostable urate oxidase-producing strain, optimize the fermentation conditions and study the enzymatic properties.MethodsA urate oxidase-producing strain was screened from high temperature starter based on transparent circle method. Its 16S rDNA sequence was then amplified and analyzed. Meanwhile, the phylogenetic trees were built. Optimization of the fermentation conditions from this strain was carried out. The enzymatic properties of urate oxidase were studied.ResultsA urate oxidase-producing strain, namedBacillussubtilisZX-6 by molecular identification, was obtained. The production of urate oxidase under the optimized conditons (135.9 U/L) was 133.7% higher than before. The optimum reaction temperature and pH were 45 ℃ and 7.6 respectively. The residual activity of urate oxidase at 37 ℃ for 48 h was still 17.2%.ConclusionThe successful screening of a thermostable urate oxidase-producing strain and optimization of the fermentation conditions will lay a foundation for the further research.
urate oxidase;BacillussubtilisZX-6; screening; identification; optimization of conditions; enzymatic properties
10.3969/j.issn.1005-1678.2016.09.045
山东省医药卫生科技发展计划项目(2015WS0416);济宁医学院博士科研启动基金项目(JY2015BS12);国家级大学生创新创业训练计划项目(201510443008)
张玉然,通信作者,女,博士,讲师,研究方向:医药用生物活性物质的筛选研究,E-mail:sheng666wu@163.com。
Q554
A

