大孔树脂分离纯化状元豆黄酮及其抗油脂氧化研究
黎英 刘春艳 潘银来 李子月 曾珍清 郑兰香 陈雪梅
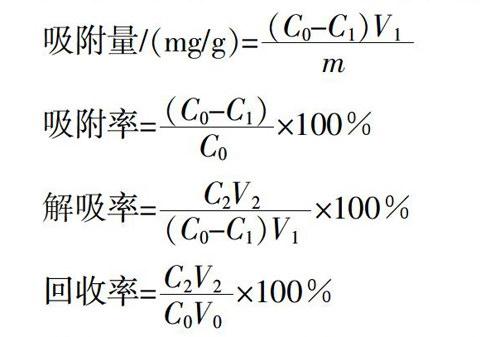


摘 要 为研究大孔树脂对状元豆黄酮的纯化工艺条件和效果,以状元豆黄酮粗提液为原料,吸附率和解吸率为评价指标,比较6种不同树脂对状元豆黄酮的静态吸附和解吸性能,筛选出AB-8树脂进行分离状元豆黄酮,并考察了纯化前后状元豆黄酮对食用油脂(猪油和花生油)的抗氧化效果。结果表明:最佳工艺条件为上样质量浓度4.0 mg/mL,上样流速3.0 BV/h,上样体积140 mL,用60 mL 65%体积分数乙醇溶液(pH6.0)为洗脱剂,以2.0 BV/h流速洗脱,得到AB-8树脂对状元豆黄酮的吸附率和解吸率分别为93.06%和95.12%,回收率为89.04%,得率为52.46%,纯度提高了约2.91倍。状元豆黄酮对油脂有一定的抗氧化效果,对猪油氧化抑制效果好于花生油,且纯化后抗氧化效果明显增强,是一种潜在的天然抗氧化剂资源。
关键词 状元豆;黄酮;大孔吸附树脂;纯化;油脂;抗氧化
中图分类号 R284.2 文献标识码 A
状元豆学名大莱豆(Phaseolus limensis Macf.),为豆科(Leguminosae),蝶形花亚科(Papilionoideae),菜豆属(Phaseolus),一年生缠绕草本植物。是福建闽西种植历史悠久的地方性特色经济作物,具有较高的食用和药用保健价值,且富含黄酮和多糖类物质[1-4]。现有研究表明,其性平和,味甘美,具有补血、祛湿、强肾、健胃、养颜防衰老等功效,在抗氧化、通便、防止骨质疏松、抑制癌细胞等方面也有显著的作用[5-6]。
黄酮类化合物是一类天然抗氧化剂,于植物体内广泛存在,具有清除自由基、抑菌、抗氧化和预防心血管疾病等功效。树脂吸附分离技术是近年来广泛应用的一种分离、纯化天然产物有效成分的方法,可显著提高有效成分的相对含量,具有选择性好、吸附容量大、吸附迅速、操作简单、成本低、解吸容易、环保及可重复使用等优点[7]。目前,有关大孔吸附树脂分离纯化植物中黄酮类化合物的研究较多[8-12],但是由于不同来源的植物黄酮组成和极性强弱存在差别,所适用的树脂类型也就有一定差异。而近年来,仅有少量研究针对状元豆营养成分、栽培、活性成分提取进行探讨[1-4],对状元豆黄酮提取物的纯化及对油脂的抗氧化作用尚未见报道。
基于以上研究背景及前期试验获得状元豆黄酮基础上,本试验采用大孔吸附树脂对状元豆黄酮粗提液进行分离,对6种大孔树脂进行静态筛选,通过静态、动态试验研究状元豆黄酮的分离纯化工艺,同时与油脂常用的Vc抗氧化剂进行比较,探讨了纯化前后的状元豆黄酮化合物对不同油脂的抗氧化效果,以期获得有效提高状元豆黄酮的富集条件,为状元豆黄酮工业化生产和作为新型天然食品抗氧化剂的开发利用及研发具有保健功效的含油食品提供科学依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 状元豆,由龙岩市上杭县农科所提供;芦丁,美国Sigma公司;树脂XDA-9、S-8、DM-130、AB-8、ADS-17、HPD-100,厦门柏嘉生物科技有限公司;亚硝酸钠、硝酸铝、维生素C、三氯甲烷、碘、冰乙酸、碘化钾等均为国产分析纯;花生油、猪油市购。
1.1.2 设备与仪器 循环水多用真空泵(SHB-3型)、旋转蒸发器(RE-2002型),郑州杜甫仪器厂;紫外可见分光光度计(UV-1800型),日本岛津公司;精密pH计(PHS-3C型),上海雷磁仪器厂;电热恒温水浴锅(DK-S24型),上海精宏实验设备有限公司;电子分析天平(TB-114型),北京赛多利斯仪器系统有限公司;玻璃层析柱(Ф35 mm×800 mm、Ф10mm×300 mm)、自动部分收集器(BSZ-100型)、恒流泵(DHL-A型),上海滬西分析仪器厂。
1.2 方法
1.2.1 大孔树脂预处理 将XDA-9、S-8、DM-130、AB-8、ADS-17、HPD-100大孔树脂用95%乙醇浸制,搅拌,待树脂沉淀,倾去上层悬浮小颗粒。选取(Ф35 mm×800 mm)玻璃层析柱,湿法装柱。先用95%乙醇以2 BV/h洗脱至流出液加等量蒸馏水不变浑浊后,再用蒸馏水洗脱至无醇味。用5% HCl溶液浸泡5 h后蒸馏水洗至中性,再用5% NaOH溶液浸泡5 h后蒸馏水洗至中性,用蒸馏水浸泡备用。
1.2.2 状元豆黄酮提取、鉴定及含量测定
(1)状元豆黄酮粗提液的制备。将状元豆干燥、粉碎过60目筛,脱脂备用。准确称取一定量放入150 mL三角瓶中,按照文献[3]中参数略作修改提取状元豆黄酮,即按液料比30 ∶ 1(mL/g)加入60%体积分数的乙醇,在设定的超声处理条件(40 ℃、工作1.5 s、间隙2 s)、450 W的超声功率下提取40 min,提取2次后真空抽滤,浓缩,得状元豆黄酮的粗提液。真空干燥备用。
(2)黄酮的定性检验。盐酸镁粉反应:于状元豆黄酮的乙醇提取液中加入少许镁粉,振摇后滴入几滴浓盐酸,1~2 min后观察颜色变化。
氢氧化钠溶液反应:于状元豆黄酮的乙醇提取液中加入几滴1%的NaOH, 1~2 min后观察颜色变化。
三氯化铝溶液反应:于状元豆黄酮的乙醇提取液中加入几滴1%的AlCl3,通过纸斑反应,1~2 min后置于紫外光下观察颜色变化。
(3)黄酮的含量测定。以芦丁作为标准品,按照文献[3]方法绘制标准曲线,回归方程为:A=10.585C+0.046 4,R2=0.999 8,C(黄酮质量浓度)在0.0~0.05 mg/mL范围内与A(吸光度)具有良好的线性关系。将粗提液稀释,取1 mL置于25 mL容量瓶中,按照上述标准曲线同法操作后测吸光度值,代入回归方程计算提取液中总黄酮含量。
1.2.3 大孔树脂静态吸附、解吸试验
(1)大孔树脂的静态筛选。分别称取2.0 g上述处理好的6种(XDA-9、S-8、DM-130、AB-8、ADS-17、HPD-100)大孔树脂,于150 mL具塞磨口锥形瓶中,依次加入30.0 mL质量浓度为2.407 mg/mL的状元豆黄酮粗提液,振荡(25 ℃,120 r/min,24 h),将树脂过滤,测定滤液吸光度并计算平衡质量浓度。用蒸馏水冲洗上述吸附饱和的树脂3~5次,加入体积分数为95%的乙醇50.0 mL振荡(25 ℃,120 r/min,24 h),过滤测定各树脂解吸液吸光度并计算解吸液质量浓度,按以下公式计算各树脂吸附量、吸附率、解吸率和回收率,选出最佳的分离纯化状元豆黄酮大孔树脂。
(2)大孔树脂AB-8的静态吸附动力学。按照1.2.3-(1)节所述方法振荡吸附,测定1、2、3、4、5、7、9、11、13、15、18、21、24 h的吸附平衡液中状元豆黄酮质量浓度,绘制动力学曲线。
(3)上样液质量浓度对大孔树脂AB-8吸附效果的影响。用蒸馏水将状元豆粗提物配制成质量浓度为1.0、2.0、3.0、4.0、5.0、6.0、7.0 mg/mL的上样液,各取50 mL分别加至经预处理好的2.0 g树脂,振荡(25 ℃、120 r/min、4 h)后测定各吸附平衡液状元豆黄酮质量浓度,进而计算吸附率。
(4)上样液pH值对大孔树脂AB-8吸附效果的影响。准确称取7份2.0 g预处理好的树脂于150 mL具塞磨口锥形瓶中,各分别加入pH值(用1 mol/L HCl溶液和1 mol/L NaOH溶液调节)为2.0、3.0、4.0、5.0、6.0、7.0、8.0上样液50 mL(质量浓度为4.0 mg/mL),振荡(25 ℃、120 r/min、4 h)后测定各吸附平衡液状元豆黄酮质量浓度,进而计算吸附率。
(5)洗脱剂乙醇体积分数对大孔树脂AB-8解吸效果的影响。将吸附饱和的树脂用蒸馏水冲洗除去残留液后抽滤,分别加入体积分数为35%、45%、55%、65%、75%、85%、95%的乙醇溶液各50 mL,振荡(25 ℃、120 r/min、24 h)后测定各解吸平衡液状元豆黄酮质量浓度,进而计算洗脱率。
(6)洗脱液pH值对大孔树脂AB-8解吸效果的影响。将吸附饱和的树脂用蒸馏水冲洗除去残留液后抽滤,加入用1 mol/L NaOH溶液和1 mol/L HCl溶液调节pH值至2.0、3.0、4.0、5.0、6.0、7.0、8.0乙醇溶液(体积分数为65%)各50 mL,振荡(25 ℃、120 r/min、24 h)后测定各解吸平衡液状元豆黄酮质量浓度,进而计算洗脱率。
1.2.4 大孔树脂AB-8动态吸附、洗脱试验
(1)上样流速和体积对大孔树脂AB-8吸附效果的影响。用湿法装柱,将10 g预处理好的大孔树脂AB-8装入玻璃层析柱(Ф10 mm×300 mm,1BV约20 mL)。按上述优化实验结果,取一定体积质量浓度为4.0 mg/mL的状元豆黄酮粗提液,用恒流泵调节分别以1.0、2.0、3.0、4.0、5.0、6.0、7.0 BV/h流速通過树脂柱,用部分收集器以每10 mL为一组收集流出液,并测定各流出液状元豆黄酮质量浓度,绘制流出液黄酮质量浓度变化曲线。
(2)洗脱流速对大孔树脂AB-8解吸效果的影响。按上述优化实验吸附条件,把7份质量浓度为4.0 mg/mL的状元豆黄酮粗提液,分别以3 BV/h的流速通过树脂柱,待吸附完全后,用蒸馏水以3~4 BV/h流速冲洗树脂柱至流出液无色(以除去多糖及蛋白质等杂质,用苯酚-浓硫酸法和考马斯亮蓝法检测)。再用一定体积65%乙醇溶液(pH6.0)分别以1.0、1.5、2.0、2.5、3.0、3.5 、4.0 BV/h洗脱流速(用恒流泵调节)进行洗脱,用部分收集器收集洗脱液,测定流出液状元豆黄酮吸光度并计算其质量浓度,绘制AB-8树脂动态洗脱曲线。
(3)洗脱体积对大孔树脂AB-8解吸效果的影响。按1.2.4-(2)节条件操作,一定体积65%的乙醇溶液(pH6.0)用恒流泵调节以2 BV/h的洗脱速度进行洗脱,10 mL体积收集1管,测定、计算并绘制变化曲线。
1.2.5 状元豆黄酮对油脂抗氧化试验 参照文献[13]推荐的碘量法,油脂中的过氧化物在无水酸性条件下,使I-定量氧化成I2,I2与I-结合生成易溶于水的I3-,利用标准碘液吸光值与I3-的吸光值进行比较定量。参考文献[24]的方法处理,在25 mL具塞比色管中,依次加入2.0 mL冰醋酸-氯仿和1.0 mL 1%淀粉溶液,分别取0.0、0.1、0.2、0.3、0.4、0.5、0.6 mL已标定过的KI-I2标准溶液(含碘 0.00~1.26 μg),加去离子水定容至刻度,摇匀,取上层清液,以去离子水为参比,在353 nm波长处测定吸光度,I2含量(m/μg)对吸光度值(A)的线性回归方程为:m=224.215 3A+56.078 5,R2=0.998 5。
采用国际上通用的Schall烘箱强化贮存法考察状元豆黄酮提取物对油脂的抗氧化作用[14],于250 mL锥形瓶中各称取20 g动物油(或花生油),分为8组,每组设 3个平行实验,加入不同比例(0.02%、0.04%、0.06%)的状元豆黄酮提取物和0.02%Vc,用漩涡混合器摇匀后,与空白对照组(未添加任何抗氧化剂的油脂)置于(65±1)℃恒温培养箱中加速氧化,间隔一段时间取定量待测试油样于15 mL干燥的比色管中,加入冰醋酸-氯仿混合溶液3 mL混匀,再加入饱和KI碱液0.2 mL轻摇30 s,然后置暗处3 min,去离子水加至刻度后加塞,颠倒混匀 2~3次,静置约5~10 min,待水相澄清后,取上清液于353 nm处测吸光值A,以空白作参比,并由回归方程计算出碘含量。按下式计算POV(油脂过氧化值)及η(抗氧化剂对油脂的氧化抑制率)。比较不同浓度状元豆黄酮对油脂抗氧化作用[15-17]。
式中POV0为未对油脂进行强制氧化初始时的过氧化值;POV1为添加抗氧化剂(黄酮或Vc)的油脂强制氧化后的过氧化值;POV2为空白对照组(即未添加任何抗氧化剂的油脂)强制氧化后的过氧化值。
2 结果与分析
2.1 状元豆黄酮提取物的鉴定
实验结果表明,状元豆黄酮提取物与盐酸镁粉、NaOH和AlCl3溶液反应,依次产生橙色泡沫溶液、溶液变黄色及在紫外光下呈黄绿色荧光,综合3个颜色试验,初步鉴定得出状元豆提取液中含有黄酮类化合物[18]。
2.2 大孔树脂静态吸附和解吸试验
2.2.1 大孔树脂类型的确定 通过比较不同型号树脂的极性、孔径大小、比表面积及考察静态吸附解吸试验对状元豆黄酮吸附和解吸特性,筛选出适合状元豆黄酮分离纯化的最优树脂(见表1)。从表1可知,6种树脂的吸附和解吸性能差异较大,其中AB-8树脂的吸附率、解吸率和回收率,显著高于其他5种树脂(p<0.05)。HPD-100树脂吸附率虽比较高,但解吸率比较低,而S-8树脂的解吸率虽然与AB-8树脂相近,但吸附率却明显低于AB-8树脂。其原因可能是由于状元豆黄酮类化合物含有酚羟基,呈现一定的弱极性,在孔径较小的弱极性AB-8树脂上更容易吸附,故吸附量相对较高;同时可能由于AB-8树脂比表面积较大,有利于洗脱,故解吸率和回收率相应也较大。考虑到树脂对状元豆黄酮类化合物的分离富集效果、洗脱难易及解吸率高低,故选定AB-8大孔树脂作进一步研究。
2.2.2 大孔树脂AB-8的静态吸附动力学 从图1可看出,AB-8树脂在较短时间内完成了对状元豆总黄酮的吸附作用,并且在3 h左右吸附基本达到饱和,之后吸附动力学曲线随着时间的延长逐渐趋于平缓。因此从节约时间和吸附效果看,大孔树脂AB-8可快速吸附状元豆黄酮类化合物,并满足工业化生产要求。
2.2.3 上样液质量浓度对AB-8树脂吸附效果的影响
由图2可知,上样液质量浓度低时,状元豆黄酮吸附率也低,当质量浓度为4.0 mg/mL时,吸附率值达到最大,之后随质量浓度的增加却呈现下降趋势。这可能是由于样品质量浓度过低时,被吸附分子与树脂吸附基团之间接触的机会少,致使吸附率低;当质量浓度增大到一定值后,由于AB-8树脂的粒径(0.3~1.25 mm)较小,会发生多层吸附,导致树脂内部微孔堵塞利用率降低。此外浓度较高时,黄酮溶液溶解性会降低,杂质含量增加,使分子扩散受抑制,不利于状元豆黄酮与树脂的结合造成吸附率下降。故选择4.0 mg/mL为上样液质量浓度为宜。
2.2.4 上样液pH值对AB-8树脂吸附效果的影响
上样液的酸碱度变化会影响目标成分在溶液中的电离程度,使其在溶液中的存在形式和溶解度相应发生改变,进而影响溶液的极性和大孔树脂与目标成分之间的作用力及吸附效果[19]。由图3可知,大孔树脂AB-8对状元豆黄酮的吸附率,随上样液pH值的增大呈现先升高后降低趋势,在pH值为 4~6時AB-8树脂对状元豆黄酮的吸附率差别不大(p>0.05)。由于状元豆黄酮类化合物含多羟基酚类而呈现一定弱酸性,在酸性条件下,有利于其保持分子状态,进而易于其借助范德华力被树脂吸附;在碱性条件下则使状元豆黄酮类化合物分解离子化,导致不利与树脂发生物理吸附。考虑到未调节pH值之前状元豆黄酮原液pH值为5.72~5.86,为了减少因pH调节引起提取液中黄酮含量及其他物质的变化,因而本试验中不调节状元豆黄酮上样液的pH值。
2.2.5 洗脱剂乙醇体积分数对AB-8树脂解吸效果的影响 由图4可知,解吸率随乙醇体积分数的增加呈现先增大后减小趋势,当乙醇体积分数达65%时解吸效果最好。这可能是由于乙醇体积分数较低时,状元豆提取液中混杂的糖类、蛋白质等水溶性物质大量溶出不利于总黄酮类物质的洗脱;而乙醇体积分数过大时,提取液中的醇溶性杂质和亲脂性强的成分溶出量加大,与黄酮类化合物形成竞争,也造成了黄酮物质的溶解量减小。故选择65%体积分数乙醇溶液洗脱。
2.2.6 洗脱液pH值对AB-8树脂解吸效果的影响
由图5可知,AB-8树脂的解吸率受洗脱剂pH的变化影响较大,当pH<6时,随着pH值的升高状元豆黄酮解吸率相应地增加,当pH=6时解吸率达最大值(83.55%)。随后解吸率明显下降,这可能与状元豆黄酮提取物呈弱酸性有密切关系。故解吸液pH值选取6.0较为合理。
2.3 大孔树脂AB-8动态吸附、洗脱试验
2.3.1 上样流速和体积对AB-8树脂吸附效果的影响 一般情况下,目标物质量浓度在流出液为上样液的1/10左右时,认为基本达到了目标物的泄漏点,泄露点出现时间越早,说明样液中目标物吸附愈不充分[20-21]。由图 6可看出,泄漏液中的黄酮质量浓度,随上样流速的增大泄露点出现越早,流速为4.0、3.0、2.0、1.0 BV/h时树脂泄露点依次出现在90、140、170、200 mL附近,流速>5.0 BV/h后未出现泄漏点。这可能是因为在相同时间内,流速越小,黄酮提取液与树脂接触时间越长,向树脂内部扩散越充分,从而吸附量也就越大;反之,流速越大,接触时间过短来不及被吸附就流出,从而使泄漏液中状元豆质量浓度偏高,因此,流速越慢吸附效果越好,但泄漏点出现延迟,造成操作周期延长,生产效率低。从图6也可知,泄漏液浓度随上样液体积的增加呈先递增后趋向恒定(即接近上样浓度),上样体积过大时大孔树脂容易中毒,物料不能完全被树脂吸附导致损失较多,且树脂再生困难,影响其重复利用;反之,体积过小会使树脂不能被充分利用,利用率低,增加成本[22]。综合考虑,吸附流速和上样体积为3.0 BV/h,140 mL比较适宜。
2.3.2 洗脱流速对AB-8树脂解吸效果的影响 由图7可看出,解吸率在1~2 BV/h区间时变化不大,超过2 BV/h后随洗脱流速的增加而剧降。说明洗脱流速越慢,解吸的效果越好,这可能是由于流速太快,洗脱剂与被吸附黄酮接触时间过短,导致深层吸附的黄酮不能很好地被置换出来;而流速太慢,耗时,不利于工业化生产。因此在解吸率不受影响的情况下,洗脱速度选择2.0 BV/h较为合理。
2.3.3 洗脱体积对AB-8树脂解吸效果的影响 由图8可知,在2 BV/h流速条件下,收集液峰值出现在20~50 mL之间,曲线的峰形对称性较好,没有明显拖尾现象,洗脱集中。洗脱体积接近60 mL时,几乎检测不出状元豆总黄酮,说明基本将树脂吸附的状元豆黄酮全部洗脱,洗脱达到终点。因此洗脱剂用量选择60 mL即可。
2.4 状元豆黄酮纯化结果
根据上述各因素的优化结果,在试验中将10 g已预处理好的大孔树脂AB-8湿法装柱,质量浓度为4.0 mg/mL(不需调pH值)的状元豆黄酮提取液,上样140 mL在3.0 BV/h 吸附流速条件下进行吸附试验,再用60 mL,65%体积分数的乙醇溶液(pH6.0)以2.0 BV/h流速进行洗脱试验,收集洗脱液,测定,浓缩,真空干燥。结果得到大孔树脂AB-8对状元豆黄酮黄酮的吸附率和解吸率分别为93.06%和95.12%,回收率为89.04%,经纯化处理后状元豆黄酮纯度由粗体液的18.03%提高到52.46%,纯度提高了约2.91倍。
2.5 状元豆黄酮对油脂抗氧化作用
从表2、表3可见,状元豆黄酮对猪油的抗氧化性随其使用量的增加而呈现不同程度的增强,经过纯化处理后的状元豆黄酮组的抗氧化效果总体优于未纯化处理的组。随着放置时间的延长,添加了0.04%纯化过的状元豆黄酮组对猪油的抗氧化效果与0.02% Vc组的效果接近,0.06%的粗提物组的抗氧化效果稍强于0.02%的纯提物组;在添加0.02%~0.06%的质量浓度范围内,状元豆黄酮对植物油的氧化抑制效果的变化趋势大体相同,随质量浓度增大而逐渐增强,具有一定剂量相关效应,但总体上,未经纯化处理的状元豆黄酮组的抗氧化效果总体不及纯化处理过的组,其中添加了0.02%Vc组对花生油的抗氧化效果优于0.02%~0.06%粗提物组,弱于0.02%~0.06%纯提物组。
总体上看,花生油组氧化抑制效果不及猪油组明显,这可能与猪油主要由饱和脂肪酸组成,相对植物油中不饱和脂肪酸更难氧化有关,且经过纯化处理过的状元豆黄酮的抗氧化效果明显上升;并且在烘箱强制温度相同下,随着放置时间的延长,含不同质量浓度的粗提组和纯提组对油脂的保护率均先升高后有所下降,这可能是因为前期阶段抗氧化剂对油脂氧化所起的作用较大,到后期由于长时间强制既使油脂发生自氧化反应程度更加剧烈,同时又使抗氧化剂的抗氧化活性成分减少所致[23-24]。
3 讨论
不同类型的大孔吸附树脂由于其本身化学结构、孔径大小、极性、比表面积的不同,使它们对同一黄酮类化合物的吸附、解吸特性不尽相同[25]。通过静态试验,比较6种不同树脂对状元豆黄酮的吸附效果,并综合考虑降低成本及适合工业化生产等因素,选取吸附量及回收率较高的AB-8树脂研究其吸附动力学过程,发现其能快速实现吸附平衡,且对状元豆黄酮吸附、解吸效果优于其他树脂。其对状元豆黄酮的吸附率和解吸率分别达到91.28%和87.24%,吸附量和回收率分别达到32.95 mg/g和79.63%,吸附平衡时间约为3 h,是一种分离纯化状元豆黄酮的理想树脂。
同一类型的树脂也可能因为不同植物材料所提取的类黄酮不同(如分子量、结构及吸附力的不同)及粗提液黄酮含量的不同,而使分离纯化效果有所差异。刘广淼等[9]在研究AB-8树脂纯化香鳞毛蕨总黄酮时,确定黄酮纯度由4.21%提高到了38.40%;方贺等[10]运用AB-8型树脂黄花柳花总黄酮进行富集,可使总黄酮由纯化前(4.60±0.27)%提高至(51.99±0.47)%;骆党委等[11]利用AB-8大孔吸附树脂分离芦柑皮总黄酮时,确定其纯度从17.8%提高到63.1%;王晓林等[26]采用AB-8型大孔树脂对锦灯笼宿萼总黄酮富集,确定总黄酮含量由原来的6.95%提高到23.62%;张昊等[27]研究AB-8大孔树脂纯化山丹鳞茎总黄酮后表明,黄酮纯度从10.56%提高到35.13%。因此,选择合适的树脂类型,并对其进行科学的试验设计和各因素参数分析,有利于提高纯化效率。本试验以吸附率、解吸率为评价指标,通过静态及动态吸附和洗脱试验考察了状元豆黄酮质量浓度、上样液流速以及洗脱剂浓度等影响因素,确定了最佳分离纯化条件:140 mL,4.0 mg/mL(不需调pH值)的状元豆黄酮提取液以3.0 BV/h流速上样,用60 mL体积分数65%乙醇溶液(pH6.0)以2.0 BV/h流速洗脱,在此工艺条件下,大孔树脂AB-8对状元豆黄酮黄酮富集由原来的18.03%提高到52.46%,吸附率和解吸率分别为93.06%和95.12%,回收率为89.04%,纯度提高了2.91倍。通过验证试验证明AB-8树脂作为状元豆黄酮初步纯化材料是可行,且分离纯化条件也可为工业生产提供理论参考。
油脂抗氧化试验结果也表明:状元豆黄酮对植物油和动物油均有一定的抗氧化效果,總体而言,在氧化抑制效果上随状元豆黄酮质量浓度增大而逐渐增强,猪油组的抑制效果明显好于花生油组,且经过纯化处理后抗氧化效果明显上升。在相同强制温度下,随时间的延长不同质量浓度的粗提组和纯提组对油脂的保护率均先升高后有所下降。说明状元豆黄酮作为油脂新型天然的抗氧化剂是有潜力、可行的,尤其经树脂纯化处理后可明显降低其在食品中的添加量,既可抑制油脂氧化,延长保质期,又可起到保健作用,因此有望在含油食品中推广应用。
本研究同时存在着许多不足,比如,仅从上样质量浓度、上样流速及洗脱体积等单因素方面研究分析试验条件对纯化状元豆黄酮的效果,未考虑各单因素的相互作用;对状元豆黄酮的分离纯化仅局限在大孔树脂的初级阶段,对深层次如有效成分的分级分离和组分结构分析等方面问题的探究都有待进一步深入。
参考文献
[1] 张莉萍, 杨俊霞. 状元豆无公害高产栽培技术[J]. 农村科技, 2010(11): 47.
[2] 张其宾, 林炎照, 林警周, 等.莱豆新品种龙莱1号的选育[J].福建农业科技, 2011(5): 56-57.
[3] 黎 英, 赖丹妮, 尤双圳, 等. 超声波辅助提取状元豆总黄酮工艺条件优化[J]. 食品工业科技, 2015, 36(9): 224-228.
[4] 黎 英, 尤双圳, 赖丹妮, 等. 响应面法优化超声波辅助提取状元豆多糖工艺[J]. 食品与发酵工业, 2015, 41(4): 223-229.
[5] 翁维健. 中医饮食营养学[M]. 上海: 上海科学技术出版社, 1992: 121-123.
[6] 中国药典委员会. 中国药典[M]. 北京: 中国医药科技出版社, 2010: 183-184.
[7] Deng T, Jia J F, Luo N, et al. A dual-task method for the simultaneous detoxification and enrichment of stilbene glycoside from polygonum multiflorum roots extract by macroporous resin[J]. Chem Eng J, 2014, 237: 138-145.
[8] Dong Y, Zhao M M, Sun-Waterhuouse D X, et al. Absorption and desorption behaviour of the flavonoids from Glycyrrhiza glabra L. leaf on macroporous adsorption resins[J]. Food Chem, 2015, 168: 538-545.
[9] 刘广淼, 常 缨. AB-8大孔吸附树脂分离香鳞毛蕨总黄酮的研究[J]. 中国农学通报, 2014, 30(16): 170-174.
[10] 方 贺, 宋旺弟, 陈 文. 大孔吸附树脂纯化黄花柳花总黄酮工艺研究[J]. 北方园艺, 2016(6): 120-124.
[11] 骆党委, 叶 静, 黄雅燕, 等. AB-8吸附树脂精制芦柑皮总黄酮及黄酮类化合物的分离[J]. 食品科学, 2014, 35(6): 30-35.
[12] 王竞红, 王 非, 杨成武, 等. 大孔吸附树脂分离纯化紫穗槐叶类黄酮的研究[J]. 中南林业科技大学学报, 2016, 36(1): 112-118.
[13] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T5009.37-2003. 食用油脂卫生标准的分析方法[S]. 北京: 中国标准出版社, 2004: 303-308.
[14] 赵新淮, 张 娜, 王 琳. 油脂过氧化值的碘量测定法比较研究[J]. 中国油脂, 2003, 28(4): 60-62.
[15] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB2760-2011. 食品添加剂使用卫生标准[S]. 北京: 中国标准出版社, 2012.
[16] 王 淼, 吕晓玲. 食品生物化学[M]. 北京: 中国轻工业出版社, 2009: 122-123.
[17] Oueslati S, Ksouri R, Falleh H, et al. Phenolic content, antioxidant, anti-inflammatory and anticancer activities of the edible halophyte Suaeda fruticosa Forssk[J]. Food Chemistry, 2012, 132(2): 943-947.
[18] 中国科学院上海药物研究所植物化学研究室. 黄酮体化合物鉴定手册[M]. 北京: 科学出版社, 1981: 56-57
[19] Li C, Zheng Y Y, Wang X F, et al. Simultaneous separation and purification of flavonoids and oleuropein from Olea europaea L.(olive)leaves using macroporous resin[J]. Journal of the Science of Food and Agriculture, 2011, 91: 2 826-2 834.
[20] Xiong Q P, Zhang Q H, Zhang D Y, et al. Preliminary separation and purification of resveratrol from extract of peanut(Arachis hypogaea)sprouts by macroporous resins[J]. Food Chem, 2014, 145: 1-7.
[21] 吴海霞, 吴彩娥, 李婷婷, 等. 大孔树脂纯化银杏叶黄酮的研究[J]. 现代食品科技, 2013, 29(12): 2 964-2 969.
[22] 苗修港, 余 翔, 張贝贝, 等. NKA-9大孔树脂纯化香椿叶黄酮类物质工艺优化[J]. 食品科学, 2016, 37(8): 32-38.
[23] 王晓静, 陈莉华, 黄玉龙. 火棘果黄酮对油脂的抗氧化活性[J]. 天然产物研究与开发, 2015, 27: 909-914.
[24] 张俊生, 陈莉华, 段琛圭, 等. 车前子中黄酮提取物对油脂的抗氧化活性研究[J]. 中国粮油学报, 2012, 27(2): 62-67.
[25] Ma C, Tao G, Tang J, et al. Preparative separation and purification of rosavin in Rhodiola rosea by macroporous adsorption resins[J]. Separation and Purification Technology, 2009, 69: 22-28.
[26] 王晓林, 钟方丽, 薛健飞, 等. AB-8型大孔树脂对锦灯笼宿萼总黄酮的富集工艺[J]. 北方园艺, 2015(12): 131-135.
[27] 张 昊, 绍 青, 贺晓龙, 等. AB-8大孔树脂纯化山丹鳞茎总黄酮的研究[J]. 榆林学院学报, 2016, 26(3): 31-33.

