瘤胃源酵母的分离筛选及对不同底物发酵能力影响
王晓成,刘军花,朱伟云,毛胜勇(南京农业大学动物科技学院,江苏 南京 210095)
瘤胃源酵母的分离筛选及对不同底物发酵能力影响
王晓成,刘军花,朱伟云,毛胜勇*
(南京农业大学动物科技学院,江苏 南京 210095)
本实验旨在分离筛选瘤胃源酵母,研究其对不同饲料底物的发酵特性。实验以山羊及奶牛瘤胃液为菌源,利用酵母选择性培养基,通过分离筛选、生长曲线测定和26S rD N A鉴定,获得1株生长速度较快的Meyerozyma属酵母菌株。在此基础上,采用体外发酵技术,分别以羊草与精料混合物、马铃薯淀粉和玉米淀粉为底物,以奶牛瘤胃液为接种物,研究该酵母菌株对瘤胃微生物体外发酵参数的影响。结果表明,在以羊草和精料混合物为底物时,添加瘤胃源酵母显著降低了发酵液p H和乳酸浓度(P<0.001),显著提高了丙酸浓度和干物质消失率(P<0.05);以玉米淀粉为底物时,添加该酵母菌显著降低了发酵液p H和乳酸浓度(P<0.001);以马铃薯淀粉为底物时,显著降低了p H(P<0.05),提高了丙酸浓度(P<0.05);但在上述3种底物条件下,添加酵母菌对发酵液中总产气量、氨态氮、乙酸、丁酸、异丁酸、戊酸和异戊酸浓度无显著影响(P>0.05)。采用Real-tim e PC R测定结果表明,添加该酵母菌可显著提高以羊草和马铃薯淀粉为底物时发酵液中总菌16S rD N A的挎贝数(P<0.05)。结果说明,本研究分离获取的瘤胃源酵母可提高瘤胃微生物对羊草精料混合物的降解能力,降低羊草精料混合物组和玉米淀粉组发酵液中乳酸浓度,提示该菌株可能具有提高日粮消化利用效率、促进丙酸生成和瘤胃细菌生长的作用。
酵母;瘤胃;分离;体外发酵
http://cyxb.lzu.edu.cn
王晓成,刘军花,朱伟云,毛胜勇.瘤胃源酵母的分离筛选及对不同底物发酵能力影响.草业学报,2016,25(5):141-148.
W A N G Xiao-Cheng,LIU Jun-H ua,Z H U W ei-Y un,M A O Sheng-Yong.Isolation and characterization of ru m en yeast and an evaluation ofits effect on ru minal ferm entation with different types of substrate.Acta Prataculturae Sinica,2016,25(5):141-148.
在当前反刍动物生产中,为提高奶牛的产奶量,养殖者常在奶牛日粮中使用高比例精料,但这种饲喂方式常导致奶牛瘤胃中乳酸浓度增加,瘤胃微生物功能紊乱。研究表明,相对于瘤胃中挥发性脂肪酸而言,乳酸的电离度更大,因此,其更容易引发瘤胃p H降低[1]。为防止瘤胃中乳酸累积和瘤胃微生物功能失衡,人们常采用添加酵母培养物或乳酸利用菌等方式来降低瘤胃乳酸浓度,使瘤胃微生物功能恢复正常。一些研究表明,添加活性酵母菌可提高干物质和中性洗涤纤维的降解率[2-3],提高奶产量[2];Chaucheyras等[4]发现,酵母培养物可促进瘤胃乙酸菌对氢的利用;促进瘤胃总细菌和纤维降解菌数量的增长,加强反刍兽新月单胞菌对乳酸的利用,显著提高丙酸含量[5-7]。但也有一些报道显示,添加酵母对奶牛瘤胃发酵无显著影响。如那日苏等[8]报道,添加酵母培养物对育肥羊体重、瘤胃p H和挥发性脂肪酸(volatile fatty acid,V F A)含量没有显著影响;New bold等[5]发现,体外发酵中添加酵母对p H、丙酸、乙酸和总挥发性脂肪酸浓度均无显著影响。由此,这些研究提示,酵母菌对奶牛瘤胃发酵的影响结果并不一致。分析其原因,我们发现当前养殖生产中所用酵母培养物或活酵母生产菌株主要分离自外界环境。实际上,源自消化道外的酵母菌的最适生存环境可能与瘤胃环境并不一致,这种生存环境的不一致可能直接影响其在动物消化道内的生长速度与作用效果,这也许是当前生产中所用活酵母或酵母培养物在奶牛等反刍动物生产中的应用效果不稳定的主要原因之一。相对而言,利用源于动物消化道内的微生物,可能避免以上应用效果不稳定的问题。由此,本论文拟分离筛选瘤胃源性酵母,并通过体外发酵技术,研究其对瘤胃微生物发酵参数的影响。
1 材料与方法
1.1 动物饲养及瘤胃液的获取
本实验于2013年12月至2014年6月进行。分离酵母的瘤胃液采自于3头装有永久性瘤胃瘘管的干奶期奶牛(体重为590±48 kg,干物质采食量为12 kg/d,日粮精粗比为2∶8)及4头装有永久性瘤胃瘘管的波杂山羊(平均体重27±3 kg,干物质采食量为850 g,全粗料)的瘤胃液为菌源。体外研究瘤胃源酵母对瘤胃发酵参数的影响的实验中所用接种瘤胃液采自上述奶牛。奶牛与山羊皆单栏饲喂,自由饮水。
1.2 培养基成分及其配制
酵母浸出物3 g(购自奥博星公司),麦芽提取物3 g(购自奥博星公司),蛋白胨5 g(购自奥博星公司),葡萄糖10 g(购自奥博星公司),琼脂20 g(购自奥博星公司),链霉素0.1 g(购自Sig m a公司),加蒸馏水至1 L,115℃高温灭菌15 min,待培养基温度降至60℃后,制备平板备用[9]。酵母浸出物麦芽糖液体培养基组成:酵母浸出物3 g,麦芽浸出物3 g,蛋白胨5 g,葡萄糖10 g,链霉素0.1 g,加蒸馏水至1 L,115℃高温灭菌15 min。乳酸液体培养基:酵母抽取物3 g,麦芽抽取物3 g,蛋白胨5 g,乳酸7.5 g(购自国药集团),链霉素0.1 g,加蒸馏水至1 L,115℃高温灭菌15 min。
1.3 瘤胃源酵母菌的分离纯化
实验当日,于饲喂前分别从奶牛或山羊瘤胃腹囊下部抽取瘤胃液,将瘤胃液经3层纱布过滤。取1 m L过滤所得的瘤胃液进行梯度稀释,将稀释至10,100和1000倍的瘤胃液进行平板涂布,将培养基放入39℃培养箱中培养,72 h后取出培养基,挑取形态、颜色等不同单菌落进行反复纯化,至所获菌株的形态完全一致后保存备用[9]。
1.4 酵母菌的筛选
将分离出的酵母菌株置于含一定浓度乳酸的培养基中,39℃培养24 h后,通过测定培养基中乳酸含量,计算酵母对乳酸的利用能力,将乳酸利用率较高的菌株放入液体培养基中39℃培养24 h,在波长为600 n m下测定其生长曲线,最终筛选出生长较快的疑似酵母菌株[9]。
1.5 酵母菌的鉴定
将分离到的疑似菌经体外培养24 h后,收集菌体用于D N A提取,D N A提取参照M urray等[10]的方法。所用引物序列如下:上游引物N L-1(5′-G C A T A T C A A T A A G C G G A G G A A A A G-3′),下游引物N L-4(5′-G G T CC G T G T T T C A A G A C G G-3′)。P C R扩增体系为:94℃预变性4 min,94℃变性45 s,55℃退火45 s,72℃延伸1 min,30个循环,72℃修复延伸10 min。通过1%琼脂糖电泳,150 V、100 m A下20 min电泳观察,P C R产物电泳条带切割所需D N A目的条带,P C R产物送至上海生工有限公司测序。测序结果通过B L A S T数据库进行比对,再用M A G A(6.0)软件构建系统进化树。
1.6 体外法测定瘤胃源菌株对瘤胃发酵参数的影响
1.6.1 厌氧培养基制备 培养基成分:292 m g/L K2H P O4,240 m g/L K H2P O4,480 m g/L(N H4)2S O4,480 m g/L NaCl,100 m g/L M gS O4·7 H2O,64 m g/L CaCl2·H2O,4000 m g/L Na2C O3,600 m g/L半胱氨酸盐酸盐。将上述组分溶于1 L去离子水中,混合后通入饱和二氧化碳至完全厌氧[11-12]。
1.6.2 实验分组与瘤胃液接种 实验分别以羊草精料混合物、玉米淀粉和马铃薯淀粉为底物,在各底物条件下,分别按酵母添加量为0,0.625×107,1.250×107和2.500×107C F U/m L设为4组,每组设4个重复。试验另设16个添加羊草精料混合物的发酵瓶,用于底物干物质消化率的测定。
试验开始前,准确称取266 m g羊草精料混合物(羊草∶精料=6∶4,精料由玉米与豆粕组成,比例为7∶3,羊草、玉米与豆粕均经粉碎、过筛和烘干处理)、玉米淀粉和马铃薯淀粉于100 m L发酵瓶中。于晨饲前经瘤胃瘘管分别从奶牛腹囊下部抽取瘤胃内容物,经3层纱布过滤。将所得瘤胃液与厌氧培养基按1∶2混合,取混合厌氧培养基40 m L厌氧条件下分装至上述已装入底物的并提前预热至39℃的发酵瓶中后,各发酵瓶经橡胶塞密封、铝盖封口和平衡气压后,迅速放入39℃培养箱静置培养24 h。培养期间,分别于接种后2,4,6,8,12,24 h采用气压转换仪测定各发酵瓶中的总产气量。发酵结束后立即测定各发酵瓶中发酵液的p H值,同时冰浴终止发酵,随后取样备测氨态氮和乳酸等指标。另将16个添加羊草精料混合物的发酵瓶转移至离心管中,4℃下10000 r/min离心15 min,105℃烘干测定干物质消失率。
1.6.3 发酵液D N A提取 取发酵结束后发酵液1 m L,采用珠磨法,参照M urray等[10]的方法提取瘤胃微生物总D N A。
1.6.4 Real-tim e P C R法定量总菌数量 参照K onstantinov等[13]的方法,利用iCycler IQ real-tim e检测系统及配套软件(iCycler optical syste m interface software version 2.3)进行Real-tim e P C R分析。P C R反应体系为20μL:S Y B R Green Supermix(Bio-Rad,美国)10.4μL,上、下游引物(25μm ol/L)各0.4μL、D N A样品2μL、超纯水6.8μL。引物为1369F(5′-C G G T G A A T A C G T T C Y C G G-3′)和1492 R(5′-G G W T A C C T T G T T A C G A C T T-3′),反应条件参照Su等[14]的方法。
1.7 指标测定
p H的测定采用手持型p H计;产气量测定参照T heodorou等[15]的方法;氨态氮测定参照冯宗慈和高民[16]的方法;挥发性脂肪酸测定参照秦为琳[17]的方法。
乳酸的测定采用试剂盒法(购自南京建成生物工程研究所),按照试剂盒说明书,分别向空白管、标准管、测定管中相对应地加入0.02 m L蒸馏水、3 m m ol/L标准液和待测样品,然后均加入1 m L酶工作液和0.2 m L显色剂,混匀后置于37℃水浴锅中准确反应10 min,再分别加入2 m L终止液,混匀,用空白管调零,在530 n m波长、1 c m光径下分别测各管吸光度值。乳酸的计算公式如下:
瘤胃液中乳酸含量(m m ol/L)=(测定O D值-空白O D值)/(标准O D值-空白O D值)×标准品浓度(3 m m ol/L)×样品测试前稀释倍数
1.8 数据统计
数据经Excel(2010)初步处理后,采用SPSS(20.0)统计软件中的O ne-way A N O V A分析,显著性水平置于0.05。
2 结果与分析
2.1 瘤胃源酵母的富集与分离纯化
采用涂板划线分离法,大量挑取形态与颜色不同的菌落,经连续分离纯化,最终从奶牛瘤胃液中分离出30株疑似酵母菌株,从山羊瘤胃液中分离出64株疑似酵母菌株,共计94株。如图1所示,对分离菌株进行乳酸利用率试验,结果共获得14株乳酸利用率相对较高的疑似酵母菌株。对上述14株菌进行生长速率测定,结果发现其中6株菌生长速率较低,另外9株生长速率相对较快(图2)。结合生长速率与乳酸利用率数据结果,最终筛选到1株乳酸利用率较高及生长速度较快的疑似酵母菌株,编号为Y09。
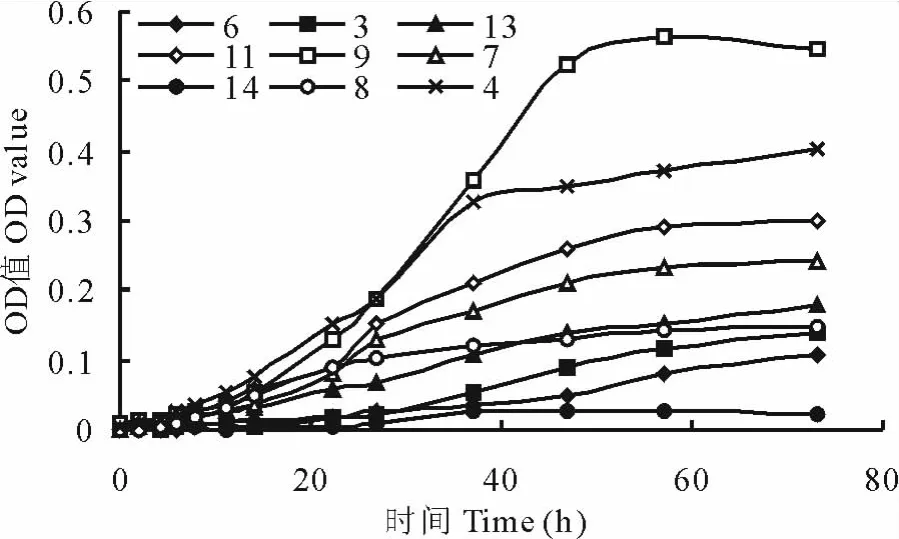
图2 分离酵母的生长曲线Fig.2 Growth curve of isolates
2.2 菌株鉴定
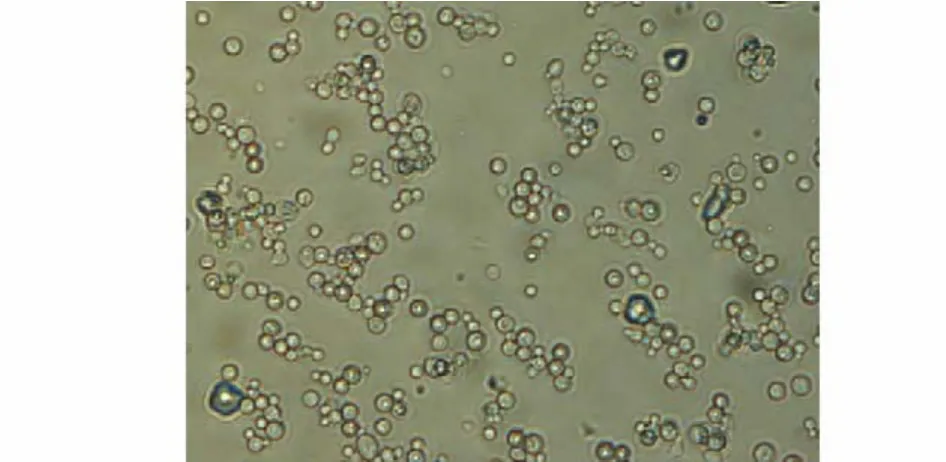
图3 Y09号酵母菌形态(×400)Fig.3 M orphological characterization of isolates Y09
2.2.1 菌落及菌体形态的观察 将Y09号菌在麦芽糖琼脂培养基上培养72 h后,菌落呈乳白色,棋子状突起,边缘整齐,表面无光泽,菌落松软湿润,发酵产物呈酒香味;在麦芽汁液体培养基中静止培养时,有菌环,沉淀,液体澄清。400倍光学显微镜下显示该菌为椭圆状,细胞多为单个或成对出现,出芽生殖(图3)。2.2.2 Y09号酵母菌的系统发育学分析 采用B L A S T软件,将该菌扩增序列与GenBank中的序列进行同源性比较(图4)。结果发现,Y09号菌与Meyerozyma属的相似性达100%,故将该菌归属于Meyerozyma属酵母菌。该菌序列已提交GenBank,序列号为K P797883.1。
2.3 体外法评定添加Y09号瘤胃源酵母对3种不同底物发酵参数的影响
2.3.1 添加Y09号酵母菌对羊草精料混合物为底物时瘤胃微生物体外发酵参数的影响 与对照组相比,当以羊草精料混合物为底物时,添加活酵母显著降低了发酵液p H和乳酸含量(P<0.001)(表1),显著提高了(P<0.05)丙酸浓度、总菌数和干物质消失率,其中酵母添加量为0.625×107C F U/m L组的p H降低了2%,酵母菌添加量为2.500×107C F U/m L组的乳酸浓度降低了25%,丙酸浓度提高了6%,总菌数提高了31%,干物质消失率提高了17%;但添加酵母对氨态氮浓度、总产气量、乙酸、丁酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸浓度与乙丙比无显著影响(P>0.05)。随酵母添加量的逐渐增加,添加酵母对p H的影响呈线性和二次方效应(P<0.001),但对乳酸、丙酸浓度和底物干物质消失率仅呈线性效应(P<0.05)。

图4 筛选酵母26S rD N A系统进化树的构建Fig.4 Phylogenetic tree of 26S rD N A sequence of isolate
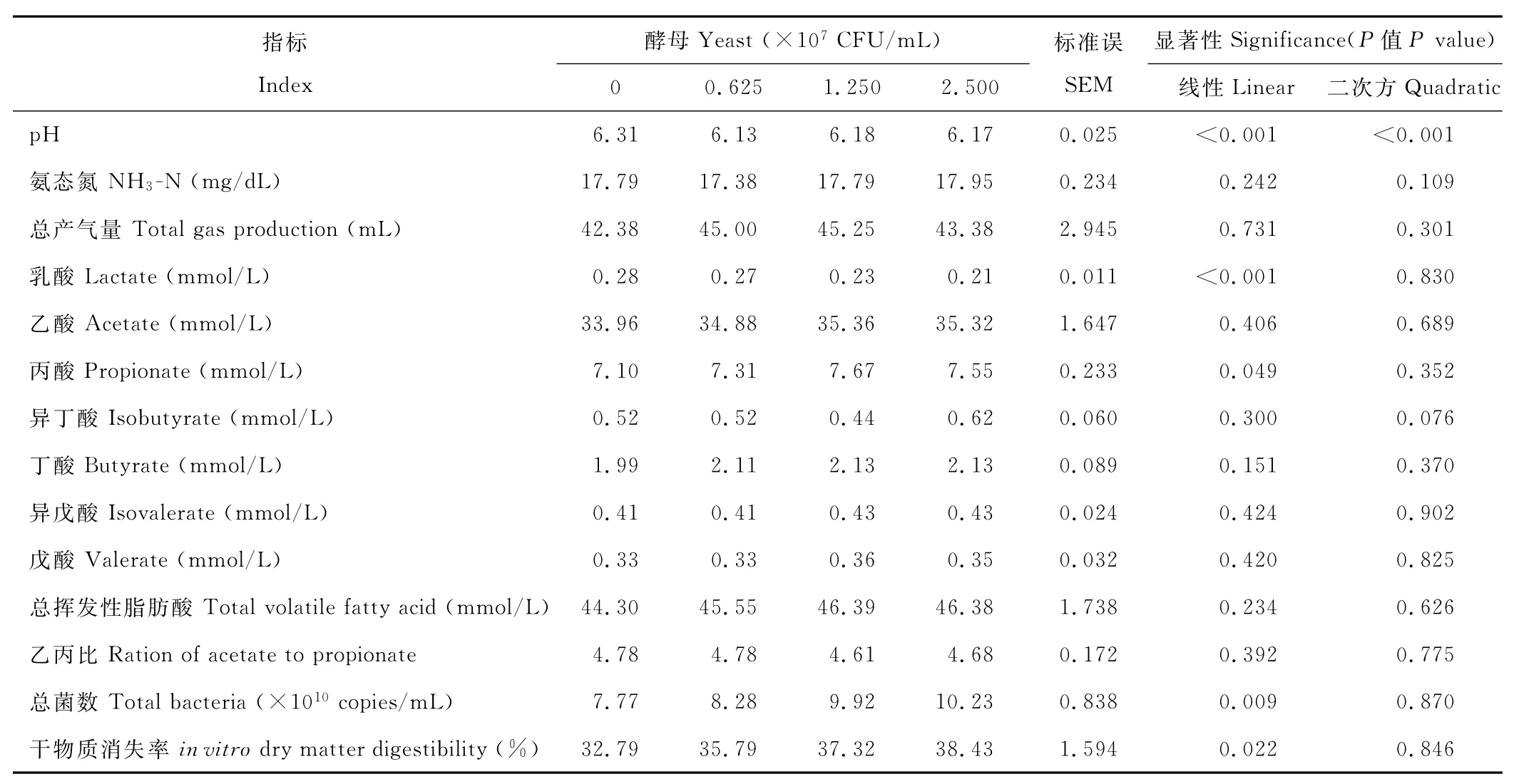
表1 以羊草精料混合物为底物时添加瘤胃源酵母对瘤胃微生物体外发酵参数的影响Table 1 Effect of live yeast addition on invitro fermentation with mixture of chinese wildrye and concentrate as substrate
2.3.2 添加Y09号酵母菌对以玉米淀粉为底物时瘤胃微生物体外发酵参数的影响 与对照组相比,当以玉米淀粉为底物时,添加活酵母显著降低了发酵液p H和乳酸含量(P<0.001)(表2),其中2.500×107C F U/m L组的发酵液p H值降低了3%,乳酸浓度降低了76%;但对总产气量、氨态氮、乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸浓度、总菌数和乙丙比无显著影响(P>0.05)。随酵母添加量的逐渐增加,添加酵母对发酵液p H和乳酸浓度的影响呈线性效应(P<0.001)。
2.3.3 添加Y09号酵母菌对以马铃薯淀粉为底物时瘤胃微生物体外发酵参数的影响 以马铃薯淀粉为底物时,与对照组相比,添加活酵母显著降低了发酵液p H(P<0.05)(表3),提高了丙酸浓度和总菌数量(P<0.05),其中,酵母添加量为2.500×107C F U/m L组的发酵液p H降低了1%,丙酸提高了9%,总菌数提高了19%;但添加酵母未显著影响总产气量、氨态氮、乳酸、乙酸、丁酸、异丁酸、戊酸、异戊酸和总挥发性脂肪酸浓度(P>0.05)。随酵母添加量的逐渐增加,添加酵母对发酵液p H和丙酸浓度的影响呈线性效应(P<0.05)。
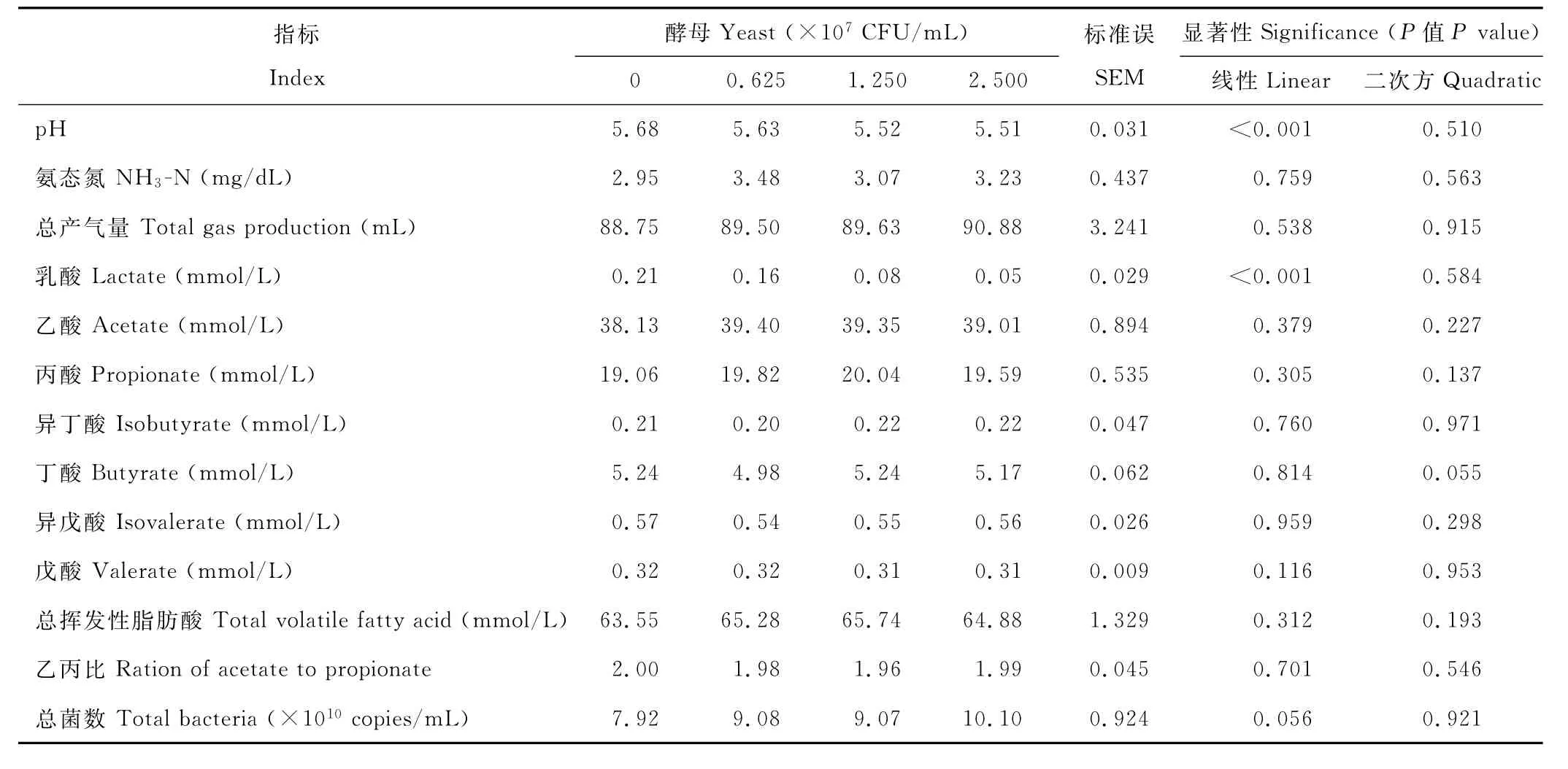
表2 以玉米淀粉为底物时添加酵母对瘤胃微生物体外发酵参数的影响Table 2 Effect of live yeast addition on invitro fermentation with corn starch as substrates
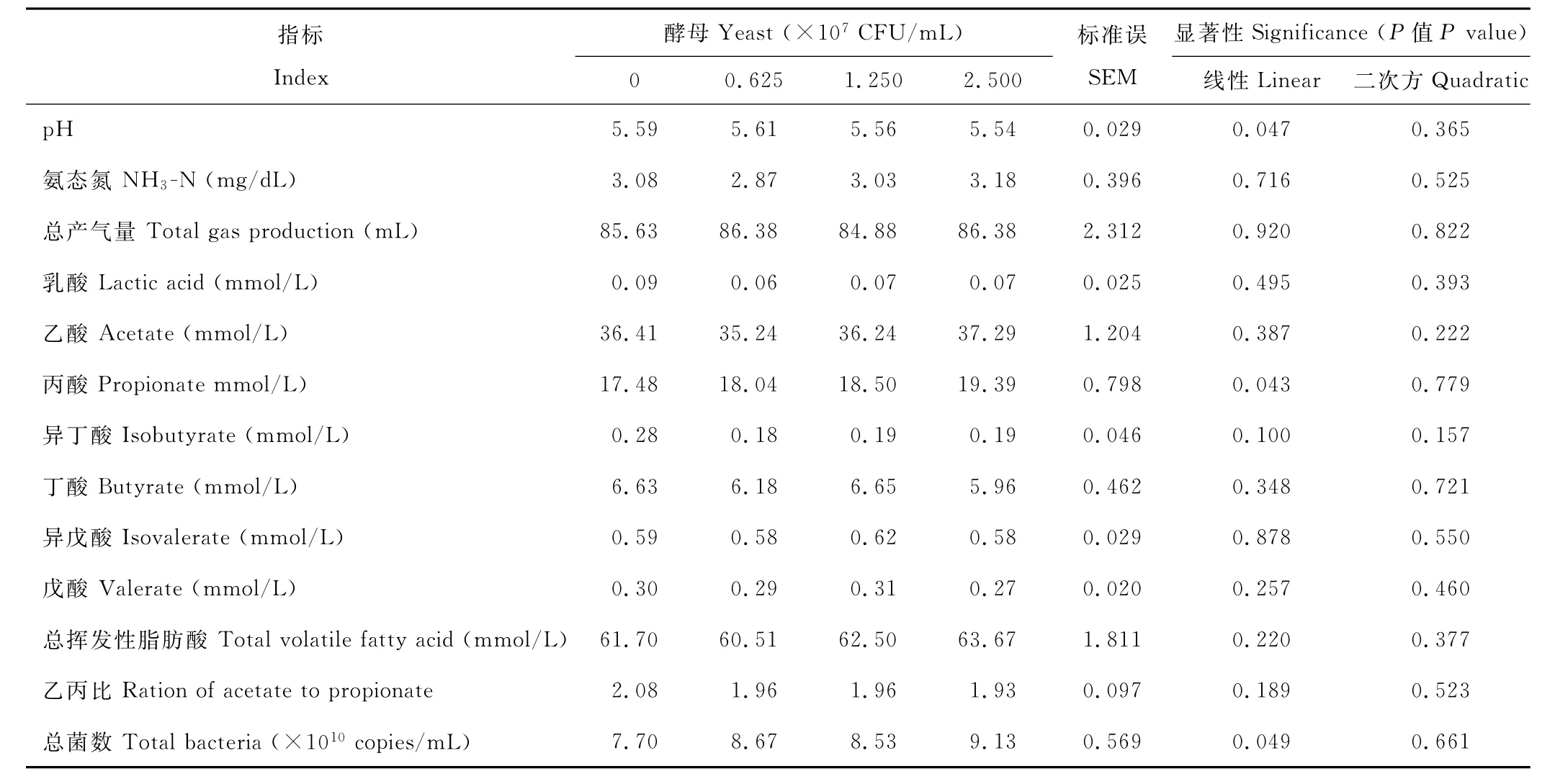
表3 以马铃薯淀粉为底物时添加酵母对瘤胃微生物体外发酵参数的影响Table 3 Effect of yeast addition on invitro fermentation with potato starch as substrate
3 讨论
研究表明,在反刍动物饲料中添加活酵母或酵母培养物可改善瘤胃内环境、调整菌群结构以及提高日粮纤维消化率[18];同时,一些报道显示,添加酵母还可显著提高瘤胃内乳酸的利用速度,降低瘤胃乳酸浓度[11]。本研究从山羊及奶牛瘤胃中分离获得了14株酵母菌,通过乳酸利用和生长速度比较实验,筛选到一株乳酸利用率较高且生长速度较快的酵母菌株。该酵母菌对乳酸的利用率可达69.92%,说明其对乳酸具有较强的代谢能力。同时体外试验也表明,添加所分离的酵母菌显著降低了羊草精料组和玉米淀粉组发酵液中的乳酸浓度,该结果进一步说明,所分离酵母具有利用乳酸的能力。我们在以前的研究中发现,瘤胃中的一些乳酸利用菌具有利用乳酸生成丙酸的能力[19]。结合本实验的报道结果,我们认为,在瘤胃微生物区系中,除瘤胃细菌具有利用乳酸的能力外,瘤胃内的酵母等部分微生物也具有代谢乳酸的能力,这些结果显示,瘤胃微生物可能通过多类微生物代谢利用乳酸。
瘤胃p H是衡量瘤胃发酵程度的一项重要参数,本实验结果表明,添加瘤胃源酵母显著降低了3种底物下发酵液的p H值,由于p H值是反映瘤胃酸度的一个重要指标,p H值降低暗示瘤胃微生物发酵产物尤其是挥发性脂肪酸产量增加,但本试验发现,添加酵母并未显著影响挥发性脂肪酸浓度,仅在数字上提高了总挥发性脂肪酸的产量。该结果与Chung等[20]报道基本一致,其在研究中也发现,添加酵母可影响奶牛瘤胃p H值,但并未显著影响瘤胃液中挥发性脂肪酸浓度。本研究显示,添加酵母对羊草、玉米淀粉和马铃薯淀粉3种底物下乳酸浓度的影响并不一致。其中对以玉米淀粉组影响最大、羊草精料混合组次之,而对马铃薯淀粉组无显著影响。该结果说明,酵母对瘤胃微生物发酵参数的影响具有底物特异性。To m ankova和H o m olka[21]报道,较其他谷物类饲料比较,玉米淀粉的瘤胃降解速率相对较低,其原因与玉米淀粉相对较低的溶解度及较低比例的支链淀粉有关。本试验中,玉米淀粉处理组中未添加酵母组的发酵液p H值相对高于马铃薯组,其原因可能与玉米淀粉的较低发酵速率有关。由于相对较高的p H值及较低的底物发酵速率有利于瘤胃微生物菌群结构稳定及功能发挥,因此,玉米淀粉组发酵液中乳酸浓度显著下降可能该底物下乳酸利用菌群的活力较高有关。另一方面,较玉米淀粉与马铃薯淀粉等单一原料为底物时比较,羊草与精料混合物组发酵液p H值更高,而高p H值有利于瘤胃乳酸利用菌生长并发挥作用,这也可能是该底物条件下乳酸浓度较低的主要原因之一。
在瘤胃中,丙酸主要通过两条途径生成,一为乳酸经琥珀酸途径生成丙酸,另一方面是经丙烯酸途径生成。本研究发现,添加活酵母显著提高了羊草精料混合组发酵液中丙酸浓度,该结果与乳酸浓度降低相对应,结果说明,在以羊草精料混合物为底物时,添加9号酵母可能有利于瘤胃微生物发酵乳酸生成丙酸。但本研究发现,添加酵母虽未显著影响马铃薯淀粉组发酵液中乳酸浓度,但显著提高了丙酸浓度。我们推测,以马铃薯淀粉为底物时,发酵液中丙酸浓度显著升高可能与添加酵母影响了丙烯酸途径相关菌群的组成有关。本实验中,添加酵母对3种不同底物条件下发酵液中总菌数均有不同程度的提高,其中对以羊草和精料混合物为底物时的作用效果更明显。此外,本实验结果还显示,添加瘤胃源酵母菌显著促进了羊草精料混合物组的瘤胃降解率,该结果也与Lila等[11]的报道一致。这些结果也进一步证实,添加酵母可影响瘤胃微生物的生长与功能。
4 结论
本实验从奶牛和山羊瘤胃液中分离到94株疑似酵母菌,基于乳酸利用率和生长参数,筛选获得1株乳酸利用率较高及生长速率较快的酵母菌,基因比对表明,该酵母菌属于Meyerozyma属。体外试验表明,添加酵母可显著提高羊草精料混合物的底物降解率,降低羊草精料混合物组和玉米淀粉组中的乳酸浓度,提高羊草精料混合物组和马铃薯淀粉组发酵液中丙酸含量以及发酵液中总菌数。结果说明,所筛选的瘤胃酵母菌具有影响瘤胃微生物发酵的作用,但影响程度和作用效果与底物类型相关。
References:
[1]Skory C D,H ector R E,Gorsich S W,etal.A nalysis of a functional lactate perm ease in the fungus Rhizopus.Enzy m e and Microbial Technology,2010,46:43-50.
[2]Willia ms P E V,Tait C A G,Innes G M,et al.Effects of the inclusion of yeast culture(Saccharomycescerevisiae plus growth m ediu m)in the diet of cows on milk yield and forage degradation and ferm entation patterns in the ru m en of sheep and steers.Journal of A nim al Science,1991,69:3016-3026.
[3]Carro M D,Lebzien P,Rohr K.Effects of yeast culture on ru m en ferm entation,digestibility and duodenalflow in dairy cows fed a silage based diet.Livestock Production Science,1992,32:219-229.
[4]Chaucheyras F,Fonty G,Bertin G,etal.Invitro H2utilization by a ru minal acetogenic bacteriu m cultivated alone orin association with an archea m ethanogen is stim ulated by a probiotic strain of Saccharomycescerevisiae.A pplied and Environ m ental Microbiology,1995,61:3466-3469.
[5]New bold C J,W allace R J,M cIntosh F M.Different strains of Saccharomycescerevisiae differin their effects on ru minal bacterial nu m bers in vitro and in sheep.Journal of A nim al Science,1995,73:1811-1818.
[6]Sullivan H M,M artin S A.Effects of Saccharomycescerevisiae culture on in vitro mixed ru minal microorganis m ferm entation.Journal of Dairy Science,1999,82:2011-2016.
[7]M artin S A,Nisbet D J.Effect of direct-fed microbials on ru m en microbialferm entation.Journal of Dairy Science,1992,75:1736-1744.
[8]Na R S,Gui R,Ao C J,etal.Effects of yeast culture of ru minal ferm entation and growing proferm ance of sheep.Chinese A nim al H usbandry and Veterinary M edicine,2004,(1):6-9.
[9]Sirisan V,Pattarajinda V,Vichitphan K,etal.Isolation,identification and growth determination oflactic acid-utilizing yeasts fro m the ru minal fluid of dairy cattle.Letters in A pplied Microbiology,2013,57(2):102-107.
[10]M urray A E,Preston C M,M assana R.Seasonal and spatial variability of bacterial and archaeal asse m blages in the coastal waters near A nvers Island.A ntarctica A pplied and Environ m ental Microbiology,1998,64(7):2585-2595.
[11]Lila Z A,M oha m m ed N,Yasui T,etal.Effects of a twin strain of Saccharomycescerevisiae live cells on mixed ru minal microorganis m ferm entation in vitro.Journal of A nim al Science,2004,82(6):1847-1854.
[12]W ang F Y,Li Y.M ethod invitro study of acarbose regulation function of sim ulating ru m en acidosis.Review of Chinese A nim al H usbandry and Veterinary M edicine,2012,(1):22-50.
[13]Konstantinov S R,S midt H,de Vos W M.Representational difference analysis and real-tim e PC R for strain-specific quantification of Lactobacillussobrius sp.nov.A pplied and Environ m ental Microbiology,2005,71(11):7578-7581.
[14]Su Y,Yao W,Perez-Gutierrez O N,etal.16S riboso m al R N A-based m ethods to m onitor changes in the hindgut bacterial co m m unity of piglets after oral ad ministration of Lactobacillussobrius S1.A naerobe,2008,14(2):78-86.
[15]Theodorou M K,Willia ms B A,Dhanoa M S,etal.A sim ple gas production m ethod using a pressure transducer to determine the ferm entation kinetics of ru minant feeds.A nim al Feed Science and Technology,1994,48(3):185-197.
[16]Feng Z C,Gao M.Determination on N H3-N of ru minalfluid by colorim etric m ethod im prove m ent.Inner M ongolian Journal of A nim al Sciences and Production,1993,4:40-41.
[17]Qing W L.Determination on volatile fatty acids by colorim etric m ethod im prove m ent.Journal of Nanjing A gricultural U niversity,1982,5:10-16.
[18]Dawson K A,H opkins D M.Differential effects of live yeast on the cellulolytic activities of anaerobic ru minal bacteria.A nim al Science,1991,69:531.
[19]Long L M,M ao S Y,Su Y,etal.Isolation and in vitro m etabolic characterization of a lactate-utilizing bacteriu m fro m goat ru m en.Acta Microbiological Sinica,2008,12:1571-1577.
[20]Chung Y H,W alker N D,M cGinn S M,etal.Differing effects of 2 active dried yeast(Saccharomycescerevisiae)strains on ru minal acidosis and m ethane production in nonlactating dairy cows.Journal of Dairy Science,2011,94(5):2431-2439.
[21]To m ankova O,H o m olka P.In vitro ru minal degradability of cereal grain starch.Czech Journal of A nim al Science,2004,49(4):151-155.
[8]那日苏,桂荣,敖长金,等.酵母培养物对绵羊瘤胃发酵及生产性能的影响.中国畜牧兽医,2004,(1):6-9.
[12]王方园,李艳.体外法研究阿卡波糖对模拟瘤胃酸中毒的调控作用.中国畜牧兽医文摘,2012,(1):22-50.
[16]冯宗慈,高民.通过比色测定瘤胃液氨氮含量方法的改进.内蒙古畜牧科学,1993,4:40-41.
[17]秦为琳.应用气象色谱法测定挥发性脂肪酸的改进.南京农学院学报,1982,5:10-16.
[19]龙黎明,毛胜勇,苏勇,等.一株瘤胃源乳酸利用菌的分离鉴定及其体外代谢特性.微生物学报,2008,12:1571-1577.
Isolation and characterization of ru men yeast and an evaluation of its effect on ru mi-nal fermentation with different types of substrate
W A N G Xiao-Cheng,LIU Jun-H ua,Z H U W ei-Y un,M A O Sheng-Y ong*
The College of Animal Science and Technology,Nanjing Agricultural University,Nanjing 210095,China
T his study was conducted to isolate ru m en yeast and evaluate its possible role in changing ferm entation characteristics by using in vitro ferm entation with three different substrates.A yeast strain with a fast growth rate belonging to the Meyerozyma genus was isolated through screening,growth curve determination and identification of 26S rD N A using a selective m ediu m of yeast co m posed of goat and dairy cow ru minalfluid.T he effect of thisisolated culture on ru minalferm entation was evaluated with three substrates:Chinese wildrye plus concentrate mixture,potato starch and corn starch.Ru minal fluid fro m dairy cattle was used as an inoculant.T he results showed that with the Chinese wildrye plus concentrate mixture as substrate,yeast addition decreased ru minal p H and the concentration of lactic acid(P<0.001),w hile it increased the concentration of propionic acid and the digestibility of dry m atter(P<0.05).T he addition of yeast decreased ru minal p H and lactic concentration(P<0.001)in the corn starch substrate.M oreover,the addition of yeast culture decreasedru minal p H(P<0.05)and increased the concentration of propionic acid(P<0.05).H owever,total gas production and concentrations of a m m onia-N,acetic acid,butyric acid,isobutyric acid,valeric acid and isovaleric acid were not affected(P>0.05)by yeast addition in the three substrate groups.T he real-tim e P C R data showed that isolate addition increased the nu m ber of total bacteria in the Chinese wildrye plus concentrate and potato starch substrates.Results indicate that the ru m en yeastisolates can im prove the ru m en’s dietary degradation capability and reduce lactic acid levels for the Chinese wildrye plus concentrate and corn starch substrates.T his suggests that the yeastisolates could im prove digestibility efficiency in ways that enhance the propionate production and the growth of ru minal bacteria.
yeast;ru m en;isolation;ferm entation in vitro
.E-m ail:m aoshengyong@163.com
10.11686/cyxb2015348
2015-07-15;改回日期:2015-10-12
奶业“973”项目子课题(2011 C B100801)资助。
王晓成(1991-),男,江苏南京人,在读硕士。E-m ail:2013105055@njau.edu.cn

