水淹胁迫对狗牙根光合、生长及营养元素含量的影响
韩文娇,白林利,李昌晓(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715)
水淹胁迫对狗牙根光合、生长及营养元素含量的影响
韩文娇,白林利,李昌晓*
(西南大学生命科学学院,三峡库区生态环境教育部重点实验室,重庆 400715)
以狗牙根当年生扦插苗为试验材料,采用盆栽控制实验,设置对照组(C K)、表土水淹组(SF)和全淹组(T F),研究水淹对狗牙根光合、生长、生物量和营养元素含量的影响。结果显示,1)与C K相比,SF组的狗牙根净光合速率、气孔导度、蒸腾速率和气孔限制值均显著降低,胞间C O2浓度显著增加,但水分利用效率与C K组差异不显著。2)SF组分枝数、叶片数、根生物量、叶生物量和根冠比均显著低于C K组,而株高、基径、茎生物量和总生物量与C K组差异不显著;T F组除根冠比与C K组无显著差异外,株高、基径、分枝数、叶片数、根生物量、茎生物量和总生物量均显著低于C K组。3)与C K组相比,SF和T F组根的N、P、K、Fe、M n含量均呈上升趋势,Cu含量显著降低;叶片中,SF组P、K、Cu含量显著下降,Fe、M n含量显著升高。研究表明,水淹显著影响了狗牙根光合、生长及营养元素含量。狗牙根通过适度降低叶片P、K、Cu含量及升高Fe、M n含量促进狗牙根叶片净光合速率的降低。然而狗牙根可通过提高对N、P、K等营养元素的吸收,促进其生长,维持较高的净光合速率,以有效应对水淹环境;其次,全淹环境中,狗牙根叶片衰老、凋落,叶片中N、P等营养元素可直接进入水体,存在增加水体富营养化的潜在风险,因此,应加强对三峡库区消落带狗牙根植被的刈割收获管理,以尽可能减少由此引起的二次污染。
三峡库区;水淹;狗牙根;光合;生长;营养元素含量
http://cyxb.lzu.edu.cn
韩文娇,白林利,李昌晓.水淹胁迫对狗牙根光合、生长及营养元素含量的影响.草业学报,2016,25(5):49-59.
H A N W en-Jiao,B AI Lin-Li,LI Chang-Xiao.Effects of flooding on photosynthesis,growth and nutrient content of Cynodon dactylon.Acta Prataculturae Sinica,2016,25(5):49-59.
(CS T C2013JJB00004)和中央高校基本科研业务费专项资金(X DJK2013 A011)资助。
水淹是环境胁迫的一种重要表现形式,可干扰植物生长[1]、光合作用[2-3]、矿质元素的吸收和运输[4-5]、营养分配格局[6-7]等生理过程,长期水淹甚至还可导致某些耐淹能力不强的植物死亡[8]。在以往研究中,许多学者已从光合生理、矿质元素吸收、活性氧代谢等多个不同角度研究植物的耐淹特性,发现矿质元素的吸收作为植物重要的生理过程之一,在一定程度上可揭示植物种的适应特征,并能反映植物与环境间的紧密关系[9]。然而,水淹后,植物根系损伤可导致矿质元素吸收及运输能力降低,并通过植物营养元素含量的变化格局进一步影响光合作用过程以及植株的生长[6,10]。然而,截至目前,已有的大量研究均是从较为单一的角度出发,缺乏将光合、生长、生物量和营养元素含量综合集成的系统性研究。
狗牙根(Cynodon dactylon)属禾本科多年生草本植物,广泛分布于三峡库区消落带。目前,多数研究表明,狗牙根可通过改变形态[11-13]、提高抗氧化酶活性[14-15]等方式适应水淹环境,并且在水淹胁迫去除后,能够快速地恢复光合与生长能力[16-17]。此外,李强等[18]对狗牙根的研究也发现,狗牙根水淹出露后,狗牙根矿质元素发生显著变化,但有关水淹胁迫条件下狗牙根营养元素含量的变化与光合、生长和生物量之间的关系却报道较少。因此,本研究拟通过室内模拟实验,分析不同水淹条件下,狗牙根光合、生长、生物量及营养元素含量之间的关系,以期为三峡库区消落带植被修复重建提供参考。
1 材料与方法
1.1 材料
2014年5月选取重庆北碚区嘉陵江边自然生长的狗牙根,剪成长为10 cm 的茎段扦插于每盆装有2 kg土壤的盆钵中(盆中央内径17 c m,盆高20 cm ),每盆3株,共24盆(72株),盆内供试土壤营养元素特征为p H 8.17,有机质34.73 g/kg,全氮0.74 g/kg,全磷0.79 g/kg,全钾12.17 g/kg,有效磷2.47 m g/kg,速效钾137.63 m g/kg。所有盆栽实验均置于西南大学三峡库区生态环境教育部重点实验室实验基地透明大棚下(海拔249 m),进行相同水分、光照等管理,2014年6月5日正式开展实验,此时株高(31.08±1.32)c m。
1.2 实验设计
将实验用苗分为3组,即对照组(control,C K),表土水淹组(soil-surface flooding,SF)和全淹组(total flooding,T F),每组各8盆,共24盆。对照组(C K),土壤含水量保持在田间持水量的60%~63%[19];表土水淹组(SF),将实验用苗放入直径68 c m,高22 c m的塑料大盆中,然后向盆内注水,直至水淹超过土壤表面5 c m;全淹组(T F),将试验盆钵放入专用水池中,并将池水保持没过狗牙根植株顶端1 m[20]。此外,为尽可能模拟消落带土壤水分的动态变化特征,保证淹水过程中适当的氧气供应,每隔7 d换一次水。在三峡库区,生长于消落带下部的狗牙根经常受到夏季洪汛的长时段淹没,根据长江水位监测数据(2014年6-7月水位介于146~153 m)显示其连续淹没时间可长达48 d。因此,本实验设定48 d后,对每棵植株的株高、基径、叶片数和分枝数进行测定,随后,每处理随机选取4盆用于光合参数及生物量指标的测定,另外4盆用于狗牙根营养元素含量指标的测定。
1.3 光合指标的测定
实验结束时,采用Li-6400便携式光合系统(Li-Cor 6400,Li-Cor Inc,U S A),于晴天9:00-12:00,对狗牙根的净光合速率(net photosynthetic rate,Pn)、气孔导度(sto m atal conductance,Gs)、胞间C O2浓度(intercellular C O2concentration,Ci)与蒸腾速率(transpiration rate,Tr)等指标进行测定,并计算水分利用效率(water use efficiency,W U E=Pn/Tr)和气孔限制值(sto m ata limitation,Ls=1-Ci/Ca,Ca为环境中C O2浓度)[21]。光合指标测定部位选取健康成熟的功能叶片中部[16](从植株顶端往下数第3~4片叶),每处理随机选取4盆,每盆测定2株,共8株。在预备试验的基础上确定光合有效辐射(P A R):1200μm ol/(m2·s),叶室温度:25℃,C O2浓度:340~355μm ol/m ol,光源:红蓝光,叶室:2 c m×3 c m。同时,标定放入叶室的狗牙根叶片区域,测定结束后立即放入冰盒带回实验室,使用叶面积分析仪扫描其测定部位的叶面积,并通过换算得出各处理的光合参数。
1.4 叶绿素含量的测定
选取用于测定光合参数的植物叶片,采用浸提法[22]测定叶绿素含量。使用岛津5220分光光度计(U V-5220,Shim adzu,日本)分别对叶绿素a(chlorophyll a,Chla)、叶绿素b(chlorophyll b,Chlb)、类胡萝卜素(carotene,Car)的吸光值A663、A645和A470进行测定,并参照文献[22]计算Chla、Chlb、Car以及总叶绿素(Chls)含量。
1.5 植物生长的测定
水淹胁迫结束后,分别用卷尺和游标卡尺对每棵植株的株高、基径进行测定。将植物根、茎、叶分开取样。植物洗净后,采用根系分析仪(Win R HIZ O,L C4800-II L A2400)分析根系的总根长、总表面积和总体积,然后将根、茎、叶分别放置60℃烘箱中烘干至恒重,测定生物量,并计算根冠比,每处理重复测定4盆。
1.6 植物养分含量的测定
分别取烘干的各处理的根、茎、叶样,粉碎、过筛,采用微波消解仪(Speed W ave M W S-4,Berghof,德国)消解后测定各营养元素含量。全N采用Vario E L cube C H N O S元素分析仪(Ele m entar,德国)进行测定;P、K、M n、Fe、M g、Cu、Ca等元素则采用电感耦合等离子体质谱(IC P-O SE)(IC A P6300,T herm o Fisher,U S A)法测定。每处理重复测定4盆。
1.7 数据分析
将水分作为独立因素,采用SPSS 19.0进行单因素方差分析(O ne-way A N O V A),以揭示不同水分处理对狗牙根光合生理、生长与生物量及营养元素含量的影响,并使用T ukey’s检验法检验每个指标在不同处理组(P<0.05)的差异显著性。采用Pearson相关性分析法考察的狗牙根各营养元素含量与生物量、光合指标之间的相关性。
2 结果与分析
2.1 水淹对狗牙根生长及生物量的影响
与C K组相比,T F组株高、基径、分枝数、根生物量、茎生物量、总生物量、根长、根表面积和根体积均显著降低。SF组的株高、基径、茎生物量和总生物量与C K组相比均未达到显著差异,但其根生物量、叶生物量、根长、根表面积和根体积均显著低于C K组(表1)。此外,T F组的狗牙根叶片在水淹7 d后已发黄凋落,且在处理期间无新叶长出,但经检查植株存活率为100%。与C K组相比,SF、T F组的根冠比均未达到显著性水平(表1)。
2.2 水淹对狗牙根光合特性的影响
ANOVA分析结果显示,水淹胁迫对狗牙根净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和气孔限制值(Ls)有显著影响(图1)。与C K组相比,SF组的净光合速率、气孔导度、蒸腾速率和气孔限制值分别显著降低了44%(P<0.05)、37%(P<0.05)、40%(P<0.05)和10%(P<0.05)。而与之相反,SF组的胞间C O2浓度(Ci)却比C K组显著增加13%(P<0.05),这与其水分利用效率(W U E)同C K组无显著差异形成鲜明对比。试验过程中,由于T F组的叶片凋落,未能获得光合参数(图1)。
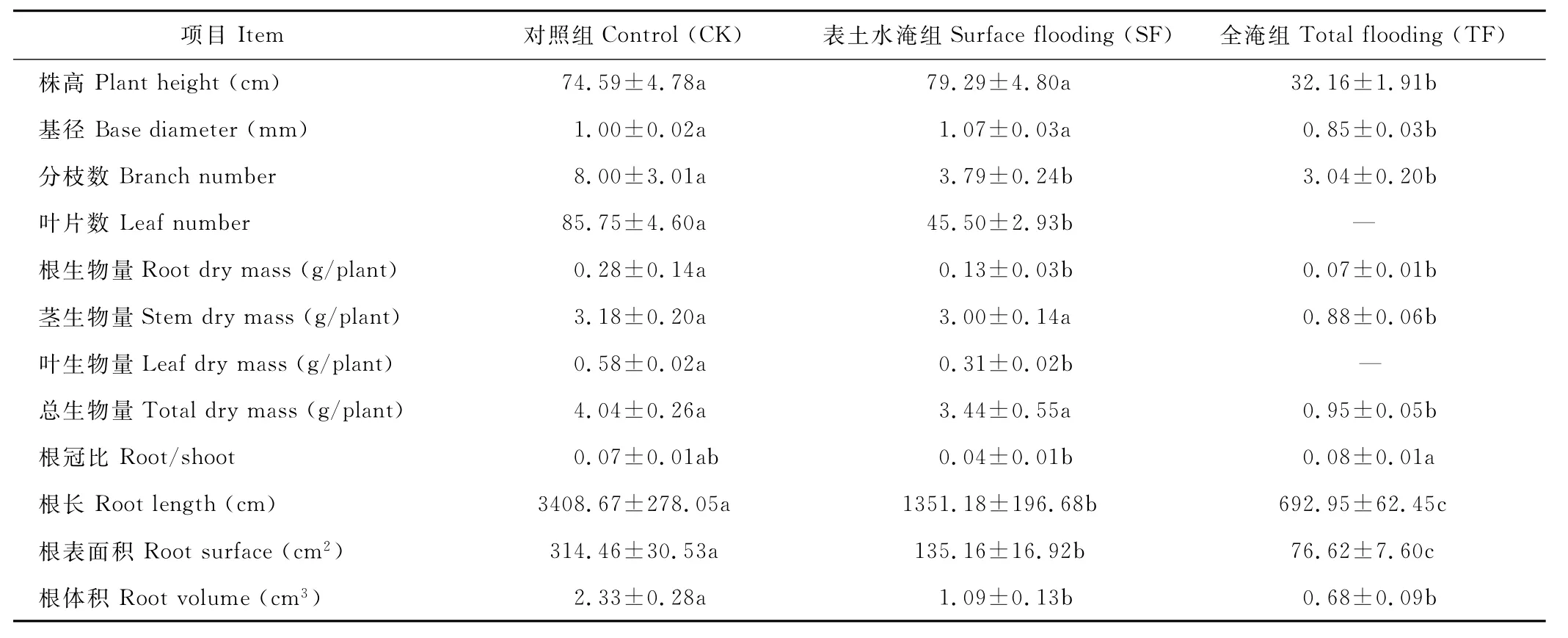
表1 不同处理组生长和生物量的变化Table 1 Changes of growth and biomass under different water treatments during flooding stress
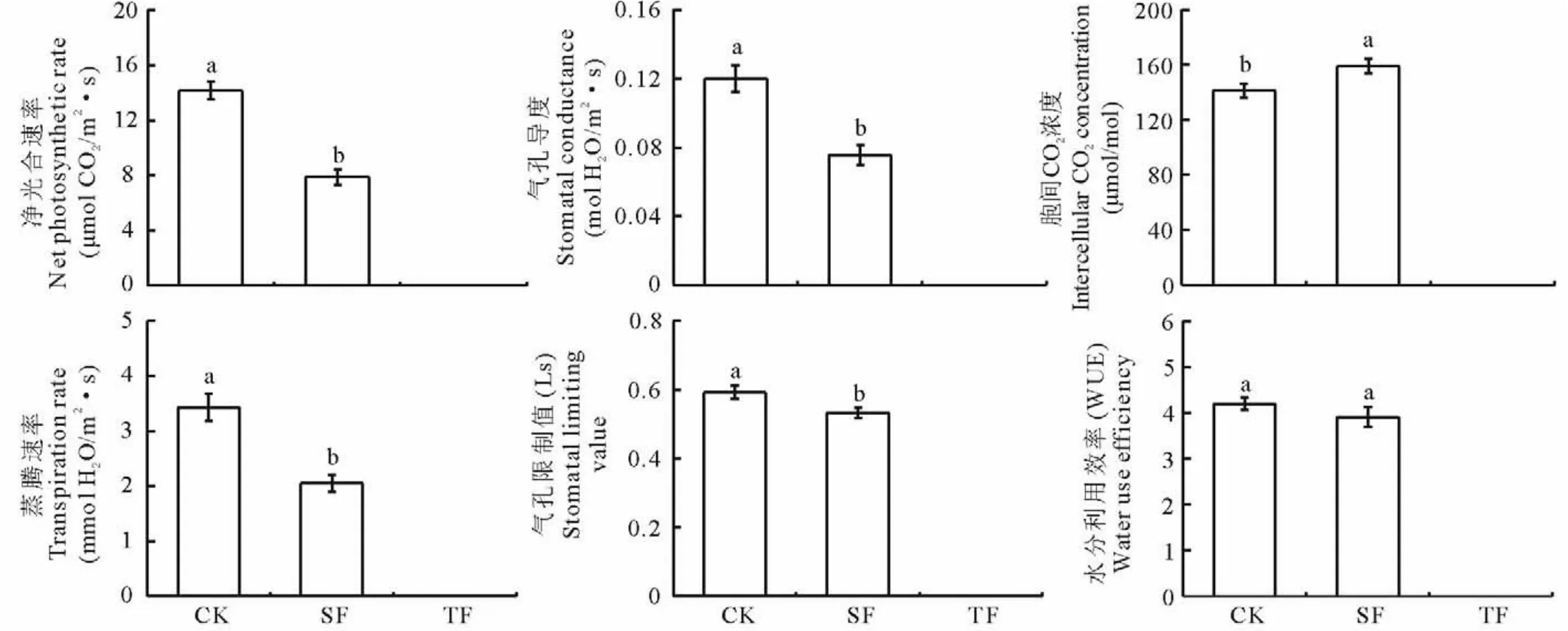
图1 不同处理组光合指标的变化Fig.1 Changes of photosynthetic indexes under different treatments during flooding stress
2.3 水淹对狗牙根光合色素的影响
由表2可知,淹水48 d后,SF组的Chla、Chlb、Chls、Car相较于C K组而言,分别均未达到显著差异(表1)。然而,与C K组相比,SF组的Chla/Chlb却显著增加了9%(P<0.05)。
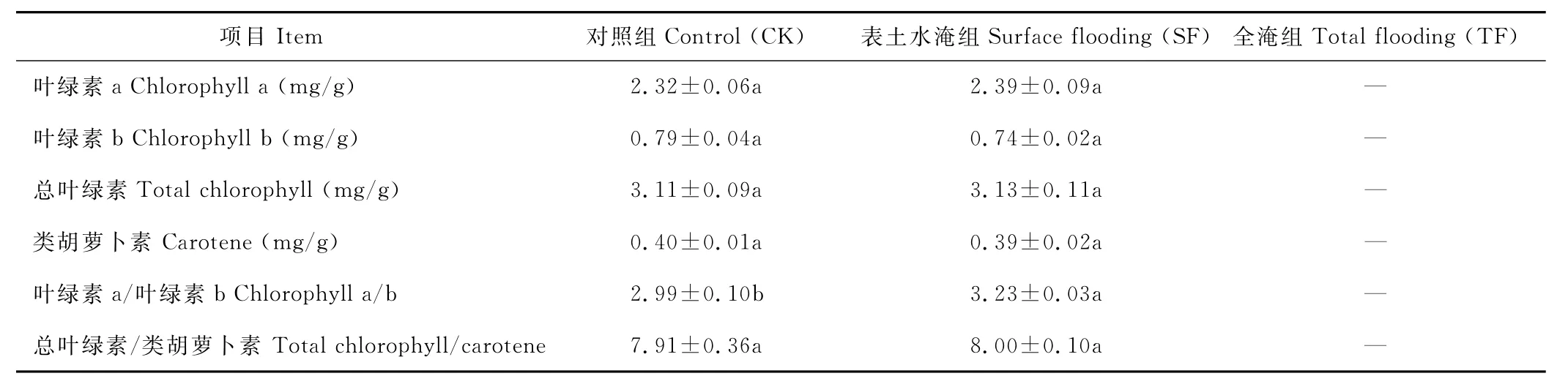
表2 不同处理组光合色素的变化Table 2 Changes of photosynthetic pigments under different treatments during flooding stress
2.4 水淹对狗牙根营养元素含量的影响
水淹48 d后,SF组叶片的P、K、Cu含量较对照而言均显著降低,分别比C K组显著降低34%(P<0.05)、16%(P<0.05)和71%(P<0.05)。然而,与叶P、K、Cu含量变化趋势不同,狗牙根叶片的Fe、M n含量却分别比C K组显著增加34%(P<0.05)、115%(P<0.05)。此外,与C K组相比,狗牙根叶片的N、Ca、M g含量均未达到显著差异的水平(图2)。
在狗牙根茎中,虽然各个处理组N、P、K、Ca、M g、Cu这6种营养元素含量与C K相比分别均无显著差异,但其Fe、M n含量却随着水淹深度的增加而呈现增加的趋势,且T F组茎中的Fe、M n含量分别是C K组的4.7和5.1倍(图2)。
经历48 d水淹后的狗牙根根部,其SF和T F组根系的N、P、K、Fe、M n含量均高于C K组(其中,T F组的P、Fe含量与C K组相比均未达到显著性差异),这与二者根系中的Cu含量均显著低于C K组形成鲜明对照。然而,SF、T F组的根部Ca、M g营养元素含量与C K组相比分别均无显著差异,且其根部Ca、M g营养元素含量变化规律与茎、叶中的Ca、M g含量变化规律类似(图2)。
就狗牙根平均每株的各营养元素总均值而言,SF组N元素含量比C K组显著增加15%(P<0.05),而T F 组N元素含量与C K组无显著差异;SF、T F组P元素含量分别低于C K组26%(P<0.05)、49%(P<0.05),与这两个处理组的Fe、M n元素含量显著高于C K组形成反差(其中,SF组的Fe、M n含量分别是C K组的1.5和6.4倍,T F组的Fe、M n含量分别是C K组的2.1和6.6倍);与P含量变化趋势类似,SF、T F组的Cu元素含量均低于C K组,但T F组的Cu含量与C K相比未达到显著水平(P>0.05)。此外,与C K组相比,3个处理组的K、Ca、M g单株平均含量与C K组相比均无显著性差异存在(表3)。
2.5 相关性分析
由表4可知,N元素与狗牙根总生物量和净光合速率均呈显著正相关;P与根长、总生物量、净光合速率、气孔导度呈极显著或显著正相关,而与Fe、M n均呈极显著负相关性;Fe与M n呈极显著正相关,而与根长、总生物量、净光合速率、气孔导度均呈极显著负相关性;M n元素与根长、总生物量和气孔导度均呈极显著或显著负相关性;根长与总生物量和气孔导度均呈极显著和显著正相关;总生物量与净光合速率、气孔导度均呈极显著正相关;净光合速率与气孔导度呈极显著正相关。

图2 水淹对狗牙根根、茎、叶营养元素含量的影响Fig.2 Effects of different water regimes on nutrient elements concentration in root,stem,leaf of C.dactylon
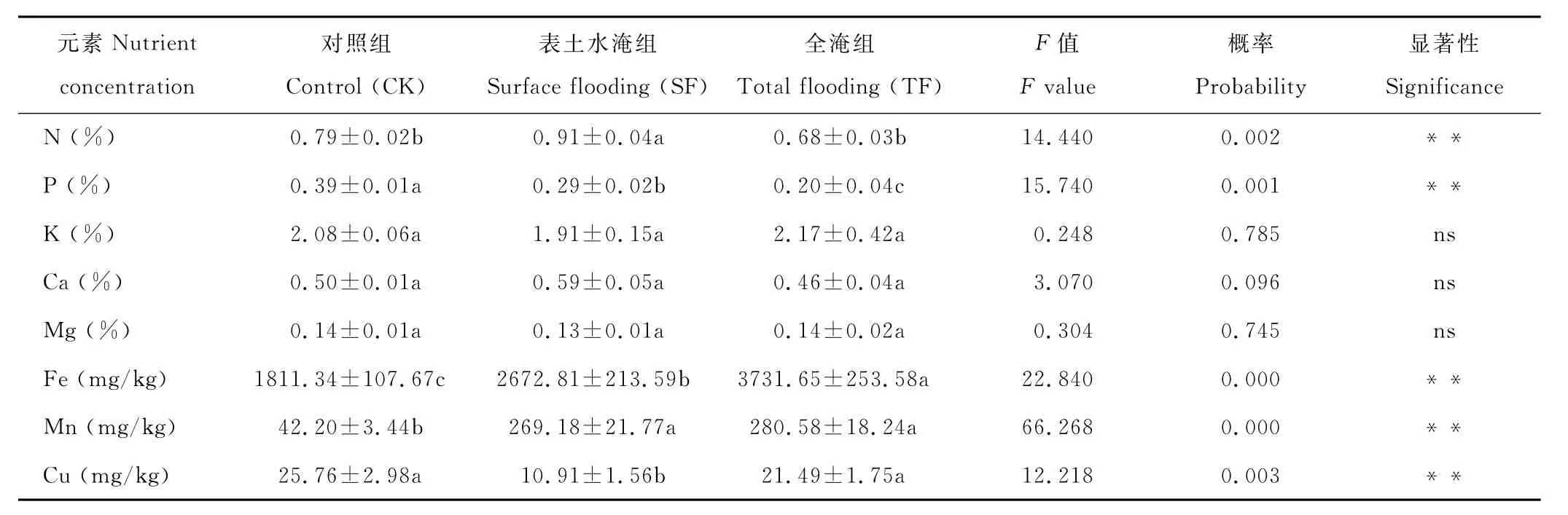
表3 水淹胁迫下狗牙根植株营养元素含量变化Table 3 Effects of different water regimes on nutrient contents of C.dactylon

表4 狗牙根植株营养元素含量与生物量、光合相关性分析Table 4 Correlations among soil nutrient contents,biomass and photosynthesis of C.dactylon
3 讨论
水淹环境中,缺氧是影响植物生长的主要因素之一。长时间的供氧不足将导致植物由有氧呼吸逐渐向无氧呼吸转变,在此过程中植物体内A T P的合成以及光合产物的同化也将大量减少,植物生长因此受到明显的影响[8,23-24]。然而,面对不同程度的水淹胁迫,不同的植物通常具有不同的适应策略,一种是逃避策略,植物通过促进其茎伸长,加快植物出露于水面,使其水面部分与空气接触,获取充足的氧气以维持较强的光合作用,从而缓解水淹对植物的损伤[8,25];另一种是静默策略,植物抑制地上部分生长,减少养分消耗,细胞通过代谢调节维持其完整的结构和功能,从而使植物在有限的营养储备情况下存活时间更长[25-26]。陈芳清等[12]对狗牙根的研究表明,水淹使狗牙根茎快速伸长以加快与空气的接触,从而获取生存所需的氧气。本研究中,SF组株高较C K组虽然未达到显著差异,但平均增加4.7 c m(表1),说明狗牙根营养繁殖体在表土水淹条件下也会加快茎的伸长,以便与水面的空气尽快接触,本研究与陈芳清等[12]的研究结果基本一致。可见,在表土水淹条件下(SF组),狗牙根通过维持或者促进茎偏上性伸长(表1),从而增加水淹耐受力。王海锋等[11]指出,全淹条件下,狗牙根通过减少生物量增量以维持较高的存活率,李秋华等[27]在此基础上进一步研究证实了全淹环境中,狗牙根是通过减缓生长、损失部分生物量以增加对水淹的耐受性。本研究中,T F组株高和总生物量均显著降低,说明狗牙根通过抑制地上部分生长,进而提高狗牙根对全淹环境的适应性。
植物遭受水淹胁迫时,生物量的降低与光合作用的下降密不可分。因此,维持较高的光合作用有助于增加植株生命活性及抗逆能力。本研究中,SF组净光合速率(Pn)显著降低,但仍具有较高的光合能力(净光合速率为对照组59%),Chen等[28]对宽叶独行菜(Lepidium latifolium)的研究发现,水淹50 d后,净光合速率为对照组的56~72%,本研究SF组的净光合速率也在此范围内,说明狗牙根具有较强的耐淹性。多数研究表明,淹水初期,净光合速率的下降与气孔关闭相关,气孔的关闭必然会抑制植物对C O2的吸收,进而导致净光合速率显著降低[5,29-30]。然而,随着淹水时间的延长,净光合速率的降低还可能与非气孔因素有关,水淹条件下,植物光合磷酸化、电子传递过程受阻,核酮糖-1,5-二磷酸羧化/加氧酶活性(RuBP)的降低均会对植物净光合速率造成显著影响[30]。Farquhar和Sharkey[31]曾提出,通过胞间C O2浓度(Ci)和气孔限制值(Ls)可判定净光合速率的降低是由气孔因素还是非气孔因素所致,认为若Pn、Ci均降低,而Ls增加,则说明气孔关闭是导致净光合速率降低的主要因素,相反若Pn、Ls下降,Ci增加则说明净光合速率的降低主要是由非气孔因素所引起的。经48 d淹水后,本试验的SF组净光合速率(Pn)和气孔限制值(Ls)均显著低于C K组,而胞间C O2浓度(Ci)呈增长趋势,由此说明水淹胁迫下狗牙根净光合速率的降低主要是由非气孔因素所致[32]。
光合色素是叶片光合作用的物质基础,具有吸收、传递和转化光能的能力[33-34]。在淹水胁迫下,植物光合色素会因叶片的衰老和凋亡而发生改变[35]。然而,本研究发现,SF组Chla、Chlb、Chls与C K组均无显著差异,这与水淹条件下香蒲(Typhalatifolia)[36]的研究结果相似,这极有可能是处于表土水淹条件下的狗牙根通过维持较高的光合色素含量来促进光合能力的提高,进而为其茎伸长提供足够的能量供给。作为光合吸收的辅助色素,Car还是一种抗氧化剂,具有清除自由基和防止膜质过氧化的能力[37],本试验中,SF组Car与C K组无明显差异,说明狗牙根可在表土水淹条件下维持较高的Car含量,降低水淹对植物的膜质损伤。与Chla、Chlb等变化趋势不同,狗牙根Chla/Chlb是反映反应中心数量和捕光复合体的一项重要指标[38]。水淹后,SF组Chla/Chlb显著高于C K组,表明狗牙根捕光色素降解速率大于反应中心色素,可通过调节Chla/Chlb维持其较高的光合能力[39]。此外,C K和SF组Chls/Car均高于3∶1,这同陈芳清等[40]的研究结果类似,表明处于表土水淹条件下的狗牙根可通过提高叶绿素在光合色素中的比例,确保有充足的反应中心色素,进而提高光合能力[40]。
水淹胁迫下,狗牙根根系作为直接受到胁迫的器官,其水分及矿质元素吸收能力受到显著影响。此外,由于水淹使狗牙根蒸腾速率显著降低,阻碍了狗牙根根系矿质元素的向上运输[41]。有研究表明,淹水导致植物N、P、K等矿质元素出现明显的亏缺,如Ashraf和Reh m an[42]对玉米(Zea mays)的研究发现,水淹后,玉米叶片N、P、K、Ca、M g含量显著降低。而且植株叶片N、P、K降低将导致蛋白质、叶绿素等合成过程受阻,光合相关酶活性显著降低,最终导致光合作用下降[43]。然而,在本试验中,SF和T F组根系N含量却显著增加,SF组叶片N含量与C K组无显著差异,说明狗牙根根系具有较强的氮富集能力,可将N优先供应于叶片,以促进植株光合作用,从而增加狗牙根对水淹胁迫的耐受性[9]。Rubio等[44]指出水淹条件下,植物P含量的增加与土壤中P有效性的提高,根系形态以及根系对P的亲和力增加等因素相关。本研究中,狗牙根SF组根生物量显著低于C K组,而P含量却显著升高,说明水淹条件下狗牙根通过促进P的吸收补偿其根系生长所需的养分供应[44]。然而,与根的P含量变化不同,SF组叶P含量显著低于C K组,说明水淹阻碍了狗牙根P向上运输的能力。有研究表明,叶片P含量的降低会干扰植物光合磷酸化、RuBP的再生等过程,进而导致净光合速率降低[43],因此,水淹后,狗牙根叶片P含量的降低可能进一步促进了净光合速率的下降。A kra m等[45]指出,干旱胁迫下,狗牙根地上部分K元素的含量与对照组无显著差异,而在本研究中,SF组叶片中K含量却显著降低,这种截然不同的结果极有可能是由于不同的水分处理所引起的。由此也进一步说明,水淹抑制了K向狗牙根地上部分的运输。K是植物体内重要的渗透调节物质,且K+与气孔的开闭有十分密切的关系[46-47]。水淹条件下狗牙根叶片细胞中较低的K+含量促进了气孔的关闭,从而导致净光合速率下降,据此我们可以推测,狗牙根净光合速率下降的部分原因是由于K+含量降低导致狗牙根部分气孔关闭所引起的。与叶片K显著降低不同,SF和T F组根系却显著升高,其原因可能是水淹导致土壤中K元素的有效性升高,根系可通过被动吸收方式吸收K+[42],其次,蒸腾作用的降低抑制了K的向上运输,从而导致K富集于狗牙根的根部。此外,全淹T F组条件下,狗牙根叶片发黄、凋落,叶片中的N、P将直接释放到水体,存在增加水体富营养化的潜在风险,因此应当注重水淹前的及时收获利用。
Board[48]对大豆(Glycine max)的研究发现水淹使大豆叶片Ca含量显著下降。然而,在本研究中,狗牙根SF组和T F组根、茎、叶Ca含量却均呈现增长趋势,其原因可能是狗牙根对水淹产生了适应机制,通过提高对Ca2 +的吸收,促进狗牙根对逆境胁迫信号的传导,增加抗氧化酶系统活性,防止厌氧呼吸产生的活性氧(R O S)对细胞膜造成损伤[49]。M g是构成叶绿素的中心色素,参与类囊体膜的组装和基粒垛叠,对叶绿体的形成及稳定具有重要作用[50-51]。在光合呼吸过程中,M g作为活化剂,具有活化A T P酶、核酮糖-1,5-二磷酸羧化酶(RuBP)、蛋白激酶等磷酸化酶和激酶的功能[52]。因此,植物缺M g可导致叶绿素不能合成,植物光合作用下降[52-53]。本研究中,狗牙根SF组叶片M g含量与C K组无显著差异,与SF和C K组chls含量无显著差异的结果相一致,说明水淹胁迫并未对M g参与的叶绿素合成过程造成显著影响,从而也进一步反映出狗牙根Pn的下降不是由叶绿素降低所致[43]。
淹水缺氧条件下土壤氧化还原降低,土壤中Fe3 +、M n4 +转变为可溶性的Fe2 +、M n2 +[6],植物体内Fe、M n含量显著升高。作为光合作用的组成成分,Fe、M n参与植物光合传递氧化还原过程,对维持光合反应中心和叶绿体结构等方面具有重要作用[54-55]。然而,植物Fe2 +、M n2 +积累过量将导致气孔关闭,自由基大量产生,从而降低植物光合作用[6,47]。狗牙根叶片和根系中,SF和T F组(T F组无叶片)Fe、M n含量均显著增加,说明水淹胁迫下狗牙根Fe、M n含量的增加可能使气孔部分关闭,自由基含量升高,进而促进了净光合速率的降低。此外,本研究中,狗牙根根系在T F组的Fe、M n含量分别低于SF组(图2),其原因是随着水淹深度的增加,土壤氧化还原电位进一步下降,Fe2 +、M n2 +产生的毒害作用加剧了植物根系损伤,因此,导致T F组狗牙根根部的Fe、M n含量低于SF组[9]。另一方面,由于SF与T F组二者之间单株的Fe、M n平均含量分别均无显著差异(表3),说明T F组根部的Fe、M n元素较SF组可能更多地迁移到了地上的茎部(图2)。此外,本研究发现SF和T F组根、叶Cu含量均低于C K组,其原因可能是水淹抑制了狗牙根Cu的吸收和转运能力。Cu是植物叶绿体中质体蓝素的组成成分,在光合电子传递链中具有重要作用[56],而Cu元素含量的降低可能使狗牙根PSII系统电子传递效能进一步下降,光合能力降低[7]。
References:
[1]Parad G A,Zarafshar M,Striker G G,etal.So m e physiological and m orphological responses of Pyrusboissieriana to flooding.Trees,2013,27(5):1387-1393.
[2]Yordanova R Y,Popova L P.Flooding-induced changes in photosynthesis and oxidative status in m aize plants.Acta Physiologiae Plantaru m,2007,29(6):535-541.
[3]Yordanova R Y,Uzunova A N,Popova L P.Effects of short-term soilflooding on sto m ata behaviour and leaf gas exchange in barley plants.Biologia Plantaru m,2005,49(2):317-319.
[4]Patrick W H,Mikkelsen D S,W ells B R.Plant nutrient behavior in flooded soil[A].In:Engelstad O P.Fertilizer Technology & Use[M].M adison:Soil Science Society of A m erica,1985:197-228.
[5]Pezeshki S R.W etland plant responses to soil flooding.Environ m ental and Experim ental Botany,2001,46(3):299-312.
[6]Pierce S C,M oore M T,Larsen D,etal.M acronutrient(N,P,K)and redoxim orphic m etal(Fe,M n)allocation in Leersia oryzoides(Rice Cutgrass)grow n under different flood regim es.W ater,Air,& Soil Pollution,2010,207(1-4):73-84.
[7]S m ethurst C F,Garnett T,Shabala S.N utritional and chlorophyllfluorescence responses oflucerne(Medicagosativa)to waterlogging and subsequent recovery.Plant & Soil,2005,270(1):31-45.
[8]Voesenek L A C J,Colm er T D,Pierik R,etal.H ow plants cope with co m plete sub m ergence.New Phytologist,2006,170 (2):213-226.
[9]Jin X,W ang R,Zhou X R,etal.Vegetative growth and nutrient ele m ent accu m ulation of A morphafruticosa under different waterlogging stress conditions.Pratacultural Science,2013,30(6):904-909.
[10]Liu Z B,Cheng R M,Xiao W,etal.Effect of off-season flooding on growth,photosynthesis,carbohydrate partitioning,and nutrient uptake in Distylium chinense.Plos O ne,2014,9(9):e107636-e107636.
[11]W ang H F,Zeng B,Li Y,etal.Effects of long-term sub m ergence on survival and recovery growth of four riparian plant species in Three Gorges Reservoir Region,China.Journal of Plant Ecology,2008,32(5):977-984.
[12]Chen F Q,H uang Y Z,Zeng X.Biological response of Cynodon dactylon vegetative propagule to sim ulated flooding.Journal of Tropical and Subtropical Botany,2010,18(1):15-20.
[13]Zhang X Y,Fan D Y,Xie Z Q,etal.Clonal integration enhances perform ance of Cynodon dactylon subjected to sub m ergence.Chinese Journal of Plant Ecology,2010,34(9):1075-1083.
[14]Li Z J,Xiong G M,Deng L Q,etal.Dyna mics of antioxidant enzy m e activities in roots of Cynodon dactylon and Hemarthria altissima recovering fro m annual flooding.Acta Ecologica Sinica,2013,33(11):3362-3369.
[15]Tan S D,Zhu M Y,Dang H S,etal.Physiological responses of berm udagrass(Cynodon dactylon(L.)Pers.)to deep subm ergence stress in the Three Gorges Reservoir Area.Acta Ecologica Sinica,2009,29(7):3685-3691.
[16]Tan S D,Zhang S J,Zhang K R,etal.Effect of long-tim e and deep sub m ergence on recovery growth and photosynthesis of three grass species in Three Gorges Reservoir Area.Journal of W uhan Botanical Research,2009,27(4):391-396.
[17]Pei S X,H ong M,Guo Q S,etal.Photosynthetic characteristics of Cynodon dactylon in hydro-fluctuation belt of Three Gorges Reservoir at the end of flooding.Chinese Journal of Ecology,2014,22(12):3222-3229.
[18]Li Q,Song L,W ang S M,etal.Influence of water level on nutritional characteristics of Cynodon dactylon population in wa
ter-level-fluctuating zone of the Three Gorges Reservoir.Ecological Science,2015,34(4):15-20.
[19]Li C X,Zhong Z C.Photosynthetic physio-response of Taxodium ascendens seedlings to different soil water regim es.Forest Research,2006,19(1):54-60.
[20]Luo F L,Nagel K A,Zeng B,etal.Photosynthetic acclim ation is im portant for post-sub m ergence recovery of photosynthesis and growth in two riparian species.A nnals of Botany,2009,104(7):1435-1444.
[21]Yang Y H,W u J C,W u P T.Effects of superabsorbent poly m er on the physiological characteristics of w heat under drought stress and rehydration.African Journal of Biotechnology,2011,10(66):14836-14843.
[22]Gao J F.Experim ental Guide of Physiology of Plant[M].Beijing:Higher Education Press,2006:74-77.
[23]M ukassabi T A,Polwart A,Coleshaw T,et al.H ow long can young Scots pine seedlings survive waterlogging.Trees,2012,26(5):1641-1649.
[24]Jackson M B,Colm er T D.Response and adaptation by plants to flooding stress.A nnals of Botany,2005,96(4):501-505.
[25]Nishiuchi S,Ya m auchi T,Takahashi H,et al.M echanis ms for coping with sub m ergence and waterlogging in rice.Rice,2012,5(17):2314-2322.
[26]Xiong H Y,Yang Q,A n B G,et al.M olecular m echanis m of rice adaptation and im prove m ent strategies to su m ergence stress.Journal of W uhan U niversity(Natural Science Edition),2013,59(1):17-23.
[27]Li Q H,Liu S P,Zhi S Y,etal.A daptation m echanis m of three herbs in the water-level-fluctuation-zone of reservoir to co m plete sub m ergence.Journal of Tropical and Subtropical Botany,2013,21(5):459-465.
[28]Chen H J,Q ualls R G,Blank R R.Effect of soilflooding on photosynthesis,carbohydrate partitioning and nutrient uptake in the invasive exotic Lepidium latifolium.Aquatic Botany,2005,82(4):250-268.
[29]Tang Z C,Kozlowski T T.So m e physiological and m orphological responses of Quercus macrocarpa seedlings to flooding.Canadian Journal of Forest Research,1982,12(2):196-202.
[30]Striker G G.Flooding Stress on Plants:A nato mical,M orphological and Physiological Responses[M].I Rijeka-Croatia:Intech O pen Access Publisher,2012:1-28.
[31]Farquhar G D,Sharkey T D.Sto m atal conductance and photosynthesis.A nnual Review of Plant Physiology,1982,33(4):317-345.
[32]Pierce S C,Pezeshki S R,M oore M T.Ditch plant response to variable flooding:A case study of Leersiooryzoides(rice cutgrass).Journal of Soil & W ater Conservation,2007,62(4):216-225.
[33]Liu Z B,Cheng R M,Xiao W F,etal.Effects of flooding on growth,photosynthesis and fluorescence characteristics of Distylium chinese.Scientia Silvae Sinicae,2014,50(9):73-81.
[34]Ronzhina D A,Nekrasova G F,P'Yankov V I.Co m parative characterization of the pig m ent co m plex in e m ergent,floating,and sub m erged leaves of hydrophytes.Russian Journal of Plant Physiology,2004,51(1):21-27.
[35]Casanova M T,Brock M A.H ow do depth,duration and frequency of flooding influence the establish m ent of wetland plant co m m unities.Plant Ecology,2000,147(2):237-250.
[36]Li S W,Pezeshki S R,Good win S.Effects of soil m oisture regim es on photosynthesis and growth in cattail(Typhalatifolia).Acta Oecologica,2004,25(1):17-22.
[37]Tracewell C A,Vrettos J S,Bautista J A,etal.Carotenoid photooxidation in photosyste m II.Archives of Bioche mistry & Biophysics,2001,385(1):61-69.
[38]Li X L,Li N,Yang J,etal.M orphological and photosynthetic responses of riparian plant Distylium chinense seedlings to sim ulated autu m n and winter flooding in Three Gorges Reservoir Region of the Yangtze River,China.Acta Ecologica Sinica,2011,31(1):31-39.
[39]Zhou J,W ei H,Lü Q,etal.Effects of soil water regim e on leaf photosynthetic characteristics of slash pine(Pinuselliottii Engelm.)seedlings.Chinese Journal of Ecology,2012,31(1):30-37.
[40]Chen F Q,H uang Y Z,Fan D Y,etal.Ecophysiologicalresponses of vegetative propagule of Cynodon dactylon to sim ulated su m m er flooding.Guihaia,2010,30(4):488-492.
[41]Luo M J,Cui L J,Zhang S G,etal.Effects of flooding stress on water and mineral nutrients in Aegicerascorniculatum seedlings.Journal of Fujian College of Forestry,2012,32(4):336-340.
[42]Ashraf M,Reh m an H.Mineral nutrient status of corn in relation to nitrate and long-term waterlogging.Journal of Plant N utrition,1999,22(8):1253-1268.
[43]Tho m as D S,M ontagu K D,Conroy J P.Leafinorganic phosphorus as a potentialindicator of phosphorus status,photosynthesis and growth of Eucalyptusgrandis seedlings.Forest Ecology & M anage m ent,2006,223(1-3):267-274.
[44]Rubio G,Oesterheld M,Alvarez C R,etal.M echanis ms for the increase in phosphorus uptake of waterlogged plants:soil phosphorus availability,root m orphology and uptake kinetics.Oecologia,1997,112(2):150-155.
[45]A kra m N A,Shahbaz M,Ashraf M.N utrient acquisition in differentially adapted populations of Cynodon dactylon(L.)Pers.and Cenchrusciliaris L.under drought stress.Pakistan Journal of Botany,2008,40(4):1433-1440.
[46]Pan R Z,W ang X J,Li N H.Plant Physiology[M].Beijing:Higher Education Press,2004:66-68.
[47]Shabala S,Shabala L,Barcelo J,etal.M e m brane transporters m ediating root signalling and adaptive responses to oxygen deprivation and soil flooding.Plant,Cell and Environ m ent,2014,37(10):2216-2233.
[48]Board J E.W aterlogging effects on plant nutrient concentrations in soybean.Journal of Plant N utrition,2008,31(5):828-838.
[49]Girdhar K P.Elucidation of A biotic Stress Signaling in Plants[M].New York:Springer,2015:227-238.
[50]Zhou M,Gong X L,W ang Y,etal.Im prove m ent of ceriu m of photosynthesis functions of m aize under m agnesiu m deficiency.Biological Trace Ele m ent Research,2011,142(3):760-772.
[51]Xiong Y J,Chen S F,Li E X,etal.Research progress and outlook on m agnesiu m deficiency in plants.Journal of A nhui A gricultural Science,2010,38(15):7754-7757.
[52]Cak m ak I,Kirkby E A.Role of m agnesiu m in carbon partitioning and alleviating photooxidative da m age.Physiologia Plantaru m,2008,133(4):692-704.
[53]Yang G H,Yang L T,Jiang H X,etal.Physiologicalim pacts of m agnesiu m-deficiency in Citrusseedlings:photosynthesis,antioxidant syste m and carbohydrates.Trees,2012,26(4):1237-1250.
[54]Zhang Y X,Li L F,Chai T Y,etal.M echanis ms of m anganese toxicity and m anganese tolerance in plants.Chinese Bulletin of Botany,2010,45(4):506-520.
[55]Pereira E G,Oliva M A,Rosado-Souza L,etal.Iron excess affects rice photosynthesis through sto m atal and non-sto m atal limitations.Plant Science,2013,201-202(3):81-92.
[56]Vinit-Dunand F,Epron D,Alaoui-Sosse B,etal.Effects of copper on growth and on photosynthesis of m ature and expanding leaves in cucu m ber plants.Plant Science,2002,163(1):53-58.
[9]金茜,王瑞,周向睿,等.水淹胁迫对紫穗槐生长及营养元素积累的影响.草业科学,2013,30(6):904-909.
[11]王海锋,曾波,李娅,等.长期完全水淹对4种三峡库区岸生植物存活及恢复生长的影响.植物生态学报,2008,32(5):977-984.
[12]陈芳清,黄友珍,曾旭.狗牙根营养繁殖体对模拟水淹的生物学响应.热带亚热带植物学报,2010,18(1):15-20.
[13]张想英,樊大勇,谢宗强,等.克隆整合有助于狗牙根抵御水淹.植物生态学报,2010,34(9):1075-1083.
[14]李兆佳,熊高明,邓龙强,等.狗牙根与牛鞭草在三峡库区消落带水淹结束后的抗氧化酶活力.生态学报,2013,33(11):3362-3369.
[15]谭淑端,朱明勇,党海山,等.三峡库区狗牙根对深淹胁迫的生理响应.生态学报,2009,29(7):3685-3691.
[16]谭淑端,张守君,张克荣,等.长期深淹对三峡库区三种草本植物的恢复生长及光合特性的影响.武汉植物学研究,2009,27(4):391-396.
[17]裴顺祥,洪明,郭泉水,等.三峡库区消落带水淹结束后狗牙根的光合生理生态特性.生态学杂志,2014,22(12):3222-3229.
[18]李强,宋力,王书敏,等.水位变化对三峡库区消落带狗牙根种群营养特征的影响.生态科学,2015,34(4):15-20.
[19]李昌晓,钟章成.池杉幼苗对不同土壤水分水平的光合生理响应.林业科学研究,2006,19(1):54-60.
[22]高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:74-77.
[26]熊怀阳,阳菁,安保光,等.水稻适应淹水胁迫的分子机理及品种改良.武汉大学学报:理学版,2013,59(1):17-23.
[27]李秋华,刘送平,支崇远,等.三种水库消落带草本植物对完全水淹的适应机制研究.热带亚热带植物学报,2013,21(5):459-465.
[33]刘泽彬,程瑞梅,肖文发,等.模拟水淹对中华蚊母树生长及光合特性的影响.林业科学,2014,50(9):73-81.
[39]周珺,魏虹,吕茜,等.土壤水分对湿地松幼苗光合特征的影响.生态学杂志,2012,31(1):30-37.
[40]陈芳清,黄友珍,樊大勇,等.水淹对狗牙根营养繁殖植株的生理生态学效应.广西植物,2010,30(4):488-492.
[41]罗美娟,崔丽娟,张守攻,等.淹水胁迫对桐花树幼苗水分和矿质元素的影响.福建林学院学报,2012,32(4):336-340.
[46]潘瑞炽,王小菁,李娘辉.植物生理学[M].北京:高等教育出版社,2004:66-68.
[51]熊英杰,陈少风,李恩香,等.植物缺镁研究进展及展望.安徽农业科学,2010,38(15):7754-7757.
[54]张玉秀,李林峰,柴团耀,等.锰对植物毒害及植物耐锰机理研究进展.植物学报,2010,45(4):506-520.
Effects of flooding on photosynthesis,growth and nutrient content of Cynodon dactylon
H A N W en-Jiao,B AI Lin-Li,LI Chang-Xiao*
Key Laboratory forthe Eco-Environmentof the Three Gorges Reservoir Region of the Ministry of Education,Collegeof Life Sciences,Southwest University,Chongqing 400715,China
A flooding sim ulation experim ent was conducted to detect the effects of flooding on photosynthesis,growth and nutrient concentrations of Cynodon dactylon.T w o flooding-depth levels,surface flooding(SF)and total flooding(T F)were im posed,and co m pared with control(C K).Net photosynthetic rate(Pn),sto m atal conductance(Gs),transpiration rate(Tr)and sto m atal limitation(Ls)of C.dactylon under SF were significantly lower than those for the C K treatm ent,w hile the intercellular C O2concentration(Ci)was significantly higher.H owever,water use efficiency(W U E)did not differ significantly between SF and the C K treatm ent.U nder SF,root length,root surface,root volu m e,branch nu m ber,leaf nu m ber,root bio m ass,leaf bio m ass and root∶shoot ratio were all significantly reduced,w hereas plant height,base dia m eter,ste m bio m ass andtotal bio m ass did not differ significantly between SF and C K.U nder T F,root length,root surface,root volu m e,plant height,branch nu m ber,leaf nu m ber,root bio m ass,base dia m eter,ste m bio m ass and total biom ass were also significantly lower than those of C K.Co m pared to C K,root nutrient concentrations(N,P,K,Fe,and M n)of C.dactylon under SF and T F were increased,w hereas Cu content was significantly decreased.Leaf concentrations of Fe and M n under SF were significantly increased,but the contents of P,K and Cu under SF were significantly decreased,co m pared to C K.T hus flooding resulted in significant reductions in photosynthesis,growth,and uptake of nutrients of C.dactylon.T he reduction of leaf concentrations of P,K,and Cu and the rise in leaf concentrations of Fe,and M n could account for the reduction in Pn.H owever,C.dactylon was able to im prove the absorption of N,P,and K,pro m ote ste m elongation and m aintain a high net photosynthetic rate to cope with flooding.A dditionally,w hen flooded,leaf N and P could potentially be directly released into the water on leaf fall,w hich could increase the risk of eutrophication in waterways.
T he T hree Gorges Reservoir Area;flooding;Cynodon dactylon;photosynthesis;growth;nutrient concentration
.E-m ail:lichangx@sw u.edu.cn
10.11686/cyxb2015472
2015-10-08;改回日期:2015-12-28
重庆市林业重点科技攻关项目(渝林科研2015-6),国家科技部国际合作专项(2015 D F A90900),重庆市基础与前沿研究计划重点项目
韩文娇(1990-),女,重庆万州人,在读硕士。E-m ail:hanhan1028@sw u.edu.cn

