连翘苷对Lewis肺癌VEGF和内皮抑素表达的影响*
郑 末, 姜忠敏
(天津市第五中心医院病理科,天津 300450)
连翘苷对Lewis肺癌VEGF和内皮抑素表达的影响*
郑末△,姜忠敏
(天津市第五中心医院病理科,天津 300450)
[摘要]目的: 探讨连翘苷对Lewis肺癌组织中血管内皮生长因子(VEGF)和血管生成抑制因子内皮抑制素(endostatin)蛋白表达的影响。方法: 免疫组化染色检测临床收集的正常肺部组织、癌旁组织和肺癌组织样本中VEGF和endostatin的蛋白表达。设空白对照组10只,同时于40只小鼠右肢腋窝皮下接种Lewis瘤细胞,随机分为模型组、连翘苷低剂量组、连翘苷中剂量组和连翘苷高剂量组,每组10只。模型组每天1次灌胃等体积无菌水;连翘苷低、中剂量组每天灌胃5、10 g/kg连翘苷1次;高剂量组每天灌胃10 g/kg连翘苷2次。给药20 d后取肺部组织进行HE染色和免疫组化染色检测肿瘤组织形态学与肺部组织中VEGF和endostatin的蛋白表达。 结果: 临床样本中,与正常组织和癌旁组织相比,肺癌组织中的VEGF呈高表达,endostatin呈低表达。连翘苷随剂量增加可显著减少Lewis肺癌小鼠肿瘤体积和瘤组织密度;给予不同剂量连翘苷后,VEGF在肺癌组织中表达显著低于模型对照组,而endostatin表达则明显高于模型对照组。结论: 连翘苷通过下调VEGF的表达、上调endostatin的表达而发挥抑制肺部肿瘤发展的作用。
[关键词]连翘苷; Lewis肺癌; 血管内皮生长因子; 内皮抑制素
研究表明肺癌已成为世界上发生率和死亡率最高的恶性肿瘤之一,主要分为小细胞肺癌和非小细胞肺癌两大类[1]。其中非小细胞肺癌占肺癌总数的80%~85%。由于肺癌很容易发生早期转移,从而导致早期诊断和治疗效果不明显,患者的5年生存率往往不足20%[2]。随着环境污染日益加重以及生活习惯的改变,近年来我国的肺癌发生率迅速上升,预计到2025年,我国将成为世界第一肺癌大国[3]。常见的肺癌治疗以手术为主,结合化疗和放疗,取得了一定的疗效。但由于治疗普遍缺乏针对患者病情的特异性,而放、化疗常出现较强的毒副作用以及耐受性,往往难以取得进一步的疗效。另一方面,西方医疗手段联合中医中药对肿瘤患者进行治疗也是我国特色之一。近年来随着肿瘤分子生物学的迅速发展,从基因的角度进行研究,使得基因治疗也有可能得以实现。本研究采用免疫组化方法研究连翘苷(phillyrin)对Lewis肺癌小鼠肿瘤组织中血管内皮生长因子(vascular endothelial growth factor,VEGF)和血管生成抑制因子内皮抑制素(endostatin)蛋白表达的变化,并初步研究其机制。
材料和方法
1样本来源
收集医院2012年1月~2014年12月间手术切除的54例非小细胞肺癌组织(男性28例,女性26例),另取癌旁正常组织36例,正常肺部组织28例,组织切除后立即置于-80 ℃液氮中冷冻;样本年龄均大于18岁,中位年龄56.7岁;所有组织均经过病理学专家确诊,经本院伦理委员会通过。
2材料
Lewis肺癌细胞株购自中国医学科学院;C57BL/6J小鼠购于北京维通利华实验动物中心;连翘苷购自南京泽朗医药科技有限公司,纯度98%;VEGF和endostatin抗体购自Abcam;其它试剂为国产分析纯。
3方法
3.1肺癌模型建立与实验分组将Lewis肺癌细胞株在37 ℃中复苏,接种于10只C57BL/6J小鼠右肢腋窝皮下作为瘤源动物。约10 d后,待小鼠右腋部皮下瘤体明显隆起,在超净工作台内无菌条件下剥离瘤组织,剪碎,研磨制备细胞悬液,用无菌生理盐水调整细胞浓度约为1×1010/L。取此细胞悬液0.2 mL接种于40只C57BL/6J小鼠右肢腋窝皮下。实验分为空白对照组、模型组、连翘苷低剂量组、连翘苷中剂量组和连翘苷高剂量组。
3.2给药方法空白对照组:C57BL/6J小鼠正常饮食;模型组:造模第1天,以0.2 mL无菌水灌胃,每日1次;连翘苷低剂量组:造模第1天,以5 g/kg,0.2 mL灌胃,每日1次;连翘苷中剂量组:造模第1天,以10 g/kg,0.2 mL灌胃,每日1次;连翘苷高剂量组:造模第1天,以10 g/kg,0.2 mL灌胃,每日2次。连续给药20 d。于最后一次给药后处死,取出肺部组织,标记,置于-80 ℃液氮中冷冻备用。
3.3石蜡切片和HE染色将各C57BL/6J小鼠肿瘤组织置于4%甲醛中固定,常规石蜡包埋,切片,分别用二甲苯Ⅰ、Ⅱ浸泡10 min,梯度乙醇分别浸泡5 min,苏木精染色,盐酸乙醇分化,0.2%氨水返蓝,伊红染色,再次用乙醇脱水3 min,二甲苯Ⅰ、Ⅱ、Ⅲ透明5 min,中性树胶封固。显微镜下观察各组织形态学变化。
3.4免疫组化染色法将各组织切片置于二甲苯Ⅰ、Ⅱ、Ⅲ中脱蜡,梯度乙醇分别浸泡5 min,洗涤,置于3% H2O2去离子水孵育10 min,封闭,加入 I 抗,37 ℃孵育2 h,PBS洗涤,加入Ⅱ抗,37 ℃孵育20 min,PBS洗涤,DAB显色。苏木素复染,返蓝,脱水透明,封片晾干。光镜下观察免疫组化切片染色结果,计算阳性细胞率。评分方法:阳性细胞率≤1%为0分,2%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分;无染色为0分,弱强度染色为1分,中等强度染色为2分,强染色为3分;以阳性细胞率和染色强度之积进行综合判断:0~1分为阴性(-);2~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++)。
4统计学处理
数据处理采用SPSS 15.0软件,结果以均数±标准差(Mean±SD)表示,采用t检验或方差分析(one-way ANOVA)行组间差异的统计推断,以P<0.05为差异有统计学显著性。
结果
1VEGF和endostatin蛋白在临床不同肺部组织的表达
VEGF和endostatin的阳性表达呈棕黄色或棕褐色。在临床收集的样本中, VEGF的表达在正常组织中为弱阳性,癌旁组织为中等阳性,肺癌组织为强阳性;endostatin的表达在正常组织中为中等阳性,癌旁组织为弱阳性,肺癌组织为阴性,见图1。
2Lewis肺癌小鼠肿瘤组织病理形态学的变化
空白对照组肉眼未发现肿物,光镜下可见细胞排列规则,整齐,分布均匀。模型组肉眼见肿瘤体积巨大,不规则形状,光镜下瘤组织大片分布,排列紧密,细胞形状不一。连翘苷低剂量组肉眼见肿瘤体积比模型组减小,光镜下见瘤细胞密度降低,瘤组织片状分布,未见显著改变。连翘苷中剂量组肉眼见肿瘤体积显著小于模型组与低剂量组,光镜下瘤细胞明显分散,排列疏松,呈大片坏死。连翘苷高剂量组肉眼见肿瘤体积比模型组明显减小,瘤细胞密度明显降低,部分核细胞固缩,见图2。各组小鼠肿瘤重量和形态见图3、4。
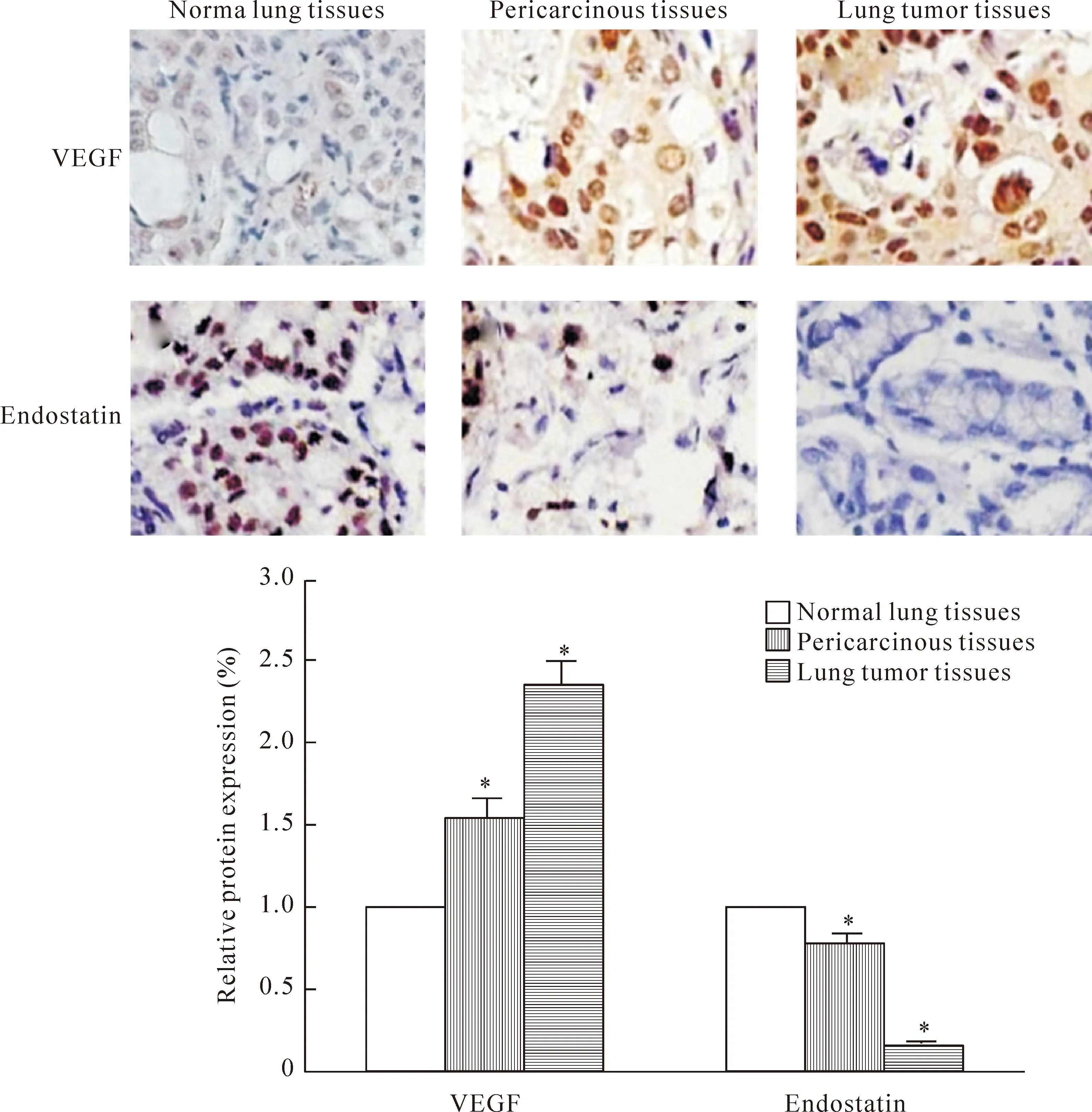
Figure 1.The protein expression of VEGF and endostatin in different lung tissues (immunohistochemical staining,×400). Mean±SD.n=10.*P<0.05vsnormal lung tissues.
图1VEGF和Endostatin在不同肺部组织中的蛋白表达

Figure 2.Morphological observation in each group (HE staining,×40).
图2各处理组的组织形态观察

Figure 3.Statistical data of tumor weight in each group. Mean±SD.n=10*P<0.05vsmodel.
图3各组小鼠肿瘤重量统计
3VEGF和endostatin蛋白在各组织中的表达
采用免疫组化染色法检测连翘苷对Lewis肺癌小鼠中VEGF和endostatin蛋白表达的影响。随连翘苷剂量的升高,VEGF的蛋白表达逐渐减弱,而endostatin的蛋白表达则逐渐减少,见图5、6。
讨论
肿瘤血管的生成是一个多因素多步骤的过程,包括了细胞增殖、迁移和胞外基质降解等。多种恶性实体肿瘤均是血管依赖性的肿瘤,通常是由于血管异常增生,导致的一系列级联反应,主要取决于血管生成促进因子和抑制因子二者之间的比例[4]。这两类因子以VEGF和endostatin最具代表性。
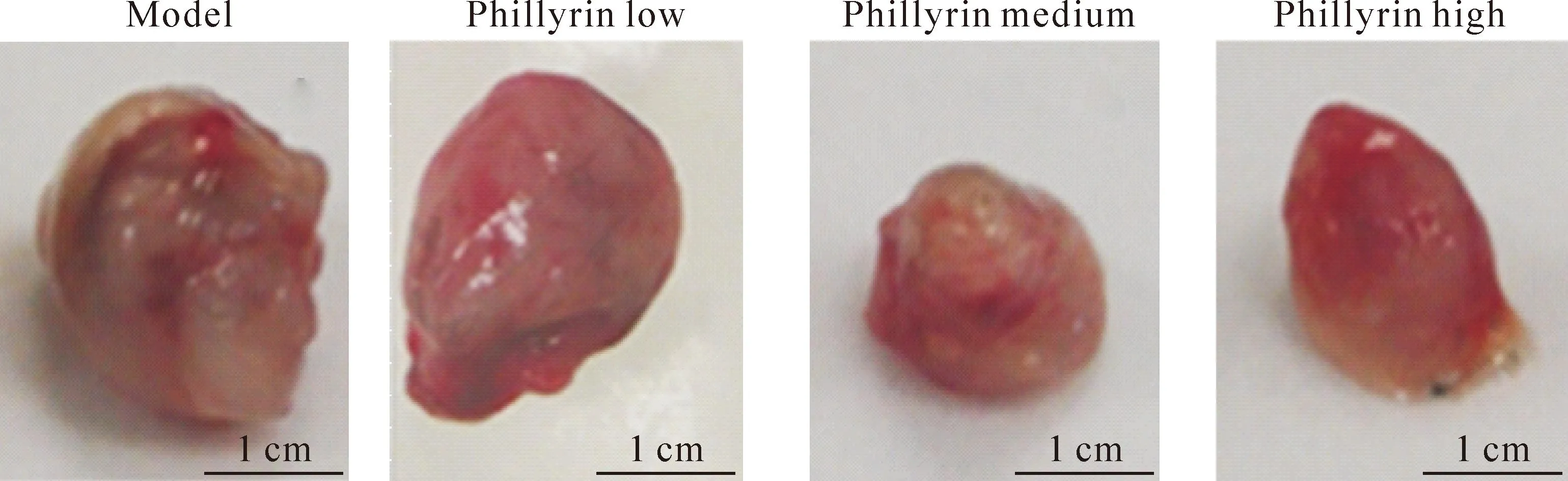
Figure 4.Tumor size observation in each group.
图4各处理组肿瘤大小

Figure 5.The protein expression of VEGF in the tumor tissues isolated from Lewis lung carcinoma treated with phillyrin (immunohistochemical staining,×400). Mean±SD.n=10.*P<0.05vscontrol.
图5Lewis肺癌小鼠给予连翘苷后肿瘤组织中VEGF的表达

Figure 6.The protein expression of endostatin in the tumor tissues isolated from Lewis lung carcinoma treated with phillyrin (immunohistochemical staining,×400). Mean±SD.n=10.*P<0.05vscontrol.
图6Lewis肺癌小鼠给予连翘苷后肿瘤组织中endostatin的表达
VEGF是血管内皮生长因子,能够促进血管内皮细胞分裂,通过与内皮细胞膜上的特异性受体结合来发挥调节内皮细胞增殖、促进血管生成和调节血管通透性的功能[5]。研究发现,VEGF在多种肿瘤中的表达水平显著增加,与肿瘤的浸润、转移及预后有关[6-7]。肿瘤细胞的生长或转移,都依赖于VEGF的作用,具有明显的特异性。我们对临床收集的肺部正常组织、癌旁组织和非小细胞肺癌组织的样本进行免疫组化染色,结果显示在肺癌组织中VEGF呈强阳性表达,显著高于正常组织和癌旁组织,表明VEGF在肺癌组织中的表达具有特异性。给予Lewis肺癌小鼠不同剂量连翘苷后,肺癌组织中VEGF的表达下调,且与剂量呈负相关。提示连翘苷可能具有抑制肺癌组织中VEGF表达的作用,从而抑制肿瘤血管的进一步生成。
Endostatin是内源性血管生成抑制剂,特异性地抑制内皮细胞的生长、迁移,诱导其凋亡,从而抑制肿瘤血管的形成[8-9]。在多种研究中,endostatin被认为是作用最强,特异性最高的血管生成抑制因子。研究表明endostatin通过抑制eNOS的激活,从而抑制VEGF诱导的内皮细胞迁移和血管形成,也能阻断VEGF介导的信号传导通路[10]。同样地,我们也对肺部正常组织,癌旁组织和非小细胞肺癌组织的临床样本进行了免疫组化染色,结果表明,肺癌组织中endostatin呈阴性表达,低于正常组织和癌旁组织,表明endostatin在肺癌组织中的表达同样具有特异性。给予Lewis肺癌小鼠不同剂量连翘苷后,肺癌组织中endostatin的表达上调,且与剂量呈正相关。提示连翘苷可促进肺癌组织中endostatin的表达,与下调肺癌组织中VEGF表达起协同作用,共同抑制肿瘤血管的生成。
连翘苷是中药连翘的主要有效成分,已有研究表明连翘苷具有明显的抗炎、解热、内毒素中和作用和抗氧化作用。由于连翘在我国的地理分布广,可广泛种植,具有很好的开发价值。研究表明连翘苷元对免疫性大鼠纤维化有较好的治疗作用[11]。在本实验中,给予Lewis肺癌小鼠连翘苷治疗后能显著减少VEGF和增加endostatin的表达,提示连翘苷可抑制肿瘤血管的生长。再者,HE切片染色结果显示,高剂量的连翘苷能显著减少肝肿瘤的体积,瘤组织密度显著减少,提示连翘苷具有抑制肝癌发展的作用。具体机制还需进行下一步研究。综上所述,本研究为连翘苷用于临床肝癌治疗提供了一定的实验基础。
[参考文献]
[1]Ulahannan SV, Brahmer JR. Antiangiogenic agents in combination with chemotherapy in patients with advanced non-small cell lung cancer[J]. Cancer Invest, 2011, 29(4): 325-337.
[2]van Loon J, van Baardwijk A, Boersma L, et al. Therapeutic implications of molecular imaging with PET in the combined modality treatment of lung cancer[J]. Cancer Treat Rev, 2011, 37(5): 331-343.
[3]潘博. 潘敏求主任医师治疗肺癌经验[J]. 湖南中医杂志,2010,26(3):44-45.
[4]闫长青,刘三光,戚诚,等.胰腺癌患者外周血VEGF和endostatin表达及意义[J].中国肿瘤临床与康复,2011,18(4):293-295.
[5]段泽星,谢立群. VEGF在肿瘤生成和血管生成中的作用[J]. 世界华人消化杂志,2010, 18(27):2894-2900.
[6]Sullivan LA, Brekken RA. The VEGF family in cancer and antibody-based strategies for their inhibition [J]. MAbs, 2010, 2(2):165-175.
[7]Khromova N, Kopnin P, Rybko V, et al. Downregulation of VEGF-C expression in lung and colon cancer cells decelerates tumor growth and inhibits metastasis via multiple mechanisms[J]. Oncogene, 2012, 31(11):1389-1397.
[8]钟晓刚,殷舞,黄顺荣,等.载体肝干细胞分泌表达的Endostatin对血管内皮细胞增殖和凋亡的影响[J]. 临床肝胆病杂志,2011, 27(11):1203-1206.
[9]蒋晓东,戴鹏,吴瑾,等. 放疗联合周剂量重组人血管内皮抑素对A549肺腺癌裸鼠移植瘤生长抑制作用的研究[J]. 肿瘤,2010, 30(11):917-923.
[10]Gao P, Gao YJ, Liang HL. Effect of NF-κB inhibitor PDTC on VEGF and endostatin expression of mice with Lewis lung cancer[J]. Asian Pac J Trop Med, 2015, 8(3):220-224.
[11]王恩力,姚景春,刘铮.连翘苷元对大鼠免疫性肝纤维化的影响[J]. 药物评价研究,2015, 38(2):161-164.
(责任编辑: 林白霜, 罗森)
Effects of phillyrin on VEGF and endostatin expression in Lewis lung carcinoma
ZHENG Mo, JIANG Zhong-min
(DepartmentofPathology,TianjinFifthCentreHospital,Tianjin300450,China.E-mail:zhengzz1978@126.com)
[ABSTRACT]AIM: To investigate the effects of phillyrin on vascular endothelial growth factor (VEGF) and endostatin expression in lung tumor tissues isolated from Lewis lung carcinoma. METHODS: The expression of VEGF and endostatin in control individuals and the patients with lung cancer was determined by immunohistochemistry. In the animal experiment, 5 groups of animals were examined: control, tumor model, and tumor model with 3 different concentrations of phillyrin treatments. For preparation of transplanted tumor model, Lewis cells were subcutaneously injected into the right limb armpit of the nude mice. After that, phillyrin was administered via oral gavage once daily for 20 d at dose of 5 or 10 g/kg, or twice daily at 10 g/kg. Lung tumor tissues isolated from each group were observed by hematoxylin-eosin staining. VEGF and endostatin expression were examined by immunohistochemistry. RESULTS: VEGF expression was increased in lung tumor tissues as compared with normal and pericarcinous tissues, while endostatin expression was decreased. Phillyrin significantly inhibited the tumor size and tumor tissue density dose-dependently, which was accompanied with a decrease in VEGF expression and an increase in endostatin expression. CONCLUSION: Phillyrin inhibits the development of lung tumor through reducing VEGF expression and increasing endostatin expression.
[KEY WORDS]Phillyrin; Lewis lung carcinoma; Vascular endothelial growth factor; Endostatin
[文章编号]1000- 4718(2016)01- 0167- 06
[收稿日期]2015- 08- 17[修回日期] 2015- 09- 21
*[基金项目]国家自然科学基金青年科学基金资助项目(No. 81001001)
通讯作者△Tel: 022-65665599; E-mail: zhengzz1978@126.com
[中图分类号]R734.2; R730.23
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.029

