过表达miR-132改善阿尔茨海默病样学习记忆障碍*
王雪银, 李宜培, 程相树, 赵昆朋△
(1河南医学高等专科学校,河南 郑州 451191; 2河南大学医学院,河南 开封 475004)
过表达miR-132改善阿尔茨海默病样学习记忆障碍*
王雪银1,李宜培1,程相树2,赵昆朋2△
(1河南医学高等专科学校,河南 郑州 451191;2河南大学医学院,河南 开封 475004)
[摘要]目的: 获得过表达微小RNA-132(microRNA-132,miR-132)的慢病毒,并检测对Tg2576小鼠学习记忆损伤的改善。方法: 从小鼠脑组织中克隆miR-132成熟序列上下游各100 bp的基因,将基因克隆至慢病毒表达载体pLenti7.3,酶切鉴定并且DNA序列测定正确。 pLenti7.3-miR-132和ViraPower Packaging Mix 共转染293FT细胞。72 h后收获上请,采用超速离心和聚乙二醇法纯化病毒颗粒并分装保存。分别以病毒颗粒感染细胞系和小鼠海马组织验证病毒的感染能力。Tg2576小鼠海马区注射病毒,Western blot和Morris水迷宫分别检测记忆相关蛋白水平和空间学习记忆能力。 结果: 所包装的miR-132病毒颗粒能够高效地感染细胞系,并且在体内也有理想的感染效率。和对照组相比,过表达miR-132的Tg2576小鼠PSD95和GluR1明显升高,并且空间依赖的学习记忆能力明显提高。结论: 过表达miR-132通过影响突触相关蛋白PSD95和GluR1的水平改善Tg2576小鼠的空间学习记忆能力障碍。
[关键词]微小RNA-132; 病毒包装; Tg2576小鼠; 学习; 记忆
微小RNA(microRNA,miRNA)是在1993年被发现的一类在进化上非常保守,短的(大约21~22 nt),非编码的RNA分子[1]。人源miR-132定位于染色体17p13.3,富含于脑组织,尤其是在海马区高表达。miR-132在多种神经系统相关疾病或者模型动物中表达下调,包括阿尔茨海默病(Alzheimer di-sease,AD)[1-2]、胎儿无脑畸形[3]、亨廷顿疾病[4-5]、精神分裂症和双相情感障碍[6]、帕金森病[7]。miR-132还能影响一些突触相关蛋白的表达,研究证实体外过表达miR-132会引起谷氨酸受体NR2A、NR2B和GluR1的表达上调[8]。最新研究揭示在原代培养的神经元中敲除miR-132导致FOXO3a的表达升高而诱导大量的神经元凋亡[9]。miR-132由于参与了众多的神经生理和病理过程而被称为“NeurimmiR”。以上的研究结果也说明miR-132涉及到了突触可塑性和学习记忆的过程,但是具体的分子机制现在还不清楚。因此,探索miR-132调控学习记忆的机制对于一些神经退行性疾病的理解和治疗有重要意义。为了探讨miR-132在神经系统的作用机制,本研究构建和纯化了表达带有EGFP标签蛋白的miR-132慢病毒颗粒并探讨了miR-132对阿尔茨海默病模型小鼠学习记忆损伤的影响。
材料和方法
1材料和试剂
用于包装病毒的载体系统的pLenti7.3/V5-TOPO TA Cloning Kit试剂盒购自Invitrogen;293FT细胞购自ATCC;Pyrobest高保真酶购自TaKaRa;T4 DNA连接酶、TaqDNA聚合酶和限制性内切酶购自BioLab;质粒提取试剂盒、miRNA提取试剂盒和DNA回收试剂盒购自北京天根生物公司;聚乙二醇[poly(ethylene glycol),PEG]-8000购自Sigma;阿尔茨海默病模型小鼠Tg2576(转人突变APP)由本室饲养保存。
2方法
2.1miRNA的提取小心分离小鼠脑组织,按照miRNA提取试剂盒说明书操作miRNA, 1.5%的琼脂糖电泳和A260/A280比值鉴定其纯度和浓度。
2.2反转录PCR克隆pri-miR-132取1 μL mi-RNA, 按照第1链cDNA合成试剂盒说明书操作合成第1链cDNA。以cDNA为模板,用特异性克隆pri-miR-132的上、下游引物(上游引物为5’-CCCTGTGGGTTGCGGTGGGCGCAG-3’,下游引物为5’-CATCGAATGTTGCGTCGCCG-3’)扩增pri-miR-132序列,1%的琼脂糖凝胶鉴定PCR产物,DNA回收试剂盒回收目的基因。
2.3病毒表达载体的构建将纯化后的pri-miR-132基因用T4 DNA连接酶连接至病毒表达载体pLenti7.3,转化JM109,菌落PCR及酶切鉴定并获得阳性克隆。提取质粒,测定纯度和浓度并分装保存。
2.4病毒包装转染前1 d,在10 cm直径的培养皿内种植处于对数生长期的293FT细胞。于第2天当细胞融合度达到90%时进行转染。利用脂质体2000把miR-132的表达载体pLenti7.3-miR-132和病毒支持载体ViraPower® Packaging Mix共转染293FT细胞,具体操作见Lippo2000说明书。转染24 h后,更换新鲜的无抗生素的完全培养基。72 h和5 d后,各收获1次细胞培养上清,0.45 μm的滤膜过滤初步纯化病毒。PEG-8000浓缩病毒后分装保存于-80 ℃。
2.5病毒感染小鼠海马组织选取3~4月龄的雄性C57/BL小鼠,采用脑立体定位技术,将4 μL浓缩后的病毒悬液注射至小鼠两侧海马齿状回区。2周后,一组小鼠常规灌流,脑组织冰冻切片,荧光显微镜下观察miR-132表达情况。同时另一组小鼠提取海马组织的miRNA, 定量PCR法检测miR-132的表达水平。
2.6Western blot实验感染Tg2576小鼠海马区神经元,设置空载体为阴性对照。2周后提取2组小鼠海马组织蛋白,12%的聚丙烯酰胺凝胶电泳分离蛋白,常规转膜,抗PSD95和GluR1抗体作为 I 抗进行孵育,常规 II 抗孵育,洗膜。Odensey激光红外扫描仪扫膜检测蛋白水平。
2.7Morris水迷宫实验由于本实验采用的是Tg2576小鼠,所以圆桶水内添加有钛白粉便于记录小鼠运动轨迹。设定潜伏期为90秒。如果小鼠在潜伏期内找到并停留在平台上5 s,则记录实际潜伏期。定位航行实验时将圆桶目标象限内放置有隐藏的平台,任选圆桶平面4个象限中的1个作为小鼠入水点,将小鼠沿着桶壁面朝实验者轻轻放入水中,同时软件记录小时游泳轨迹。如果在潜伏期内小鼠找不到平台,则引导至平台上,停留15 s。每只小鼠每天进行1个象限的训练,每个象限完成后休息10 min,固定时间连续训练6 d。每只小鼠每个象限的潜伏期均被记录。如果室内温度过低,每只小鼠完成一轮实验后迅速擦干身上水迹,并注意保暖。经过连续6 d的训练后,休息24 h后行空间搜索实验。撤去圆桶内的平台,其余条件同定位航行实验。任选一象限(避免目标象限)轻轻放入小鼠,同时开始记录90 s内小鼠在目标象限的停留时间和穿越原有平台位置的次数以及运动轨迹。实验动物分为2组,每组15只。实验组为Tg2576小鼠海马区注射pLenti7.3-miR132病毒;对照组为Tg2576小鼠注射空载体对照病毒。
3统计学处理
全部数据采用平均数±标准差(mean±SD)表示,运用SPSS 12.0统计学软件对以上所有实验数据进行分析处理统计,多组间比较采用单因素方差分析,两组间比较采用Student’sttest,以P<0.05为差异有统计学意义。
结果
1Pri-miR-132基因的克隆和pLenti7.3-miR-132载体的构建
以小鼠脑组织cDNA为模板,特异性的上、下游引物扩增获得了pri-miR-132的基因。从图1中可以看到大小为250 bp的条带被特异性扩增。纯化后的pri-miR-132基因直接连至病毒表达载体pLenti7.3, 转化大肠杆菌后,菌液PCR和双酶切鉴定结果见图2。

Figure 1.Cloning the pri-miR-132 gene from mouse brain. Lane 1, 2: pri-miR-132 gene.
图1从小鼠脑组织中扩增pri-miR-132基因

Figure 2.Construction and identification of pLenti7.3-pri-miR-132 vector. A: lane 1~6: the production of PCR; B: lane 1~5: the pLenti7.3-pri-miR132 plasmid were treated by dual restriction enzymes.
图2构建并鉴定pLenti7.3-pri-miR-132载体
2病毒感染小鼠海马组织
为了检测获得病毒的体内感染能力,我们分别利用定量PCR和脑片免疫荧光检测了病毒感染后小鼠海马组织的miR-132的表达水平。定量PCR结果示同生理盐水组比较,注射pLenti7.3-pri-miR-132病毒颗粒组的小鼠海马区miR-132的表达水平明显增高。同时脑片荧光结果也提示了病毒感染后的小鼠海马区miR-132的表达水平也显著上调。以上的结果说明了我们获得的miR-132过表达慢病毒颗粒在体内可以有效地感染组织细胞,见图3。
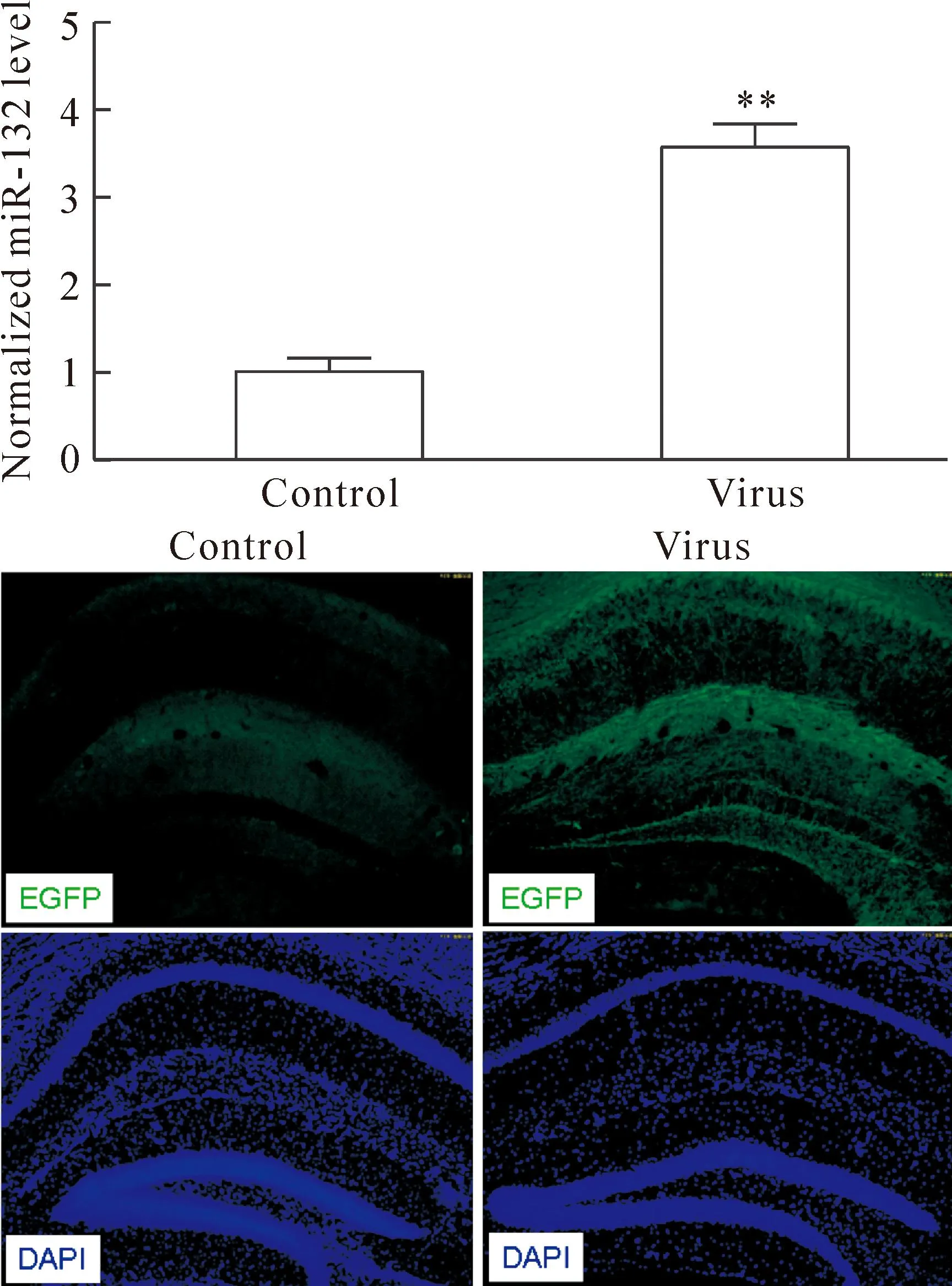
Figure 3.Detection of pLenti7.3-miR-132 virus infection efficiency. Mean±SD.n=3.**P<0.01vscontrol.
图3miR-132慢病毒感染效率的检测
3过表达miR-132增加PSD95和GluR1蛋白水平
我们利用Western blot检测了过表达miR-132对突触蛋白的影响,结果显示同对照组相比,过表达miR-132后,海马区PSD95和GluR1的蛋白水平明显增加,说明miR-132可能通过调控突触相关蛋白的水平影响学习记忆的能力,见图4。
4过表达miR-132改善Tg2576小鼠学习记忆损伤
为了确认miR-132对于AD样学习记忆损伤的影响,我们利用Morris水迷宫的方法分别检测病毒感染后和空载体病毒感染后的Tg2576发病小鼠海马依赖的空间学习记忆能力。结果提示同空载体对照相比,经过病毒介导的miR-132过表达后,Tg2576小鼠在训练阶段即学习的能力明显增强,潜伏期显著缩短,而在训练结束后的记忆检测证实过表达miR-132后的Tg2576小鼠的记忆能力显著增强,撤去平台后穿越平台的次数明显增加,见图5。
讨论
MicroRNA是近年来出现的一种新的蛋白调控因子,通常是和靶蛋白3’UTR端互补结合导致蛋白表达抑制或者mRNA降解[10-11]。miR-132是一种富含于脑内海马组织的miRNA,更是特异性表达在神经元上[12]。过表达miR-132可以通过下调p250GAP增加突触的分支和树突棘的数目[13]。敲除齿状回的miR-132损伤树突的发育[14]。嗅球区过表达miR-132在迁移期保护神经元的存活,这种保护会引起迁移增加而改善学习记忆[15]。所以我们有理由推测miR-132参与了学习记忆的调控,而且这种调控机制现在还不清楚。

Figure 4.The levels of the synapse-related proteins regulated by miR-132. pLenti7.3 vector was empty control vector, and pLenti7.3-miR-132 was miR-132 over-expression virus. Mean±SD.n=3.*P<0.05vspLenti7.3 vector.
图4过表达miR132显著影响PSD95、GluR1蛋白的表达水平

Figure 5.Overexpression of miR-132 attenuated Tg2576 mouse hippocampus-dependent spatial leanimg and memory impairment. Mean±SD.n=12.*P<0.05 ,**P<0.01vspLenti7.3 vector.
图5过表达miR132改善Tg2576小鼠海马依赖的空间学习记忆障碍
慢病毒具有可以感染非分裂期和分裂期细胞、容纳外源性基因片段大、可以长期表达等显著优点已经被广泛应用[16]。为了更好地研究miR-132在神经系统中的功能,本研究利用Invitrogen最新的慢病毒表达系统ViraPowerTMHiPerformTMLentiviral Expression System,该系统具有更高的表达水平,更好的感染效率,而且能够有效地感染体内组织。我们利用分子生物学方法克隆了miR-132的前体序列,构建了表达载体pLenti7.3-pri-miR-132,通过和病毒支持载体ViraPowerTMPackaging Mix共转染293FT细胞获得了病毒颗粒。采用PEG-8000浓缩病毒后,体内实验证实了该病毒具有很好的感染效率和有效提升miR-132的表达水平。在阿尔茨海默疾病模型Tg2576小鼠海马区注射该病毒过表达miR-132能够显著增加海马区突触相关蛋白PSD95和GluR1的水平。长时程增强(long-term potentiation,LTP)是学习记忆的分子基础,GluR1属于谷氨酸受体家族成员,PSD95(突触后致密蛋白)可以整合谷氨酸受体家族成员之间的相互作用,促进Ca2+内流,进而增强LTP。Morris水迷宫结果表明过表达miR-132的Tg2576小鼠在定位航行阶段的潜伏期明显缩短,而在空间搜索阶段穿越平台位置的次数也显著增加,说明了其空间依赖的学习和记忆能力都得到了明显改善。综上所述,我们的研究结果初步证实了miR-132上调PSD95和GluR1的表达,可能通过增强LTP从而改善AD鼠的学习记能力,为进一步的研究提供一定的理论依据。
[参考文献]
[1]De Pietri Tonelli D, Pulvers JN, Haffner C, et al. miRNAs are essential for survival and differentiation of newborn neurons but not for expansion of neural progenitors during early neurogenesis in the mouse embryonic neocortex[J]. Development, 2008, 135(23):3911-3921.
[2]Cheng LC, Pastrana E, Tavazoie M, et al. miR-124 regulates adult neurogenesis in the subventricular zone stem cell niche[J]. Nature Neurosci, 2009,12(4): 399-408.
[3]Fiore R, Khudayberdiev S, Christensen M, et al. Mef2-mediated transcription of the miR379-410 cluster regulates activity-dependent dendritogenesis by fine-tuning Pumilio2 protein levels[J]. EMBO J, 2009, 28(6):697-710.
[4]Vo N, Klein ME, Varlamova O, et al. A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J]. Proc Natl Acad Sci U S A, 2005, 102(45):16426-16431.
[5]Siegel G, Obernosterer G, Fiore R, et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis[J]. Nature Cell Biol, 2009, 11(6):705-716.
[6]Schratt GM, Tuebing F, Nigh EA, et al. A brain-specific microRNA regulates dendritic spine development[J]. Nature, 2006, 439(7074):283-289.
[7]Bonhoeffer T, Yuste R. Spine motility, phenomenology, mechanisms, and function[J]. Neuron, 2002, 35(6):1019-1027.
[8]Hébert SS, De Strooper B. Alterations of the microRNA network cause neurodegenerative disease[J]. Trends Neurosci, 2009, 324(4):199-206.
[9]Smith PY, Delay C, Girard J, et al. MicroRNA-132 loss is associated with tau exon 10 inclusion in progressive supranuclear palsy[J]. Hum Mol Genet, 2011, 20(20):4016-4024.
[10]Vasudevan S, Tong Y, Steitz JA. Switching from repression to activation: microRNAs can up-regulate translation[J]. Science, 2007, 318(5858):1931-1934.
[11]Verdel A, Vavasseur A, Le Gorrec M, et al. Common themes in siRNA-mediated epigenetic silencing pathways[J]. Int J Dev Biol, 2009, 53(2-3):245-257.
[12]Magilla ST, Cambronnea XA, Luikarta BW, et al. microRNA-132 regulates dendritic growth and arborization of newborn neurons in the adult hippocampus[J]. Proc Natl Acad Sci U S A, 2010, 107(47):20382-20387.
[13]Wayman GA, Davare M, Ando H et al. An activity-regulated microRNA controls dendritic plasticity by down-regulating p250GAP[J]. Proc Natl Acad Sci U S A, 2008, 105(26):9093-9098.
[14]Remenyi J, van den Bosch MW, Palygin O, et al. miR-132/212 knockout mice reveal roles for these miRNAs in regulating cortical synaptic transmission and plasticity[J]. PLoS One, 2013, 26(4):e62509.
[15]Pathania M, Torres-Reveron J, Yan L, et al. miR-132 enhances dendritic morphogenesis, spine density, synaptic integration, and survival of newborn olfactory bulb neurons[J]. PLoS One, 2012, 7(5):e38174.
[16]Cockrell AS, Kafri T. Gene delivery by lentivirus vectors[J]. Mol Biotechnol, 2007, 36(3):184-204.
(责任编辑: 林白霜, 罗森)
Overexpression of miR-132 attenuates Alzheimer disease-like learning and memory impairment
WANG Xue-yin1, LI Yi-pei1, CHENG Xiang-shu2, ZHAO Kun-peng2
(1HenanMedicalCollege,Zhengzhou451191,China;2MedicalCollegeofHenanUniversity,Kaifeng475004,China.E-mail:zhaokp@henu.edu.cn)
[ABSTRACT]AIM: To obtain miR-132 lentivirus and to detect the effect of miR-132 overexpression on the improvement of learning and memory impairment in Tg2576 mice. METHODS: The pri-miR-132 gene was purified from mouse brain and cloned into lentivirus vector pLenti7.3-miR-132. The miR-132 lentivirus was packaged by co-transfected pLenti7.3-miR-132 with ViraPower Packaging Mix into 293FT cells. The miR-132 lentivirus was purified 72 h later from the supernatant by ultracentrifugation and poly(ethylene glycol) method. The efficiency of miR-132 lentivirus was identified by transfection into N2A cells and mouse hippocampus region. Tg2576 mice were injected with miR-132 virus in the hippocampus region and the expression of learning- and memory-related proteins and functions were determined. RESULTS: miR-132 lentivirus expression vector was constructed successfully. The purified virus was obtained with transfection activity. Tg2576 mice with overexpression of miR-132 had a significant improvement in learning and memory abilities. CONCLUSION: miR-132 lentivirus with biological activity was obtained. Overexpression of miR-132 in the hippocampus region of Tg2576 mice attenuates the learning and memory impairment.
[KEY WORDS]MicroRNA-132; Virus package; Tg2576 mouse; Learning; memory
[文章编号]1000- 4718(2016)01- 0041- 05
[收稿日期]2015- 04- 15[修回日期] 2015- 11- 03
*[基金项目]国家自然科学基金资助项目(No. 81401062;No. U1504809)
通讯作者△Tel: 0371-23880585; E-mail: zhaokp@henu.edu.cn
[中图分类号]R363.1+4
[文献标志码]A
doi:10.3969/j.issn.1000- 4718.2016.01.007

