大黄素通过内质网应激诱导的细胞凋亡途径对结肠癌细胞增殖的抑制作用
刘保荣, 袁 博, 慕喜喜, 慕为民, 王重民
(西安市中心医院普外二科,西安 710003; *通讯作者,E-mail:bobopaulcn@163.com)
大黄素通过内质网应激诱导的细胞凋亡途径对结肠癌细胞增殖的抑制作用
刘保荣*, 袁博, 慕喜喜, 慕为民, 王重民
(西安市中心医院普外二科,西安710003;*通讯作者,E-mail:bobopaulcn@163.com)
摘要:目的观察大黄素对结肠癌细胞增殖的抑制作用,并探讨其可能机制。方法取人结肠癌SW620细胞,分为对照组,大黄素低浓度(30 μmol/L,LD)组,中浓度(60 μmol/L,MD)组,高浓度(90 μmol/L,HD)组和大黄素+内质网特异性应激抑制剂4-PBA(大黄素90 μmol/L、PBA8 μmol/L,HD+PBA)组。各实验组细胞在培养基中对应加入相应浓度的大黄素溶液或大黄素+4-PBA溶液后培养48 h,MTT比色法观察细胞增殖,Hoechst染色法观察细胞凋亡,Western blot法检测ERS标志蛋白GRP-78、CHOP以及活化Caspase-12的表达变化。结果与正常对照组相比,LD、MD及HD组大黄素对结肠癌SW620细胞增殖的抑制率、细胞凋亡率和细胞内GRP-78、CHOP和活化Caspase-12的表达水平均显著升高(P<0.05),且呈现浓度依赖性(P<0.05);与HD组相比,HD+PBA组对结肠癌SW620细胞增殖的抑制作用、细胞凋亡以及细胞内GRP-78、CHOP以及活化caspase-12的表达水平均显著降低(P<0.05)。结论大黄素能够通过内质网应激(ERS)诱导的细胞凋亡途径抑制结肠癌细胞增殖。
关键词:结肠癌;大黄素;内质网应激;细胞增殖;细胞凋亡
结肠癌为世界范围内最常见的实体恶性肿瘤之一,近年来其发病率以每年2%的速度递增。随着医学技术的不断发展,恶性肿瘤的根治成功率及患者生存率均有提高,但结肠癌的预后仍然不佳[1]。目前能够根治结肠癌的治疗方式仍然是手术治疗,但大部分患者出现明显临床症状时已失去根治性手术治疗机会而只能选择放疗、化疗等姑息疗法。然而,相当一部分结肠癌患者因严重副反应而无法耐受放疗、化疗。因此,具有抗肿瘤活性而毒副作用小的药物成为近年来研究的热点。
近年来,源自中草药的单体成分,如姜黄素、苦参素以及大黄素等均具有抗肿瘤的药理学活性。大黄素提取自传统中药大黄的根茎中,研究表明其具有多种药理学活性,如抗炎、抗感染、抗纤维化以及抗肿瘤等[2]。既往研究显示大黄素具有抑制结肠癌细胞增殖以及诱导其凋亡的作用[3,4]。内质网应激(ERS)能够诱导细胞凋亡,是多种外界因素诱导细胞凋亡的重要通路之一。本研究以大黄素处理人结肠癌SW620细胞,观察大黄素诱导的ERS和细胞凋亡,以及二者之间的相互关系,探讨ERS诱导的细胞凋亡是否为大黄素抑制结肠癌细胞增殖的可能分子机制。
1材料与方法
1.1细胞系及主要试剂
SW620细胞系购自南京凯基生物科技发展有限公司。GRP78、CHOP及GAPDH购自美国Abcam公司;Caspase-12购自Cell Signaling Technology公司。RIPA裂解液购自Santa Cruz公司。
1.2细胞培养与分组处理
将SW620细胞系接种于含10%胎牛血清(FBS)的RPMI1640培养基中,于37 ℃,5%CO2传代培养。根据实验设计,分为对照组,大黄素低浓度组(LD),大黄素中浓度组(MD),大黄素高浓度组(HD)和大黄素高浓度+4-PBA组(HD+PBA)。对照组细胞于培养基中培养48 h;LD组细胞在培养基中加入大黄素溶液(30 μmol/L)后培养48 h;MD细胞在培养基中加入大黄素溶液(60 μmol/L)后培养48 h;HD组细胞在培养基中加入大黄素溶液(90 μmol/L)后培养48 h;HD+PBA组细胞在培养基中加入大黄素溶液(90 μmol/L)的同时加入4-BPA(DMSO溶解,8 μmol/L,pH=7.2)培养48 h。
1.3细胞增殖检测
采用MTT比色法检测细胞增殖。将对数生长期的SW620细胞接种于96孔板中,每孔接种1×105个。细胞贴壁生长后,按预定对照组、LD、MD、HD和HD+PBA分组对应加入浓度为0,30,60,90 μmol/L的大黄素,或90 μmol/L的大黄素同时加入4-PBA(DMSO溶解,8 μmol/L,pH=7.2),每组均设4个复孔。培养48 h,随后加入MTT溶液(5 g/L)20 μl,孵育4 h,弃去上清后加入DMSO 150 μl,震荡后在酶标仪上测量490 nm波长处吸光值(A),按照以下公式计算抑制率:抑制率=(A对照组-A试验组)/A对照组×100%。
1.4细胞凋亡检测
采用Hoechst33342染色法检测细胞凋亡。将各组细胞制成细胞涂片,以0.1%多聚甲醛固定30 min,PBS洗涤,避光条件下以Hoechst33342染色10 min,倒置荧光显微镜观察,激发波长为340 nm。凋亡细胞内可见浓染致密的颗粒块状荧光。
1.5Western blot 检验相关蛋白表达
胰酶消化后收集各组细胞,以RIPA裂解液处理,对细胞进行匀浆及离心后获得总蛋白。BCA法检测蛋白浓度,各组蛋白样品分别取100 μg 总蛋白,加6×上样缓冲液,100 ℃变性5 min,经10%SDS-PAGE 凝胶电泳后,电转移至PVDF 膜。5%脱脂奶粉37 ℃封闭2 h,加入GRP-78、Caspase-12、GAPDH和CHOP抗体,4 ℃孵育12 h。PBST洗涤后室温下采用相应二抗孵育30 min,ECL显色法显色。
1.6统计学分析
2结果
2.1大黄素抑制SW620细胞增殖且具有浓度依赖性
本研究MTT检测显示,经过大黄素孵育后,低、中、高浓度组SW620细胞增殖抑制率分别为(13.2±2.3)%,(34.3±6.3)%,(50.4±8.5)%。与对照组[(6.1±1.4)%]相比较,低、中、高浓度组SW620细胞增殖抑制率均显著升高(P<0.05);随着大黄素浓度的升高,细胞增殖抑制率亦呈现显著升高(见图1)。
2.2大黄素能够诱导SW620细胞凋亡且具有浓度依赖性
通过Hoechst33342荧光染色发现,大黄素孵育后,低、中、高浓度组SW620细胞凋亡逐渐增多(见图2),细胞凋亡率分别为(16.9±4.3)%,(29.4±5.2)%,(38.6±6.8)%。与对照组[(3.3±1.3)%]相比较,各浓度组均呈现浓度依赖性升高(P<0.05, 见图3)。
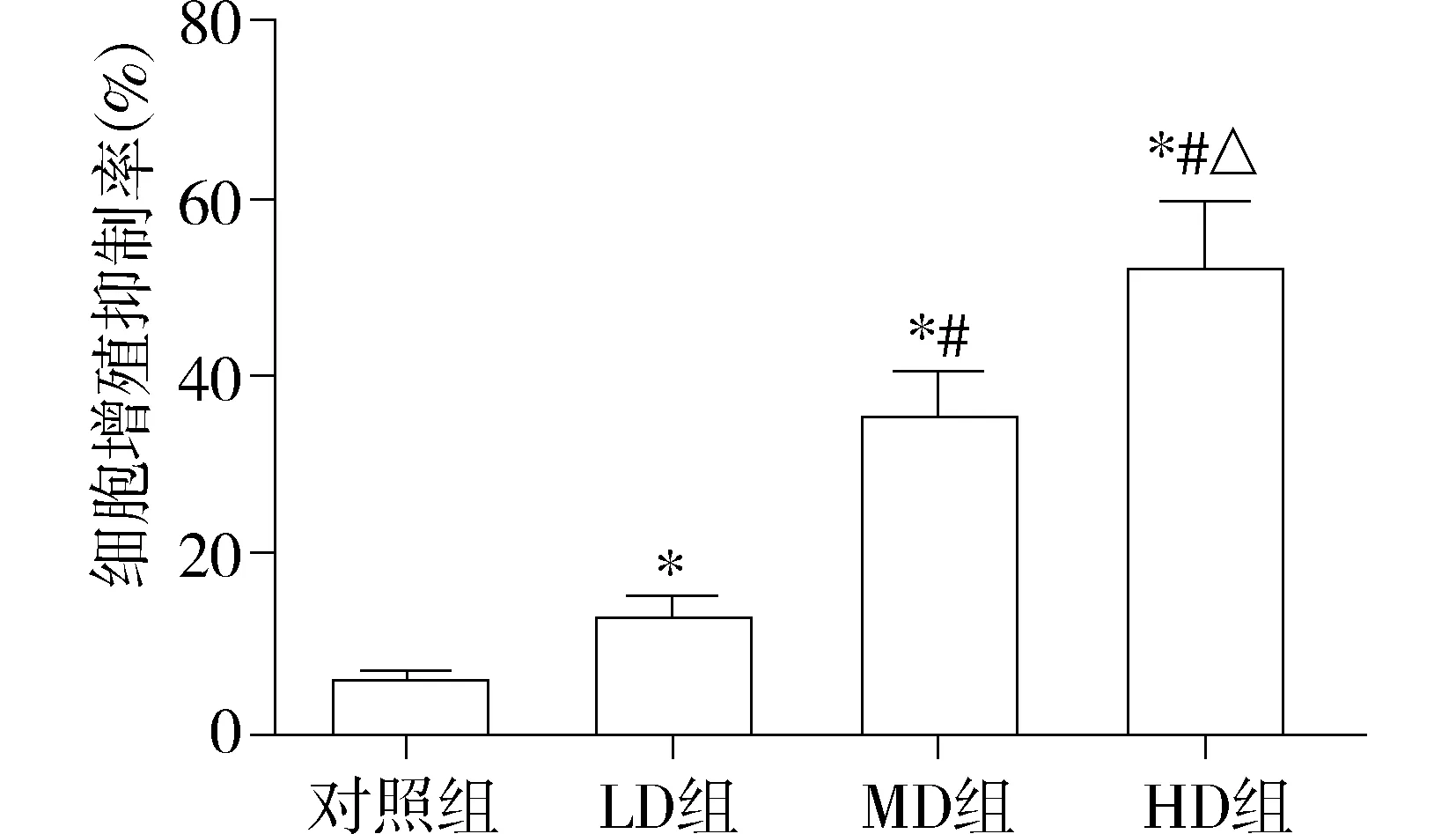
与对照组比较*P<0.05;与LD组比较 #P<0.05;与MD组比较,△P<0.05图1 不同浓度大黄素作用后SW620细胞增殖抑制率的变化Figure 1 The proliferation inhibition rate of SW620 cells after cultured with different concentrations of emodin
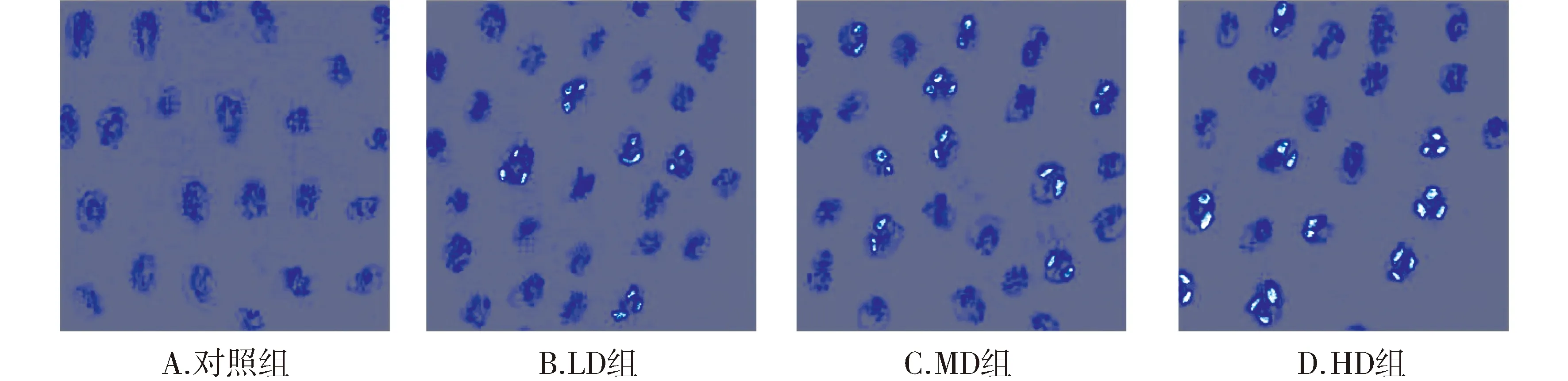
图2 不同浓度大黄素诱导的SW620细胞凋亡变化 (Hoechst染色)Figure 2 Changes of apoptosis of SW620 cells induced by different concentrations of emodin (Hoechst Staining)
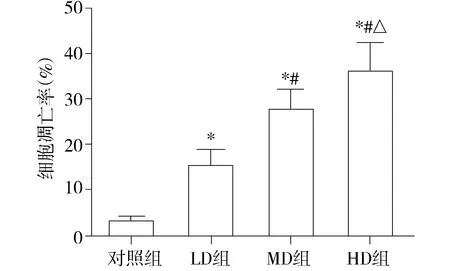
与对照组比较,*P<0.05;与LD组比较,#P<0.05;与MD组比较,△P<0.05图3 大黄素对SW620细胞凋亡影响Figure 3 Effect of emodin on the apoptosis of SW620 cells
2.3内质网应激抑制剂4-PBA抑制大黄素抗肿瘤作用
在大黄素处理SW620细胞的同时采用4-PBA进行干预,4-PBA能够同时抑制大黄素对SW620细胞凋亡的诱导作用及大黄素对SW620细胞增殖的抑制活性(见图4,5)。
2.4大黄素通过内质网应激诱导SW620细胞凋亡
如图6所示,大黄素处理SW620细胞后,细胞内GRP-78、CHOP及Caspase-12表达水平均显著升高(P<0.05),且呈现相应的浓度依赖性(P<0.05);然而,在大黄素及4-PBA共处理的SW620细胞中,与同浓度大黄素处理的SW620细胞相比,GRP-78、CHOP以及活性Caspase-12表达水平均显著下降(P<0.05)。
3讨论
大黄素为蒽醌类衍生物,是中药大黄的主要有效单体,其结构为1,3,8-三羟基-6甲基蒽醌。既往研究表明其具有多种药理学活性,如抗炎、抗感染、抗纤维化以及抗肿瘤等[2]。大黄素对多种人类肿瘤如乳腺癌、肝细胞癌、膀胱癌以及宫颈癌等均有显著的抑制作用[5,6]。既往研究同时显示大黄素具有抑制结肠癌细胞增殖以及诱导其凋亡的作用[3,4],研究显示,大黄素是通过抑制肿瘤细胞的增殖,阻滞细胞周期进程,促进肿瘤细胞的凋亡,抑制肿瘤血管生成和侵袭、转移,增加肿瘤的化疗敏感性和逆转肿瘤多药耐药,减轻化疗药物毒副反应等多种机制表现出抗肿瘤效应[7]。内质网应激能够诱导细胞凋亡,是多种外界因素诱导细胞凋亡的重要通路之一。因此将二者之间相互联系,探讨内质网应激是否为抑制结肠癌细胞增殖的可能相关分子机制是本研究的目的。
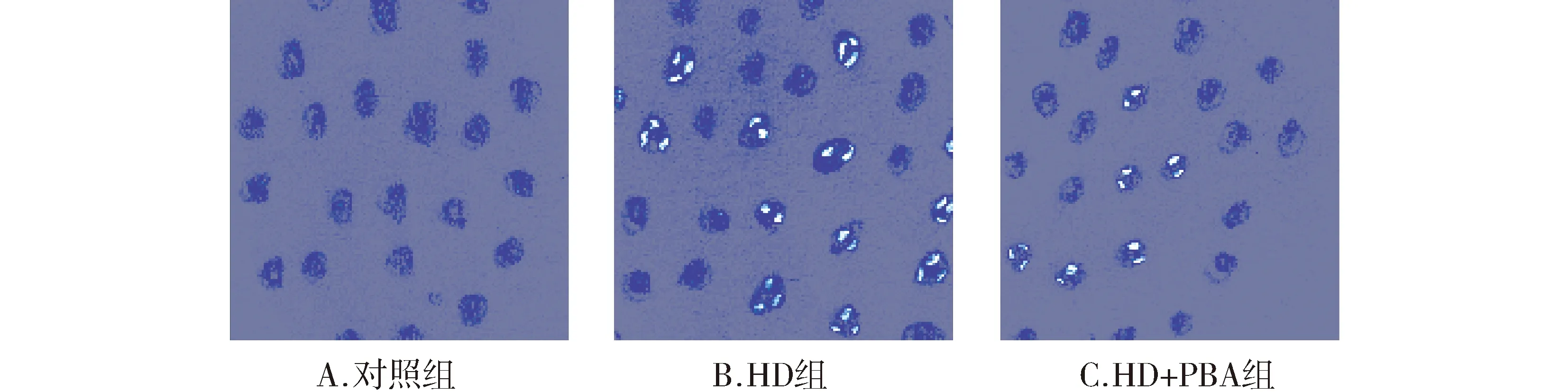
图4 4-PBA干预后大黄素孵育的SW620细胞凋亡变化Figure 4 Changes of apoptosis of SW620 cells incubated by emodin or emodin+4-PBA
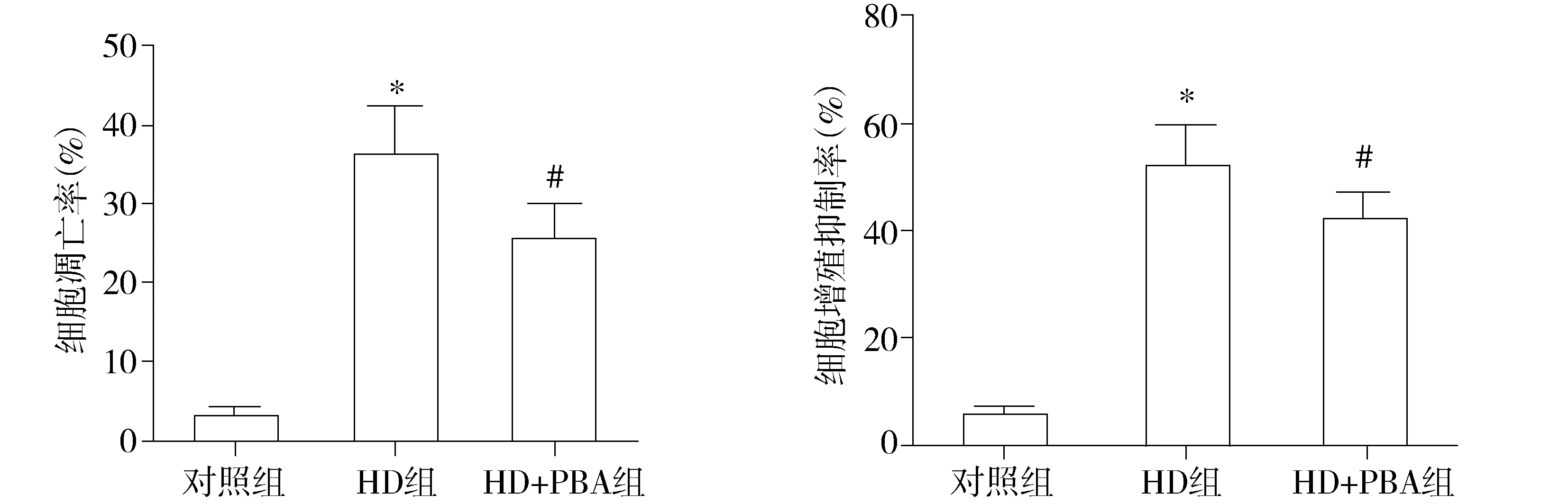
与对照组比较,*P<0.05;与HD组比较,#P<0.05图5 4-PBA对大黄素孵育SW620细胞凋亡及细胞增殖的影响Figure 5 Effect of 4-PBA on the apoptosis and proliferation of SW620 cells
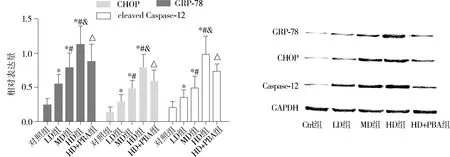
与对照组比较,*P<0.05;与LD组比较,#P<0.05;与MD组比较,&P<0.05;与HD组比较,△P<0.05图6 各组细胞内GRP-78,CHOP以及活化Caspase-12蛋白的相对表达情况Figure 6 Relative expression of GRP-78,CHOP and Caspase-12 proteins in different groups by Western blot
本研究中用不同浓度大黄素处理人结肠癌SW620细胞,观察大黄素诱导的ERS和细胞凋亡,实验结果显示,经不同浓度大黄素孵育后,人结肠癌SW620细胞的细胞凋亡增加,对结肠癌细胞增殖产生抑制,且呈现浓度依赖性,提示大黄素表现出对结肠癌的抗肿瘤活性。此结果与文献报道结果[8]基本一致。
GRP78是内质网应激的分子伴侣,位于内质网膜上,当内质网应激激活后从内质网膜上解离,其表达水平与内质网应激的程度呈正相关,是内质网应激的分子标志[9]。CHOP是内质网应激发生的效应蛋白,起转录因子的活性,可诱导下游凋亡效应蛋白的合成及凋亡通路激活。在哺乳动物体内,Caspase-12被认为是内质网应激诱导凋亡通路的特异性caspase蛋白,通过裂解激活,其活性片段(42 kD)能够进一步诱导下游Caspase-3及Caspase-9的激活,进而引起细胞凋亡[10]。本研究显示,在大黄素处理后,SW620细胞内GRP-78、CHOP以及Caspase-12水平均明显升高,进而且凋亡水平升高,细胞增殖被抑制。证实SW620细胞经大黄色孵育后,ERS参与了SW620细胞的凋亡,导致SW620增殖抑制。另一方面,在使用内质网应激特异性抑制剂4-PBA处理后,大黄素处理的SW620细胞内GRP-78、CHOP以及Caspase-12表达水平均显著下降,大黄素对细胞凋亡的诱导作用被抑制,最终表现为大黄素对SW620细胞增殖抑制活性的下降。反向证明ERS是大黄色诱导SW620细胞增殖抑制的重要机制。
总之,作用一种具有抗肿瘤活性的中药单体,大黄素对人类结肠癌细胞增殖具有明显的抑制作用,内质网应激诱导的凋亡可能是大黄素抗肿瘤活性的重要机制之一。
参考文献:
[1]Gill AA,Enewold L,Zahm SH,etal,Colon cancer treatment:are there racial disparities in an equal-access healthcare system?[J].Dis Colon Rectum,2014,57(9):1059-1065.
[2]Wei WT,Lin SZ,Liu DL,etal,The distinct mechanisms of the antitumor activity of emodin in different types of cancer(Review)[J].Oncol Rep,2013,30(6):2555-2562.
[3]Liu JX,Zhang JH,Li HH,etal,Emodin induces Panc-1 cell apoptosis via declining the mitochondrial membrane potential[J].Oncol Rep,2012,28(6):1991-1996.
[4]Cha Tai-Lung,Qiu Lin,Chen Chun-Te,etal,Emodin down-regulates androgen receptor and inhibits prostate cancer cell growth[J].Cancer Res,2005,65(60):2287-2295.
[5]Ok S,Kim SM,Kim C,etal.Emodin inhibits invasion and migration of prostate and lung cancer cells by downregulating the expression of chemokine receptor CXCR4[J].Immunopharmacol Immunotoxicol,2012,34(5):768-778.
[6]Xu YY,You YW,Ren XH,etal.Endoplasmic reticulum stress-mediated signaling pathway of gastric cancer apoptosis[J].Hepatogastroenterology,2012,59(120):2377-2384.
[7]夏启松,孙仁宇,修瑞娟.大黄素抗肿瘤分子机制的研究进展[J].中国中西医结合杂志,2006,29(1):85-88.
[8]左文英,陈媛媛,蔡骏,等.大黄素抑制人结肠癌RKO、Caco-2细胞体外增殖作用的研究[J].辽宁中医杂志,2013,40(3):580-582.
[9]Xu YY,You YW,Ren XH,etal.Endoplasmic reticulum stress-mediated signaling pathway of gastric cancer apoptosis[J].Hepatogastroenterology,2012,59(120):2377-2384.
[10]Xu Xiucai,Liu Tingting,Zhang Aimei,etal.Retraction for Xu et al,Reactive oxygen species-triggered trophoblast apoptosis is initiated by endoplasmic reticulum stress via activation of caspase-12,CHOP,and the JNK pathway in Toxoplasma gondii infection in mice[J].Infect Immun,2015,83(4):1735.
Inhibitory effect of emodin on the proliferation of colon cancer cells through the pathway of apoptosis induced by endoplasmic reticulum stress
LIU Baorong*, YUAN Bo, MU Xixi, MU Weimin, WANG Chongmin
(SecondDepartmentofGeneralSurgery,Xi’anCentralHospital,Xi’an710003,China;*Correspondingauthor,E-mail:bobopaulcn@163.com)
Abstract:ObjectiveTo investigate the inhibitory effect of emodin on the proliferation of colon cancer cells and to explore its possible mechanism.MethodsThe human colon cancer cells of SW620 were divided into control group, low concentration of emodin(30 mol/L) group(LD), middle concentrations of emodin(60 mol/L) group(MD), high concentration of emodin(90 mol/L) group(HD) and emodin(90 mol/L) plus 4-PBA(ERS inhibitor,8 μmol/L) group(HD+PBA). The SW620 cells were cultured with the corresponding concentrations of emodin or emodin plus 4-PBA. After culture for 48 h, the proliferation rate of SW620 cells was observed by MTT colorimetric method, the apoptosis of SW620 cells was observed by Hoechst staining, and the expression of endoplasmic reticulum stress(ERS) marker proteins(GRP-78, CHOP and activated Caspase-12) in SW620 cells were detected by Western blot.Results Compared with control group, the inhibitive rate of proliferation, the apoptosis rate and the expression levels of GRP-78, CHOP and activated Caspase-12 were significantly increased in a concentration dependent manner in LD, MD and HD groups(P<0.05). Compared with HD group, the inhibitive rate of proliferation, the apoptosis rate and the expression levels of GRP-78, CHOP and activated Caspase-12 were significantly decreased in HD+PBA group(P<0.05).ConclusionThe proliferation of colon cancer cells can be inhibited by emodin through the pathway of apoptosis induced by ERS.
Key words:colon cancer;emodin;endoplasmic reticulum stress; cell proliferation; apoptosis
作者简介:刘保荣,男,1974-09生,硕士,副主任医师,E-mail:bobopaulcn@163.com
收稿日期:2016-03-09
中图分类号:R735.35
文献标志码:A
文章编号:1007-6611(2016)06-0517-05
DOI:10.13753/j.issn.1007-6611.2016.06.007

