超声支气管镜引导下针吸活检术结合免疫组化及基因学检测在肺癌诊治中的应用*
陈升,刘爱群,刘立义,陈小妮,叶新青,陈航言(广西医科大学附属肿瘤医院内镜中心,广西南宁530021)
超声支气管镜引导下针吸活检术结合免疫组化及基因学检测在肺癌诊治中的应用*
陈升,刘爱群,刘立义,陈小妮,叶新青,陈航言
(广西医科大学附属肿瘤医院内镜中心,广西南宁530021)
摘要:目的 评价超声支气管镜引导下针吸活检术(EBUS-TBNA)结合免疫组化技术和基因学检测在肺癌的诊断及治疗中的应用价值。方法 回顾性分析从2013年5月-2015年10月共55例初诊的临床诊断纵隔占位或疑为肺癌伴纵膈或肺门淋巴结转移的患者,为明确诊断行EBUS-TBNA检查,必要时联合免疫组化检测进一步完善诊断及分型,并对部分肺癌患者行表皮生长因子受体(EGFR)或间变性淋巴瘤激酶(ALK)检测以明确分子分型从而为靶向治疗提供依据。结果 55例患者中,经EBUS-TBNA确诊为肺癌37例,肺转移癌3例,软组织肉瘤1例,转移性淋巴结腺癌1例,淋巴瘤1例,结核病4例,慢性炎症1例,7例经EBUS-TBNA未能明确诊断。EBUS-TBNA在该组肺癌诊断中的敏感性及准确性分别为92.5%(37/40)和94.5%(52/55)。29 例EBUS-TBNA组织标本依赖免疫组化检测证实为肺癌且得到明确分型,其中17例肺腺癌,6例肺鳞癌,6例小细胞肺癌。6例EBUS-TBNA组织标本行EGFR基因检测,其中1例同时行ALK基因检测,基因检测结果示EGFR基因突变型4例,ALK基因无融合1例。所有病例无1例严重并发症发生。结论 EBUS-TBNA诊断肺癌具有良好价值,且安全性较好,结合免疫组织组化检测及基因突变检测对肺癌的诊断及指导治疗有突出的价值。
关键词:超声支气管镜;超声支气管镜引导下针吸活检术;免疫组化;基因检测
肺癌是世界上最常见的恶性肿瘤之一,早期症状不典型,患者就诊时多数已出现纵隔或肺门淋巴结转移。早期及准确的诊断是肺癌患者选择最佳治疗方案和预后的关键[1]。对于确诊肺癌常规的检查手段,如经支气管镜活检及经CT引导下经胸肺活检,它们分别适用于表现为肺内病变的中央型肺癌及部分周围型肺癌,但对于管腔内黏膜未见明显肿瘤侵犯的肺内占位性病变或仅伴单纯纵隔或肺门淋巴结肿大的疑诊肺癌,以上两种手段非常有限,此时需要对纵隔或肺门淋巴结进行活检。经支气管超声支气管镜针吸活检(endobronchial ultrasound-guided transbronchial needle aspiration,EBUS-TBNA)作为一种微创而安全的检查方法已成为肺癌的诊断和分期的重要手段[2]。多个研究表明,对于纵隔及肺门淋巴结肿大病变的诊断,EBUS-TBNA较普通的其他检查方法如纵隔镜、常规经支气管针吸活检(transbronchial needle aspiration,TBNA)及经超声胃镜引导下针吸活检(endoscopic ultrasound-guided fine needleaspiration,EUS-FNA)具有更高的诊断价值[3]。
然而,EBUS-TBNA一般为细针在负压状态下穿刺活检,所得标本量较支气管镜活检、纵隔镜更少[4],且常混有较多血液,所得组织信息量少,单从形态学进行确诊及组织分型较为困难,在一定程度上加大了诊断的难度。近年来免疫组化及基因检测手段的普及为肺癌的诊断及组织和分子分型提供了一种有效的方法[5-7]。本研究通过EBUS-TBNA获取组织标本行免疫组化及基因检测技术,能提供更为精确的组织及基因分型,从而指导患者的治疗及评估预后,对肺癌的进一步诊断和治疗提供有意义的参考。
1 资料与方法
1.1 一般资料
回顾分析2013年5月-2015年10月在广西医科大学附属肿瘤医院经影像学(CT或PET/CT)发现纵隔占位或疑为肺癌伴纵隔或肺门淋巴结转移,且经常规支气管镜活检未能明确诊断的年龄在28~82(55.2±11.5)岁的55例患者行EBUS-TBNA以明确诊断。所有患者诊断最终以活检穿刺(EBUS-TBNA、锁骨上淋巴结穿刺、CT引导下肿物穿刺)及手术的病理学或细胞学证实,未能获得病理及细胞学确诊者,通过大于6个月临床随访验证。
1.2 仪器
奥林巴斯BF-UC-260FW,奥林巴斯NA-201SX-4022细胞学穿刺针。超声主机ME1。所有患者超声检查及穿刺过程中均应用利多卡因联合丙泊酚或肌松药全身麻醉并常规行心电监护。
1.3 方法
1.3.1 穿刺部位 根据影像学检查结果择点定位。见图1。
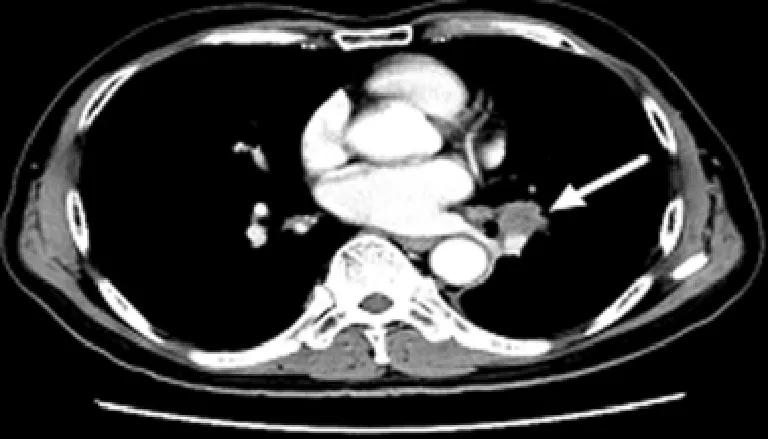
图1 CT检查结果
1.3.2 穿刺过程根据超声支气管镜(endobroncheal ultrasonography,EBUS)下确定病灶,采用彩色多普勒观察病灶内部及周围的血流,选择合适的穿刺路径,然后用22G穿刺针连同针芯插入内镜工作管道,固定好穿刺针,依据病灶大小,确定进针长度,快速将穿刺针插入病灶内,连接负压注射器,保持负压5~15 ml,在病灶中反复提抽15~20次,穿刺2~5次。见图2。
1.3.3 标本的处理 穿刺组织行细胞学涂片(图3A)并立即置于无水酒精中固定,行HE染色。使用穿刺针将获取的组织条连同血液一同推到一盛有标本液的标本盒中(图3B),充分震荡后静置,待标本中有形成分沉淀后,将上层液体送液基细胞学检查(图3A),剩余的固体组织条取出置于小纸片上,然后包裹好后放入10%福尔马林中固定,石腊包埋,行组织病理学检查,必要时行免疫组织化学检测(immunohistochemistry,IHC),其中IHC抗体选取甲状腺转录因子-1(thyoid transciiption factor-1,TTF-1)、CK7、CK5/6、P63、Syn、CD56、Ki-67,实际情况根据病史及已测免疫组化指标结果加做部分抗体,采用免疫组化二步法染色步骤,具体细节参照试剂说明。抗体及试剂盒均购于福州迈新生物技术开发有限公司。组织分型为腺癌病例选择行表皮生长因子受体(epithelial growth factor receptor,EGFR)检测,再结合病理医生评估组织标本条件,部分标本行EGFR基因检测,并采用实时定量PCR检测技术。试剂盒为凯杰的therascreen EGFR(Scorpion ARMS)。
图2 穿刺过程
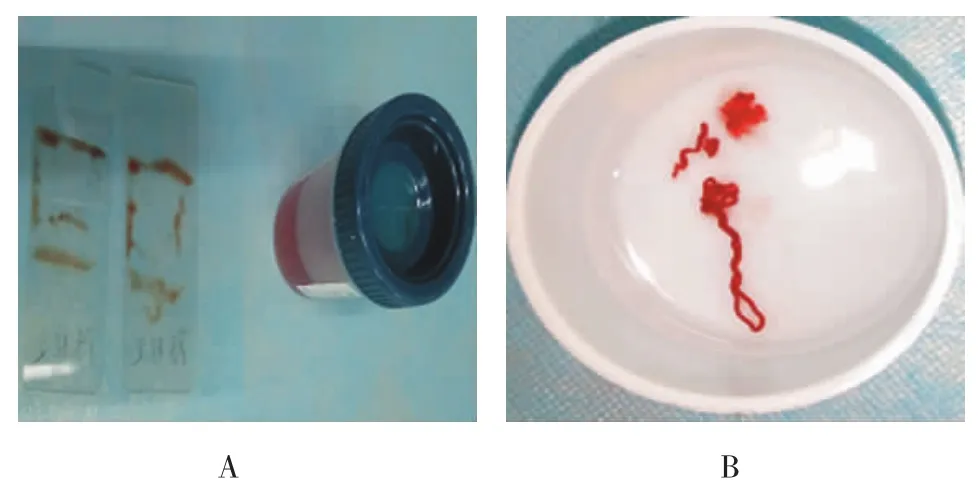
图3 标本的处理
1.4 随访及疗效评价
EBUS-TBNA组织病理学、细胞涂片及液基细胞学3项中1项及1项以上见到恶性肿瘤细胞,均判断总结果为阳性。标本中判断为高度可疑恶性肿瘤细胞,则结合临床及影像学随访高度怀疑恶性肿瘤或者已通过其他途径在细胞学及组织学确诊为恶性,判断结果为阳性,否则判断结果为阴性。多部位淋巴结穿刺检查的患者其任何一部位穿刺结果阳性均判断为总结果阳性,全部部位穿刺结果均阴性,则判定为总结果阴性。
2 结果
2.1 穿刺结果
55例患者,48例经EBUS-TBNA穿刺活检后确诊,其中肺癌37例,非肺癌病例11例(转移性肺癌3例,软组织肉瘤1例,转移性淋巴结腺癌1例,淋巴瘤1例,结核病4例,慢性炎症1例)。7例经EBUS-TBNA未能明确诊断者,其中6例经纵膈镜、锁骨上淋巴结穿刺、CT引导下肿物穿刺活检确诊(其中肺癌3例,良性囊肿1例,神经节细胞瘤1例,恶性间皮瘤1例),另外1例经随访6个月示诊断性抗结核治疗后复查CT提示纵隔淋巴结缩小,症状好转,证实为结核病。EBUS-TBNA在本组肺癌诊断中的敏感性和准确性分别为92.5%(37/40)和94.5%[(37+15)/55)]。见表1。
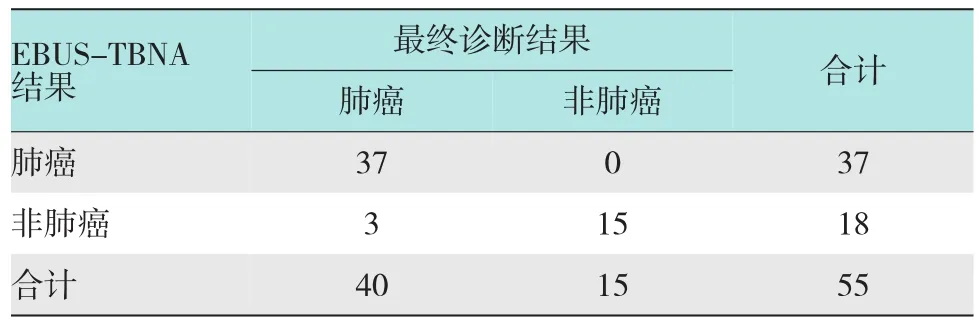
表1 EBUS-TBNA诊断结果与最终结果的比较 例
2.2 免疫组化结果
37例患者行EBUS-TBNA标本免疫组化检测,29例肺癌患者明确分型,其中肺腺癌17例,肺鳞癌6例,小细胞肺癌(small cell lung cancer,SCLC)6例。以腺癌为例:肺腺癌细胞对CK7(图4A),EGFR检测阳性(图4B),Ki-67高表达(图4C),TTF-1阳性表达率高(图4D);肺鳞癌细胞对CK5/6、p63阳性表达率高,SCLC细胞对Syn、CD56阳性表达率高,且Ki-67高表达。此外,3例肺转移癌中,1例既往存在子宫内膜癌病史,经EBUS-TBNA见异形细胞团,免疫组化结果:CK广谱(+),CK7(+),TTF-1(-),CK5/6(+),Syn(-),CgA(-),结合病史最终诊断为子宫内膜腺样腺癌;1例CT发现肝占位及纵隔和锁骨上多发淋巴结肿大,经EBUS-TBNA见癌细胞,免疫组化结果:CKpan(+),CK18(+),CK19(+),CK20 (-),Hepatocyte(+),TTF-1(-),NapsinA(-),Vimentin、CD5、CD3、CD20、CD30、ALK、TDT、CD1a均阴性,Ki-67约15.0%(+),免疫组化结果排除胸腺癌、间变大细胞淋巴瘤及霍奇金淋巴瘤,综合影像学结果诊断为肝细胞癌转移;1例既往存在左乳癌病史,经EBUS-TBNA见腺癌细胞,免疫组化结果:ER (+,30%中等),HER-2(3+),结合病史最终诊断为乳腺浸润性导管癌转移。另有1例软组织肉瘤,经EBUS-TBNA见异形细胞散在分布,形态欠清,考虑恶性肿瘤,免疫组化结果:EGFR(++),Vimentin(+),Syn(-),CKpan(-),LCA(-)及其他指标(-),最终明确诊断为软组织肉瘤。余4例肺癌病例经免疫组化检测未能明确分型。见表2。
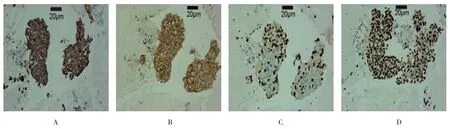
图4 EBUS-TBNA活检组织免疫组织化学染色
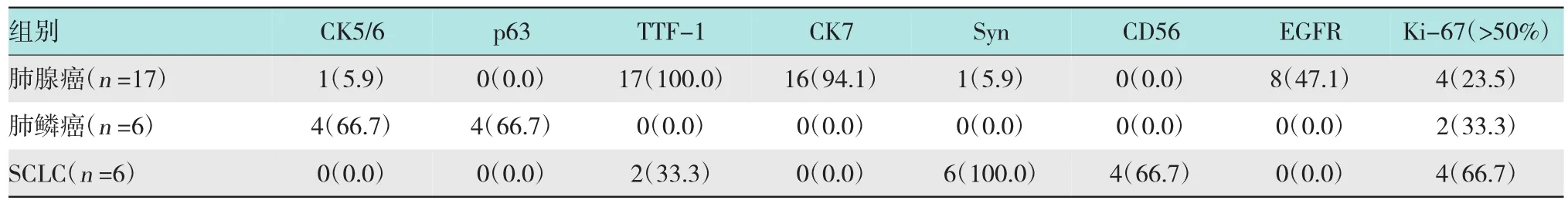
表2 免疫组化指标在各类型肺癌的表达情况 例(%)
2.3 基因检测结果
EBUS-TBNA穿刺病理结果为腺癌病例19例,行EGFR检测6例,且同时行间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)融合基因检测1例,基因检测结果示4例均为21外显子L858R突变型(图5),2例为EGFR野生型,1例ALK基因未见融合。
2.4 患者转归
经EBUS-TBNA确诊的43例恶性肿瘤,6例SCLC患者中5例先接受化疗,化疗疗效明显,后部分行同步放化疗,1例放弃治疗;19例肺腺癌患者,4例基因检测结果为EGFR基因突变型患者,2例直接行靶向治疗,其中1例患者1个月后复查CT评价疗效为部分缓解(图6),1例先化疗,疾病进展后再行靶向治疗,1例因经济原因放弃治疗,另外15例其中1例为早期肺癌,行胸腔镜下肿物及肺叶切除术,10例序贯化放疗,4例放弃治疗;6例肺鳞癌患者中3例行序贯化放疗,1例化疗,2例放弃治疗;4例未分型肺癌患者中1例接受化疗,3例放弃治疗;2例非小细胞肺癌(non-small cell lung cancer,NSCLC)患者均放弃治疗;3例转移性肺癌患者中1例子宫内膜样癌并肺转移者及1例乳腺癌并纵隔淋巴结转移者均行肺或纵隔淋巴结转移灶放疗,放疗后转移灶缩小,1例肝癌并肺转移放弃治疗。1例原发灶不明转移性腺癌及1例软组织肉瘤患者均放弃治疗;1例弥漫大B淋巴瘤患者接受8周期联合化疗后病灶明显缩小,评价疗效为部分缓解。
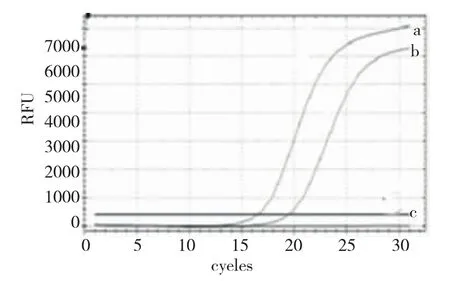
图5 EBUS-TBNA活检标本EGFR基因检测
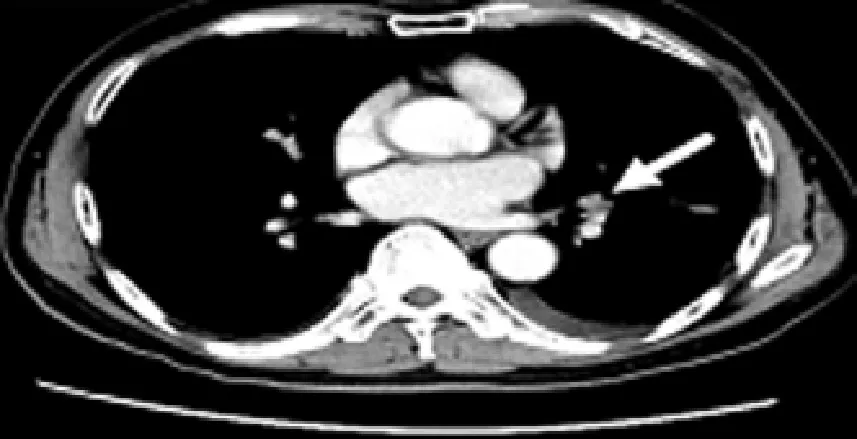
图6 靶向治疗1个月后复查CT
3 讨论
在本研究中,通过对55例初诊的临床诊断纵隔占位或疑为肺癌伴肺门或纵隔淋巴结转移的患者,为明确诊断行EBUS-TBNA检查,EBUS-TBNA获取组织常规行细胞学涂片及组织病理检查,结果示EBUS-TBNA在肺癌诊断中的敏感度为92.5% (37/40),准确性为94.5%(52/55)。37例EBUS-TBNA标本行免疫组化检测,29例EBUS-TBNA组织标本依赖免疫组化检测证实为肺癌且得到明确分型,其中17例肺腺癌,6例肺鳞癌,6例小细胞肺癌。6例EBUS-TBNA组织标本行EGFR基因检测,1例行ALK基因检测,其中EGFR基因突变型4例,ALK基因无融合1例。临床医生根据EBUS-TBNA诊断结果及组织病理和基因分型制定相应治疗方案。以上结果证实了EBUS-TBNA是诊断肺癌的一种有效且安全的诊断方法,结合免疫组化技术及基因检测技术可进一步明确诊断及明确组织病理和分子分型,从而指导治疗和评价预后。
EBUS-TBNA作为一种微创检查,对纵隔及肺门肿物定性诊断及肺癌分期诊断以较高的敏感性、特异度、准确性及并发症少的优势已得到临床广泛证实。国内外学者争相报道了EBUS-TBNA在肺癌或纵隔淋巴结分期中的应用情况[8-10],其对肺癌的诊断敏感度达88.0%~93.0%,特异度达100.0%[11]。近来一个开放、多中心、随机对照临床试验结果表明,EBUS-TBNA不仅较常规检查方法具有更高的诊断价值,同时还明显缩短诊断时间与最终决定时间的窗口期,文中还推荐该技术应作为疑诊肺癌患者的首要诊断方法[12]。
肺癌传统病理分型主要为NSCLC及SCLC。近年来肺癌的个体化治疗进展特别是肺癌的靶向治疗,传统组织分型面临了挑战,国际肺癌研究学会已提出了肺癌新的分型标准,NSCLC应继续分类为腺癌和鳞癌[13]。对于手术切除的大体标本中鳞癌和腺癌的分型,免疫组化技术并不是至关重要的,然而对于活检的小标本通过形态学分型困难时需要通过一些免疫组化指标如TTF-1、p63、CK5/6等进一步将腺癌和鳞癌区分开来[5]。LOO等[14]对经支气管镜活检的44例石腊切片且诊断为未分型NSCLC使用免疫组化技术,结果显示p63、TTF-1对腺癌及鳞癌分型诊断有重要意义。NAVANI等[7]等报道了对774例怀疑为NSCLC患者行EBUS-TBNA检查,通过免疫组化技术相关指标如CK5/6、p63、TTF-1明显提高了分型诊断率,从而减少了NSCLC中无法分型的病例比例。本组55例,37例EBUS-TBNA标本行免疫组化检测,29例肺癌患者明确分型,其中肺腺癌17例,肺鳞癌6例,SCLC 6例,免疫组化结果示肺腺癌细胞对CK7、TTF-1阳性表现出高表达率,肺鳞癌细胞对CK5/6、p63阳性表现出高表达率,SCLC细胞对Syn、CD56阳性表现出高表达率,这与以往相关报道相符[15]。
肺癌恶性程度高,确诊时约40.0%即为不可切除Ⅳ期肺癌[16],而NSCLC发病率约占所有肺癌发病率的85.0%,且NSCLC中腺癌所占比例较高,达总数的50.0%[17]。晚期肺癌常规的治疗方式主要化疗或放疗,近年来对于肺腺癌的靶向治疗特别是存在EGFR激活突变的患者行酪氨酸激酶抑制剂治疗已经改变了肺癌的治疗模式,EGFR基因突变状态可预测患者的治疗和预后[18-19]。相对于疗效差且毒副作用大的常规化疗、放疗,靶向治疗明显提高了疗效且不良反应少,针对存在EGFR突变的患者行靶向治疗客观反应率达73.7%,抗EGFR靶向治疗已被推荐为EGFR突变的晚期肺癌患者一线治疗方案[20]。靶向药物虽然疗效好,但价格昂贵,能针对性的行靶向治疗对于提高肺癌治疗疗效及为节约成本尤为重要,基因检测极大的影响着肺癌患者的治疗及预后。欧洲近期的一项共识[21]表明EGFR基因突变检测组织应该使用手术大体或活检样本,尽可能不使用细胞标本,对于常规检查方法无法获取病理及失去手术机会的晚期患者,EBUS-TBNA可获取活检样本从而行进一步行基因检测。NAKAJIMA等[22]于2007年首次报告了对NSCLC并淋巴结转移患者使用EBUS-TBNA检查并将穿刺样本行EGFR检测的研究,随后各研究学者陆续报道的结果中都表明了EBUS-TBNA技术是获取用于EGFR检测标本的一个可信度高的重要途径,甚至检测率与手术大体标本无差异[4,18,23]。CASADIO等[23]报道了经EBUS-TBNA获取的组织行EGFR基因检测与手术大标本行EGFR基因检测,两者检出结果中EGFR突变率差异无统计学意义(16.9%与14.8%,P =0.450)。本文亦对6例EBUS-TBNA组织标本行基因检测,检测可行性为100.0%。但是本文中行基因检测病例数相对较少,分析原因有以下几点:①肺癌中EGFR或ALK基因突变率较高的组织类型为腺癌,其他类型突变率极低,临床上一般对确诊为肺腺癌类型才推荐行基因检测;②行基因检测费用较高,且靶向治疗费用较高,部分患者因经济原因不愿意行基因检测;③EBUS-TBNA是通过细针在负压状态下抽吸组织,部分病理取材组织样本不足或样本质量不达标无法行基因检测。
综上所述,EBUS-TBNA是一种有效且安全的诊断方法,对于影像学高度可疑肺癌的患者,如伴有纵隔或肺门肿大淋巴结,EBUS-TBNA可作为重要的诊断方法,且可结合免疫组化技术提高肺癌分型诊断,同时EBUS-TBNA技术取得的标本可用于基因学突变检测,检测结果可以指导分子靶向治疗,从而改善患者的预后。
参考文献:
[1]VARELA-LEMA L, FERNÁNDEZ-VILLAR A, RUANO-RAVINA A. Effectiveness and safety of endobronchial ultrasound-transbronchial needle aspiration: a systematic review[J]. Eur Respir J, 2009, 33(5): 1156-1164.
[2]刘爱群,葛莲英. EUS-FNA和EBUS-TBNA在消化道和呼吸道肿瘤诊断治疗新进展[J].中国内镜杂志, 2015, 21(1): 46-50.
[3]HERTH F J. Nonsurgical staging of the mediastinum: EBUS and EUS[J]. Semin Respir Crit Care Med, 2011, 32(1): 62-68.
[4]ESTERBROOK G, ANATHHANAM S, PLANT P K. Adequacy of endobronchial ultrasound transbronchial needle aspiration samples in the subtyping of non-small cell lung cancer[J]. Lung Cancer, 2013, 80(1): 30-34.
[5]NICHOLSON A G, GONZALEZ D, SHAH P, et al. Refining the diagnosis and EGFR status of non-small cell lung carcinoma in biopsy and cytologic material, using a panel of mucin staining, TTF-1, cytokeratin 5/6, and P63, and EGFR mutation analysis[J]. J Thorac Oncol, 2010, 5 (4): 436-441.
[6]STEINFORT D P, RUSSELL P A, TSUI A, et al. Interobserver agreement in determining non-small cell lung cancer subtype in specimens acquired by EBUS-TBNA[J]. Eur Respir J, 2012, 40(3): 699-705.
[7]NAVANI N, BROWN J M, NANKIVELL M, et al. Suitability of endobronchial ultrasound-guided transbronchial needle aspiration specimens for subtyping and genotyping of non-small cell lung cancer: a multicenter study of 774 patients[J]. Am J Respir Crit Care Med, 2012, 185(12): 1316-1322.
[8]赵辉,王俊,李剑锋,等.支气管内超声引导针吸活检术在肺癌诊断中的应用价值[J].中国内镜杂志, 2011, 17(2): 124-127.
[9]CETINKAYA E, GUNLUOGLU G, OZGUL A, et al. Value of real-time endobronchial ultrasound-guided transbronchial needle aspiration[J]. Ann Thorac Med, 2011, 6(2): 77-81.
[10]CHOI Y R, AN J Y, KIM M K, et al. The diagnostic efficacy and safety of endobronchial ultrasound-guided transbronchial needle aspiration as an initial diagnostic tool[J]. Korean J Intern Med, 2013, 28(6): 660-667.
[11]GU P, ZHAO Y Z, JIANG L Y, et al. Endobronchial ultrasound-guided transbronchial needle aspiration for staging of lung cancer: a systematic review and meta-analysis[J]. Eur J Cancer, 2009, 45(8): 1389-1396.
[12]NAVANI N, NANKIVELL M, LAWRENCE D R, et al. Lung cancer diagnosis and staging with endobronchial ultrasound-guided transbronchial needle aspiration compared with conventional approaches: an open-label, pragmatic, randomised controlled trial[J]. Lancet Respir Med, 2015, 3(4): 282-289.
[13]TRAVIS W D, BRAMBILLA E, NOGUCHI M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma[J]. J Thorac Oncol, 2011, 6(2): 244-285.
[14]LOO P S, THOMAS S C, NICOLSON M C, et al. Subtyping of undifferentiated non-small cell carcinomas in bronchial biopsy specimens[J]. J Thorac Oncol, 2010, 5(4): 442-447.
[15]KHAYYATA S, YUN S, PASHA T, et al. Value of P63 and CK5/6 in distinguishing squamous cell carcinoma from adenocarcinoma in lung fine-needle aspiration specimens[J]. Diagn Cytopathol, 2009, 37(3): 178-183.
[16]SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2015[J]. CA Cancer J Clin, 2015 65(1): 5-29.
[17]SHARMA S V, SETTLEMAN J. ErbBs in lung cancer[J]. Exp Cell Res, 2009, 315(4): 557-571.
[18]GARCIA-OLIVE I, MONSO E, ANDREO F, et al. Endobronchial ultrasound-guided transbronchial needle aspiration for identifying EGFR mutations[J]. Eur Respir J, 2010, 35(2): 391-395.
[19]COUDERT B, CIULEANU T, PARK K, et al. Survival benefit with erlotinib maintenance therapy in patients with advanced non-small-cell lung cancer(NSCLC)according to response to first-line chemotherapy[J]. Ann Oncol, 2012, 23(2): 388-394.
[20]MAEMONDO M, INOUE A, KOBAYASHI K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-2388.
[21]PIRKER R, HERTH F J, KERR K M, et al. Consensus for EGFR mutation testing in non-small cell lung cancer: results from a European workshop[J]. J Thorac Oncol, 2010, 5(10): 1706-1713.
[22]NAKAJIMA T, YASUFUKU K, SUZUKI M, et al. Assessment of epidermal growth factor receptor mutation by endobronchial ultrasound-guidedtransbronchialneedleaspiration[J]. Chest, 2007, 132(2): 597-602.
[23]CASADIO C, GUARIZE J, DONGHI S, et al. Molecular testing for targeted therapy in advanced non-small cell lung cancer: suitability of endobronchial ultrasound transbronchial needle aspiration[J]. Am J Clin Pathol, 2015, 144(4): 629-634.
(吴静 编辑)
Clinical value of EBUS-TBNA combining IHC and molecular testing in lung cancer*
Sheng Chen, Ai-qun Liu, Li-yi Liu, Xiao-ni Chen, Xin-qing YE, Hang-yan Chen
(Department of Endoscopy, Tumor Hospital Affiliated to Guangxi Medical University, Nanning, Guangxi 530021, China)
Abstract:Objective To investigate the clinical value of endobronchial ultrasound-guided transbronchial needle aspiration(EBUS-TBNA)combining immunohistochemisty(IHC)and molecular testing in lung cancer. Methods 55 patients with mediastinal, and/or hilar lymphadenopanthy, and/or mediastinal mass previously detected by CT or PET/CT scan and who underwent EBUS-TBNA from May 2013 and October 2015 was retrospectively reviewed. Additional immunohistological analysis was performed for establishing a reliable diagnosis when necessary. Some samples were tested for the EGFR and/or ALK mutations to provide suitable mutational genotyping for adenocarcinoma. Results Of the 55 patients, 37 primary lung cancer, 3 metastatic lung cancer, 1 soft tissue sarcoma, 1 lympoma, 1 metastatic lymph node adenocarcinoma, 4 tuberculosis and 1 reactive lymphadenitis was diagnosed by EBUS-TBNA, non-diagnosed in 7 cases. The sensitivity and diagnostic accuracy of EBUS-TBNA in the diagnosis of lung cancer were 92.5%(37/40)and 94.5%(52/55), respectively. 29 samples were further confirmed and obtained definite type by Immunohistochemistry(IHC), seventeen adenocarcinoma of lung, 6 lung squamous EBUS-TBNA carcinoma and 6 small cell lung cancer. 6 EBUS-TBNA samples from patients with adenocarcinoma of lung referred for EGFR testingwere analyzed, 4 patients were found to have EGFR gene mutations, ALK-negative 1 cases. The procedure was uneventful without complications. Conclusions EBUS-TBNA was a safe and effective method with high sensitivity and specificity in the diagnosis of lung cancer. Especially it combining with IHC and molecular testing have important clinical value in diagnosis and guiding the treatment strategy.
Keywords:endoscopic ultrasonography; EBUS-TBNA; IHC; molecular testing
中图分类号:R734.2
文献标识码:A
收稿日期:2015-11-13
*基金项目:广西卫生厅自筹课题(No:2014583);广西医疗卫生适宜技术研究与开发项目(No:S201515)
[通信作者]刘爱群,E-mail:liuaiqun_2004@163.com;Tel:0771-5310521
DOI:10.3969/j.issn.1007-1989.2016.05.002
文章编号:1007-1989(2016)05-0006-06

