甲氨蝶呤与雷公藤多苷片联用对类风湿性关节炎大鼠的治疗作用
铁宁 张桂芝(内蒙古医科大学附属医院,内蒙古 呼和浩特010059)
甲氨蝶呤与雷公藤多苷片联用对类风湿性关节炎大鼠的治疗作用
铁宁张桂芝
(内蒙古医科大学附属医院,内蒙古呼和浩特010059)
【摘要】目的观察甲氨蝶呤与雷公藤多苷片联用对大鼠类风湿性关节炎(RA)的治疗作用。方法50只大鼠随机选取10只为正常组,其余40只建立Ⅱ型胶原诱导的关节炎(CIA)大鼠模型,然后分为模型组、甲氨蝶呤组、雷公藤组和联合治疗组,每组10只。采用甲氨蝶呤与雷公藤多苷片进行治疗,用药后每隔3 d评估其关节炎指数和肿胀度,治疗7周后,采用ELISA法检测关节液中肿瘤坏死因子-α(TNF-α)和白细胞介素-6 (IL-6)水平,并通过实时荧光定量PCR法检测大鼠滑膜组织中血管内皮因子(VEGF)、转化生长因子(TGF-β1)mRNA的表达。结果与模型组相比,在用药第24日、36日和48日各治疗组大鼠关节炎指数评分和肿胀度显著降低(P<0.05),并且联合治疗组大鼠在用药第24日、36日和48日的关节炎指数评分和肿胀度显著低于甲氨蝶呤组和雷公藤组(P<0.05);与正常组相比,所有造模组大鼠关节液中TNF-α和IL-6水平均显著提高(P<0.05);与模型组相比,各治疗组大鼠关节液中TNF-α和IL-6水平均显著降低(P<0.05),并且联合治疗组大鼠关节液中IL-6的水平降低程度显著高于甲氨蝶呤组和雷公藤组(P<0.05);与正常组相比,所有造模组大鼠关节滑膜组织中VEGF、TGF-β1 mRNA表达均显著提高(P<0.05);与模型组相比,各治疗组VEGF、TGF-β1 mRNA表达均显著降低(P<0.05),并且联合治疗组大鼠关节滑膜组织中VEGF、TGF-β1 mRNA表达的降低程度显著高于甲氨蝶呤组和雷公藤组(P<0.05)。结论甲氨蝶呤联合雷公藤多苷治疗RA能最大限度地发挥药物的协同作用,促进RA大鼠症状改善,其作用机制可能与降低关节液中TNF-α和IL-6水平和抑制关节滑膜组织中VEGF、TGF-β1 mRNA表达有关。
【关键词】甲氨蝶呤雷公藤多苷类风湿性关节炎实时荧光定量PCR疗效
类风湿性关节炎(RA)是一类由于自身免疫系统疾病引起滑膜慢性炎症,出现关节病变,若不及时有效治疗,极易形成侵袭性血管翳,最终导致患者关节功能丧失[1]。目前,甲氨喋呤为国内外公认RA治疗的首选和基础药物,但疗程较长,不少患者难以耐受[2]。雷公藤多苷为我国传统中草药雷公藤的主要活性成分,研究显示其具有良好的抗炎、免疫调节、抗肿瘤和改善微循环活性的作用,对自身免疫性疾病RA的治疗具有良好的前景[3]。基于此,笔者通过建立Ⅱ型胶原诱导的关节炎(CIA)大鼠模型,研究甲氨蝶呤联合雷公藤治疗对其关节液中炎症因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的浓度水平及对滑膜炎症发展起关键作用的转化生长因子(TGF-β1)mRNA和血管内皮因子(VEGF)mRNA表达的影响,探讨二者联合对治疗RA作用效果。现报告如下。
1 材料与方法
1.1实验动物Wistar大鼠50只,雌性,10~12周龄,体质量(200±20)g。由内蒙古医科大学实验动物中心提供。动物许可证号:SCXK(蒙)2015-0001。大鼠笼中散养,正常光照,室温(25±2)℃,正常食水饲养。
1.2试剂与仪器甲氨蝶呤片(通化茂祥制药有限公司,国药准字H22022674,规格为2.5 mg/片),雷公藤多苷片(浙江普洛康裕天然药物有限公司,国药准字Z33020778,规格为10 mg/片),RNA提取试剂盒、cDNA第一链合成试剂盒和Ultra SYBR Mixture购于北京全式金生物技术有限公司公司,牛Ⅱ型胶原(10 mg)和不完全弗氏佐剂(5 mL)均购于德国Sigma公司,大鼠IL-6和TNF-α ELISA试剂盒购于上海酶联生物科技有限公司,Multiskan MK3酶标仪购于美国Thermo Fisher Scientific公司,ABI 7900HT型荧光定量PCR仪购于美国Applied Biosystems公司,Z216MK微量高速冷冻型离心机购于德国Hermle公司。
1.3造模与分组1)CIA大鼠模型建立[4]。在无菌条件下,利用均质仪将牛Ⅱ型胶原和弗氏不完全佐剂按1∶1比例充分乳化,牛Ⅱ型胶原的终浓度为1 mg/mL。初次免疫位于尾根部左侧皮内,注射剂量为0.2 mL胶原乳剂。加强免疫在初次免疫1周后于尾根部右侧皮内及左脚趾处,注射剂量为0.2 mL胶原乳剂。2)动物分组及给药方式。50只大鼠中随机选取10只作为正常组,其余大鼠建立CIA模型。造模成功后,大鼠随机分为模型组、甲氨蝶呤组、雷公藤组和联合治疗组,每组10只。
1.4给药方法自造模2周后,治疗组开始灌胃给药,每日1次,连续灌胃7周。其中,甲氨蝶呤组给药剂量为1 mg/kg,雷公藤组的给药剂量为3 mg/kg。模型组和正常组灌服等体积的0.9%氯化钠注射液。
1.5检测方法1)关节炎指数和肿胀度测定。给药后,每隔3 d对每个大鼠进行关节炎评分,并计算关节肿胀度。其中,关节炎评分标准参照0~4级关节评分法[5],即0分为脚爪正常,无红肿症状;1分为趾关节出现轻度红肿;2分为趾关节和足趾出现红肿;3分为整个脚爪出现红肿;4分为踝关节出现红肿,并发生严重变形。关节肿胀体积采用趾体积测量仪进行测定,肿胀度(%)=(Vt-V0)/V0×100%,其中V0为造模前的容积,Vt为造模后的容积。2)关节液中TNF-α和IL-6测定。治疗7周后,大鼠仰位固定,打开膝关节腔,用注射器取1 mL氯化钠注射液注入关节腔中,然后收集关节腔液,并于4℃2000 rpm离心15 min,取上清液置于-80℃冰箱保存待测。参照大鼠ELISA试剂盒说明书测定TNF-α和IL-6含量。3)大鼠关节滑膜组织TGF-β1 mRNA和VEGF mRNA表达的检测。打开膝关节腔后,用眼科直镊钝性分离关节囊的滑膜层和纤维层,完整剥离滑膜组织,于-80℃冰箱保存待测。参照试剂盒说明书分别提取大鼠滑膜组织的总RNA,并逆转录为cDNA,以β-actin为内对照进行实时荧光定量,反应条件:95℃预变性10 min,95℃变性15 s,60℃退火10 min,40个循环。根据Gene Bank提供Wistar大鼠TGF-β1、VEGF的mRNA序列设计目的基因的引物序列,见表1所示。根据各组的平均CT值,计算出每个目的基因相对表达量。

表1 目的基因的引物设计
1.6统计学处理应用SPSS16.0统计软件分析。计量数据以(±s)表示,采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠不同时间点关节炎指数、肿胀度评分见表2,表3。大鼠建立CIA模型后,出现足趾关节红肿,局部伴溃疡,并且精神倦怠甚至萎靡,运动迟缓。正常组大鼠无上述现象。与模型组相比,在用药第24日、36日和48日各治疗组大鼠关节炎指数评分和肿胀度显著降低(P<0.05),并且联合治疗组大鼠在用药第24日、36日和48日的关节炎指数评分和肿胀度显著低于甲氨蝶呤组和雷公藤组(P<0.05)。
表2 各组大鼠不同时间点关节炎指数评分比较(分,±s)
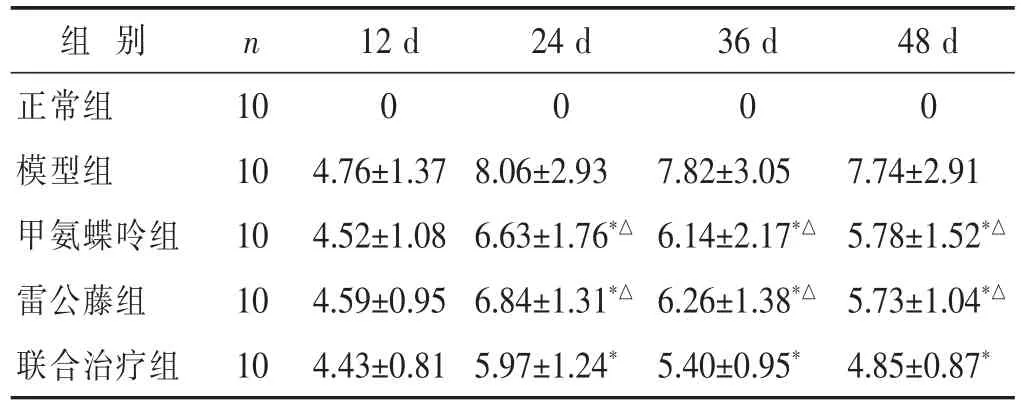
表2 各组大鼠不同时间点关节炎指数评分比较(分,±s)
与模型组比较,*P<0.05;与联合治疗组比较,△P<0.05。下同。
组别 n正常组 10模型组 10甲氨蝶呤组 10 12 d 24 d 36 d 48 d 0000 4.76±1.37 8.06±2.93 7.82±3.05 7.74±2.91 4.52±1.08 6.63±1.76*△6.14±2.17*△5.78±1.52*△雷公藤组 10 4.59±0.95 6.84±1.31*△6.26±1.38*△5.73±1.04*△联合治疗组 10 4.43±0.81 5.97±1.24*5.40±0.95* 4.85±0.87*
表3 各组大鼠不同时间点肿胀度比较(%,±s)

表3 各组大鼠不同时间点肿胀度比较(%,±s)
组别 n正常组 10模型组 10甲氨蝶呤组 10 12 d 24 d 36 d 48 d 0 0 0 0 83.51±0.33 93.24±0.36 92.78±0.31 83.51±0.33 82.37±0.23 88.16±0.25*△85.24±0.23*△79.26±0.19*△雷公藤组 10 82.42±0.18 89.58±0.23*△86.59±0.26*△80.42±0.18*△联合治疗组 10 82.15±0.13 85.69±0.18*79.20±0.11*74.51±0.12*
2.2各组大鼠关节液中TNF-α和IL-6水平比较
见表4。结果显示,与正常组相比,所有造模组大鼠关节液中TNF-α和IL-6水平均显著提高(P<0.05);与模型组相比,各治疗组大鼠关节液中TNF-α和IL-6水平均显著降低(P<0.05),并且联合治疗组大鼠关节液中IL-6的水平降低程度显著高于甲氨蝶呤组和雷公藤组(P<0.05)。
表4 各组大鼠关节液中TNF-α和IL-6水平比较(pg/mL,±s)
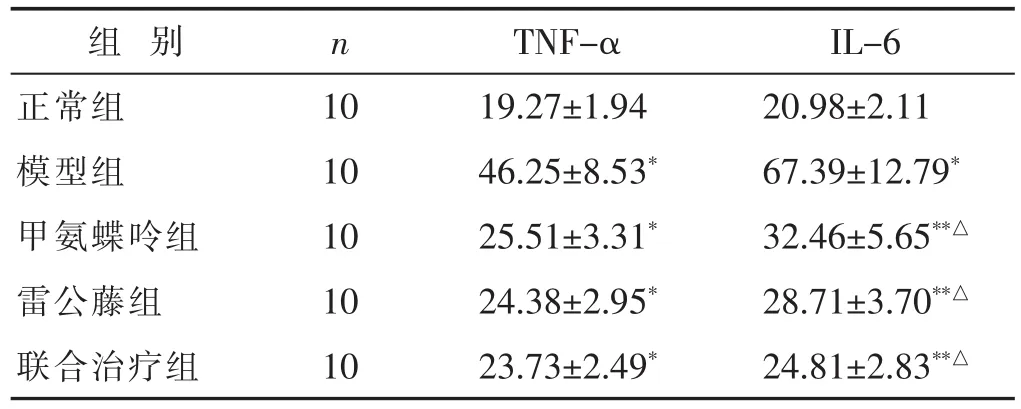
表4 各组大鼠关节液中TNF-α和IL-6水平比较(pg/mL,±s)
与正常组比较,*P<0.05;与联合治疗组比较,△P<0.05。下同。
组别 n TNF-α IL-6正常组 10 19.27±1.94 20.98±2.11模型组 10 46.25±8.53* 67.39±12.79*甲氨蝶呤组 10 25.51±3.31* 32.46±5.65**△雷公藤组 10 24.38±2.95* 28.71±3.70**△联合治疗组 10 23.73±2.49* 24.81±2.83**△
2.3各组大鼠关节滑膜组织VEGF和TGF-β1表达的情况比较见表5。通过荧光定量PCR对凋亡基因VEGF、TGF-β1 mRNA表达进行定量分析。结果显示,与正常组相比,所有造模组大鼠关节滑膜组织中VEGF、TGF-β1 mRNA表达均显著提高(P<0.05);与模型组相比,各治疗组VEGF、TGF-β1 mRNA表达均显著降低(P<0.05),并且联合治疗组大鼠关节滑膜组织中VEGF、TGF-β1 mRNA表达的降低程度显著高于甲氨蝶呤组和雷公藤组(P<0.05)。
表5 各组大鼠关节滑膜组织VEGF和TGF-β1表达情况比较(μmol/mL,±s)
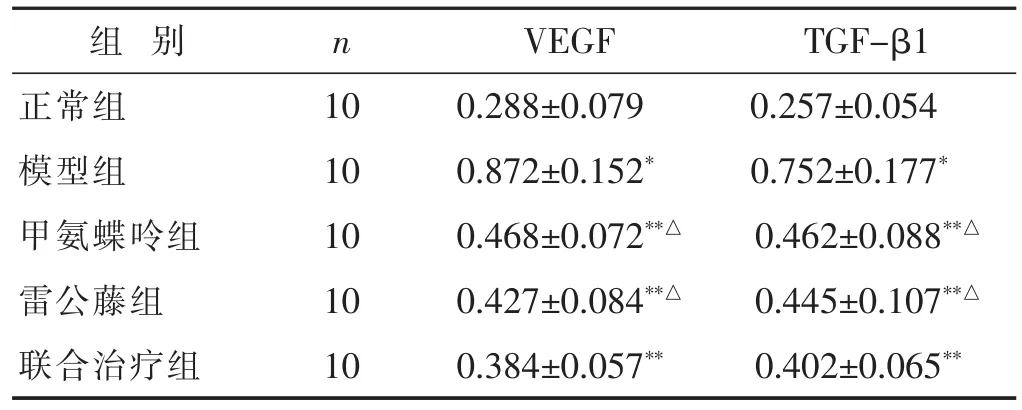
表5 各组大鼠关节滑膜组织VEGF和TGF-β1表达情况比较(μmol/mL,±s)
组别 n VEGF TGF-β1正常组 10 0.288±0.079 0.257±0.054模型组 10 0.872±0.152* 0.752±0.177*甲氨蝶呤组 10 0.468±0.072**△ 0.462±0.088**△雷公藤组 10 0.427±0.084**△ 0.445±0.107**△联合治疗组 10 0.384±0.057** 0.402±0.065**
3 讨论
雷公藤多苷作为雷公藤的主要活性成分,由于具有较强的祛风除湿、通络解毒、免疫调节活性而倍受关注。如何伟珍等[6]观察雷公藤多苷治疗老年类风湿关节炎,结果发现其能迅速改善与类风湿关节炎相关的各项症状、体征和患者的生活质量,并有良好的安全性。又如宋明爱等[7]研究发现雷公藤多苷能抑制慢性肾小球肾炎患者血清中炎症因子IL-6和TNF-α含量,促进患者康复。近年来,RA在我国的发病率逐年提高,并且治疗后反复发作,致残率较高,给患者身体健康和生活质量带来了严重威胁。目前全世界对RA的治疗尚无较好的根治方法。我国多数医家认为采用中西医结合治疗能最大限度地发挥药物的协同作用,提高疗效,降低毒副作用[8-9]。本研究中,笔者在用药第24日、36日和48日各治疗组大鼠关节炎指数评分和肿胀度均显著低于模型组,并且联合治疗组大鼠关节炎指数评分和肿胀度降低程度显著高于甲氨蝶呤组和雷公藤组,提示甲氨蝶呤和雷公藤多苷均能有效缓解RA症状,当两药联合作用有助于促进RA症状缓解。
既往研究表明,RA关节滑膜组织内聚集大量免疫细胞,并分泌一系列炎症因子,其中TNF-α和IL-6能够激活淋巴T细胞表面CD40受体与滑膜细胞结合,启动胞内NK-κB核转录因子,进而促进细胞增殖和基质金属蛋白酶分泌,加速关节软骨的破坏。因此,TNF-α和IL-6在RA的发展过程中发挥重要作用[10-11]。本研究结果显示与正常组相比,各治疗组大鼠关节液中TNF-α和IL-6水平均显著低于模型组,并且联合治疗组大鼠关节液中IL-6的水平降低程度显著高于甲氨蝶呤组和雷公藤组,提示甲氨蝶呤和雷公藤多苷均能有效降低RA大鼠关节液中TNF-α和IL-6的水平,减轻细胞因子对滑膜细胞的刺激,缓解疾病的进一步恶化,并且当两药联合作用时,IL-6水平降低程度更高,对于破坏炎症因子聚集构成的恶性循环具有实际意义。
RA的发病过程涉及诸多基因的调控,比如VEGF、TGF-β1等,二者均是参与血管形成的重要因子。其中,VEGF不仅具有有丝分裂活性,通过高效地刺激血管内皮细胞增生、移动并改变其基因表达,促使血管形成,同时还能增大血管内皮细胞通透性,导致纤维蛋白渗出并凝结于血管外,构成血管形成的临时基质[12]。因此,VEGF的高表达与RA滑膜血管翳的形成具有密切关系。TGF-β1是TGF-β家族的成员,研究发现其具有调节细胞生长和分化功能,其过度表达与滑膜细胞增生有密切关系。本研究中,笔者借助荧光定量PCR对VEGF、TGF-β1 mRNA表达进行定量分析,结果显示,与模型组相比,各治疗组VEGF、TGF-β1 mRNA表达均显著低于模型组,并且联合治疗组大鼠关节滑膜组织中VEGF、TGF-β1 mRNA表达的降低程度显著高于甲氨蝶呤组和雷公藤组,提示甲氨蝶呤和雷公藤多苷可能通过抑制滑膜细胞的过度增生,抑制血管翳的形成,减轻软骨与骨的破坏,起到阻止关节炎病程进展的作用,而且当二者联合作用时抑制效果更佳。
综上所述,甲氨蝶呤联合雷公藤多苷治疗RA能最大限度地发挥药物的协同作用,提高疗效,进而缓解和阻止RA的进展作用,其作用机制可能是通过减轻细胞因子对滑膜细胞的刺激和抑制关节滑膜组织内VEGF、TGF-β1的基因表达来实现的。
参考文献
[1]Paleolog EM.Angiogenesis in rheumatoid arthritis[J].Autoimmunity,2013,23(4):339-365.
[2]Cipriani P,Ruscitti P,Carubbi F,et al.Methotrexate in rheumatoid arthritis:optimizing therapy among different formulations.Current and emerging paradigms[J].Clinical Therapeutics,2014,36(3):427-435.
[3]韩曼丽,章金春.雷公藤多苷对胶原诱导性关节炎大鼠组织中血管内皮生长因子及血管内皮生长因子受体2 mRNA表达水平的影响[J].医学研究生学报,2013,26(5):478-480.
[4]Chunfang L,Xiangying K,Xiangbin L,et al.Wen Luo Yin inhibits angiogenesis in collagen -induced arthritis rat model and in vitro[J].Journal of Ethnopharmacology,2013,149(2):478-489.
[5]何国雄,梁清华,杨波,等.胶原诱导性关节炎大鼠滑膜组织醛缩酶A表达及痹肿消汤的干预效应[J].中国临床康复,2007,10(47):103-106.
[6]何伟珍,尹志华,高建华,等.依那西普联合雷公藤多苷治疗老年类风湿关节炎的临床观察[J].中国中西医结合杂志,2014,3(3):267-271.
[7]宋明爱,翟磊.雷公藤多苷对慢性肾小球肾炎患者血清中白细胞介素-6和肿瘤坏死因子-α含量的影响[J].中国中医药现代远程教育,2013,11(8):42-43.
[8]黄成辉,曾颖瑜,陶怡.中西医结合治疗对类风湿关节炎患者生活质量及病情的影响[J].现代中西医结合杂志,2013,1(1):71-72.
[9]王建明,陶庆文,张英泽,等.补肾祛寒治尪汤联合甲氨喋呤治疗类风湿关节炎肾虚寒盛证的疗效与安全性评价[J].中国中西医结合杂志,2013,33(5):614-618.
[10]Moelants EAV,Anneleen M,Jo VD,et al.Regulation of TNF-α with a focus on rheumatoid arthritis[J].Immunology & Cell Biology,2013,91(6):393-401.
[11]Naoshi N,Yuko K,Hideto K,et al.Reduction of plasma IL-6 but not TNF-α by methotrexate in patients with early rheumatoid arthritis:a potential biomarker for radiographic progression[J].Clinical Rheumatology,2013,32(11):1661-1666.
[12]Kim HR,Kim KW,Kim BM,et al.The effect of vascular endothelial growth factor on osteoclastogenesis in rheumatoid arthritis[J].Plos One,2015,10(4):e0124909.
[13]Muñoz-Valle JF,Torres-Carrillo NM,Guzmán-Guzmán IP,et al.The functional class evaluated in rheumatoid arthritis is associated with soluble TGF -β1 serum levels but not with G915C(Arg25Pro)TGF-β1 polymorphism[J].Rheumatology International,2012,32(2):367-372.
·综述·
·文献分析·
中图分类号:R285.5
文献标志码:A
文章编号:1004-745X(2016)04-0655-04
doi:10.3969/j.issn.1004-745X.2016.04.029
收稿日期(2015-10-29)

