锰诱导体外培养耳蜗毛细胞的损伤与凋亡研究
李丹王卫龙卢连军张建彬米文娟邱阳陈俊宋勇莉田克勇唐晓旭第四军医大学西京医院耳鼻喉头颈外科(西安700)第四军医大学唐都医院耳鼻喉头颈外科(西安700)第四军医大学军事预防医学劳动卫生与环境卫生学教研室(西安700)解放军后勤学院门诊部五官科(北京00858)
锰诱导体外培养耳蜗毛细胞的损伤与凋亡研究
李丹1王卫龙2卢连军2张建彬3米文娟1邱阳1陈俊1宋勇莉1田克勇1唐晓旭4
1第四军医大学西京医院耳鼻喉头颈外科(西安710032)
2第四军医大学唐都医院耳鼻喉头颈外科(西安710032)
3第四军医大学军事预防医学劳动卫生与环境卫生学教研室(西安710032)
4解放军后勤学院门诊部五官科(北京100858)
【摘要】目的探讨锰诱导体外培养耳蜗毛细胞损伤与凋亡的关系。方法将出生3天的新生Sprague Dawley大鼠的耳蜗器官体外培养,将贮存浓度为100mM氯化锰用SFM稀释到终浓度为1mM,3mM,5mM后进行体外染毒处理耳蜗基底膜。应用鬼笔环肽染色特异性显示耳蜗毛细胞的静纤毛,同时用β-Tubulin对神经纤维进行染色,用TUNEL试剂盒;Cleaved caspase-3抗体对耳蜗基底膜进行染色,在激光共聚焦显微镜下分别观察耳蜗基底膜的毛细胞,神经纤维。结果耳蜗基底膜培养24小时,1mM氯化锰对耳蜗毛细胞及神经纤维损伤甚微,差异无统计学意义(P>0.05),内,外毛细胞排列整齐规律,听神经纤维分布均匀,成束排列。最高浓度5mM氯化锰处理24小时后对神经纤维造成明显的损害,与对照组相比,差异有统计学意义(P<0.05)。当浓度逐渐增加,损伤愈加显著并呈浓度依赖性。2mM氯化锰处理,对耳蜗基底膜底转损伤较中转、顶转明显。不同浓度氯化锰处理24小时TUNEL染色阳性细胞随着氯化锰浓度的增加而增多;Cleaved caspase-3染色阳性细胞亦随着氯化锰浓度的增加而增多。结论通过大鼠耳蜗器官体外培养方法,发现氯化锰会造成毛细胞缺失,神经纤维变细变少,而这种损伤的机制与细胞凋亡密切相关。
【关键词】锰;毛细胞;神经纤维;耳蜗;凋亡
Fund Project:Natural Science Foundation of China(81172635)
Conflict of interest The authors declare that there are no conflicts of interest.
锰是人体必需的微量元素之一,涉及人体多种生化功能和代谢过程。但长期摄入过量锰可引起锰中毒,临床上出现椎体外束损伤表现,如手指震颤,肌张力增高,腱反射亢进等症状,其表现与帕金森综合症类似。流行病学调查研究表明长期接触锰尘的矿工其听力下降可能与锰中毒有关,动物实验结果提示慢性锰中毒后锰可在内耳聚集,通过损伤耳蜗毛细胞,螺旋神经节细胞引起大鼠听力下降,进而提供了锰中毒对耳蜗器官影响的直接证据,其发生机制仍有待于进一步探究[1]。本研究组通过大鼠慢性锰中毒的动物模型,研究锰对听力的影响,发现锰在大鼠体内具有耳毒性,慢性锰中毒通过损伤耳蜗毛细胞和螺旋神经节细胞引起大鼠听力下降[2]。本文通过对新生3天SD大鼠的耳蜗器官体外培养并在培养基中加入不同浓度氯化锰,观察锰对离体培养耳蜗毛细胞(HC)、周围神经纤维(ANF)的损害作用,利用TUNEL染色以及免疫荧光染色方法探究损伤与细胞凋亡的关系,为进一步探讨锰诱导毛细胞,神经纤维凋亡的分子机制做好基础。
1 材料与方法
1.1实验动物
选用出生3天(P3)发育正常的Sprague-Dwaley (SD)新生大鼠,由第四军医大学动物中心提供。
1.2大鼠耳蜗器官培养
预先制备胶原凝胶(Collagen Gel)。A:0.02醋酸和(50X)Collagen gel溶液(Corning-354249)。B:10X Basal Medium Eagle溶液(sigma)。C:2%碳酸钠(Sodium Carbonate)溶液。A:B:C=9:1:1比例配成。在直径35mm培养皿中滴入15μl新鲜配置的胶原凝胶液,放置30分钟后加入1ml按如下方法配置的无血清培养液(Serum-free medium,SFM)。
1.3SFM培养液制备
牛血清蛋白(Bovine Serum Albumin)2g(sigmaA-4919);Serum-free Supplement 2ml(sigmaI-1884);20%葡萄糖4.8ml(sigmaG-7021);青霉素G 0.2g(sigmaP-3414);200mmol/L谷氨酰胺2ml;碳酸氢钠0.2g;1X BME190.8ml(sigmaB-1522)。
1.4氯化锰处理
氯化锰的存储浓度为100mmol/L,分别用SFM稀释成1mmol/L,3mmol/L,5mmol/L。
1.5TUNEL染色
将1mM Mn处理后培养24小时带胶滴的基底膜用0.1mol/L PBS液漂洗2遍后,4%多聚甲醛固定20分钟,转入96孔板中,加入含1%tritonX-100的0.1mol/L PBS打孔15分钟,用TUNEL凋亡检测试剂盒(Roche),分别向96孔板中,加入TUNEL反应液50μL,将96孔板移入温度恒定在37℃,5%二氧化碳培养箱孵育60分钟,0.1mol/L PBS液漂洗3遍,加入用0.1mol/L PBS液稀释的FITC标记的鬼笔环肽(Phalloidin)(1:100)与DAPI(1:500)共染。
1.6Cleaved caspase-3染色
带胶滴的基底膜用0.1mol/L PBS液漂洗2遍后,4%多聚甲醛固定20分钟,转入96孔板中,加入含1%tritonX-100的PBS打孔15分钟,用Cleaved caspase-3抗体(CST)1:200作为一抗,分别向96孔板中加入50μl,将96孔板移入4℃冰箱72小时,0.1mol/L PBS液漂洗3遍,加入免疫荧光二抗1:200(Life technology)50μl,4℃冰箱过夜,0.1mol/L PBS液漂洗3遍,加入用0.1mol/L PBS液稀释的(1:100)FITC标记的鬼笔环肽(Phalloidin)与(1:500)DAPI共染。
1.7免疫荧光染色
取SD新生大鼠耳蜗,分为4组,第一组:正常对照组,第二组:1mmol/L氯化锰处理组,第三组:3 mmol/L氯化锰处理组及第四组:5 mmol/L氯化锰处理组。用75%酒精喷洒消毒动物的头颈部,断头后剪开顶骨,去除脑组织暴露颅底,在Hanker's培养液中(Solarbio)用尖镊挑开内听道骨壁以暴露耳蜗底回的基底膜,用游丝镊沿蜗壳分离去除耳蜗螺旋韧带,保留全耳蜗基底膜及螺旋神经节,然后将耳蜗器官移入新鲜配制的胶原凝胶并铺放平整。将培养皿移入温度恒定在37℃,5%二氧化碳培养箱培养。4小时后向培养皿中加入不同浓度的氯化锰无血清培养液,继续培养24小时终止培养[3]。带有样本的胶滴经4%多聚甲醛固定,用0.1mol/L PBS液漂洗。1%triton×100室温20分钟,用0.1mol/L PBS液漂洗3遍后,5%的驴血清(博士德)室温封闭1h,用0.1mol/L PBS液漂洗3遍后,加入用0.1mol/L PBS液稀释的β-Tubulin (1:100 Millipore)50μL,于4℃冰箱中孵育72小时,漂洗后加入0.1mol/L PBS液稀释的β-Tubulin二抗驴抗鼠(1:200,Life technology)4℃冰箱中过夜,漂洗后加入用0.1mol/L PBS液稀释的(1:100)FITC标记的鬼笔环肽(phalloidin)与(1:500)DAPI共染。室温避光30分钟,漂洗后把带有样本的胶滴移入载玻片上的甘油滴上,铺放平整并盖上盖玻片,激光共聚焦显微镜下观察拍照(Olympus FV1000),参照有关文献用Adobe Photoshop CS6处理图像并于24h选取3组基底膜中转分别计算单位长度(100μm)的毛细胞计数,测量单位长度(200μm)的神经纤维数目。
1.8统计学分析
所有实验数据的处理和计算采用SPSS16.0 (SPSS公司,美国)软件完成,实验结果均数±标准差表示,每组3个平行重复(n=3),每种实验重复3次,各组间是否存在差异采用单因素方差分析(One-way ANOVA)分析,两两比较采用LSD法,P<0.05表明差异具有统计学意义。
2 结果
2.1正常培养情况下耳蜗器官
培养24小时外毛细胞,内毛细胞,神经纤维以及螺旋神经节细胞的形态(图1)。FITC偶联的鬼笔环肽标记耳蜗毛细胞,在激光共聚焦显微镜下,耳蜗毛细胞呈绿色荧光,毛细胞的纤毛结构和表面结构正常,3排外毛细胞和1排内毛细胞排列整齐,细胞形态良好,轮廓清楚。神经纤维,螺旋神经节细胞以及神经终末被β-tubilin标记,神经纤维呈红色荧光,聚集成束,粗细均匀,排列有序,螺旋神经节细胞的外围神经纤维向外辐射到内毛细胞和外毛细胞,并在内毛细胞和外毛细胞上形成神经终末。螺旋神经节细胞及突起呈红色荧光,细胞基本呈椭圆形,胞浆被深染,而胞核淡染,着色均匀,有细长突起[3,4]。
2.2染毒培养24小时后耳蜗毛细胞以及神经纤维
将P3天的大鼠耳蜗器官在含有不同浓度氯化锰的培养基中培养24小时后,耳蜗毛细胞和听神经纤维在1mmol/L氯化锰培养条件下3排外毛细胞和1排内毛细胞仍可保持正常的形态结构和数量,神经纤维聚集成束,排列轻度紊乱,但数量仍保持正常,但当氯化锰的浓度达到5mmol/L,出现3排外毛细胞和1排内毛细胞明显缺失,排列紊乱,细胞数明显减少,听神经纤维数量明显减少,神经纤维成束排列消失,出现单根神经纤维丝,与内毛细胞底部的交联明显减少(图2)。2mmol/L氯化锰体外培养24小时,耳蜗基底膜底转内外毛细胞明显缺失,3排外毛细胞及1排内毛细胞排列紊乱,中转内外毛细胞缺失数目较底转数目减少,细胞排列较底转整齐,顶转内外毛细胞缺失数目较底转明显减少,细胞排列较底转整齐,可见,氯化锰对体外耳蜗器官培养基底膜的底转损伤最重(图3)。24小时含有不同浓度氯化锰的培养基中取耳蜗基底膜中转进行毛细胞计数,1mM氯化锰毛细胞计数与对照组之间差异无统计学意义;3mM和5mM氯化锰毛细胞计数组与对照组之间差异有统计学意义(P<0.01)。24小时含有不同浓度氯化锰的培养基中进行神经纤维计数,1mM氯化锰神经纤维计数组与对照组之间差异无统计学意义;3mM和5mM氯化锰神经纤维计数组与对照组之间差异有统计学意义(P<0.01)(图4)。2mM氯化锰培养24h,取耳蜗基底膜顶转,中转,底转毛细胞进行计数,顶转,中转,底转毛细胞与对照组之间差异均有统计学意义;中转,底转毛细胞与对照组之间差异有显著统计学意义(One-way ANOVA;P<0.01)。(图5)

图1 毛细胞体外培养24小时,激发光570nm,神经纤维和螺旋神经节细胞呈红色荧光,激发光495nm,毛细胞的纤毛和表面结构呈绿色荧光,神经纤维排列有序,粗细均匀,从毛细胞胞体的底部一直延续到螺旋神经节细胞处。激光共聚焦显微镜×200。Fig.1 Photomicrograph of control organotypic culture from the middle of the cochlea after 24h without Mn treatment(0mM Mn).HaircellslabeledwithAlexaFluor488-phalloidin.Nervefiberslabeledwithantibodyagainstβ-tubilinandAlexaFluor594conjugated secondary antibody.Three rows of OHC and the single row of IHCweremarkedwithgreenfluorescence;SomaofSGNsandbundlesofANFweremarkedwithredfluorescence;AbundleofANF radiatingoutfromtheSGNtowardsthehaircells.Scalebar:100μm.
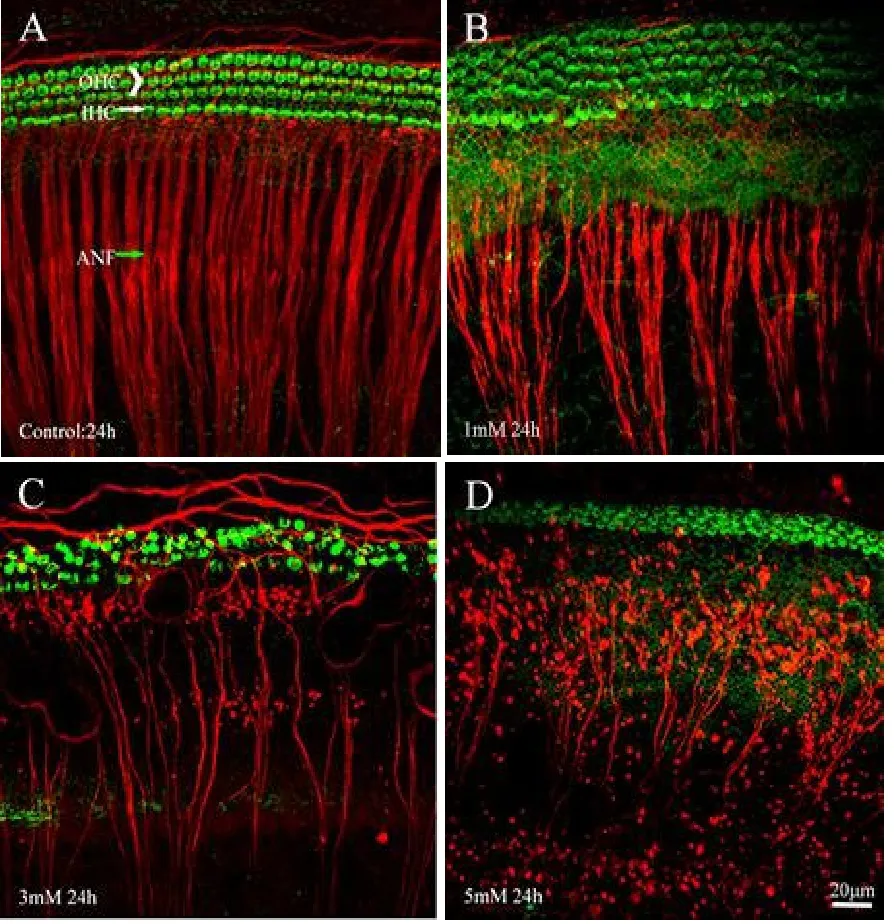
图2 应用不同浓度氯化锰对培养24小时的耳蜗毛细胞和听神经纤维的破坏作用。图A显示0mmol/L氯化锰培养24小时的耳蜗的毛细胞(绿色)和听神经纤维(红色);图B、C、D分别显示1mmol/L、3mmol/L、5mmol/L氯化锰培养24小时后耳蜗结构;可见应用1mmol/L氯化锰培养24小时的耳蜗毛细胞排列仍可保持整齐,细胞结构尚完整,听神经纤维粗细分布仍均匀,但当氯化锰的浓度增加到5mmol/L时,毛细胞和听神经纤维遭到严重破坏。Fig.2 Photomicrographs show cochlear organotypic cultures from the middle of the cochlea after 24h treatment with Mn.Hair cells labeled with FITC-phalloidin.Nerve fibers labeled with antibody against β-tubulin and Alexa Fluor 594 conjugated secondary antibody.Mn concentration is shown in each panel.Bracket shows three rows of OHC;arrowhead marks the single row of IHC,green arrow points to a bundle of ANF radiating out towards the hair cells.Scale bar in 20 μm.
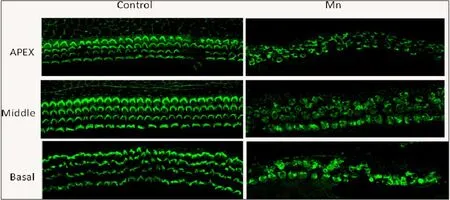
图3 2mmol/L氯化锰培养24小时的耳蜗基底膜顶转、中转、底转毛细胞损伤作用。可见,与对照组比较,2mmol/L氯化锰处理对耳蜗基底膜底转损伤最为严重,毛细胞数目明显减少,3排外毛细胞及1排内毛细胞排列紊乱,表皮板缺失。Fig.3 Photomicrographs show cochlear organotypic cultures from the apex to basal of the cochlea after 24h treatment with Mn.Hair cells labeled with FITC-phalloidin.The image show that the basal of the cochlear basement membrane was most seriously damaged.Scale bar in 20 μm.
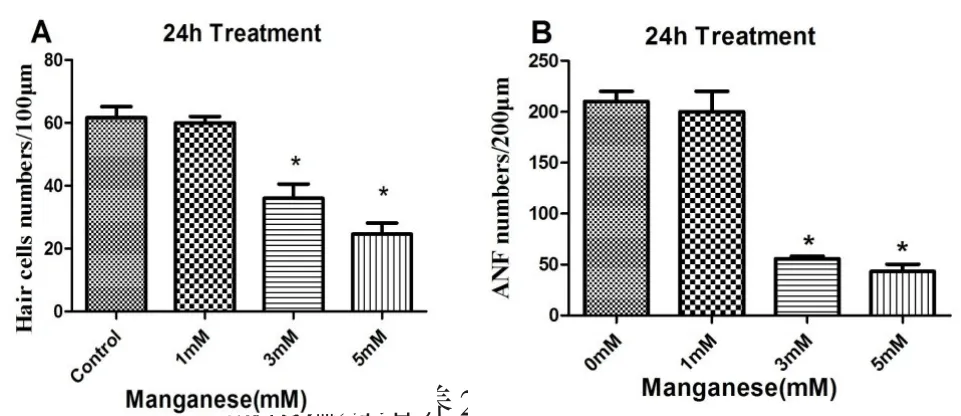
图4 不同浓度氯化锰对培养24小时的耳蜗毛细胞和听神经纤维损伤作用的统计分析。体外培养耳蜗基底膜毛细胞(个╱100μm)体外培养耳蜗基底膜神经纤维(个╱200μm),3mmol/L和5mmol/L氯化锰毛细胞及神经纤维计数组与对照组之间差异有统计学意义(*P<0.01)。Fig.4 Manganese caused HC/100μm(A)and ANF/200μm(B)reduction in cochlear basement membrane.In vitro cochlear basement membrane were exposed in 1mM,3mM and 5mM Mn for 24h.(A)HCs were analyzed and quantified.(B)The ANFs were examined using confocal laser scanning microscopy and quantified.The data are representative of 3 independent experiments.The values are the means±SEM;* P<0.01 vs.the control group.Asterisks show Mn conditions that were significantly different (P<0.01)fromuntreatedcontrolcultures(0mM).

图5 2mmol/L氯化锰对培养24小时的耳蜗基底膜顶、中、底转毛细胞统计分析。体外培养耳蜗基底膜毛细胞(个╱100μm)顶转毛细胞与对照组之间差异有统计学意义(*P<0.05);中、底转毛细胞与对照组之间差异有统计学意义(**P<0.05)Fig.5 The 2mM doses of Manganese caused HC/100μm reduction from the apex to the basal of cochlear basement membrane after 24h treatment.HCs were analyzed and quantified using confocal laser scanning microscopy.The data are representative of 3 independent experiments.The values are the means± SEM;* P<0.05 vs.the control group;** P<0.01 vs.the control group.Single Asterisks show Mn conditions that were significantly different(P<0.05)from untreated control cultures (0mM);Double Asterisks show Mn conditions that were significantly different(P<0.01)from untreated control cultures(0mM).
2.3毛细胞TUNEL染色结果
目前,对锰诱导耳蜗毛细胞,神经纤维的毒性作用与哪一种细胞凋亡通路有关仍不明确,为探究锰的耳毒性作用是否与凋亡相关,对培养24小时不同浓度氯化锰处理组用凋亡检测试剂盒(Roche)进行TUNEL染色(图6),对照组3排外毛细胞和1排内毛细胞用FITC鬼笔环肽标记呈绿色荧光,凋亡染色为红色荧光,毛细胞排列整齐,细胞形态良好,轮廓清楚。未见凋亡染色阳性毛细胞。当1mM氯化锰处理后,毛细胞排列尚整齐,轮廓尚清楚,可见少许凋亡染色阳性细胞,但当氯化锰浓度达到5mM时,FITC鬼笔环肽标记的毛细胞3排外毛细胞严重缺失,内毛细胞排列紊乱,细胞形态不规则,出现大量的凋亡染色阳性细胞,并对耳蜗中转毛细胞及凋亡阳性细胞以200μm为计数单位进行计数(图7),(n=3),1mM氯化锰处理组凋亡阳性细胞与对照组相比无显著性差异(One-way ANOVA;P<0.05),而3mM,5mM氯化锰处理组凋亡阳性细胞与对照组相比有显著性差异(One-way ANOVA;P<0.01)
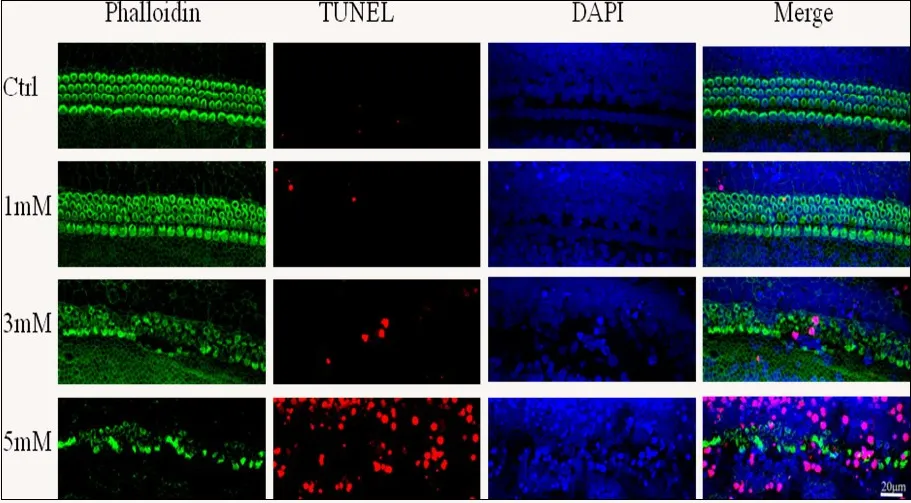
图6 用不同浓度氯化锰处理耳蜗基底膜,体外培养24小时后,取3组耳蜗基底膜,在毛细胞范围内,进行单位长度(200μm)TUNEL计数(图5),结果显示对照组以及1mM氯化锰处理组未见TUNEL染色阳性细胞,3mM以及5mM氯化锰处理后,出现TUNEL染色阳性细胞,并且随着氯化锰处理浓度的升高TUNEL染色阳性细胞数逐渐增多。Fig.6 Representative confocal images showing hair cells from upper middle turn of the cochlea labeled for TUNEL(red)and FITC-phalloidin(green)after 24h in culture.Images shown for controlsandaftertreatmentwith1-5mMMn.Scalebarin20μm.
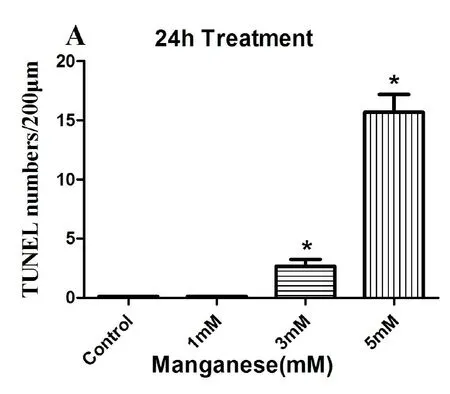
图7 体外培养24小时不同浓度氯化锰处理耳蜗基底膜进行TUNEL阳性细胞数统计分析。TUNEL染色阳性细胞数(个╱200μm);3mmol/L和5mmol/L氯化锰处理组TUNEL染色阳性细胞计数与对照组之间差异有统计学意义(P<0.01)。Fig.7 Manganese caused cochlear basement membrane of haircells apoptosis in vitro.Cochlear basement membrane of hair cells were exposed to 1mM,3mM and 5mM for 24h.The number of TUNEL positive cells(个╱200μm)were examined using confocal laser scanning microscopy and quantified.The data are representative of 3 independent experiments.The results are expressed as a percentage of control,which was set at 100%.The values are the means±SEM;* P<0.01 vs.the control group.Mean percentages of TUNEL positive cell in cochlear organotypic cultures;The graph show 3mM,5mM Mn treatment that was significantly different(p<0.01)from control cultures.
2.4毛细胞Cleaved Caspase-3染色结果
Cleaved Caspase-3作为细胞凋亡的标记物,不同浓度氯化锰处理,基底膜体外培养24小时后,对照组Cleaved Caspase-3染色未检测到阳性细胞,1mM氯化锰毛细胞排列仍可保持整齐,细胞结构尚完整,出现Cleaved Caspase-3阳性细胞,但当氯化锰浓度达到5mmol/L时,毛细胞损伤严重,Cleaved Caspase-3阳性细胞明显增多(图8)。

图8 应用不同浓度氯化锰对培养24小时的耳蜗毛细胞Cleaved caspase-3染色。0mmol/L氯化锰培养24小时的耳蜗的毛细胞(绿色)和Cleaved caspase-3染色(红色);如图显示1mmol/L氯化锰培养24小时的耳蜗毛细胞排列仍可保持整齐,细胞结构尚完整,Cleaved caspase-3染色阳性细胞增多,但当氯化锰的浓度增加到5mmol/L时,毛细胞遭到严重破坏,Cleaved caspase-3染色阳性细胞明显增多。Fig.8 Representative confocal images showing HC from upper middle turn of the cochlea.Specimens labeled with Cleaved caspase-3(red)and FITC-phalloidin(green)after 24h in culture.Images shown for controls and after treatment with 1-5 mM Mn.Scale bar in 20μm.
3 讨论
过量接触锰对人体造成最显著的损害即椎体外系损伤,表现为肌肉震颤,肌张力增高,腱反射亢进等类似帕金森综合征症状,目前研究已表明,其发病机制与多巴胺合成减少和乙酰胆碱递质系统的兴奋性增强有关,并因此导致一系列的精神-神经症状[3,6]。
近年来,医学文献中有越来越多的证据表明,长期接触锰尘的工人中,会出现或引发听力下降,或锰尘会使噪音诱发的听力下降加剧[6,7]。国外医学文献中,锰对耳蜗听觉细胞及螺旋神经节细胞的毒性作用已有研究,但国内在此方面的研究仍未见报道。如上所述,本文通过对新生3天SD大鼠的耳蜗器官体外培养实验,观察锰对毛细胞,神经纤维的损伤作用。初步证实了锰可诱导耳蜗毛细胞,神经纤维凋亡。这种细胞的凋亡形态学特征,与细胞水样变性和破裂出现的细胞坏死恰好相反[8]。纹状体神经元原代培养研究表明锰的毒性与细胞凋亡的特性有关,如线粒体功能障碍、自由基形成、DNA断裂[9,10]。锰引发的ROS会激活多个程序性细胞死亡的信号通路,包括TUNEL染色增强、核苷体间DNA裂解、JNK激活、P38(应激活化蛋白激酶)、半胱氨酸蛋白酶活化、PARP半胱氨酸蛋白酶依赖性裂解[11,12]。
基底膜体外培养24小时,1mmol/L的锰对耳蜗毛细胞及神经纤维损伤甚微,差异无统计学意义。内,外毛细胞排列整齐规律,听神经纤维分布均匀,成束排列。以此得知在24小时1mmol/L锰浓度仍不足以引起耳蜗听觉细胞及螺旋神经节细胞损伤,TUNEL染色肯定了这一实验结果。当浓度逐渐增加,损伤愈加显著,与毛细胞形成交联的末梢神经纤维对锰的毒性亦较敏感。损伤的严重程度与锰的剂量成正相关。最高剂量为5mmol/L的锰处理24小时后对末梢神经纤维造成明显的损害。耳蜗器官体外培养24小时2mmol/L氯化锰处理对耳蜗基底膜底转损伤程度较中转,顶转严重;由此可见,氯化锰对听力损伤是以高频听力损失为重。
一般而言,细胞死亡方式可以分为细胞凋亡和细胞坏死,二者在细胞体积上差别非常明显,细胞凋亡往往表现为细胞固缩变小,而坏死则表现为细胞肿胀增大,常规内耳病理学检查中,如果只是进行常规染色而没有检测凋亡和坏死的专门鉴别指标,是很难区分细胞死亡的方式。本文通过对细胞凋亡的特异性染色,TUNEL染色能对完整的单个凋亡细胞核或凋亡小体进行原位染色,能准确的反应细胞凋亡的形态特征和生化特征[13]。为了进一步探究细胞凋亡的上游机制,本研究进行了Cleaved Caspase-3染色,Caspase家族介导细胞凋亡的过程,在凋亡早期阶段,Caspase-3被激活,裂解相应的胞浆胞核底物,导致细胞凋亡,但在细胞凋亡晚期和死亡细胞,Caspase-3的活性明显下降[14]。
最近文献报道了新霉素敏感期(p8-p14)的小鼠,在注射了新霉素之后,凋亡因子Casp3,Casp9,Diablo,Htra2的表达水平明显高于对照组,说明了凋亡因子参与了新霉素引起的耳毒性过程[14],而过表达凋亡抑制因子XIAP可以完全保护新霉素引起的耳蜗基底膜顶转的毛细胞缺失,但是XIAP不能保护新霉素引起的耳蜗基底膜中转和底转的毛细胞缺失,其中可能的原因是中转、底转的毛细胞死亡不是由于经典的凋亡途径所介导的,可能是由于坏死造成的,或者就是在转基因鼠中广泛表达的人XIAP不足以保护耳蜗基底膜中转或者底转高浓度新霉素所导致的毛细胞缺失[15]。总之XIAP过表达可以保护敏感期新霉素所导致基底膜顶转毛细胞的缺失,并证实了一些凋亡因子参与了这一过程,所以XIAP可能成为新霉素导致的毛细胞缺失和听力丧失的治疗靶标[14,15]。
在本实验中,3mM以及5mM氯化锰处理后,耳蜗基底膜出现TUNEL染色阳性细胞核,并且随着氯化锰处理浓度的升高TUNEL染色阳性细胞数增多,后续的实验需更进一步探讨氯化锰引起的毛细胞凋亡机制以及验证XIAP能否保护氯化锰导致的毛细胞缺失,来探究锰诱发内耳细胞死亡的机理。因此,锰有可能与铅,镉,汞同样列为与听力下降或耳蜗病理相关的重金属[16,17,18]。
哺乳动物的耳蜗由高度分化的稳定细胞群体所组成,通常不具有分裂增殖能力,所以耳蜗器官培养相对其他组织培养有更高的要求和难度。
本研究采用大鼠耳蜗器官体外培养技术,为进一步研究耳蜗损害机制以及预防,治疗措施研究模型的建立提供了实验依据和基础,在大鼠耳蜗器官体外培养过程中,本研究的总结经验如下:一、基底膜剥离在富含营养的透明Hank's液中。二、鼠尾胶凝固的速度受温度影响,根据胶滴凝固时的颜色变化来确定加入培养基的时间。三、尽可能小心的将前庭膜铺在基底膜内侧,有利于样本中毛细胞的免疫组化染色以及共聚焦显微镜观察。四、将样本移到胶滴表面时,游丝镊夹持基底膜hook区,逐步将其以螺旋前进的方式移到胶滴表面并铺放平整,避免毛细胞面卷曲或者折叠。五、加入培养基的量和胶滴的大小和形状有关,培养基太多,则基底膜不容易被粘住,培养基过少,则基底膜暴露在空气中,容易死亡。
参考文献
1Ding D,Roth J,Salvi R.Manganese is toxic to spiral ganglion neurons and hair cells in vitro.Neurotoxicology;2011,32(2):233-241.
2丁大连亓卫东张梅王苹蒋海燕Richard Salvi顺铂及其耳毒性顺铂及其耳毒性中华耳科学杂志2008,6(2):125-125.Ding D,Weidong Qi,Mei Zhang,Ping Wang,Hai Yan Jiang,Rich-ard Salvi Cisplatin and its ototoxicity.2008,6(2):125-125.
3唐晓旭,丁忠家,王人凤,卢连军.慢性锰中毒对大鼠听力及耳蜗细胞的影响.听力学与言语疾病杂志.2014,22(3):20-23 Xiaoxu Tang,Zhongjia Ding,Renfeng Wang,Lianjun Lu.Chronic manganese poisoning effect on hearing and cochlear cells of rats.Journal of Audiology and speech pathology.2014,22(3):20-23
4丁大连,蒋涛,亓卫东,曲雁,Richard.内耳科学.2010,1:5046-5545北京;中国科学技术出版社.Ding D,Tao Jiang,Weidong Qi,Yan Qu,Richard.Inner ear science.2010,(1):5046-5545.
5杨卫平胡博华Donald Henderson.老年大鼠耳蜗毛细胞凋亡的信号通路.2011,9(2):220-220 YANG Wei-ping HU Bo-hua Donald Henderson Signal pathway associated with hair cell death in the aging rat cochlea.2011,9(2):220-220.
6付勇,丁大连.大鼠耳蜗器官培养及其组织学检查技术.中国耳鼻喉头颈外科.2009,16(11):604-607.Yong Fu,Ding D.Salvi Richard.Cochlear organotypic cultures and histological examinations in rats.Chinese Journal of Otolaryngology Head Neck surgery.2009,16(11):604-607.
7Wei L DD,Salvi R.Salicylate-induced degeneration of cochlea spiral ganglion.Neuros-apoptosis signaling.Neuroscience.2010,16(8):288-299.
8杜凤其,姜岳明,莫雪安.锰神经毒性机制的研究进展.铁道劳动卫生与环保.2006,32(2):104- 109..Fengqi Du,Yueming Jiang,Xuean Mo.Mechanism of Manganese Neurotoxicity.China Academic Journal Electronic Publishing House.2006,32(2):104- 109.
9Bouchard M MD,Baldwin ME PM.Manganese cumulative exposure and symptoms:a follow-up study of alloy workers.Neurotoxicology 2008,2(9):577-583.
10 Santamaria AB SSI.Risk assessment of an essential element:manganese.[J]Toxicol Environ Health A 2010,7(3):128-155.
11 Crooks DR WN,Smith DR.Low-level manganese exposure alters glutamate metabolism in GABA ergic AF5 cells.Neurotoxicology 2007,2(8):548-554.
12 Chun HS LH,Son JH.Manganese induces endoplasmic reticulum (ER)stress and activates multiple caspases in nigral dopaminergic neuronal cells.Neurosci Lett 2001,3(16):5-8.
13 Malecki EA.Manganese toxicity is associated with mitochondrial dysfunction and DNA fragmentation in rat primary striatal neurons.Brain Res Bull 2001,5(5):225-228.
14 Latchoumycandane C AV,Kitazawa M YY,Kanthasamy A KAG.Protein kinase C delta is a key downstream mediator of manganeseinduced apoptosis in dopaminergic neuronal cells.[J]Pharmacol Exp Ther 2005,3(13):46-55.
15 Shan Sun,Mingzhi Sun,Yanping Zhang,Cheng Cheng,Muhammad Waqas,Huiqian Yu,Yingzi He1,Bo Xu,Lei Wang,Jian Wang,Shankai Yin,Renjie Chai and Huawei Li.In vivo overexpression of X-linked inhibitor of apoptosis protein protects against neomycin-induced hair cell loss in the apical turn of the cochlea during the ototoxic-sensitive period.Cellular Neuroscience..2014,8(10)240-248.
16 Roth JA FL,Walowitz J BRW.Manganese-induced rat pheochromocytoma(PC12)cell death is independent of caspase activation.[J]Neurosci Res 2000,6(1):162-171.
17 Ma C SSN,Miller M NDW,Lind C RSM,et a.Manganese accumulation in the mouse ear following systemic exposure.[J]Biochem Mol Toxicol 2008,2(2):305-310.
18 Ozcaglar HU AB,Dinc O TM,Kilincarslan S OG.Effects of cadmium on the hearing system.Acta Otolaryngol 2001,12(1):393-397.
19 Wassick KH YA.Methyl mercury ototoxicity in mice determined by auditory brainstem responses.Acta Otolaryngol 1985,9(9):35-45.
20 Roth JA.Homeostatic and toxic mechanisms regulating manganese uptake,retention,and elimination.BiolRes.2006,39(1):45-57.
Manganese-induced Damage and Apoptosis of Cochlear organotypic cultures
LI Dan1,WANG Weilong2,LU Lianjun2,ZHANG Jianbin3,MI Wenjuan1,QIU Yang1,CHEN Jun1,SONG Yongli1,TIAN Keyong1,TANG Xiaoxu4
1 Department of Otolaryngology Head and Neck Surgery,Xijing Hospital,Fourth Military University,Shannxi,710032,China
2 Department of Otolaryngology Head and Neck Surgery,Tangdu Hospital,Fourth Military University,Shannxi,710032,China
3 Department of Occupational&Environment Health,School of Pubic Health,Fourth Military Medical University,shannxi,710032,China
4 Outpatient Department,Logistics Academy,Beijing100858,P.R.China
Corresponding author:LU LianjunEmail:lulianj@fmmu.edu.cn
【Abstract】To study relations between manganese toxicity the damage and apoptosis of cochlear hair cells.Methods Cochlear organotypic cultures were prepared using postnatal day 3 Sprague-Dawley rats.Mn chloride stock solution was prepared at a stock concentration of 100 mM in serum-free medium and diluted to final concentrations of 1,3 and 5 mM.Cochlear basilar membrane explants were incubated in the presence of the prepared Mn chloride solution.Stereocilia bundles of hair cells were immunolabeled with FITC phalloidin while nerve fibers were labeled with an antibody against the β-tubulin so that hair cells and nerve fibers in the cochlear basilar membrane were respectively observed under a fluorescent micro-scope.TUNEL kit and Cleaved caspase-3 antibody were used to label apoptosis of basilar membrane cells.Results Cochlear organotypic cultures treated for 24 h with 1mM Mn showed no obvious damage to the hair cells and auditory nerve fibers in the cochlear basilar membrane compared to the control group(P>0.05).Mn treatment at5 mM for 24 h caused noticeable damage to nerve fibers compared to the control(P<0.05).Damage by Mn treatment at 2 mM was more obvious in the basal turn than in the middle and apical turns.At 24 h of Mn treatment,the number of TUNEL(as well as cleaved caspase-3)labeling cells increased along with increasing Mn concentrations.Conclusion In this in vitro organotypic culture of rat cochlea,Mn can cause missing of hair cells and reduced number and size of nerve fibers,which may be related to the mechanisms of cellular apoptosis.
【Key words】Mn,hair cells,nerve fibers,cochlea,apoptosis
【中图分类号】R764
【文献标识码】A
【文章编号】1672-2922(2016)02-265-7
DOI:10.3969/j.issn.1672-2922.2016.02.028
基金项目:国家自然科学基金项目(81172635)
作者简介:李丹,硕士研究生,主治医师,研究方向:耳聋的基础与临床
通讯作者:卢连军,Email:lulianj@fmmu.edu.cn
收稿日期:(2015-12-03审核人:郭维维)

