四君子汤含药血清抑制甲状腺癌侧群细胞生长的实验研究
田黎 崔巍 孙红
四君子汤含药血清抑制甲状腺癌侧群细胞生长的实验研究
田黎崔巍孙红
710000 西安,西安市北方医院老年科(田黎);710043 西安,西安交通大学医学院第一附属医院内分泌科(崔巍),肿瘤科(孙红)
【摘要】目的评估四君子汤含药血清对甲状腺癌细胞株(KMH-2和8305C)生长的抑制作用。方法SD大鼠模型制备四君子汤含药血清;MTT试验检测四君子汤含药血清对甲状腺癌细胞株KMH-2和8305C体外增殖的影响;Annexin V/PI双染法检测四君子汤含药血清对KMH-2和8305C细胞凋亡的影响;流式细胞仪技术筛选和鉴定KMH-2和8305C的侧群细胞;并采用蛋白免疫印迹法检测凋亡相关蛋白Bax、Bcl-2、Cytochrome C和Caspase-3的表达水平变化。结果四君子汤含药血清显著抑制KMH-2和8305C细胞增殖和诱导细胞凋亡;KMH-2和8305C细胞中存在一定比例侧群细胞(1.45±0.01)%和(1.75±0.01)%,侧群细胞中ALDH、CD44和ABCG2蛋白表达水平较高;四君子汤含药血清可以上调Bax、下调Bcl-2、促进Cytochrome C释放,激活Caspase-3介导的细胞凋亡途径。结论四君子汤含药血清对甲状腺癌细胞中侧群细胞生长有抑制作用,而且这种抑制作用主要是通过诱导细胞凋亡产生。
【关键词】四君子汤含药血清; 甲状腺癌; 侧群细胞; 细胞凋亡
目前一些中国传统医药在治疗肿瘤上取得令人瞩目的疗效,得到国际上的认可和接受,如三氧化砷、靛玉红、苦参碱等[1-3]。四君子汤作为补脾益气的代表方剂临床主要应用于消化性胃溃疡以及脾虚体弱等疾病的治疗。近年一些研究发现四君子汤对于多种实体肿瘤具有一定的疗效[4]。有研究表明四君子汤能够有效抑制胃癌细胞株SGC-7901接种于裸鼠形成荷瘤的生长[5]。另有研究显示四君子汤还可以调控内分泌系统,如机体内血清T3、甲状腺素(T4)、TSH、下丘脑促甲状腺激素释放激素(TRH)的分泌水平[5]。众所周知,甲状腺癌发病与TSH、TRH等激素分泌异常具有密切关系[6-7]。目前关于四君子汤在甲状腺癌治疗中的作用尚未见报道,因此本研究检测四君子汤含药血清对甲状腺癌细胞株KMH-2和8305C生长和凋亡的影响,希望为甲状腺癌辅助治疗提供一种新的治疗策略。
材料与方法
一、药物制备
四君子汤含药血清采用SD大鼠模型提取,先将四君子汤熬制成汤剂,详细步骤参考文献[8]。24只SD大鼠常规饲养于SPF级动物房,随机分为4组:生理盐水组和四君子汤低剂量组、中剂量组、高剂量组,每组各6只。实验组动物按等体积药物灌胃,生理盐水组采用生理盐水灌胃,连续灌胃3 d,末次灌胃后1 h,乙醚麻醉后无菌腹主动脉采血,分离血清,-20℃保存备用。四君子汤用药剂量按公式计算:大鼠每日用药量(g/kg) =人日用剂量×0.007/1.5,即为中剂量组;高剂量组为中剂量组的2倍;低剂量组为中剂量组的1/2。
二、细胞培养
KMH-2和8305C细胞购自中科院细胞研究所。2种细胞均采用含10%胎牛血清、1%青霉素和链霉素的DMEM培养基培养于37℃、5%CO2、95%湿度条件下的培养箱中。在细胞增殖至80%融合率时传代。
三、MTT试验
取5×103对数生长期细胞接种于96孔板过夜,分别采用10%和20%四君子汤含药血清(低、中、高剂量组)处理。72 h后加MTT溶液(5 g/L)20 μl继续孵育4 h,每孔加DMSO 100 μl,避光振荡10 min充分溶解。选择490 nm波长测定各孔吸光值 (A值)。细胞生长抑制率=(1-实验组A值/对照组A值)×100%。
四、细胞凋亡检测
收集经10%和20%四君子汤含药血清(高剂量组)处理48 h的至少1×106个细胞,分别进行Annexin V-FITC和PI染色,在室温静置15 min后进行流式细胞仪检测。
五、侧群细胞分选和鉴定
将细胞分成对照组和维拉帕米组,收集1×106个细胞加入5 μg/ml Hoechst 33342,维拉帕米组同时加入100 μg/ml维拉帕米,避光37℃孵育70 min,离心后弃上清液用2%的胎牛血清的PBS重悬,再加入终浓度1 μg/ml的PI染色。流式细胞仪检测分选,350 nm(375)波长紫外光激发Hoechst染色,于450/20 nm带通下收集测定蓝光,675 nm带通下收集测定红光。通过蛋白免疫印迹法检测细胞内ALDH、CD44和ABCG2蛋白表达水平以分子鉴定。
六、蛋白免疫印迹法
含药血清处理48 h后,提取细胞总蛋白,采用Bradford法定量,取25 μg蛋白样本分别经电泳、转膜、封闭、一抗孵育、二抗孵育、曝光、显影、定影等过程对蛋白含量进行检测。Cox IV和β-actin蛋白分别作为线粒体和胞浆蛋白内参照。
七、统计学处理
结果
一、低、中、高剂量组含药血清对KMH-2和8305C细胞增殖影响的比较
MTT结果显示(图1),10%和20%(中、高剂量组)含药血清可以抑制KMH-2和8305C细胞增殖(F=4.521,P=0.013),而低剂量和生理盐水组含药血清对KMH-2和8305C细胞增殖并无显著抑制。
二、低、中、高剂量组含药血清对KMH-2和8305C细胞凋亡影响的比较
Annexin V/PI试验结果显示(图2),在10%和20%中、高剂量组含药血清处理48 h后,KMH-2和8305C细胞凋亡比例显著高于生理盐水组(F=8.965,P=0.005);其他处理组则未出现显著的细胞凋亡。
三、KMH-2和8305C中侧群细胞筛选和鉴定
Hoechst 33342染色显示(图3),KMH-2和8305C细胞中均存在一定比例的侧群细胞,比例分别为(1.45±0.01)%和(1.75±0.01)%;当采用维拉帕米处理后,两种细胞中侧群细胞比例明显下降,分别为(0.48±0.00)%和(0.50±0.01)%。蛋白免疫印迹结果显示侧群细胞的肿瘤干细胞标志物ALDH、CD44和ABCG2蛋白表达显著高于非侧群细胞。

图1 中、高剂量四君子汤灌胃组含药血清抑制两种细胞增殖
A:各剂量组含药血清对KMH-2细胞增殖的影响;B:各剂量组含药血清对8305C细胞增殖的影响
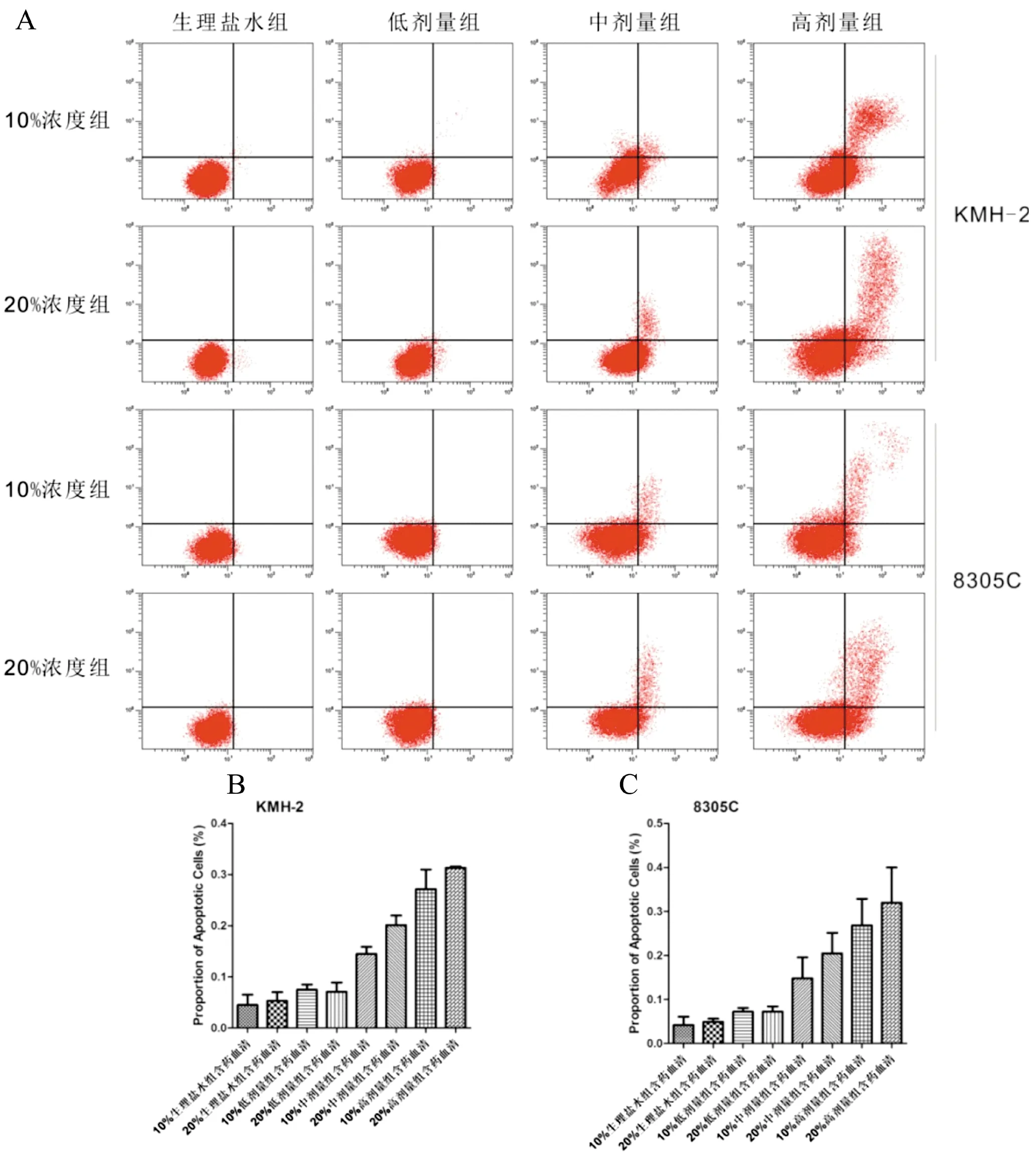
图2 中、高剂量四君子汤灌胃组含药血清诱导两种细胞凋亡
A:流式细胞仪凋亡分析图,左下象限代表活细胞、右下象限代表早期凋亡细胞、右上象限代表晚期凋亡细胞、坏死细胞;B和C:各剂量组含药血清对KMH-2和8305C细胞凋亡的影响
四、四君子汤抑制侧群细胞增殖及诱导侧群细胞凋亡
MTT实验结果显示(图4),20%高剂量灌胃组含药血清可以抑制KMH-2和8305C细胞中侧群细胞增殖,而其他处理组并不能抑制侧群细胞增殖。凋亡实验结果显示,20%高剂量灌胃组含药血清诱导KMH-2和8305C细胞中侧群细胞凋亡,而其他处理组则并未出现细胞凋亡。
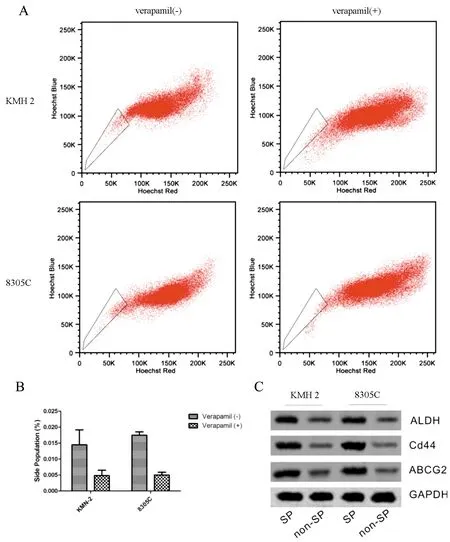
图3 侧群细胞筛选和鉴定
A:利用流式细胞仪检测Hoechst 33342荧光,筛选侧群细胞,图中小框中所示即为侧群细胞;B:两种细胞中侧群细胞比例以及维拉帕米对侧群细胞比例的影响;C:肿瘤干细胞标志物ALDH、CD44和ABCG2蛋白在侧群和非侧群细胞的表达水平
五、四君子汤激活侧群细胞内源性凋亡途径
蛋白免疫印迹结果显示(图5),20%四君子汤高剂量组含药血清处理48 h后, 侧群细胞内bax蛋白表达显著上调,而Bcl-2蛋白表达显著下降,胞浆内Cytochrome C含量增高,另外可检测到Caspase-3的活性片段,说明内源性凋亡途径被激活。
讨论
在晚期甲状腺癌治疗的临床实践中,面对临床常用化疗药物较严重的毒副作用,人们更加迫切地希望找到治疗甲状腺癌的新方法。现代研究发现,四君子汤治疗中晚期恶性肿瘤,不仅能抑制肿瘤细胞生长,而且能增强机体的免疫力,改善症状,延长生存期,提高生活质量。四君子汤由4种天然植物熬制而成,其有效活性成分非常复杂难以明确,这也是许多在临床上被证明有效的中国传统医药无法获得国际认可的重要原因。在本研究中,我们采用血清药物学方法提取更适用于体外细胞实验的四君子汤含药血清,含药血清比汤剂成分更纯净,不会存在过多影响细胞生物学行为的杂质[9]。
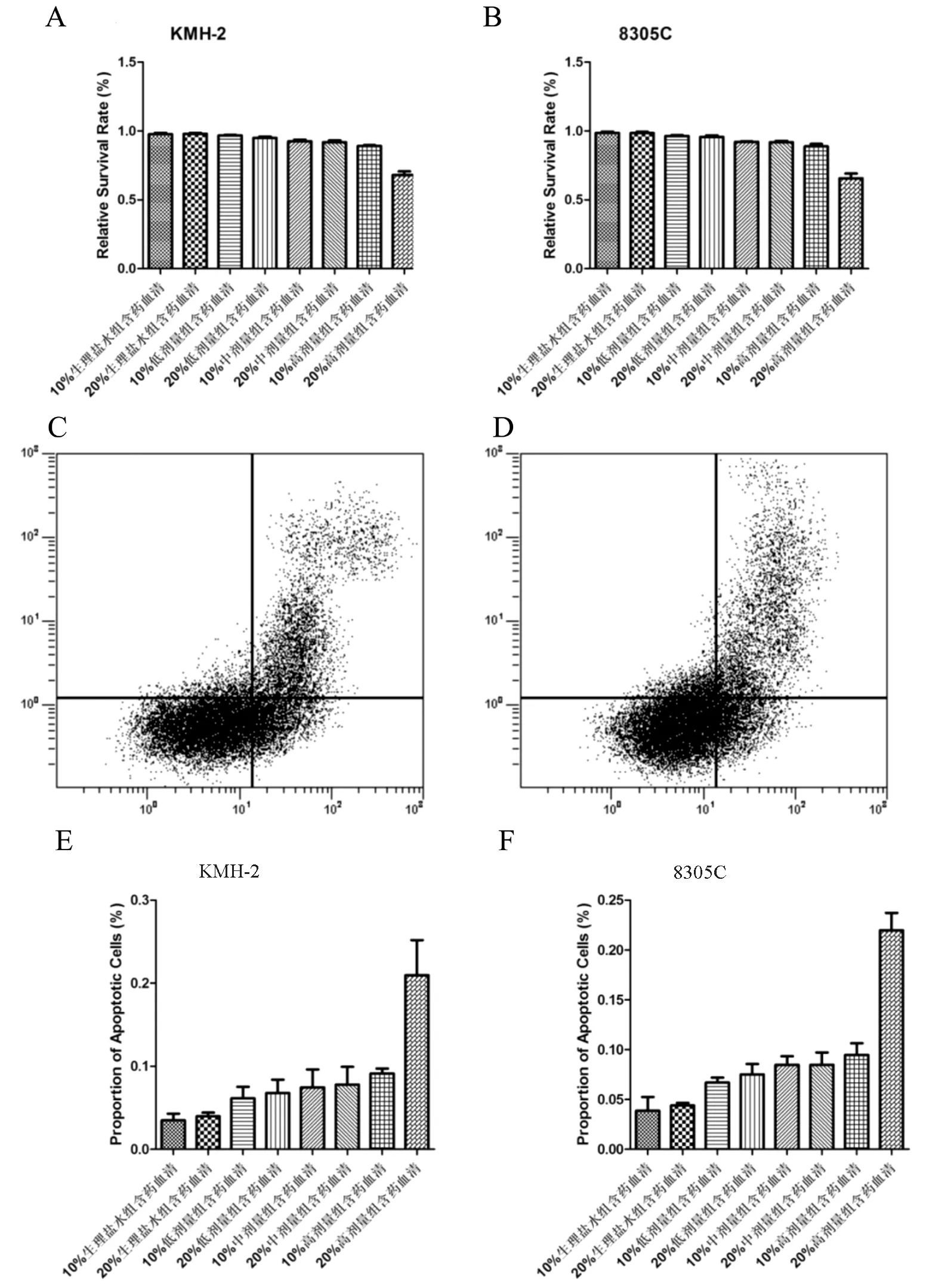
图4 20%高剂量灌胃组含药血清抑制侧群细胞增殖、诱导侧群细胞凋亡
A、B:各剂量组含药血清对侧群细胞增殖的影响;C、D :Annexin V/PI试验(20%高剂量组含药血清处理组,其余处理组未显示);E、F:各剂量组含药血清对侧群细胞凋亡的影响
通过MTT实验证实四君子汤含药血清能够抑制KMH-2和8305C细胞增殖,然后通过流式细胞仪技术对KMH-2和8305C细胞中的侧群细胞进行筛选和鉴定。肿瘤干细胞学说认为肿瘤组织中存在极少量的肿瘤干细胞,它们具有自我更新和无限增殖能力,与其他肿瘤细胞相比,它们具有更强的成瘤性、转移性和抗药性,肿瘤之所以难以消灭,手术后易复发,都是因为常规治疗方法并未彻底杀死肿瘤干细胞。侧群细胞被认为是一群具有肿瘤干细胞特征的细胞,它们可以表达丰富的药物转运蛋白,能够迅速泵出荧光染料Hoechst[10]。通过流式细胞仪技术人们相继在肺癌、肝癌、胰腺癌和结肠癌等肿瘤中发现侧群细胞[11-14]。甲状腺癌组织中也存在侧群细胞,并且认为ALDH、CD44和ABCG2是甲状腺癌SP细胞的标记物[15-16]。在本研究中我们也发现KMH-2和8305C细胞株中存在一定比例侧群细胞,并且这部分细胞中ALDH、CD44和ABCG2蛋白表达水平显著高于其他肿瘤细胞,进一步证明它们是侧群细胞。通过MTT实验和凋亡实验,我们发现四君子汤能显著地抑制侧群细胞生长,诱导侧群细胞凋亡。细胞凋亡过程涉及一系列基因调控和信号通路,例如线粒体凋亡途径、死亡受体凋亡途径以及内质网凋亡途径等[17-18]。在本研究中我们发现四君子汤含药血清可以诱导Bax/Bcl-2比例增加,促进Cytochrome C含量升高,并且激活Caspase-3,因此可以推断四君子汤是通过激活线粒体凋亡途径诱导侧群细胞凋亡。
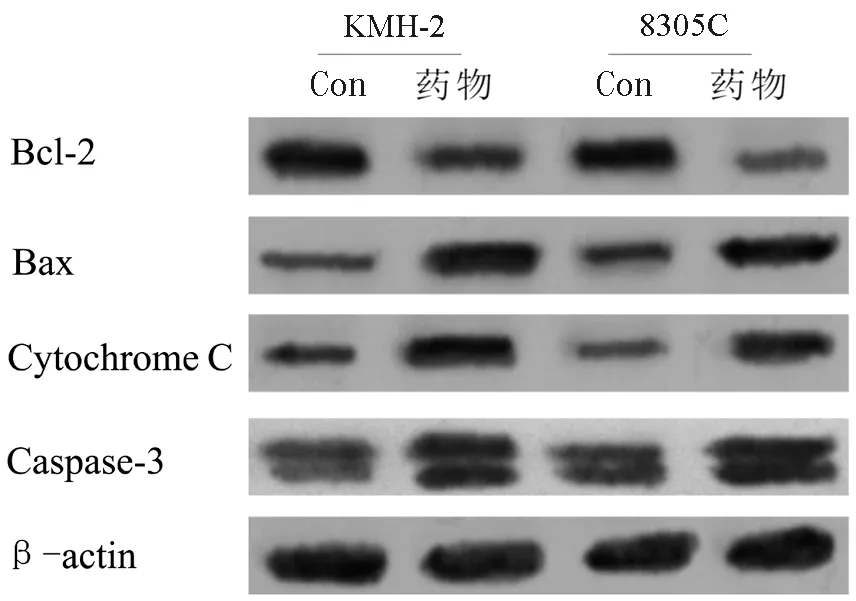
图5 20%四君子汤高剂量组含药血清对凋亡相关蛋白表达的影响
综上所述, KMH-2和8305C细胞中存在侧群细胞,四君子汤含药血清能够通过激活线粒体凋亡途径诱导侧群细胞凋亡,抑制其增殖。在本研究中我们使用四君子汤含药血清作为刺激物,在后续研究中将利用现代色谱技术设法找到四君子汤中的有效活性分子。
参考文献
[1]Chen GQ, Shi XG, Tang W, Xiong SM, Zhu J, Cai X, Han ZG, Ni JH, Shi GY, Jia PM, Liu MM, He KL, Niu C, Ma J, Zhang P, Zhang TD, Paul P, Naoe T, Kitamura K, Miller W, Waxman S, Wang ZY, de The H, Chen SJ, Chen Z. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): I. As2O3 exerts dose-dependent dual effects on APL cells. Blood,1997,89(9):3345-3353.
[2]Nam S, Scuto A, Yang F, Chen W, Park S, Yoo HS, Konig H, Bhatia R, Cheng X, Merz KH, Eisenbrand G, Jove R. Indirubin derivatives induce apoptosis of chronic myelogenous leukemia cells involving inhibition of Stat5 signaling. Mol Oncol,2012,6(3):276-283.
[3]Wang HQ, Jin JJ, Wang J. Matrine induces mitochondrial apoptosis in cisplatin-resistant non-small cell lung cancer cells via suppression of β-catenin/survivin signaling. Oncol Rep,2015,33(5):2561-2566.
[4]Wu B, Xuan ZR. Progress in research on applying Sijunzi Decoction in treating digestive malignant tumor. Chin J Integr Med,2007,13(2):156-159.
[5]Zhao AG, Zhao HL, Jin XJ, Yang JK, Tang LD. Effects of Chinese Jianpi herbs on cell apoptosis and related gene expression in human gastric cancer grafted onto nude mice. World J Gastroenterol,2002,8(5):792-796.
[6]Cao Y, Liu F, Huang Z, Zhang Y. Protective effects of Guanxin Shutong capsule drug-containing serum on tumor necrosis factor-α-induced endothelial dysfunction through nicotinamide adenine dinucleotide phosphate oxidase and the nitric oxide pathway. Exp Ther Med,2014,8(3):998-1004.
[7]Jiang YR, Miao Y, Yang L, Xue M, Guo CY, Ma XJ, Yin HJ, Shi DZ, Chen KJ. Effect of chinese herbal drug-containing serum for activating-blood and dispelling-toxin on ox-LDL-induced inflammatory factors’ expression in endothelial cells. Chin J Integr Med,2012,18(1):30-33.
[8]贾建光,马莉,李靖,金鑫,张立功,刘建文,钱军. 四君子汤及拆方含药血清对胃癌细胞株侧群细胞的生长抑制研究.中国临床药理学与治疗学, 2013,18(5): 513-518.
[9]Gao SY, Gong YF, Sun QJ, Bai J, Wang L, Fan ZQ, Sun Y, Su YJ, Gang J, Ji YB. Screening antitumor bioactive fraction from Sauromatum giganteum (Engl.) Cusimano & Hett and sensitive cell lines with the serum pharmacology method and identification by UPLC-TOF-MS. Molecules,2015,20(3):4290-4306.
[10]Chiba T, Kita K, Zheng YW, Yokosuka O, Saisho H, Iwama A, Nakauchi H, Taniguchi H. Side population purified from hepatocellular carcinoma cells harbors cancer stem cell-like properties. Hepatology,2006,44(1):240-251.
[11]Niess H, Camaj P, Renner A, Ischenko I, Zhao Y, Krebs S, Mysliwietz J, Jäckel C, Nelson PJ, Blum H, Jauch KW, Ellwart JW, Bruns CJ. Side population cells of pancreatic cancer show characteristics of cancer stem cells responsible for resistance and metastasis. Target Oncol,2015,10(2):215-227.
[12]Sussman RT, Ricci MS, Hart LS, Sun SY, El-Deiry WS. Chemotherapy-resistant side-population of colon cancer cells has a higher sensitivity to TRAIL than the non-SP, a higher expression of c-Myc and TRAIL-receptor DR4. Cancer Biol Ther,2007,6(9):1490-1495.
[13]Schmuck R, Warneke V, Behrens HM, Simon E, Weichert W, Röcken C. Genotypic and phenotypic characterization of side population of gastric cancer cell lines. Am J Pathol,2011,178(4):1792-1804.
[14]Fukuda K, Saikawa Y, Ohashi M, Kumagai K, Kitajima M, Okano H, Matsuzaki Y, Kitagawa Y. Tumor initiating potential of side population cells in human gastric cancer. Int J Oncol,2009,34(5):1201-1207.
[15]Guo Z, Jiang JH, Zhang J, Yang HJ, Yang FQ, Qi YP, Zhong YP, Su J, Yang RR, Li LQ, Xiang BD. COX-2 Promotes Migration and Invasion by the Side Population of Cancer Stem Cell-Like Hepatocellular Carcinoma Cells. Medicine (Baltimore), 2015,94(44):e1806.
[16]Hayase S, Sasaki Y, Matsubara T, Seo D, Miyakoshi M, Murata T, Ozaki T, Kakudo K, Kumamoto K, Ylaya K, Cheng SY, Thorgeirsson SS, Hewitt SM, Ward JM, Kimura S. Expression of stanniocalcin 1 in thyroid side population cells and thyroid cancer cells. Thyroid,2015,25(4):425-436.
[17]李天晓,元刚,叶丽君,孙健,黎曙霞. 棉酚衍生物ApoG2诱导胃癌细胞凋亡及对Wnt6调控作用的研究. 新医学, 2014, 45(6): 359-363.
[18]刘伟才. 二氯乙酸对急性髓系白血病细胞株U937细胞凋亡的影响及其机制的研究.新医学, 2013,44(6): 430-433.
(本文编辑:杨江瑜)

Study on anti-tumor activities of Sijunzi decoction against growth of side population in thyroid cancer cells
TianLi,CuiWei,SunHong.
DepartmentofGeriatric,NorthHospitalofXi’anCity,Xi’an710000,China
【Abstract】ObjectiveTo evaluate the inhibiting effects of Sijunzi decoction (SJZD) on the growth of thyroid cancer cell lines (KMH-2 and 8305c). MethodsThe SJZD-containing serum was obtained by using model of SD rats . The effects of SJZD-containing serum on proliferation of KMH-2 and 8305c cells were examined by using MTT assay. The effects of SJZD-containing serum on apoptosis of KMH-2 and 8305c cells were examined by using Annexin V/PI double staining assay. The side population (SP) of KMH-2 and 8305c cells was screened and identified by Flow cytometry analysis. In addition, the expressions of apoptosis-related proteins including Bax, Bcl-2, Cytochrome C and Caspase-3 were examined by western blot assay. ResultsSJZD-containing serum significantly inhibited the prolifecation of KMH-2 and 8305C cells and induced apoptosis. There existed SP(1.45±0.01)% and (1.75±0.01)% in a certain proportion that in the KMH-2 and 8305c cells, and protein expression level of ALDH, CD44 and ABCG2 in the SP were higher. Further analysis showed that SJZD-containing serum promoted apoptosis of SP cells of KMH-2 and 8305C cells by up-regulating Bax, Cytochrome C and Caspase-3 and down-regulating Bcl-2. ConclusionsOur data revealed the mechanism of the anti-cancer effect of SJZD-containing serum, and this effect was mainly produced through inducing the apoptosis of cells.
【Key words】Sijunzi decoction; Thyroid cancer;Side population; Apoptosis
DOI:10.3969/j.issn.0253-9802.2016.06.004
通讯作者,田黎,E-mail:tianlihappy1234@sina.com
Corresponding author, Tian Li, E-mail:tianlihappy1234@sina.com
(收稿日期:2015-08-11)
·基础研究论著·

