纳米金颗粒对大鼠血脑屏障结构的影响
黄昱昊 何敏彤 杨圳冲 廖智恒 许衍扬 李梦圆 柳嘉欣 顾怀宇
纳米金颗粒对大鼠血脑屏障结构的影响
黄昱昊何敏彤杨圳冲廖智恒许衍扬李梦圆柳嘉欣顾怀宇
510080 广州,中山大学中山医学院人体解剖学教研室
【摘要】目的观察颈静脉注射纳米金颗粒对大鼠血脑屏障结构的影响。方法经颈静脉向大鼠注射50 nm金颗粒。分别在1、2、3、4、5、6 h时收集大鼠脑脊液,采用电感偶合等离子体质谱仪检测脑脊液纳米金颗粒浓度。在注射纳米金颗粒6 h后取脑组织并固定制片,在透射电镜下观察纳米金颗粒及脑组织的超微结构;大鼠脑组织制作切片后经普鲁士蓝染色、免疫组织化学染色和免疫荧光染色,在光镜下观察大鼠血脑屏障的出血情况和完整性。结果大鼠脑脊液中纳米金颗粒浓度随时间延长逐渐升高,并在3 h后趋于稳定;电镜下可见大鼠脑细胞布满纳米金颗粒,超显微结构有一定改变;光镜下,大鼠血脑屏障在普鲁士蓝染色后可见出血点,在免疫组织化学染色和免疫荧光染色后可见血管缺损。结论纳米金颗粒可透过血脑屏障并造成微小出血点及血管微小缺损。
【关键词】纳米颗粒;血脑屏障;大鼠;透射电镜
近年来,中枢神经系统疾病成为国内外的研究热点,例如癫痫、帕金森综合征、阿尔茨海默病等。但大部分药物由于不能透过血脑屏障到达靶标,使得中枢神经系统疾病的治疗成为难点。虽然血脑屏障有效阻挡了毒物进入中枢神经系统,使其保持相对稳定,但同时也阻碍了药物进入中枢神经系统发挥药效[1-2]。纳米材料作为药物载体,不仅可与多种药物结合透过血脑屏障作用于中枢神经系统,而且可精确控制药物释放时间和空间[3-4]。纳米技术将会广泛运用于临床,但其作用机制和安全性仍未完全阐明。为此,本研究予大鼠注射纳米金颗粒,并对其血脑屏障的结构变化进行一系列的观察,现报告如下。
材料与方法
一、实验动物及分组
16只SPF级雄性SD大鼠,体质量180~250 g,购于广东医学动物实验中心。将大鼠分为实验组和对照组,每组各8只,遵循中山大学实验室动物管理规范饲养,大鼠适应性饲养2周。
二、主要药品和试剂
包括50 nm金颗粒(中国科学院国家纳米科学中心)、Claudin-5多克隆抗体(美国Sigma公司)、免疫组织化学试剂盒(北京中衫金桥生物技术有限公司)。
三、实验方法
1. 纳米金颗粒解聚
将纳米金颗粒悬液用磷酸盐缓冲液(PBS)稀释至0.5 mg/ml,振荡,然后用数控超声波仪在功率300 W、水温25~30℃时超声解聚3次,每次10 min。
2. 给药方法
用异氟醚麻醉大鼠后,在解剖放大镜下小心暴露大鼠颈静脉,用血管钳夹闭颈静脉近心端血流,在颈静脉远心端做一个V形切口后插入插管。实验组和对照组通过颈静脉插管分别注射0.5 mg/ml的纳米金颗粒溶液5 mg/kg和等体积的PBS溶液。
3. 大鼠脑脊液抽取
用异氟醚麻醉大鼠后,在解剖放大镜下在大鼠第二骶椎处做一正中纵向切口,小心分离肌肉暴露第二骶椎并用镊子将其掀开,暴露硬脊膜。在硬脊膜上作一V形切口,将马尾套管插入蛛网膜下隙,脑脊液即可从管中流出并连续收集,将套管扎紧并固定于皮肤。在纳米金颗粒注射1、2、3、4、5、6 h时收集脑脊液标本。
4. 纳米金颗粒的检测
将收集的脑脊液通过电感等离子体发射光谱仪[5](ICP-MS,Perkin-Elmer,USA)测定其纳米金颗粒浓度,由国家纳米科学中心完成。
5. 脑组织取材
在注射纳米金颗粒6 h后,注射甲苯噻嗪和氯胺酮(0.011、0.2 mg/kg)麻醉,经冠状动脉用生理盐水灌流处死后,取脑组织置入4%戊二醛固定液在4℃下固定过夜。
6. 电镜样本的制备
将固定的样本以0.1 mol/L PBS冲洗3次,每次30 min;后用1%四氧化锇固定1 h,统一方法冲洗3次;丙酮系列脱水,丙酮∶包埋剂Epon812环氧树脂(1∶1和1∶2)与纯包埋剂系列渗透,包埋聚合;超薄切片,经铀铅双重染色;在电子显微镜下观察[6]。
7. 普鲁士蓝染色、免疫组织化学染色和免疫荧光染色
将已固定好的脑组织行冠状面切片,厚40 μm。对于每例脑组织标本每逢第6片共12片作普鲁士蓝染色[7]。每逢第2片共10片作免疫组织化学染色[8]。每逢第4片共10片作免疫荧光染色。
在普鲁士蓝染色实验中,将组织切片脱蜡至蒸馏水;普鲁士蓝染液染色20 min,蒸馏水冲洗;1%伊红对比染色 1 min,蒸馏水冲洗; 95%乙醇至无水乙醇脱水、二甲苯透明、中性树胶封片,显微镜下观察。
在免疫组织化学染色实验中,将组织切片行过氧化物酶阻断,正常山羊血清封闭,滴加50 μl鼠抗Claudin-5(1∶100)。4℃孵育过夜后,滴加即用型生物素标记的羊抗兔二抗IgG,室温孵育15 min,辣根过氧化物酶标记链霉卵白素工作液室温孵育15 min,显色后蒸馏水冲洗终止反应,苏木素复染、脱水后中性树胶封片,显微镜下观察。
在免疫荧光染色实验中,将组织切片用5%驴血清封闭30 min,勿洗;滴加鼠抗Claudin-5(1∶100),4℃孵育过夜;用PBS冲洗后,滴加驴抗鼠荧光二抗(1∶100),室温下避光孵育1 h;甘油封片后荧光显微镜下观察。
四、统计学处理
结果
一、脑脊液中纳米金颗粒的形态及浓度
纳米金颗粒悬液经充分解聚后,透射电镜下观察可见,纳米金颗粒的直径在40~50 nm之间,颗粒分散良好,呈圆球状,见图1。实验组在1、2、3、4、5、6 h脑脊液中纳米金颗粒浓度依次为(53±4)、(60±5)、(86±3)、(94±4)、(86±5)、(100±8)μg/L,1 h和2 h、4 h和5 h、5 h和6 h、3 h和5 h、3 h和6 h、4 h和6 h间比较差异无统计学意义(t分别为0.366、2.776、0.190、4.329、1.840、4.329、P均>0.003),2 h和3 h、3 h和4 h、1 h和3 h、2 h和4 h、2 h和6 h、1 h和4 h、1 h和5 h、1 h和6 h、2 h和6 h间比较差异有统计学意义(t分别为11.598、9.887、5.085、14.429、27.524、4.632、6.002、9.226、19.750、P均<0.003)。大鼠脑脊液中纳米金颗粒浓度随时间延长逐渐升高,并在3 h后趋于稳定。对照组中脑脊液的纳米金颗粒浓度均为0。
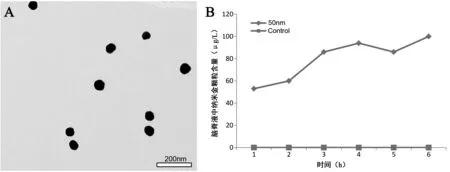
图1 脑脊液中纳米金颗粒的形态及浓度
A:50 nm金颗粒扫描电镜图(×50 000);B:脑脊液中纳米金颗粒浓度随时间延长的变化情况
二、透射电镜超微结构改变
电子显微镜下,对照组细胞核仁清晰,核膜完整,染色质均匀,线粒体无肿胀,线粒体嵴结构正常;粗面内质网结构正常;无纳米金颗粒的存在[9]。实验组细胞核电子密度较低,核周间隙变宽,线粒体轻度肿胀,内质网轻度扩张。在脉络丛、大脑皮质和海马电镜图中均出现大量黑色圆点,直径约为50 nm,为纳米金颗粒,见图2。
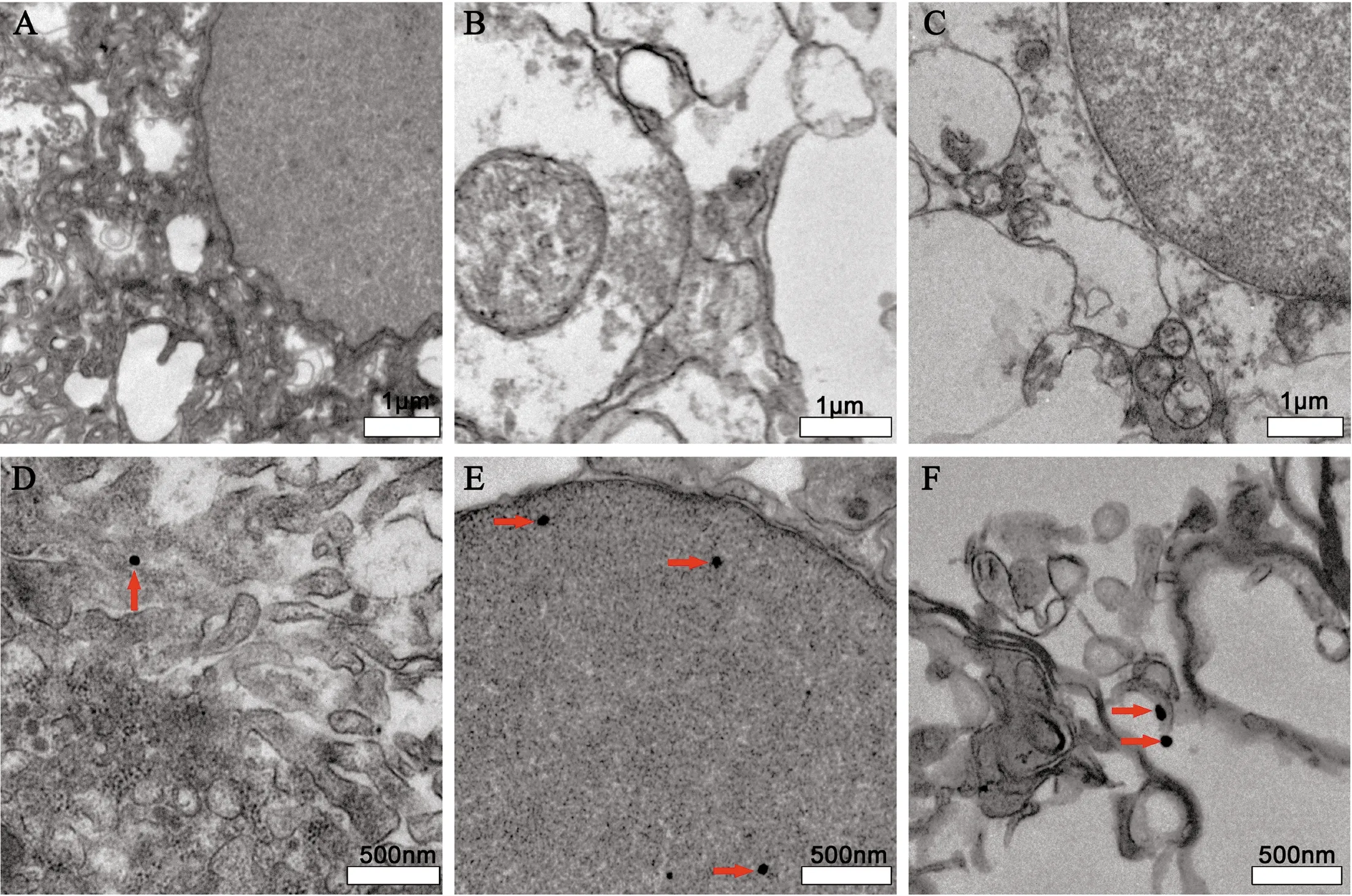
图2 电子显微镜下大鼠脉络丛、脑皮质和海马区的超微结构
A、B、C:对照组(×10 000);D、E、F:实验组(×20 000);A、D脉络丛;B、E:大脑皮质;C、F:海马;红色箭头:纳米金颗粒
三、普鲁士蓝染色、免疫组织化学染色和免疫荧光染色结果
在显微镜下,实验组大脑皮质、海马区和小脑的组织切片中均可观察到普鲁士蓝染色阳性的斑块,但数目不多,仅有2~3处;而在对照组切片中均未观察到普鲁士蓝染色阳性斑块。正常对照组大鼠Claudin-5在血脑屏障内皮细胞间表达强烈清晰呈连续条带状分布。实验组大鼠的Claudin-5表达水平下降,小血管的紧密连接出现缺损,见图3。
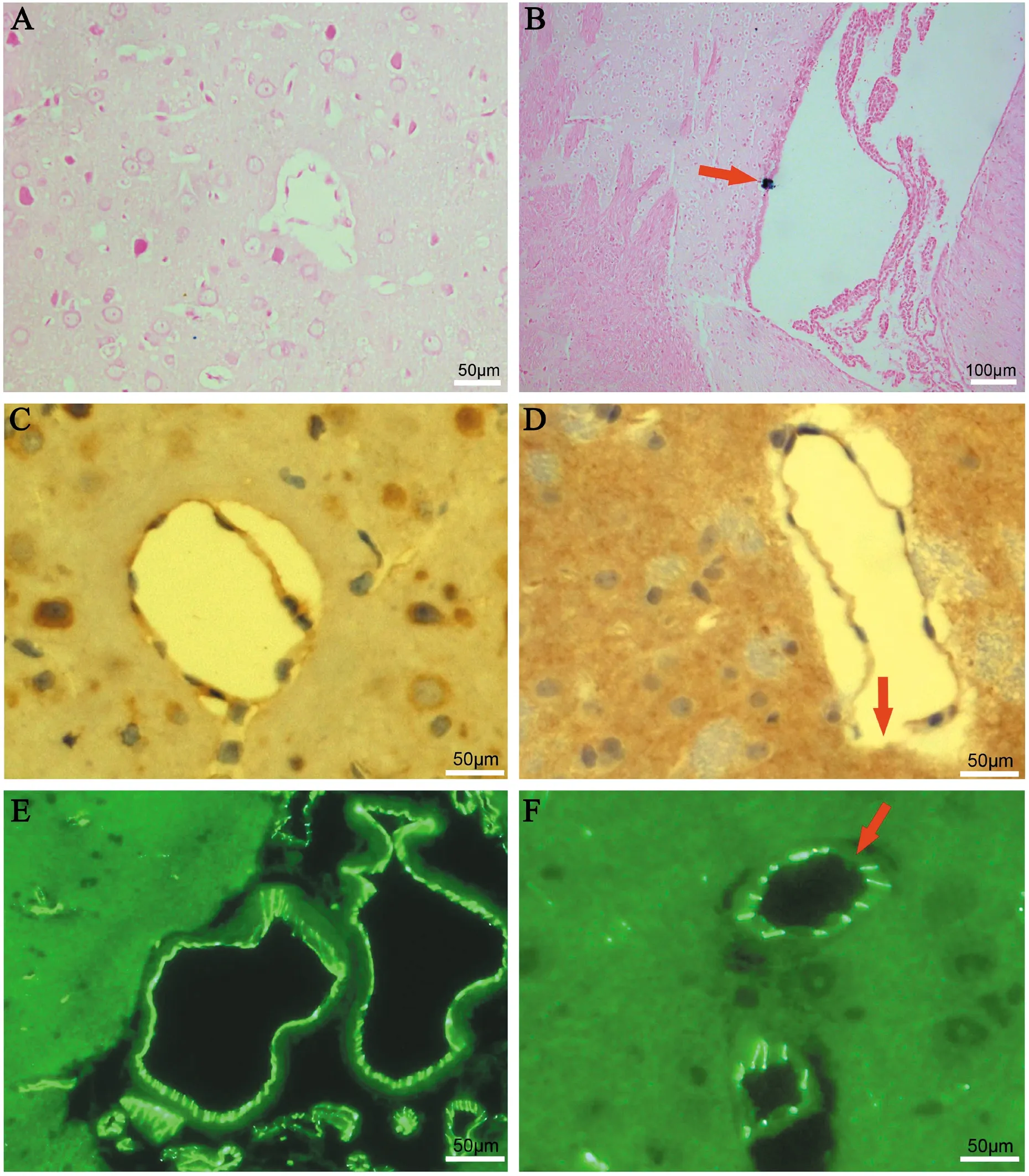
图3 大鼠脑组织普鲁士蓝染色、免疫组织化学染色和免疫荧光染色结果
A、C、E:对照组(×200);B、D、F:实验组(B×100,D、F×200);A、B:普鲁士蓝染色切片,箭头所指为出血点;C、D:免疫组织化学染色切片箭头所指为Claudin-5表达减少及血管破损处;E、F:免疫荧光染色切片,箭头所指为Claudin-5表达减少及血管破损处
讨论
近年随着纳米材料的发展,纳米材料作为药物载体运用于医学领域的研究也越来越多。纳米材料作为诊断和治疗中枢神经系统相关疾病的重要途径,能否通过血脑屏障以及会否对其结构或功能造成损害,是研发纳米材料作为诊断或治疗手段的一大瓶颈[2]。
广义的血脑屏障包括血-脑组织屏障和血-脑脊液屏障,由血管内皮细胞及其间紧密连接、内皮基膜及星形胶质细胞终足组成,它是血液循环和脑区之间的屏障,严格控制物质的进出,有效抵御血液循环中有害物质进入脑区,同时也限制了中枢神经系统疾病治疗药物的进出。本研究一方面运用颈静脉注射给药,并实时抽取脑脊液结合电感偶合等离子体质谱分析脑脊液中纳米金颗粒浓度的方法,另一方面将脑组织固定后进行普鲁士蓝染色、免疫组组化学和免疫荧光染色以及电镜制片,研究纳米金颗粒在血脑屏障的透过性。结果显示,当纳米金颗粒通过血脑屏障时,可在脑脊液及脑细胞中检测到纳米金颗粒,纳米金颗粒浓度逐渐升高,3 h后趋于稳定。推测是由于纳米金颗粒在静脉注射后逐渐在脑脊液中累积,而后金颗粒进出血-脑脊液屏障趋于稳定而使浓度维持在一定范围内。
脉络丛上皮细胞的完整性是血-脑脊液屏障完整性的重要标志之一,而大脑皮质和海马区是中枢神经系统的重要组成部分。本研究显示,在脉络丛切片中,纳米金颗粒在上皮细胞纤毛上的微绒毛聚集,由此推测纳米金颗粒可能是通过脉络丛上皮细胞的纤毛进入血-脑脊液屏障的。在大脑皮质和海马切片中可见纳米金颗粒聚集于细胞内,其中大脑皮质以细胞核中为多,由此推测纳米金颗粒可透过血-脑组织屏障。在电镜下,脑组织细胞的超微结构有一定的改变,说明细胞代谢过程发生改变,但改变细微,是否影响功能应进一步探究。当红细胞破坏时,血红蛋白被氧化为含铁血黄素后可被普鲁士蓝染成蓝色。故推测在蓝色斑块处存在血管破损点,红细胞经破损处挤压被破坏并聚集在破损处而呈蓝色。脑血管的破损可能是由于纳米金颗粒通过血脑屏障时造成的,但数目不多,其他脑组织结构无明显异常。Claudin-5是脑微血管内皮细胞紧密连接中的特异性蛋白,可作为血脑屏障完整的标志[10]。经抗体标记后,在光镜下可见血脑屏障出现微小缺损,这些缺损可能是由于金颗粒通过血脑屏障时造成的。虽然纳米金颗粒穿过血脑屏障时破坏了其结构并造成了出血,但破损处的数目少且出血点小,而且除血脑屏障的组成成分受到损伤,其余脑组织结构无明显变化。有关大鼠血脑屏障的功能是否受到纳米金颗粒的影响尚需进一步研究。
将纳米金颗粒经颈静脉注射后,纳米金颗粒在透过血脑屏障的同时,使部分脑细胞超微结构改变,造成血脑屏障的微出血和微损伤。据此推测,纳米金颗粒进入血脑屏障的机制可能是通过破坏血脑屏障的结构使其屏障功能障碍而增加血脑屏障对纳米金颗粒的透过性[11]。虽然纳米金颗粒对血脑屏障的结构造成了一定的损伤,但损伤较为微小且数量较少,在实验过程中大鼠的生命体征无明显改变。在进一步研究中,我们将在大鼠注射纳米金颗粒后检测血脑屏障的功能改变以及观察大鼠的长期行为学变化。
参考文献
[1]Hwang SR, Kim K.Nano-enabled delivery systems across the blood-brain barrier. Arch Pharm Res,2014,37(1):24-30.
[2]Palmiotti CA, Prasad S, Naik P, Abul KM, Sajja RK, Achyuta AH, Cucullo L. In vitro cerebrovascular modeling in the 21st century: current and prospective technologies. Pharm Res, 2014,31(12):3229-3250.
[3]Alyautdin R, Khalin I, Nafeeza MI, Haron MH, Kuznetsov D.Nanoscale drug delivery systems and the blood-brain barrier.Int J Nanomedicine,2014,9:795-811.
[4]Dvir T, Timko BP, Kohane DS, Langer R.Nanotechnological strategies for engineering complex tissues.Nat Nanotechnol,2011,6(1):13-22.
[5]Lee S, Bi X, Reed RB, Ranville JF, Herckes P, Westerhoff P.Nanoparticle size detection limits by single particle ICP-MS for 40 elements.Environ Sci Technol,2014,48(17):10291-10300.
[6]Shim KH, Jeong KH, Bae SO, Kang MO, Maeng EH, Choi CS, Kim YR, Hulme J, Lee EK, Kim MK, An SS.Assessment of ZnO and SiO2 nanoparticle permeability through and toxicity to the blood-brain barrier usingEvans blue and TEM.Int J Nanomedicine,2014,9(Suppl 2):225-233.
[7]Liu S, Grigoryan MM, Vasilevko V, Sumbria RK, Paganini-Hill A, Cribbs DH, Fisher MJ.Comparative analysis of H&E and Prussian blue staining in a mouse model of cerebral microbleeds.J Histochem Cytochem,2014,62(11):767-773.
[8]邓心情. 血红蛋白对内皮细胞磷酸化肌球蛋白轻链及紧密连接蛋白ZO-1和claudin-5的影响.南方医科大学, 2010.
[9]李凯,冯冠军,胡艳荣,杨小朋,陈刚,刘伟,张艳君.神经营养因子-3联合神经干细胞移植治疗缺血缺氧性脑损伤乳鼠的病理实验研究.新医学,2013,44(3):206-210.
[10]Liu J, Jin X, Liu KJ, Liu W.Matrix metalloproteinase-2-mediated occludin degradation and caveolin-1-mediated claudin-5 redistribution contribute to blood-brain barrier damage in early ischemic stroke stage.J Neurosci,2012,32(9):3044-3057.
[11]Li Z, Liang G, Ma T, Li J, Wang P, Liu L, Yu B, Liu Y, Xue Y.Blood-brain barrier permeability change and regulation mechanism after subarachnoid hemorrhage.Metab Brain Dis,2015,30(2):597-603.
Effect of Au nanoparticles on the blood-brain barrier of rats
HuangYuhao,HeMintong,YangZhenchong,LiaoZhiheng,XuYanyang,LiMengyuan,LiuJiaxin,GuHuaiyu.
DepartmentofAnatomy,ZhongshanSchoolofMedicine,SunYat-senUniversity,Guangzhou510080,China
【Abstract】ObjectiveTo study the effect on the structure of blood-brain barrier after the intravenous administration of Au nanoparticles to the rats. Methods 50 nm Au nanoparticles were intravenous administrated into rats through jugular vein. CSF was then collected with a cauda equine catheterization technique at 1, 2, 3, 4, 5 and 6 hours respectively after the administration. And the concentration of Au was detected by ICP-MS analysis. After injection the nanoparticles of 6 hours, the brains of the rats were collected and stored as fixed films, and then to observe the nanoparticles and ultrastructure of brain tissue under the TEM. Other samples were stained by Prussian blue dye, Immunohistochemistry and Immunofluorescence and observed bleeding and integrity of the blood-brain barrier under microscope after making slices of brain tissue in rats. ResultsThe concentration of Au nanoparticles in CSF gradually increased and stabilized after 3 hours. Under TEM, a large amount of Au nanoparticles appeared in the brain tissue and there were some changes of the ultrastructure of the brain tissue. Under microscope, there were hemorrhages after blood-brain barrier in rats were stained by Prussian blue-positive dye and some brain blood vessels were damaged in the Immunofluorescence and Immunohistochemistry staining slice. ConclusionAu nanoparticles are able to permeate the brain-blood barrier and cause micro bleedings and micro damages of brain vessel.
【Key words】Nanoparticles; Blood-brain barrier; Rat; Transmission electron
DOI:10.3969/j.issn.0253-9802.2016.06.003
基金项目:广东省科技计划项目(2012B090600019)
通讯作者,顾怀宇,E-mail:gu_huaiyu@yahoo.com
Corresponding author, Gu Huaiyu, E-mail: gu_huaiyu@yahoo.com
(收稿日期:2016-03-25)(本文编辑:林燕薇)
·基础研究论著·
共同第一作者,何敏彤

