乳腺癌异常表达B7-H4对T细胞分泌细胞因子和凋亡的影响①
沈依帆 黄文炼 徐 曼 苏新良 王 欣 汪 涛
(重庆医科大学基础医学院病理教研室,分子医学与肿瘤研究中心,重庆400016)
乳腺癌异常表达B7-H4对T细胞分泌细胞因子和凋亡的影响①
沈依帆黄文炼徐曼苏新良②王欣汪涛
(重庆医科大学基础医学院病理教研室,分子医学与肿瘤研究中心,重庆400016)
[摘要]目的:探讨B7-H4在乳腺癌中的表达及其对外周血T细胞分泌细胞因子及增殖、凋亡的影响。方法:应用S-P免疫组化法检测B7-H4在乳腺浸润性癌、癌旁组织和纤维腺瘤的表达。流式细胞术分析B7-H4对乳腺癌患者外周血活化T细胞增殖和凋亡的作用。ELISA芯片检测T细胞培养上清液细胞因子的含量。结果:B7-H4在乳腺浸润性癌的阳性表达率为84.62%(44/52),显著高于癌旁组织和纤维腺瘤组织(P<0.01,P<0.01 )。体外淋巴细胞混合培养结果显示, 与空白组比较,B7-H4对乳腺癌患者外周血活化T细胞的增殖指数Ki67无明显影响;但B7-H4诱导CD8+T细胞凋亡的作用强于CD4+T 细胞。B7-H4组FOXP3+T/CD4+T也高于空白组(P<0.05 )。B7-H4组较空白组细胞培养上清液中TGF-β1、IL-17含量均显著增高 (P<0.05,P<0.05)。结论:乳腺浸润性癌异常表达B7-H4。B7-H4在体外能促进CD8+T细胞凋亡、促进T细胞分泌TGF-β1 和IL-17。B7-H4在削弱乳腺癌微环境的抗肿瘤细胞免疫中发挥一定作用。
[关键词]B7-H4;乳腺癌;CD8+T细胞;细胞凋亡;TGF-β1;IL-17
乳腺癌是女性常见的恶性肿瘤之一,其在我国的发病率和死亡率呈逐年上升趋势[1]。近年的研究表明,肿瘤微环境的抗肿瘤免疫抑制与负性共刺激分子B7家族成员表达上调,调节性T细胞(Tregs)的募集以及 转化生长因子-β(TGF-β )表达上调等因素有关[2]。负性共刺激分子B7家族成员包括B7-H1、B7-DC、B7-H4,它们能抑制T细胞活化、增殖从而负向调节T细胞免疫应答[3-5]。B7-H4在体内有两种存在形式,一种为细胞膜蛋白,另一种为血清中的可溶性蛋白。B7-H4蛋白仅低水平表达于几种正常组织,但在多种恶性肿瘤如肺癌、食管癌、胃癌、肝癌、乳腺癌、卵巢癌、前列腺癌和肾细胞癌中异常表达[6,7]。研究表明B7-H4过度表达与肿瘤微环境的免疫抑制及患者预后差有关[7-9]。血清的可溶性B7-H4水平与肿瘤分级、患者预后差以及肿瘤病理类型相关[10]。肿瘤微环境中抑制性细胞因子水平增高也是导致肿瘤免疫逃逸的原因之一[11,12]。肿瘤局部高水平的TGF-β可抑制或改变天然和获得性免疫细胞(包括NK细胞、巨噬细胞、中性粒细胞、CD4+T和CD8+T细胞)的活化、成熟及分化[13,14],从而有助于肿瘤细胞逃避患者体内的免疫监视[15]。白介素能促进肿瘤生长与转移,以IL-17最为典型,它可通过招募髓源性抑制细胞(MDSCs)到肿瘤局部抑制抗肿瘤免疫 从而促进肿瘤的生长[16]。为了探讨B7-H4在浸润性乳腺癌的表达及其对乳癌患者外周血T淋巴细胞的作用,本实验采用免疫组化法观察了B7-H4在乳腺癌组织中的表达,流式细胞术和ELISA芯片检测了B7-H4对乳腺癌患者外周血T淋巴细胞的增殖、凋亡及细胞因子分泌情况的影响。
1材料与方法
1.1材料
1.1.1材料来源52例乳腺浸润性癌患者及10例乳腺纤维腺瘤的手术切除标本,均取自2012年~2014年重庆医科大学附属第一医院病理科,术前未行放疗或化疗。患者年龄30~76岁,平均(50.1±11.6岁)。10例乳腺癌患者外周血10~15 ml,由重庆医科大学附属第一医院内分泌乳腺外科收治的患者知情捐赠。
1.1.2实验试剂兔抗人B7-H4购自北京博奥森生物公司;重组人B7-H4蛋白购自美国R&D公司;人淋巴细胞分离液购自天津灏洋生物公司;尼龙毛购自德国KISKER公司;Annexin V-PE/7-ADD细胞凋亡检测试剂盒购自南京凯基生物公司;ELISA定量抗体芯片购自广州RayBiotech公司;鼠抗人Ki67-PE、抗人CD4-FITC、抗人CD8-FITC、抗人CD3-PE、抗人CD8-PE、抗人CD25-TRITC、抗人FOXP3-PE均购自美国eBioscience 公司。
1.2实验方法
1.2.1S-P免疫组化染色及结果判断石蜡切片常规脱蜡水化,柠檬酸钠缓冲液(pH6.0)微波抗原修复,内源性过氧化物酶阻断10 min,经10%正常山羊血清封闭30 min后,加B7-H4(1∶100)4℃孵育过夜,37℃复温30 min后加二抗孵育30 min,链霉菌抗生物素-过氧化物酶孵育30 min,DAB显色、苏木素复染后树胶封片。以PBS代替一抗为阴性对照。结果判断:B7-H4在胞膜、胞浆染色。细胞染色比例:无阳性细胞为0 分,阳性细胞数<10%为1 分,11%~50%为2 分,51%~75%为3 分,>75%为4 分;细胞染色强度:无着色为0 分,淡黄色为1 分,棕黄色为2 分,棕褐色为3 分。两项得分相乘结果>3 分为阳性表达病例,≤3 分为阴性表达病例。
1.2.2分离外周血T细胞与重组B7-H4蛋白共培养将乳癌患者的新鲜抗凝外周血用人淋巴细胞分离液梯度离心后获得单个核细胞,再经尼龙毛柱分离T细胞,将T细胞加入RPMI1640 (含10% 小牛血清)和PHA (5~10 μg/ml )于37℃、5% CO2孵箱内培养48 h后,流式细胞术检测T细胞增殖、凋亡和FOXP3+T/CD4+T细胞。
1.2.2.1 FCM检测T细胞增殖指数分别收集B7-H4组和空白对照组外周血活化T细胞,将抗CD4-FITC或抗CD8-FITC与抗Ki67-PE室温孵育15 min后,检测CD4+T或 CD8+T细胞Ki67阳性率。
1.2.2.2FCM检测T细胞凋亡B7-H4组和空白对照组T细胞, 避光滴加Annexin V-PE/7-AAD及抗人CD4-FITC和(或)抗人CD8-PE(FITC)、抗人CD3-PE抗体孵育20 min 后,PBS 缓冲液洗2次,5 min/次,流式细胞仪检测。
1.2.2.3FCM检测CD25+FOXP3+T/CD4+T细胞B7-H4组和空白对照T细胞, 避光滴加抗人CD25-TRITC、抗人FOXP3-PE、抗人CD4-FITC抗体孵育20 min后,PBS缓冲液洗3次后,流式细胞仪检测CD4+T细胞和CD4+CD25+FOXP3+T细胞比例。
1.2.2.4ELISA芯片检测细胞因子含量收集上述各组细胞培养48 h后的上清液,按说明书将每张芯片内加入200 μl T细胞培养上清液,室温摇床孵育2 h; 加入洗液200 μl洗液Ⅰ摇床震荡清洗3次,每次5 min;再用200 μl洗液Ⅱ 摇床震荡清洗2次,每次5 min;弃去洗液后加入生物素标记的细胞因子抗体室温摇床孵育2 h,如前清洗后与检测液C和D的混合液500 μl室温震荡2 min后放入蛋白芯片检测仪进行分析。
2结果
2.1B7-H4在乳腺浸润性癌、癌旁组织和纤维腺瘤的表达乳腺纤维腺瘤、乳腺癌旁组织中,B7-H4在腺泡细胞的顶部和末梢导管上皮呈阴性或弱阳性表达,阳性率分别为20% (2/10) 和30%(3/10) 。在乳腺浸润性癌癌细胞胞浆和胞膜的阳性表达率为84.62%(44/52),显著高于癌旁组织和纤维腺瘤组织(P<0.01,P<0.01 );而乳腺纤维腺瘤和癌旁组织的表达无明显差异(P>0.05 )(表1,图1)。
2.2重组B7-H4对乳腺癌患者外周血T细胞增殖的影响重组B7-H4与乳腺癌患者外周血活化T淋巴细胞混合培养48 h后,流式细胞术检测结果显示乳腺癌患者B7-H4组CD4+T和CD8+T细胞的Ki67指数分别为(16.08±3.24%)和(9.81±1.58%) ,而空白对照组为(15.04±2.32%)和(11.24±2.72%),两组间无明显差别(P>0.05,P>0.05) (图2)。
表1B7-H4在乳腺浸润性癌、癌旁组织和纤维腺瘤的表达
Tab.1B7-H4 expression in breast carcinomas, peri-carcinoma tissues and fibroadenomas
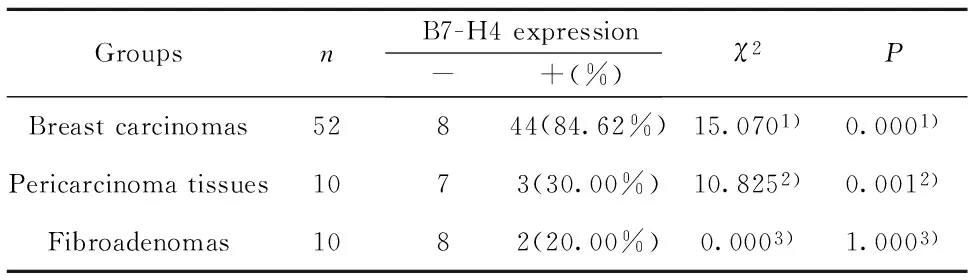
GroupsnB7-H4expression-+(%)χ2PBreastcarcinomas52844(84.62%)15.0701)0.0001)Pericarcinomatissues1073(30.00%)10.8252)0.0012)Fibroadenomas1082(20.00%)0.0003)1.0003)
Note:1)breast carcinomas and fibroadenomas; 2)breast carcinomas and peri-carcinoma tissues;3)peri-carcinoma tissues and fibroadenomas.
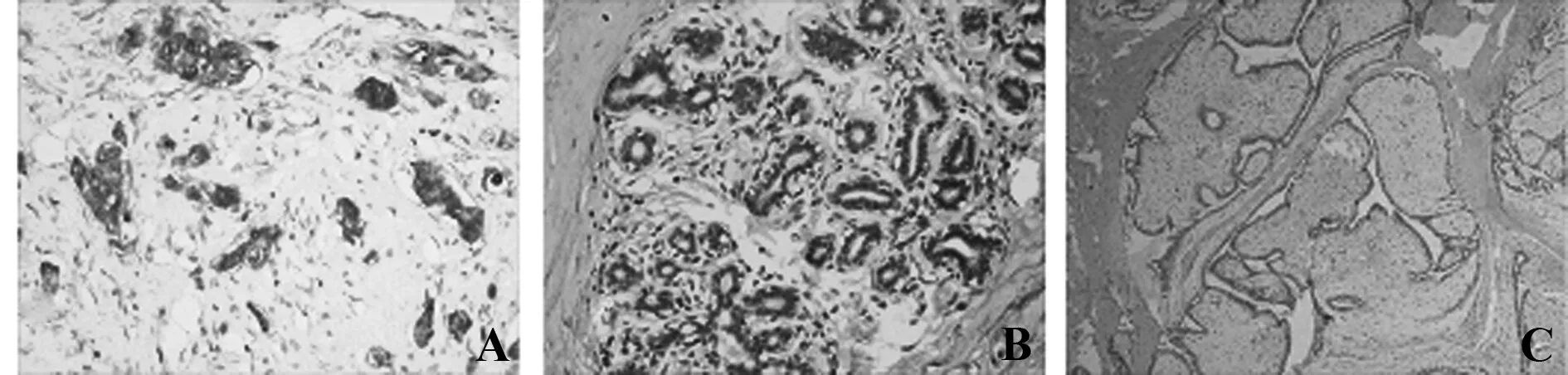
图1 B7-H4在乳腺浸润性癌、癌旁组织和纤维腺瘤的表达Fig.1 B7-H4 expression in breast carcinomas,pericarci-noma tissues and fibroadenomasNote: A.Positive B7-H4 expression in breast carcinoma(IHC,×400);B.Weak B7-H4 expression in epithelium of peri-carcinoma tissue(IHC,×400);C.Negative B7-H4 expression in fibroadenoma(IHC,×100 ).
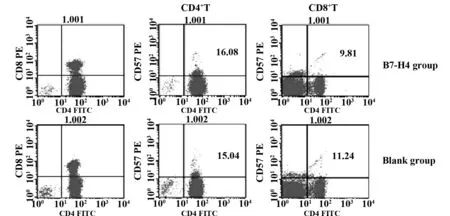
图2 混合培养T淋巴细胞的Ki67指数Fig.2 Ki67 positive rates of co-cultured T cells
2.3重组B7-H4对乳腺癌患者外周血T细胞凋亡的影响重组B7-H4与乳腺癌患者外周血活化T淋巴细胞混合培养48 h后,总T细胞凋亡率较空白组增高,分别是(17.6± 3.39)%和(14.8± 3.98)%。进一步分析发现B7-H4组和空白组CD8+T细胞凋亡率分别为(21.3±2.24)%和(10.2±1.36)%,两组间差异显著(P<0.05),而B7-H4组CD4+T细胞的凋亡率较空白组低,凋亡率分别为(10.3±2.45)%和(13.1±2.37)%,但两组间无统计学差异(P>0.05) (图3)。
2.4重组B7-H4对乳癌患者FOXP3+T细胞的影响重组B7-H4与乳腺腺癌患者外周血T淋巴细胞混合培养48 h后,CD25+FOXP3+T细胞在CD4+T细胞中所占的比例明显高于空白对照组,分别为(52.07±5.48)%和(4.12±1.25)%(P<0.05) (图4)。
2.5重组B7-H4对T细胞分泌细胞因子的影响重组B7-H4与乳腺癌患者外周血活化T细胞混合培养48 h后,定量ELISA芯片检测到培养上清液中GM-CSF、IL-1β 、IL-6、IL-17F和IL-23的含量与空白对照组无明显差异;但B7-H4组和空白组TGF-β1的含量分别为1 194.17±165.21和588.57±146.20;IL-17的含量分别为1 122.40± 221.79及555.17± 108.42。B7-H4组TGF-β1 和IL-17均显著高于空白组(P<0.05,P<0.05)(图5)。

图3 乳腺癌患者外周血T淋巴细胞凋亡Fig.3 Apoptosis of peripheral blood T lymphocytes for breast cancer patient
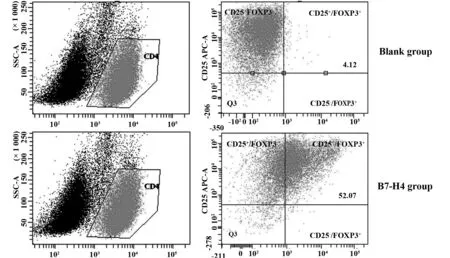
图4 B7-H4混合培养T细胞中的CD25+FOXP3+T细胞Fig.4 CD25+FOXP3+T cells in co-cultured T cells with B7-H4
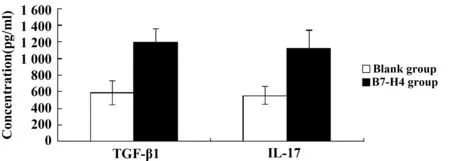
图5 T淋巴细胞培养上清液TGF-β1和IL-17含量Fig.5 Concentration of TGF-β1 and IL-17 in supernatant of cultured T lymphocytes
3讨论
本实验观察到B7-H4在84.62% 的乳腺浸润性癌细胞异常高表达,在癌旁组织及乳腺纤维腺瘤中无表达或微弱表达。因肿瘤细胞的跨膜B7-H4蛋白不稳定且可被诱导生成,文献也报道肿瘤患者血清中可溶性B7-H4蛋白的水平与预后差有关[10],因而我们将重组人B7-H4蛋白与乳腺浸润性癌患者外周血经PHA活化的T淋巴细胞混合培养,流式细胞术观察到B7-H4组和空白对照组CD4+T、CD8+T细胞Ki67指数无明显差别,提示B7-H4抑制T 细胞增殖的影响作用不明显。Kristensen等[17]在对正常小鼠肠系膜淋巴结T细胞的研究也发现B7-H4对T细胞增殖无抑制作用;然而Wang等人发现B7-H4蛋白能抑制鼠CD4+T和CD8+T细胞的增殖,通过干扰ERK、P38、JNK蛋白激酶的活性以及T细胞的AKT通路[18],我们考虑出现上述差异性结果可能与B7-H4蛋白和T细胞的种系来源不同有关。在分析CD8+T和CD4+T细胞亚群的凋亡率时,我们发现B7-H4对乳腺癌患者CD8+T细胞有明显的促凋亡作用,但对CD4+T 细胞作用较小。CD4+T和CD8+T细胞是T细胞的两个重要亚群,CD8+T细胞作为抗肿瘤效应细胞,其数量和功能决定着宿主肿瘤局部的抗肿瘤免疫水平。本研究结果证实B7-H4促进CD8+T细胞凋亡,从而削弱了CD8+T细胞在肿瘤微环境的抗肿瘤作用。
FOXP3+Tregs 是重要的负性免疫调节细胞,通过与细胞直接接触或分泌TGF-β1及IL-10等抑制性细胞因子而抑制免疫细胞功能[19],是影响乳腺癌患者预后的独立因子[20]。本实验采用流式细胞术分析了B7-H4对乳腺癌患者外周血FOXP3+T/CD4+T 的影响,结果显示B7-H4组FOXP3+T/CD4+T 显著高于空白组,结合前期发现B7-H4组CD4+T细胞的Ki67指数略高于空白对照组,但凋亡率反而较空白对照组低,我们推测B7-H4可能直接或间接刺激Treg细胞增殖或抑制其凋亡,从而导致乳腺癌患者体内的CD4+CD25+Treg细胞增多。Kristensen等也发现B7-H4融合蛋白可增加小鼠体内Tregs的功能活性[17]。
因T细胞分泌的细胞因子可反映其免疫活性,我们用定量ELISA芯片检测与B7-H4共培养的乳腺浸润癌患者外周血T细胞上清液的细胞因子含量,发现B7-H4组T细胞分泌TGF-β1和IL-17的量明显高于空白对照组。虽然TGF-β1和IL-17在肿瘤发生发展过程发挥的作用尚有争议,但众多研究结果支持两者是免疫抑制细胞因子。TGF-β1不仅在诱导Tregs细胞分化过程中起重要作用[21],还通过减少肿瘤微环境CD8+T、CD4+T和DCs浸润数量、促进血管生成来抑制免疫应答,最终促进肿瘤进展[2]。IL-17 可以上调单核细胞表面的共抑制分子B7-H1 从而抑制抗肿瘤细胞毒T细胞应答[21],也可通过招募髓源性抑制细胞到肿瘤局部发挥免疫抑制作用,从而间接促进肿瘤生长[16]。
总之,我们的研究结果表明B7-H4在乳腺浸润性癌中异常高表达,并可促进CD8+T细胞凋亡,诱导T细胞分泌免疫抑制细胞因子TGF-β1和IL-17。B7-H4在抑制乳腺癌微环境的抗肿瘤免疫应答中发挥重要作用,有可能成为新的抗肿瘤治疗靶点。
参考文献:
[1]郑莹,吴春晓,张敏璐.乳腺癌在中国的流行状况和疾病特征[J].中国癌症杂志,2013,23(8):561-569.
[2]Du C,Wang YZ.The immunoregulatory mechanisms of carcinoma for its survival and development[J].J Exp Clin Cancer Res,2011,30:1-12.
[3]Lu B,Chen L,Liu L,etal.T-cell-mediated tumor immune surveillance and expression of B7 co-inhibitory molecules in cancers of the upper gastrointestinal tract[J].Immunol Res,2011,50(2-3):269-275.
[4]Kryczek I,Wei S,Zhu G,etal.Relationship between B7-H4,regulatory T cells,and patient outcome in human ovarian carcinoma[J].Cancer Res,2007,67(18):8900-8905.
[5]Miyatake T,Tringler B,Liu W,etal.B7-H4(DD-O1l0) is overexpressed in high risk uterine endometrioid adenocarcinomas and inversely correlated with tumor T-cell infiltration[J].Gynecol Oncol,2007,106(1):119-127.
[6]Salceda S,Tang T,Kmet M,etal.The immunomodulatory protein B7-H4 is overexpressed in breast and ovarian cancers and promotes epithelial cell transformation[J].Exp Cell Res,2005,306(1):128-141.
[7]Arigami T,Uenosono Y,Ishigami S,etal.Clinical significance of the B7-H4 coregulatory molecule as a novel prognostic marker in gastric cancer[J].World J Surg,2011,35(9):2051-2057.
[8]Chen LJ,Sun J,Wu HY,etal.B7-H4 expression associates with cancer progression and predicts patient′s survival in human esophageal squamous cell carcinoma[J].Cancer Immunol Immunother,2011,60(7):1047-1055.
[9]Liu W,Shibata K,Koya Y,etal.B7-H4 overexpression correlates with a poor prognosis for cervical cancer patients[J].Mol Clin Oncol,2014,2(2):219-225.
[10]He C,Qiao H,Jiang H,etal.The inhibitory role of b7-h4 in antitumor immunity:association with cancer progression and survival[J].Clin Dev Immunol,2011,2011:1-8.
[11]Manjili MH,Egilmez N,Knutson KL,etal.Tumor escape and progression under immune pressure[J].Clin Dev Immunol,2012,2012:1-2.
[12]Hchst B,Diehl L.Antigen shedding into the circulation contributes to tumor immune escape[J].Oncoimmunology,2012,1(9):1620-1622.
[13]Li MO,Flavell RA.TGF-beta,T-cell tolerance and immunotherapy of autoimmune diseases and cancer[J].Expert Rev Clin Immunol,2006,2(2):257-265.
[14]Wrzesinski SH,Wan YY,Flavell RA.Transforming growth factor-beta and the immune response:implications for anticancer therapy[J].Clin Cancer Res,2007,13(18 Pt 1):5262-5270.
[15]Wojtowicz-Praga S.Reversal of tumor-induced immunosuppression by TGF-beta inhibitors[J].Invest New Drugs,2003,21(1):21-32.
[16]He D,Li H,Yusuf N,etal.IL-17 promotes tumor development through the induction of tumor promoting microenvironments at tumor sites and myeloid-derived suppressor cells[J].J Immunol,2010,184(5):2281-2288.
[17]Kristensen NN,Schmidt EG,Rasmussen S,etal.B7-H4-Ig treatment of normal mice changes lymphocyte homeostasis and increases the potential of regulatory T cells[J].Immunopharmacol Immunotoxicol,2013,35(4):505-513.
[18]Wang X,Hao J,Metzger DL,etal.B7-H4 treatment of T cells inhibits ERK,JNK,p38,and AKT activation[J].PLoS One,2012,7(1):e28232.
[19]Strauss L,Bergmann C,Szczepanski M,etal.A unique subset of CD4+CD25highFoxp3+T cells secreting interleukin-10 and transforming growth factor-beta1 mediates suppression in the tumor microenvironment[J].Clin Cancer Res,2007,13(15 Pt 1):4345-4354.
[20]Andrea Merlo,Patrizia Casalini,Maria Luisa Carcangiu,etal.FOXP3 expression and overall survival in breast cancer[J].J Clin Oncol,2009,27(11):1746-1752.
[21]Li YQ,Liu FF,Zhang XM,etal.Tumor secretion of CCL22 activates intratumoral Treg infiltration and is independent prognostic predictor of breast cancer[J].PLoS One,2013,8(10):e76379.
[21]Zhao Q,Xiao X,Wu Y,etal.Interleukin-17-educated monocytes suppress cytotoxic T-cell function through B7-H1 in hepatocellular carcinoma patients[J].Eur J Immunol,2011,41(8):2314-2322.
[收稿2015-09-22]
(编辑张晓舟)
B7-H4 expression in human breast carcinoma and its role on cytokine secretion and apoptosis of peripheral blood T cells
SHEN Yi-Fan,HUANG Wen-Lian,XU Man,SU Xin-Liang,WANG Tao.
Department of Pathology,Molecular Medicine and Tumor Research Center of Chongqing Medical University,Chongqing 400016,China
[Abstract]Objective:To explore B7-H4 expression in human invasive breast carcinomas and study the effect of recombinant human B7-H4 protein on the active peripheral blood T lymphocytes of the patients in vitro.Methods: B7-H4 expression was detected in 52 cases of breast cancer with immunohistochemistry staining.After the activated peripheral blood T lymphocytes of breast cancer patients were co-cultured with B7-H4,the proliferation,apoptosis and cell subtypes were tested by FCM,and the concentration of cytokines in the supernatant were detected by ELISA microarray.Results: B7-H4 was expressed in 84.62% (44/52) of invasive breast cancers,with the positive rates significantly higher than that of fibroadenomas and the adjacent tissues of breast cancers(P<0.01,P<0.01).There were no significant differences of Ki67 positive rates of T cells between B7-H4 groups and blank groups;however,B7-H4 played stronger role in promoting apoptosis of CD8+T cells than that of CD4+T cells.The rate of FOXP3+T/CD4+T cells in B7-H4 groups were higher than that of blank groups(P<0.05).The concentration of TGF-β1 and IL-17 in the supernatant of B7-H4 co-cultured T cells were significantly higher than that of blank groups(P<0.05,P<0.05) .Conclusion: B7-H4 overexpresses in invasive breast carcinomas.In vitro,B7-H4 promotes apoptosis of CD8+T cells,and the secretion of IL-17 and TGF-β1 by T cells .B7-H4 plays a role in weakening anti-tumor T cell immune response of the breast cancer microenviroment.
[Key words]B7-H4;Breast carcinoma;CD8+T;Apoptosis;TGF-β1;IL-17
doi:10.3969/j.issn.1000-484X.2016.06.021
作者简介:沈依帆(1990年-),女,在读硕士,主要从事肿瘤病理与肿瘤免疫学研究,E-mail:shenyifan1990@126.com。 通讯作者及指导教师:徐曼(1964年-),女,教授,硕士生导师,主要从事肿瘤病理与肿瘤免疫学研究,E-mail:2402316007@qq.com。
中图分类号R737.9
文献标志码A
文章编号1000-484X(2016)06-0867-05
①本文为重庆市自然科学基金(CSTC2009BB5268)项目。
②重庆医科大学附属第一医院内分泌乳腺外科,重庆400016。