溶磷菌对铅胁迫下杏鲍菇氧化应激反应的影响
何难徐恒
(1.成都中医药大学医学技术学院,成都 611137;2.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,成都 610064)
溶磷菌对铅胁迫下杏鲍菇氧化应激反应的影响
何难1,2徐恒2
(1.成都中医药大学医学技术学院,成都 611137;2.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,成都 610064)
选择使用杏鲍菇菌丝富集重金属Pb2+,从本实验室菌种库中筛选出了8株能抗800 mg/L Pb2+的菌株。通过对其溶磷能力的检测,从中筛选到了2株溶磷能力较强的菌株CG8、FFT1以及2株溶磷能力较弱的菌株FFC6、FFC11,经16S rDNA序列分析鉴定,CG8为克雷伯菌(Klebsiella sp.),FFT1为假单胞菌(Pseudomonas sp.),FFC6和FFC11为芽孢杆菌(Bacillus sp.),其序列相似度均达99%。随后,研究了4株溶磷菌株对液体培养(Pb)条件下杏鲍菇(Pleurotus eryngii)菌丝的生物量、Pb富集量、脂质过氧化、巯基蛋白含量和抗氧化酶的影响。结果显示,在Pb胁迫条件下,具溶磷能力的菌株能在一定程度上增加菌丝生物量,促进菌丝对重金属的富集,同时,使菌丝的丙二醛(MDA)含量降低,菌丝抗氧化酶(SOD)和氧化物酶(POD)活性显著降低,菌丝巯基蛋白含量升高。实验证明,微生物溶磷能力可有效减轻重金属对杏鲍菇菌丝的毒害和重金属诱导的氧化胁迫。并且溶磷能力较强的菌株(CG8)对杏鲍菇菌丝富集与抵抗重金属诱导的氧化胁迫有更为明显的作用,重金属富集量增加96.1%,巯基蛋白增加量为91.3%。
蕈菌;重金属;溶磷能力;抗氧化系统
现代社会工业技术的飞速发展也带来了重大的环境污染问题。由于冶炼、化工、矿产、制革、电池、造纸、农药等行业的兴起与发展,越来越多的重金属直接排入环境中,造成污染[1]。Pb正是其中一种毒性极强,污染范围极广的危险元素。大量无节制的污染排放大大提高了土壤中Pb浓度,据报道,我国众多城市都存在着土壤铅浓度超标的问题[2-4]。同样的报道也表明了其他国家存在相同的Pb污染问题,植物的正常含Pb量为0.05-3 mg/kg,而世界土壤含Pb量通常在2-200 mg/kg之间,平均含Pb量为15 mg/kg,远高于正常值[5]。作为高毒性重金属,Pb对植物、动物以及人类都产生巨大的危害。铅不仅会危害人体中枢神经系统,还会损害肾脏、肝脏、生殖系统、大脑功能和基本的细胞内反应[6]。因此,对土壤中Pb污染的治理,是当代环境污染研究治理的重点。对比传统的物理及化学治理手段,生物修复具有更高效,更环保,更廉价的优势,因此受到越来越多的关注与重视。1983 年美国科学家Chaney首次提出了能够利用富集重金属的植物来清除土壤重金属污染的设想。至今已有多种生物被应用于土壤重金属修复[7-9]。蕈菌作为大型真菌,对重金属也有极强的耐受和富集能力。有研究表明,香菇等丝状真菌对钙、锌、硒等元素有更高富集率[10-12]。
Pb作为非氧化还原金属,无法参与芬顿反应,但会导致土壤中生物体形成活性氧(ROS),如过氧化氢、过氧化物、羟基自由基等[13,14]。而生物体细胞和组织针对氧化损伤,会利用酶或非酶机制,例如:氧化酶(POD)、超氧化物歧化酶(SOD)、过氧化物酶(CAT)以及谷胱甘肽等[15]。关于土壤中生物体对于铅耐受而产生的氧化应激反应的研究也有许多。Wang等[16]对土壤Pb污染环境下,番茄幼苗抗氧化体系的丙二醛(MAD)、SOD变化进行研究,添加Pb后,发现O2-浓度升高,SOD两个同工酶波段增加,以抵抗氧化损伤。陈兰等[17]研究证明在Pb耐受状态下,长根菇菌丝体CAT与SOD酶活性均有提高[1.131 U/g(Pb(Ⅱ),100 mg/L),13.976 U/g(Pb(Ⅱ),200 mg/L)]。
在土壤中,不溶性磷化合物可以被植物和微生物代谢产生的有机酸、可溶性磷酸酶和络合剂所溶解[18]。如溶磷细菌(PSB)已表明可增强对不溶性磷化合物的溶解,并且已广泛应用于增加磷吸收并提高作物产量之中[19];PSB也可溶解部分难溶性重金属磷酸盐,使重金属易于被提取,从而修复重金属污染土地[20]。Jin等[21]对溶磷菌对土壤中Pb的固定化能力进行了研究,结果表明,其具有一定的重金属修复能力。Seulki等[22]对比了未接种与接种PBS的芥菜与苘麻对Cd污染土壤的耐受能力,结果表明植株生物量由0.087 g上升到0.448 g。
本实验从土壤中筛选出的抗高浓度Pb的细菌库中选取4株具有不同溶磷能力细菌(PSB),重点讨论溶磷菌溶磷能力的强弱对Pb胁迫条件下,杏鲍菇菌丝生物量、重金属富集量、丙二醛(MDA,指示脂质过氧化程度的生物标记分子)含量、总巯基蛋白(TSH)和氧化酶体系(SOD、POD)含量的差异,研究其对实验室模拟土壤条件下杏鲍菇(Pleurotus eryngii)菌丝的生长促进不同影响以及对铅毒性的减轻作用。
1 材料与方法
1.1 材料
1.1.1 培养基 SLP液体培养基:1%蔗糖;0.1%(NH4)2SO4;0.05% K2HPO4;0.05% MgSO4;0.01% NaCl;0.05%酵母浸出物;pH7.2。若配置固体培养基则需要加入1%的琼脂粉。
Pb抗性培养基:在SLP固体培养基中加入相应的Pb(NO3)2溶液即可。
蒙金娜无机固体培养基(检测溶磷能力):1%葡萄糖,0.03%氯化钠,0.05%硫酸铵,0.003%七水合硫酸亚铁,1%磷酸三钙(研磨),0.003%四水合硫酸锰,0.04%酵母浸出物,1%琼脂粉,pH7.2。
蒙金娜摇瓶培养基:以蒙金娜固体培养基不加入琼脂粉即可。
PDA培养基:马铃薯煮沸滤液20%,葡萄糖2%,琼脂1%,自然pH。
1.1.2 试剂 重金属溶液:配制重金属Pb(Pb(NO3)2)浓度为20 g/L的母液,高温灭菌后闭光保存。
酶与蛋白等检测溶液:1.0 mol/L Tris母液配制:1.0 mol/L pH8.2 Tris-Cl:12.11 g Tris(wm:121.14),3.8 mL浓盐酸,调节pH至8.2,定容至100 mL。
10 mmol/L DTNB标准溶液(Ellman’s试剂):准确称取0.198 175 g DTNB用 50 mmol/L Na2HPO4(pH7.0)配制成50 mL溶液,存放于棕色瓶中,于暗处低温保存备用。
0.2 mol/L PB母液(pH7.2):0.2 mol/L NaH2PO425 mL,0.2 mol/L Na2HPO4,75 mL,即可配成100 mL pH7.2,0.2 mol/L磷酸钠缓冲液。
0.2 mol/L磷酸钾缓冲液母液(pH7.0):配制0.2 mol/L KH2PO4溶液,用KOH调节pH7.0即可。
1.2 方法
1.2.1 铅抗性及溶磷能力细菌的筛选 使用蔗糖-低磷酸盐培养基(SLP)培养基,筛选实验室重金属抗性菌株细菌库,得到8株高抗Pb性细菌(800 mg/L Pb)。
将分离获得的菌株保存在斜面培养基上,活化2-3代,然后分别点接种于蒙金娜无机固体培养基,置于30℃培养箱中培养10 d,观察有无溶磷圈以及溶磷圈大小,初步得到4株具有溶磷性的细菌菌株。
将上述4株细菌制成108cell/mL的菌悬液(OD660nm=0.5),取1 mL磷细菌液接种于30 mL摇瓶培养基中,对照组接1 mL无菌水,接种后160 r/min 28℃,振荡培养6 d。培养好的磷细菌液在4℃ 离心(10 000 r/min)15 min,取上清液定容至50 mL,钼蓝比色法测定培养液中所含磷。沉淀经溶菌液处理,37℃水浴1 h,4℃离心(10 000 r/min)15 min,取上清液定容至50 mL,测定菌体吸收磷含量。
1.2.2 菌株鉴定 菌株鉴定均采用16S rDNA基因序列。菌落PCR采用LB液体培养基中活细胞直接作为模板序列,引物为细菌通用引物:27 f(5'-GAGTTTGATCACTGGCTCAG-3')和1492 r(5'-TACGGCTACCTTGTTACGACTT-3')[23]。PCR体 系(50 μL)为:1 μL菌液,5 μL 10×PCR buffer(Mg2+),3 μL 25 mmol/L MgCl2,4 μL 2.5 mmol/L dNTP, 20 μmol/L上、下游引物各2 μL,0.25 μL 5 Taq DNA聚合酶和32.75 μL无菌水。PCR仪器型号为PTC-200,Bio-Rad,USA,PCR程序参照Jiang等[24]方法。PCR产物经DNA纯化试剂盒(TaKaRa)纯化后,送上海英骏生物技术公司测序。所得16S rDNA序列采用NCBI Blast程序与GenBank数据库中序列进行比对。
1.2.3 菌丝培养 将4株溶磷菌制备为108cell/mL菌悬液,稀释105倍后取0.1 mL加入50℃未凝固PDA液体中,待凝固后接种培养菌丝,并设置不同重金属浓度以及不同溶磷菌种溶磷液培养组。24℃静置培养20 d后,真空抽滤得菌丝体。其中一半烘干后测生物量干重与重金属含量,另一半经液氮冷却后检测抗氧化酶类、MDA和总巯基含量。
1.2.4 菌丝金属富集量检测 菌丝经烘箱烘干后磨成粉末,用浓HNO3和30% H2O2(5∶2,V/V)进行微波消解,去离子水精确定容至25 mL后,用火焰原子吸收光谱法(AAS;VARIAN,SpectrAA-220Fs)测定Pb含量。
1.2.5 杏鲍菇SOD、POD、MDA以及TSH含量测定 杏鲍菇菌丝,先用去离子水洗净,取 1 g,混合2 g石英砂,液氮研磨至白色微粉为止,用20 mmol/L Tris-EDTA(EDTA:1 mmol/L)悬浮,3.5 mL/1 g菌丝体(0.7 mL/0.2 g)。6 200×g,10 min,4℃,取上清(0.6 mL),17 000×g,(50+15)min,4℃,均取上清(0.55 mL,0.5 mL),0.45 μm滤膜过滤,冰上保存至使用。SOD酶活性检测采用Beauchamp和Fridovich的方法[25]。POD酶活性检测采用Omran的方法[26]。杏鲍菇MDA用硫代巴比氏酸(TBA)法[27]测定,通过检测脂质过氧化反应的终产物MDA含量进行表征。MDA浓度由155 mM-1cm-1消光系数计算,单位为mmol/g鲜重。TSH含量采用Guimaraes等[28]的方法,其中待用溶液配制如上所述。
1.2.6 数据分析 对数据进行方差分析(ANOVA)后,采用Student-Newman-Keuls test(P<0.05)对包括对照组在内的各处理组进行均值比较,采用Dunnett t-test(2-sided,P<0.05)对处理组与对照组进行均值比较。包括相关性分析在内的所有的统计分析均在PASW Statistics 18.0上进行。
2 结果
2.1 铅抗性及溶磷能力细菌的筛选
共筛选出4株具有不同溶磷能力及具有铅抗性的细菌(CG8、FFT1、FFC6、FFC11),菌株提取16S DNA测序后,BLAST对比鉴定亲缘性,结果(表1)显示,菌株CG8为克雷伯菌(Klebsiella sp.),FFT1为假单胞菌(Pseudomonas sp.),FFC6和FFC11均为芽孢杆菌(Bacillus sp.),其序列相似度均达到99%。

表1 菌株鉴定及其溶磷量
2.2 溶磷菌对杏鲍菇菌丝生长的影响
Pb胁迫下,添加与未添加PSB的杏鲍菇菌丝生长结果(表2)显示,溶磷菌对杏鲍菇菌丝的生长有一定程度的促进作用。其中CG8在低浓度P b(50 mg/L)与高浓度Pb(100 mg/L)环境下都表现出最强的促进作用,分别提高了35.8%和9.7%的生物量。而且所有溶磷菌均在较低浓度Pb(50 mg/L)环境下表现出更强的促生长作用。
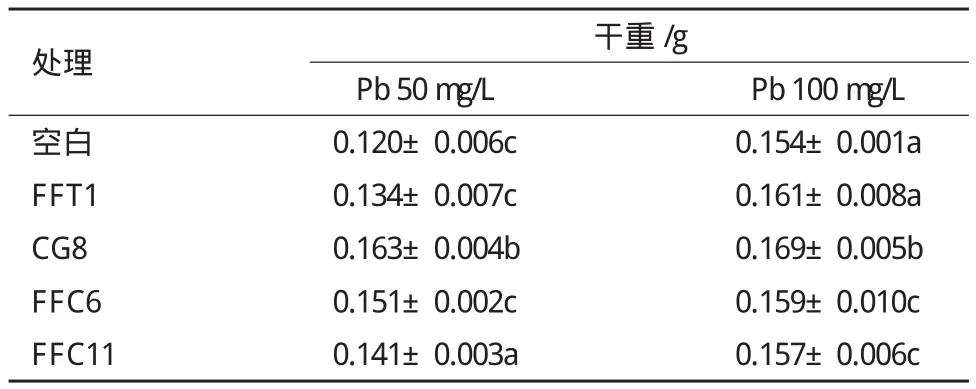
表2 溶磷菌对杏鲍菇菌丝生长的影响
2.3 溶磷菌对杏鲍菇菌丝富集Pb能力的影响
检测添加与未添加PSB杏鲍菇菌丝富集Pb的含量,结果(表3)显示,在溶磷菌影响下的杏鲍菇菌丝具有更强的Pb富集能力。其中CG8表现出最强的增强效果,在低浓度Pb(50 mg/L)与高浓度Pb(100 mg/L)环境下分别对杏鲍菇对Pb的富集量提高了96.1%和110.6%。而在高浓度Pb(100 mg/L)环境下各溶磷菌对杏鲍菇菌丝对Pb富集效果的提高表现更佳。
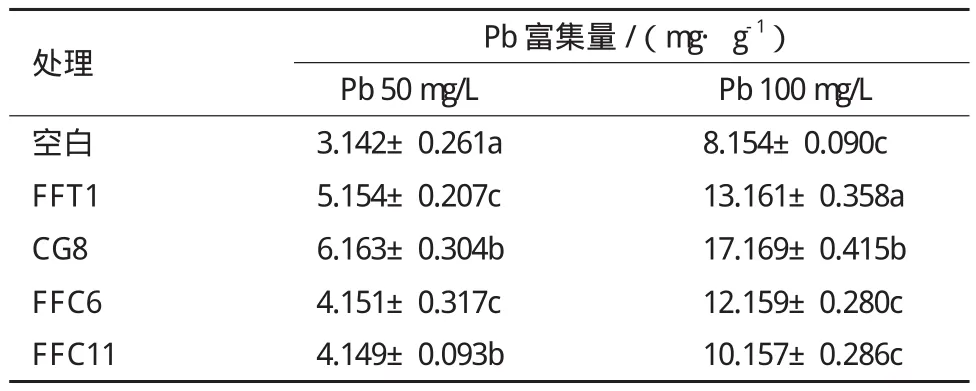
表3 溶磷菌对杏鲍菇菌丝富集Pb能力的影响
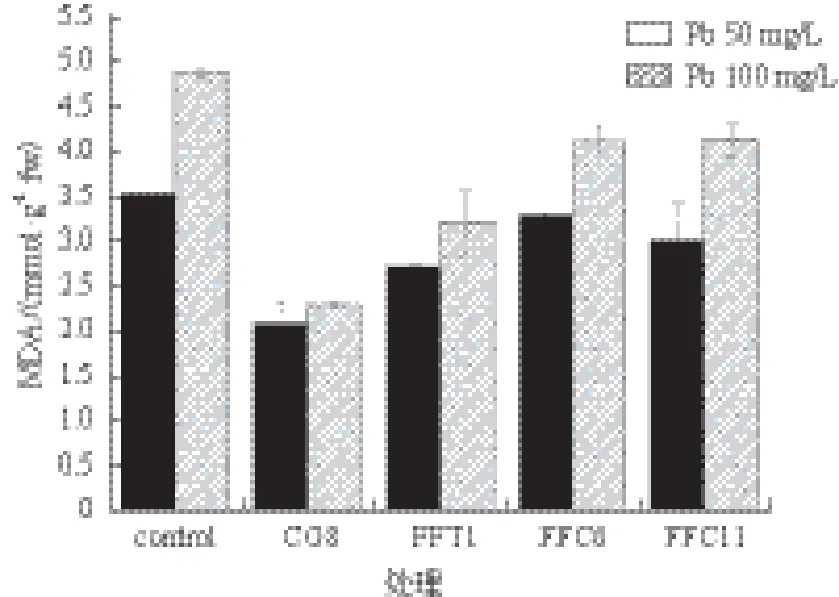
图1 溶磷菌对杏鲍菇菌丝MDA活性的影响
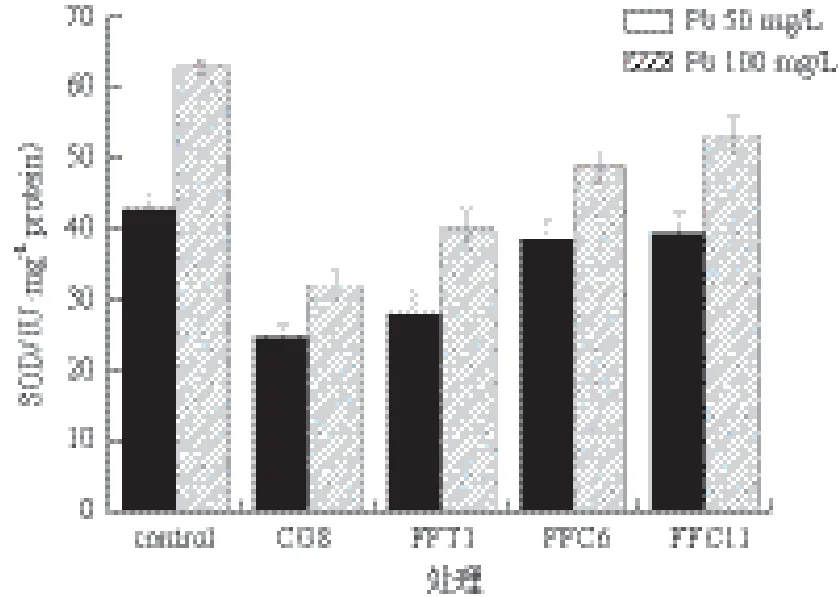
图2 溶磷菌对杏鲍菇菌丝SOD活性的影响
2.4 溶磷菌对杏鲍菇菌丝MAD、SOD、POD、TSH的影响
本实验中,菌丝在高浓度Pb(100 mg/L)胁迫下体内所含MDA含量高于低浓度(Pb 50 mg/L)胁迫下MDA含量。在溶磷菌辅助作用下,杏鲍菇菌丝体MAD含量比对照组显著降低(图1)。经溶磷菌处理的菌丝体MAD含量最高可降低52.9%(Pb 100 mg/L,CG8处理),最低也可降低14.2%(Pb 50 mg/L,FFC11处理)。图2显示,杏鲍菇菌丝体在溶磷菌影响下机体产生的SOD含量有明显降低,其中CG8菌表现的能力最强,SOD含量分别降低44.2%(Pb 50 mg/L)及49.2%(Pb 100 mg/L)。图3显示,溶磷菌还有辅助机体降低POD的能力,POD含量最高可降低59.1%(Pb 100 mg/L,CG8处理)。同时溶磷菌还具有增强杏鲍菇机体产生巯基蛋白的能力(图4)。
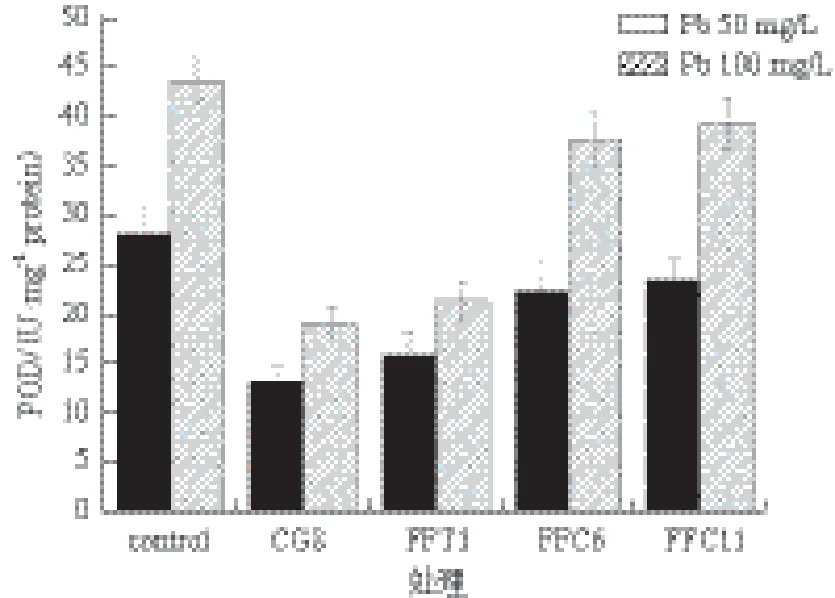
图3 溶磷菌对杏鲍菇菌丝POD活性的影响
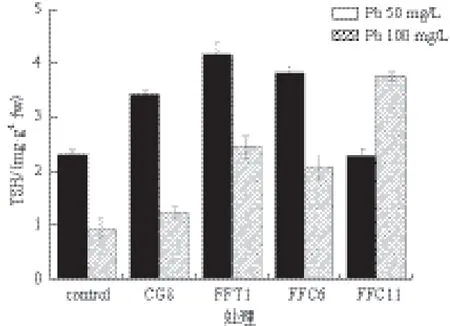
图4 溶磷菌对杏鲍菇菌丝TSH活性的影响
3 讨论
摇瓶培养基检测出各菌株的溶磷量,结果表明4株菌株的溶磷能力由强到弱依次为CG8>FTT1> FFC6>FFC11。除FFC11外,与固体蒙金娜培养基上菌株所产生溶磷圈的结果基本一致。FFC11在蒙金娜固体培养基上基本不产生溶磷圈,而在液体振荡培养中表现了一定的溶磷能力,这可能与两种培养的方式和过程不同有关。
实验表明在溶磷菌协同生长情况下,杏鲍菇生物量有所提高。并且在Pb离子浓度较低的情况下对菌丝生长的促进作用更强。同样,针对溶磷菌对作物生长的促进能力的报道也有很多,如溶磷菌对柑桔生物量有较大的影响,菌种处理过的植株地上部分鲜重的增长量可达21.6 g,而接种溶磷菌可使苜蓿株高、茎粗、干重、干鲜比和叶茎比都比对照明显增加[29,30]。溶磷菌促植株生长可能与能释放难溶性磷使植株得到有效营养有关[31];也有报道称与其改善植株营养后增加了植株跟吸收率,能有效获得更多营养元素有关[32]。
溶磷菌影响下的杏鲍菇菌丝具有更强的Pb富集能力,这可能与溶磷菌增强磷酸盐诱发的金属固定化能力有关[21]。Elena等[33]研究发现似欧石南属植物菌根真菌由于具有溶磷能力,可增强对土壤中ZnO以及Zn3(PO4)2的溶解,从而提高植株对Zn的富集量。Fomina等[34]同样发现菌根真菌可利用其增溶有毒重金属的能力,提高其对矿物质中重金属Cd、Cu、Pb、Zn等成分的吸收。但溶磷菌辅助下蕈菌和植物对重金属的吸收机制还并不完全清楚,有待进一步研究。
生命体在受到重金属或高温等不利环境胁迫时,会产生活性氧自由基(ROS),如过氧化氢、超氧化物和羟基自由基,诱导体内的脂质过氧化反应[35-37]。MDA是脂质过氧化程度的指示物,其浓度越高,表明脂质过氧化程度越严重。本研究溶磷菌对杏鲍菇菌丝MDA活性影响结果表明重金属浓度越高,生物体受到氧化胁迫越严重,从而氧化应激反应的指示物(如MDA)含量也会增加[38]。如前所述,PSB处理组中脂质过氧化程度越低,菌丝生长越好,所以其蛋白质含量明显增加就显得一点儿也不奇怪。
生物体中SOD是一种高效的活性氧自由基清除剂[39],可以降解自由的超氧化物,转化为过氧化氢和氧。而POD则以过氧化氢为电子受体,可催化底物氧化的酶,从而达到降解过氧化氢,减轻氧化损伤的目的。本实验结果表明,溶磷菌能够同时降低杏鲍菇菌丝体内SOD和POD的含量,并大致随着细菌溶磷能力的增强而含量降低,可以说明PSB可能通过降低相关ROS酶类的活性来部分减轻重金属诱导的氧化胁迫,从而引起SOD以及POD含量的降低。作为来源于SOD催化O2-生成的H2O2的清除剂,POD活性或升或降,这与重金属种类、金属浓度和受试物种有关[40,41]。尽管如此,培养基中存在PSB时,SOD和POD活性显著下降。这些结果表明,在杏鲍菇菌丝体抗氧化反应中,SOD和POD扮演着重要的角色;同时,PSB可以通过降低相关酶类的活性来部分减轻重金属诱导的氧化胁迫。
总巯基(TSH)在本实验中表现出与以上几种指标不太一致的变化特性。在Pb浓度高的环境下含量减少,并且在有溶磷菌影响的情况下,含量有升高的趋势。这可能是因为,虽然巯基化合物在应对重金属胁迫中起到积极的作用[42],但由于重金属对菌丝生长的影响,导致菌丝体的总体蛋白含量降低,因此TSH含量也相应降低。而溶磷菌辅助菌丝抵抗重金属胁迫,增强菌丝营养吸收,从而也增加了菌丝体内蛋白质含量,所以TSH含量也有所升高[43]。
4 结论
通过筛选出具抗Pb性及有溶磷能力的细菌,对Pb胁迫下生长的杏鲍菇菌丝体的生长,富集量以及一系列代谢活动作出研究,结果表明,具溶磷能力的细菌不仅可以促进菌丝体生长,还可以增强其对Pb的富集能力;在溶磷菌影响下,菌丝体氧化应激性活力增加,可以对Pb产生更强的耐受效果;溶磷菌可能会使菌丝体对营养有更好的吸收,以及促进菌丝体蛋白质含量的增加。因此推断,具有溶磷能力的细菌在减轻Pb对杏鲍菇的毒害中有重要作用。
[1]Mishra S, Srivastava S, Tripathi RD, et al. Lead detoxification by coontail(Ceratophyllum demersum L.)involves induction of phytochelatins and an tioxidant system in response to its accumulation[J]. Chemosphere, 2006, 65:1027-1039.
[2]Cai QY, Mo CH, Li HQ, et al. Heavy metal contamination of urban soils and dusts in Guangzhou, South China[J]. Environmental Monitoring and Assessment, 2013, 185:1095-1106.
[3]冯琦丽, 魏忠义, 王晶. 沈阳城市土壤Pb的污染状况及其化学形态研究[J]. 江西农业学报, 2008, 20:97-99.
[4]Søvik ML, Larssen T, Vogt RD, et al. Potentially harmful elements in rice paddy fields in mercury hot spots in Guizhou, China[J]. Applied Geochemistry, 2011, 26:167-173.
[5]刘 铮. 中国土壤微量元素[M]. 南京:江苏科学技术出版社, 1996.
[6]Naseem R, Tahir SS. Removal of P b(II)from aqueous solution by using bentonite as an adsor bent[J]. Water Res, 2001, 35:3982-3986.
[7]Salt DE, Blaylock M, Kumar NPBA, et al. Phytoremediation:A novel strategy for the removal of toxic metals from the environment using plants[J]. Nat Biotech, 1995, 13:468-474.
[8]Garbisu C, Alkorta I. Phyt oextraction:a cost-effective plant-based technology for the removal of metals from the environment[J]. Bioresource Technology, 2001, 77:229-236.
[9]王兴明, 刘桂建, 董众兵, 等. 淮南煤矸石山周边土壤中蚯蚓对重金属的富集特征[J]. 煤炭学报, 2012, 37:1219-1226.
[10]孙中涛, 王汉忠, 孙凤鸣, 等. 硒在香菇体内的生物转化及硒蛋白的生物活性[J]. 食品与发酵工业, 2003, 23:57-60.
[11]叶明, 陈辉, 章建国, 等. 香菇富锌及其培养条件优化[J].食品科学, 2006, 27:572-575.
[12]方荣利, 康德灿, 万昌秀, 等. 微生物富钙的研究[J]. 四川大学学报, 2004, 2004:24-27.
[13]Dazy M, Masfaraud JF, Ferard JF. Induction of oxidative stress biomarkers associated with heavy metal stress in Fontinalis a ntipyretica Hedw[J]. Chemosphere, 2009, 75:297-302.
[14]Zhang FQ, Wang YS, Lou ZP, Dong JD. Effect of heavy metal stress on antioxidative enzymes and lipid peroxidation in leaves and roots of two mangrove plant seedlings(Kandelia candel an d Bruguiera gymnorrhiza)[J]. Chemosphere, 2007, 67:44-50.
[15]Mishra SSS, Tripathi RD, et al. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J]. Plant Physiol Biochem, 2006, 44:25-37.
[16]Wang C, Wang X, Tian Y, et al. Oxidative stress and potentia l biomarkers in tomato seedlings subjected to soil lead contamination[J]. Ecotoxicol Environ Saf, 2008, 71:685-691.
[17]陈兰, 陈玉霞, 冯军, 徐恒. PbⅡ和CdⅡ在长根菇菌丝体中的富集及其对SOD、CAT酶活的影响[J]. 四川大学学报:自然科学版, 2011, 48:1391-1396.
[18]Duponnois R, Colombet A, Hien V, et al. The mycorrhizal fungus Glomus intraradices and rock phosphate ame n dment influence plant growth and microbial activity in the rhizosph ere of Acacia holosericea[J]. Soil Biol Biochem, 2005, 37:1460-1 468.
[19]Chen Z, Ma S, Liu LL. Studies on phosphorus solubilizing activity of a strain of phosphobacteria isolated from chestnut type soil in Chi na[J]. Bioresource Technology, 2008, 99:6702-6707.
[20]Jacobs H, Boswell GP, Harper FA, et al. Solubilization of metal phosphates by Rhizoctonia solani[J]. Mycological Research, 2 002, 106:1468-1479.
[21]Park JH, Bolan N, Megharaj M, Naidu R. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil[J]. Journal of Hazardous Materials, 2011, 185:829-836.
[22]Jeong S, Moon HS, Nam K, et al. Application of phosphate-solubilizing bacteria for enhancing bioavailability and phytoextracti on of cadmium(Cd)from polluted soil[J]. Chemosphere, 2012, 88:204-210.
[23]Byers HK, St ackebrandt E, Hayward C, Blackall LL. Molecular investigation of a microbial mat associated with the Great Artesian Basin[J]. FEMS Microbiology Ecology, 1998, 25:391-403.
[24]Jiang CY, Sheng XF, Qian M, Wang QY. Isolation and characterization of a heavy me tal-resistant Burkholderia sp. from heavy metal-contaminated paddy field soil and its potential in pr omoting plant growth and heavy metal accumulation in metalpolluted soil[J]. Chemosphere, 2008, 72:157-164.
[25]Beauchamp C, Fridovich I. Superoxide dismutase:Improved assays and an assay applicable to acrylamide gels[J]. Analytical Biochemistry, 1971, 44:276-287.
[26]Omran RG. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings[J]. Plant Physiol, 1980, 65:407-408.
[27]Heath RL, Packer L. Photoperoxidation in isolated chloroplasts:I. Kinetics and stoichiometry of fatty acid peroxidation[J]. Archives of Biochemistry and Biophysics, 1968, 125:189-198.
[28]Guimaraes-Soares L, Pascoal C, Cassio F. Effects of heavy metals on the production of thiol compounds by the aquatic fungi Fontanospora fusir amosa and Flagellospora curta[J]. Ecotox Environ Safe, 2007, 66:36-43.
[29]牛廷香, 邓烈, 易时来, 等. 溶磷菌对柑桔嫁接苗磷素营养及生长发育的影响[J]. 中国南方果树, 2011, 40:11-14.
[30]李玉娥, 姚拓, 荣良燕. 溶磷菌溶磷和分泌IAA 特性及对苜蓿生长的影响[J]. 草地学报, 2010, 18:84-88.
[31]陈国潮, 何振立, 黄昌勇. 菜茶果园红壤微生物量磷与土壤磷以及磷植物有效性之间的关系研究[J]. 土壤学报, 2001, 38:75-80.
[32]Chabot R, Antoun H, Cescas MP. Growth promotion of maize and lettuce by phosphate solubilizing rhizobium legume inorsarum biovar phaseoli[J]. Plant Soil, 1996, 184:311-321.
[33]Martinoa E, Perottos S, Personsb R, et al. Solubilization of insoluble inorganic zinc compounds by ericoid mycorrhizal fungi derived from heavy metal polluted sites[J]. Soil Biology & Biochemistry, 2003, 35:133-41.
[34]Fomina MA, Alexander IJ, Colpaert JV, Gadd GM. Solubilization of toxic metal minerals and metal tolerance of mycorrhizal fungi[J]. Soil Biology and B iochemistry, 2005, 37:851-866.
[35]Mishra S, Srivastava S, Tripathi RD, et al. Phytochelatin synthesis and response of antioxidants during cadmium stress in Bacopa monnieri L.[J]. Plant P hysiology and Biochemistry, 2006, 44:25-37.
[36]Islam E, Liu D, Li T, et al. Effect of Pb toxicity on leaf growth, physiology and ultrastructure in the two ecotypes of Elsholtzia argyi[J]. J ournal of Hazardous Materials, 2008, 154:914-926.
[37]Xu H, Song P, Gu W, Yang Z. Effects of heavy metals on production of thiol compounds and antioxidant enzymes in Agaricus bisporus[J]. Ecotoxicology and Environmental Safety, 2011, 74(6):1685-1692.
[38]张敬旭, 符绍莲, 江河, 等. 妊娠期铅暴露对新生仔鼠脑组织MDA、SOD 的影响及金属硫蛋白的诱导[J]. 中国工业医学杂志, 2003, 16:15-19.
[39]Bai Z, Harvey LM, McNeil B. Oxidative stress in submerged cultures of fungi[J]. Crit Rev Biotechnol, 2003, 23:267-302.
[40]Mishra S, Srivastava S, Tripathi RD, et al. Prasad, Phytochelatin synthesis and response of antioxidant s during cadmium stress in Bacopa monnieri L.[J]. Plant Physiology and Biochemistry, 2006, 44:25-37.
[41]Islam E, Liu D, Li T, et al. Effect of Pb toxicity on leaf growth, physiol ogy and ultrastructure in the two ecotypes of Elsholtzia argyi[J]. Journal of Hazardous Materials, 2008, 154:914-926.
[42]吴惠芳, 龚春风, 刘鹏, 等. 锰胁迫下龙葵和小飞蓬根叶中植物螯合肽和类金属硫蛋白的变化[J]. 环境科学学报, 2010, 30:2058-2064.
[43]Cao YR, Zhang XY, Deng JY, et al. Lead and cadmium-induced oxidative stress impacting mycelial growth of Oudemansiella radicata in liquid medium alleviated by microbial siderophores[J]. World Journal of Microbiology & Biotechnology, 2012, 28:1727-1737.
(责任编辑 马鑫)
Effect of Phosphate-solubilizing Bacteria on Oxidative Response of Pleurotus eryngii Under Lead Stress
HE Nan1,2XU Heng2
(1. ChengDu University of TCM,School of Medical Technology,Chengdu 611137;2. Key Laboratory of Bio-resources and Eco-environment(Ministry of Education),College of Life Science,Sichuan University,Chengdu 610064)
In this study Pleurotus eryngii was selected to enrich Pb2+,and 8 strains with capability against Pb2+of 800 mg/L were screened from the strain library of our laboratory. Two strains CG8 and FFT1 with high phosphate-solubilizing capacity,as well as FFC6 and FFC11with low phosphate-solubilizing capacity were selected. Using 16S rDNA analysis,CG8 was identified as Klebsiella sp.,FFT1 as Pseudomonas sp.,FFC6 and FFC11 as Bacillus sp.;the similarity of their sequences reached 99%. Further,the effects of 4 strains of phosphate-solubilizing bacterium(PSB)on the mycelium growth,Pb accumulation,lipid peroxidation,the content of sulfhydryl-containing protein,and antioxidant enzyme of P. eryngii in Pb-contaminating liquid medium were investigated. The result showed that inoculation with PSB enhanced the hyphal biomass of P. eryngii and accumulation of heavy metals. Moreover,the content of MAD,and the activities of SOD and POD in mycelium decreased significantly,while the content of total sulfhydryl(TSH)increased. All results confirmed that PSB efficiently reduced the toxicity of heavy metals to P. eryngii mycelium and the oxidative stress induced by heavy metals. CG8 with the strongest capacity of solubilizing phosphate had more significant effects to resist the mycelium accumulating heavy metals and oxidative stress induced by heavy metals in P. eryngii,the accumulation of Pb increasing 96.1% and the PB-SH increasing 91.3%.
mushroom;heavy metal;phosphate-solubilizing capacity;antioxidant system
10.13560/j.cnki.biotech.bull.1985.2016.05.025
2015-08-13
国家自然科学基金项目(41171253),成都中医药大学校基金项目(030021061)
何难,女,硕士研究生,研究方向:微生物生物技术;E-mail:keke_nan@sina.com
徐恒,男,博士,研究方向:微生物生物技术;E-mail:zxwf787@163.com

