胆道损伤愈合过程中cIAP-1及caspase3的表达及其意义
骆 乐,姚豫桐,李可洲,黄孝伦(.四川省医学科学院·四川省人民医院外七病区,四川 成都 6007;.四川大学华西医院肝胆胰外科,四川 成都 6004)
胆道损伤愈合过程中cIAP-1及caspase3的表达及其意义
骆 乐1,姚豫桐1,李可洲2,黄孝伦1
(1.四川省医学科学院·四川省人民医院外七病区,四川 成都 610072;2.四川大学华西医院肝胆胰外科,四川 成都 610041)
目的 观察凋亡调控蛋白cIAP1及其下游凋亡因子caspase3在胆道良性狭窄形成过程中的表达和定位情况,并探讨其意义。方法 建立胆管损伤后愈合犬模型,分别利用原位杂交检测技术及免疫组织化学过氧化酶标记的链霉卵白素(Streptavidin Peroxidase Method,SP)法对犬胆道损伤愈合不同时期的组织中cIAP1及caspase3的表达和定位情况进行分析。结果 cIAP1于各时间点均显著性表达(P< 0.05),定位于间质细胞,以成纤维细胞为甚;各组间差异无统计学意义(P> 0.05)。Caspase3表达明显弱于对照组(P< 0.05),腺上皮表达相对较强,各期之间差异无统计学意义(P> 0.05)。cIAP-1mRNA与caspase3蛋白表达呈负相关(r=-0.97,P< 0.05)。结论 抗凋亡基因cIAP-1通过抑制其下游凋亡因子caspase3可能在胆道损伤后的瘢痕愈合转归中发挥重要作用。
胆道;原位杂交;免疫组化;凋亡;cIAP1;caspase3
组织损伤愈合机制的探索一直是人们关注的焦点,有学者认为,造成不同愈合转归的最终原因在于成纤维细胞的某些基因的表达改变[1]。而胆管组织以它特有的环境使其愈合变得更加复杂,胆汁复杂的成分以及胆管细胞特有的某些性质使损伤后的炎症细胞处于持续性的激活状态,以致各种炎症因子,细胞因子不断被释放,形成一个慢性持续性的炎症环境,最终导致成纤维细胞的持续增殖,瘢痕形成[2]。因此,在胆道组织愈合过程中,有可能某些基因的表达发生了改变,并直接导致了成纤维细胞的持续增殖。本研究通过免疫组化及原位杂交的手段分别对凋亡因子caspase3及凋亡抑制基因cIAP-1的表达进行分析,探讨其在良性胆管狭窄形成中的作用。
1 材料与方法
1.1 动物模型的制备 本地健康杂交犬30只,雌雄不限,体重(12.6±2.1)kg。分笼饲养,随机分为实验组和对照组各15只。术前晚禁食,氯胺酮4 mg/kg及速眠醒0.1 ml/kg肌肉注射诱导麻醉,上肢静脉穿刺补液,青霉素320万U加入10%葡萄糖氯化钠注射液中,术中静滴。经右上腹肋缘下弧形切口入腹,首先距十二指肠上缘2 cm处游离出胆总管(上下游离范围不超过1 cm),实验组横向切开胆总管前壁,范围约为其周径1/2,以5-0不吸收丝线作胆总管壁全层吻合,针距0.4~0.5 mm,边距0.3~0.4 mm。术毕探查吻合口无渗漏,于肝肾隐窝放置引流管后关腹。对照组游离胆总管后直接关腹。术后于皮下注射生理盐水补液并预防感染治疗3天,3天后拔除腹腔引流管。
1.2 标本采集及检测 分别于术后2、3、4、5及6月取材,每次取材6只,实验组和对照组各3只。切取吻合口连同上、下1 cm 组织,4%多聚甲醛溶液,PBS(pH 7.0~7.6)含有1/1000 DEPC固定,常规脱水、透明、浸蜡、包埋制成蜡块后行4 μm连续切片,HE染色,光镜观察。免疫组化染色采用SP 法,第一抗体caspase3兔抗狗 IgG(北京博奥森),二抗羊抗兔IgG(北京中杉金桥),三抗碱性磷酸酶标记链酶亲和素;AP-Red试剂盒(北京中杉金桥)。原位杂交采用AP法,针对cIAP-1基因mRNA(GenBank,No.XM-006266)的多聚寡核苷酸探针序列(5′to3′):5′-dig-TGCGTATCAAGAACTCACACCTGGGAAACC -3′。染色步骤按AP 试剂盒说明进行;碱性磷酸酶显色,苏木素复染,封片,观察。用已知cIAP-1及caspase3的阳性切片作阳性对照,用PBS液分别代替一抗、二抗及三抗作阴性对照。每张切片随机选取5个互不重叠的高倍镜视野,进行统计。
1.3 判定标准 阳性细胞评定标准:以细胞浆染成红色为阳性细胞。应用Image pro plus10.5 图像分析软件,对各组切片平均表达强度进行定量分析,即测量其平均光密度值(mean Intensity Optical Density,mIOD)。
1.4 统计学方法 采用PASW Statistics 18统计软件包进行数据分析。计量资料以均数±标准差表示,组间及组内比较采用重复测量数据的方差分析及Bonferroni、LSD检测;cIAP-1与caspase3表达的关系采用spearman相关性分析。P< 0.05为差异有统计学意义。
2 结果
2.1 一般情况 实验组1犬术后15天死于腹腔感染,另有1犬术后9天死于胆漏,为保证样本量,于同样条件下按上述造模方法,另外补入新样本。其余犬只食欲、反应尚可。
2.2 组织学观察 各组均有慢性炎症细胞浸润,纤维组织增生并分割腺上皮,灶性淋巴滤泡形成的现象,为典型的慢性炎症表现。其中2、3、4月均有胆管壁,上皮下的灶性充血及出血现象。并有不同程度的腺体扩张。而5、6月出现腺体深陷肌层的表现,这可能是纤维增生所造成的腺体移位。由此可见,胆管损伤愈合后即处于慢性持续性的炎症环境中,管壁结构明显破坏,纤维组织大量增生是其主要的病理改变。
2.3 原位杂交结果 两组各时间点瘢痕组织cIAP-1基因表达差异均有统计学意义(P< 0.05)。实验组上皮下间质组织有明显阳性表达结果,而腺上皮鲜有表达。主要定位于纤维组织,胞浆染色呈鲜红色。炎症细胞包括淋巴细胞及单核巨噬细胞等以及血管内皮细胞等也有不同程度表达,见表1,图1a。对照组仅腺体组织有弱阳性表达,见图1b。实验组各时间点差异无统计学意义(P> 0.05)。
2.4 免疫组化结果 如表2,图1c,两组各时间点瘢痕组织caspase3表达差异均有统计学意义(P< 0.05),呈现弱表达状态,上皮细胞表达明显强于间质组织;如图1d,对照组于上皮及间质内均有程度不等的阳性结果。实验组各时间点差异无统计学意义(P> 0.05)。
2.5 相关性分析 胆道损伤愈合过程中,cIAP-1mRNA与caspase3蛋白表达呈负相关(r=-0.95,P< 0.01)。
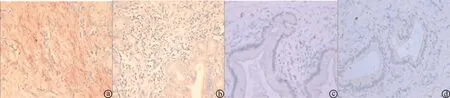
图1 两组术后不同时间点瘢痕组织cIAP-1mRNA及caspase3蛋白表达 a:实验组cIAP-1mR -NA于间质组织大量表达,腺体染色较浅(×400);b:对照组腺体及间质组织均无明显染色(×400);c:实验组caspase3总体表达弱,腺体染色相对较强;d:对照组caspase3腺体及间质组织均有表达
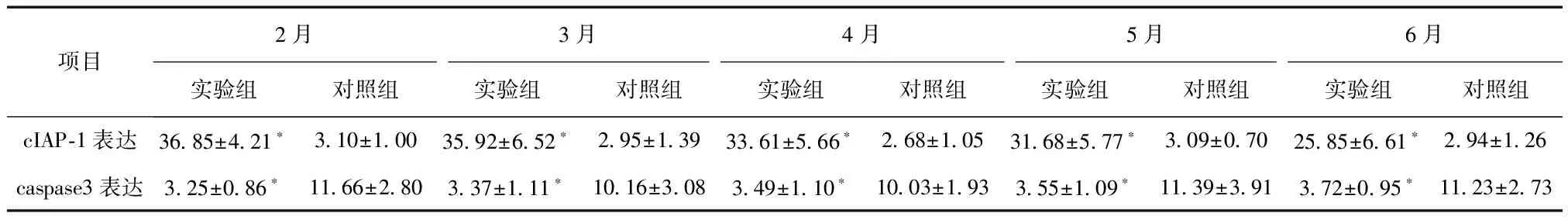
表1 术后不同时间点两组cIAP-1和caspase3表达情况比较
*与对照组比较,P< 0.05
3 讨论
凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)家族是一类保护某些细胞在遭受各种刺激的情况下免于程序性死亡的蛋白超家族。首先是从杆状病毒基因组克隆到,包括cIAP-1、cIAP-2、XIAP、survivin、BRUCE,及ML-IAP等。这其中cIAP-1、cIAP-2、XIAP的大部分结构具有同源性。它们的氨基末端均含有3个肽段BIR重复序列,羧基端则均含有1个高度保守的锌指结构域,这使其具有泛素E3的活性。IAPs抑制细胞凋亡主要通过两种方式[3]:①通过BIR序列与Caspase的蛋白质-蛋白质作用,IAP可以直接抑制Caspase-3、7和9的作用;②通过RING序列,IAP可以催化Caspase-3和-7泛素化,导致这些Caspase被蛋白酶体降解。这两种途径均可抑制caspase3活性,从而达到抗凋亡的作用。由此,我们选择检测caspase3表达作为评价IAPs在胆道损伤愈合过程中抗凋亡作用的另一视点。目前,IAPs基因在某些原发性肿瘤中被发现过度表达。Issei等[4]通过荧光原位杂交的方法研究食管鳞状细胞癌株(esophageal squamous cell carcinomas,ESCs)染色体11q21-q23中出现放大效应的靶基因时发现:cIAP-1基因呈现持续性过度表达状态即放大效应。而Ashley等[5]于最近发现XIAP在肺纤维化形成过程中也起重要作用。病理性瘢痕形成过程表现为成纤维细胞的过度增殖,这与某些基因的表达调控关系密切。有学者利用基因芯片技术证实,普通瘢痕与瘢痕疙瘩相比,有402条基因的表达有区别,其中有250条基因上调,152条基因下调,有8种凋亡基因表达过低[6]。Messadi等[7]通过标记定量研究发现,正常皮肤成纤维细胞凋亡率,比瘢痕疙瘩高两倍,凋亡相关基因表达也下降。由此可见,凋亡基因表达改变对病理性瘢痕的形成起较大作用。
胆道环境下的损伤愈合同样以瘢痕形成,成纤维细胞过度增殖为转归,我们相信在此过程中,某些凋亡基因的上调起到了关键性作用。本实验中,我们观察到,作为细胞凋亡的主要调控者之一的cIAP-1于各时间点均为强阳性表达,证明cIAP-1处于过度表达状态,凋亡严重受阻,增殖与凋亡失衡。也不难理解最终的瘢痕形成及挛缩所造成的胆管狭窄。从另一方面来看,此结果也说明了刺激因素的持续性,即慢性持续性的炎症背景的形成。NF-KB作为炎症信号介导的关键性核因子启动了下游众多基因的表达,包括IAPs基因在内的几个重要的抗凋亡基因如:cIAP-1、cIAP-2、XIAP、bcl-2、bcl-xl、c-FLIP等[8]。Messadi等[9]研究发现,瘢痕疙瘩成纤维细胞较正常皮肤在NF-KB激活及其相关下游基因包括肿瘤坏死因子受体相关因子(TNF-receptor-associated factors,TRAF)1,TRAF2,cIAP-1的表达方面表现出更高的基础水平。因此,胆管愈合过程中,有可能是慢性炎症的持续使NF-KB得以不断被激活,并迅速进入核内启动下游靶基因持续性表达。另外,从定位来看,cIAP-1过度表达于成纤维细胞,而胆管上皮细胞几乎未表达,这表明在凋亡抵抗方面,成纤维细胞较胆管上皮细胞有明显的优势。进一步证明胆管组织愈合以成纤维细胞的大量增殖修复为主。究其原因,可能与胆管上皮细胞所特有的膜结构胆酸转运蛋白(apical sodium-dependent bile acid transporter,ASBT)有关。后者负责胆管上皮对胆酸的摄取,其表达量受胆汁成分的调节[10]。有研究表明[11],胆管上皮细胞内胆酸浓度的改变,可通过Ca2+,P13K,PKC等信号通路影响细胞的增殖、凋亡、分泌及基因表达。因此,有可能是胆道损伤愈合过程中的胆汁内环境的变化使其表达发生改变,进而影响了胆管上皮细胞对胆汁成分地摄取及反应,通过复杂的信号网络传导,最终导致NF-KB的激活减少或cIAP-1基因表达直接受到抑制,其具体机制有待进一步探究。我们在实验中还发现cIAP-1在炎症细胞如单核巨噬细胞,淋巴细胞及血管内皮细胞均有不同程度表达,这或许将直接导致这些炎性细胞凋亡失败,从而大量增殖并分泌炎症介质,进而造成炎症的持续。
Caspase即半胱氨酸特异性蛋白酶,又称凋亡蛋白酶,是哺乳动物中与线虫死亡基因产物ced-3同源且具有相同作用的一类半胱氨酸蛋白酶家族[12],是各种凋亡信号传导的共同终末。激活的Caspase可以水解约100个底物,包括细胞调节、细胞信号转导、DNA修复、组织平衡、细胞存活等环节中重要的蛋白,从而使细胞表现为凋亡特有的形态学及生化特征:细胞皱缩、断裂,染色质聚集,DNA降解,以及随后的凋亡细胞被吞噬细胞迅速地清除等。许多影响细胞凋亡的基因,如p53、bcl-2、Fas、Rb 等;细胞因子,药物等均可以通过调节caspase活化发挥作用。caspase3的序列和功能与ced-3最为接近,能特异地在天冬氨酸残基的位置剪切底物蛋白,而自己本身在细胞凋亡中也在天冬氨酸的位置被剪切为两个片断,即前体Caspase3(35 kD)在Asp28和Ser29之间及Asp175和Ser176之间进行剪切,产生有活性的17 kD亚基和12 kD的亚基[13]。因此,caspase3的表达将直接反应细胞凋亡的程度。我们在实验中发现,caspase3于各时间点均弱表达,且结缔组织弱于腺上皮,但均低于正常组。说明胆道愈合过程中伴有细胞失凋亡,并且以结缔组织最为明显。我们通过相关分析还发现,cIAP-1mRNA表达与caspase3蛋白表达呈负相关,证明两者在调控胆管组织愈合过程中的细胞凋亡方面有着较为密切的关系。或许可以这么认为,胆道修复过程中,cIAP-1作为caspase3上游的凋亡调控因子,其过度表达至少部分导致了caspase3的失活,凋亡抑制,最终造成纤维细胞的大量增殖,造成最终的胆道狭窄形成。
我们或许可以通过适当抑制IAPs基因表达以增加胆道愈合过程中的成纤维细胞的凋亡进程,从而达到遏制成纤维细胞过度增殖的状态,软化瘢痕,最终避免胆道良性狭窄的形成。
[1] Galatz LM,Gerstenfeld L,Heber-Katz E,et al.Tendon regeneration and scar formation:The concept of scarless healing[J].J Orthop Res,2015,33(6):823-831.
[2] Geng ZM,Yao YM,Liu QG,et al.Mechanism of benign biliary stricture:a morphological and immunohistochemical study[J].World J Gastroenterol,2005,11(2):293-295.
[3] Douglas J,Turner MD,Samuel M,et al.Bile Salts Induce Resistance to Apoptosis Through NF-kB mediated XIAP Expression[J].Ann Surg,2007,245:415-425.
[4] Issei I,Zeng-Quan Y,Atiphan P.Identification of cIAP1As a Candidate Target Gene within an Amplicon at 11q22 in Esophageal Squamous Cell Carcinomas1[J].Cancer Research,2001,61:6629-6634.
[5] Ashley SL,Sisson TH,Wheaton AK,et al.Targeting Inhibitor of Apoptosis Proteins Protects from Bleomyc in -induced Lung Fibrosis[J].Am J Respir Cell Mol Biol,2016,54(4):482-492.
[6] Chen W,Fu XB,Ces L,et al.Development of gene microarry in screening differently expressed genes in keloid and normal-control skin[J].Clin Med J(Edgl),2004,117(6):877-881.
[7] Messadi DV,Lea Berc S.Expression of apoptosis-associated gene by human dermal sear fibroblasts [J].Wound Repair Regen,1999,7(6):511-517.
[8] Tomohiro B,Alix G,Miroslav B.Pathway-specific Profiling Identifies the NF-kB-dependent Tumor Necrosis Factor kB regulated Genes in Epidermal Keratinocytes[J].The Journal of Biological Chemistry,2005,280(19):18973-18980.
[9] Messadi DV,Doung HS,Zhang Q,et al.Activation of NF-kappaB signal pathways in keloid fibroblasts[J].Arch Dermatol Res,2004,296(3):125,133.
[10]Alpini G,Glaser S,Phinizy JL,et al.Regulation of cholangiocyte apical bile acid transporter (ABAT) activity by biliary bile acids:different potential compensatory changes for intrahepatic and extrahepatic cholestasis[J].Gastroenterology,2001,20:A6.
[11]Xuefeng X,Heather F,Shannon G,et al.Bile acid interactions with cholangiocytes[J].World J Gastroenterol,2006,12(22):3553-3563.
[12]刘晋西,岑瑛.细胞凋亡与病理性瘢痕的研究进展[J].西部医学,2004,16(4):364-366.
[13]Nicholson DW,Thonberry NA.Caspases:Killer proteases[J].TIBS,1997,22(8):299-306.
The expression and significance of caspase3 and cIAP-1 in the wound healing process of bile duct
LUOLe1,YAOYu-tong1,LIKe-zhou2,HUANGXiao-lun1
(1.TheSeventhWardofDepartmentofSurgery,SichuanAcademyofMedicalSciences&SichuanProvincialPeople'sHospital,Chengdu610072,China;2.DepartmentofHepatopancreatobiliarysurgery,WestChinaSchoolofMedicine/WestChinaHospitalofSichuanUniversity,Chengdu610041,China)
HUANGXiao-lun
Objective To observe the expression and localization of the apoptosis regulation protein cIAP1 and its downstream factor caspase3 in the course of the formation of benign biliary stricture and to explore its significance.Methods After establishment of canine model for healing after bile duct injury,expression and localization of cIAP1 and caspase3 in biliary tissue at different stages of healing were analyzed by using in situ hybridization technique and immunohistochemical peroxidase labeled avidin-streptavidin (Streptavidin Peroxidase Method,SP) method,respectively.Results cIAP1 was significantly expressed at all time points (P< 0.05).The expression was located in the interstitial cells,especially in fibroblasts.There was no significant difference among the healing stages (P> 0.05).The expression of caspase3 in the experimental group was significantly less than that in the control group (P<0.05).The expression in epithelial cells was relatively stronger.There was no significant difference among the healing stages (P> 0.05).There was a negative correlation between cIAP-1 mRNA and caspase3 protein (r =-0.97,P<0.05).Conclusion The inhibition of caspase3 by cIAP-1 may play an important role in scar-less healing after bile duct injury.
Biliary;In situ hybridization;Immunohistochemistry;Apoptosis;cIAP1;Caspase3
黄孝伦
R657.4
A
1672-6170(2016)05-0087-04
2015-12-10;
2016-03-24)

