猪流行性腹泻焦磷酸测序检测方法的建立
曹丙蕾,邱洪凯,孙 涛,凌宗帅,张 群(. 济南出入境检验检疫局,山东济南 5004;. 山东临沂新程金锣牧业有限公司,山东沂水 76400;. 山东出入境检验检疫局,山东青岛 6600)
猪流行性腹泻焦磷酸测序检测方法的建立
曹丙蕾1,邱洪凯2,孙 涛3,凌宗帅1,张 群1
(1. 济南出入境检验检疫局,山东济南 250014;
2. 山东临沂新程金锣牧业有限公司,山东沂水 276400;
3. 山东出入境检验检疫局,山东青岛 266002)
摘 要:本研究旨在建立一种基于RT-PCR的焦磷酸测序方法,以便对猪流行性腹泻(PED)进行高效准确地检测。利用PSQ Assay Design SW软件分析了猪流行性腹泻病毒(PEDV)N蛋白基因的保守区域,设计了一对扩增引物及一条测序引物,建立了PEDV N蛋白基因的焦磷酸测序检测方法。实验结果表明,该方法可以直接通过PSQ的序列结果直观地判定PEDV,大大提高了PEDV的检出率和准确性。该方法特异性强,不与其他猪源病毒发生交叉反应,最低核酸检测限为0.05 pg/μL。本研究所建立的焦磷酸测序方法灵敏度高、稳定性好,能从基因序列水平上精确鉴定PEDV,避免了假阳性结果的出现,对于PED的快速确诊具有重要意义。
关键词:猪流行性腹泻;猪流行性腹泻病毒;RT-PCR;焦磷酸测序;鉴定
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的急性、接触性、高度传染性消化道疾病,主要症状为呕吐、水样腹泻和脱水。PED波及的范围广,在全球均有病例报道,成为几十年来影响亚洲地区养猪业的大问题[1]。PED通常多发于寒湿较重的秋冬季,近年多呈地方性流行。不同年龄段的猪只对该病毒均易感,幼年猪感染率高达100%,7日龄以下仔猪的病死率为80%~100%。PED已给我国养猪业造成了巨大的经济损失[2-3]。由于PED与猪传染性胃肠炎(TGE)的临床症状较为相似,临诊中较难进行鉴别诊断,给疾病的确诊、治疗和防控带来了很大困难,故PED的病原检测成为目前最有效的鉴别诊断方法[4-5]。
传统的病原诊断方法包括病毒分离与鉴定、RT-PCR、荧光RT-PCR等,具有一定的特异性和灵敏性,但其无法满足快速准确检测的要求,即无法获得分子诊断的黄金标准——基因序列,从而可能出现假阳性结果[6-7]。而利用常规的Sanger测序法仅在对大片段DNA进行序列测定时才显示出优势,且速度慢、成本高、通量低,但如果在实际工作中,引物选择得好,那么很短的一段保守特异性序列就可满足对病原体分子诊断的需要[6,8]。
焦磷酸测序技术(Pyrosequencing)是一种能够进行定量序列测定的短链测序技术。该技术可以快速、准确、实时地进行短DNA序列分析,检测通量高;可同时进行多达96份样品的测序,无需进行电泳;对DNA片断无需荧光标记,操作简单方便,可程序化;便于构建标准化操作流程和规范,能够保证实验结果的稳定性和准确性[6,9-10]。目前该技术在物种鉴定、病毒快速鉴定和分型、微生物检测等方面被广泛应用。本研究针对PEDV N蛋白基因序列,利用焦磷酸测序软件设计RT-PCR扩增引物及焦磷酸测序引物,建立了N蛋白基因的焦磷酸测序检测方法,直接通过测序结果就能够快速从基因序列水平上直观地进行PEDV鉴别诊断,既能快速鉴定PEDV,又能区分鉴别PEDV和TGEV,大大提高了检测效率,实现了从基因水平上对PEDV进行精确鉴定。
1 材料与方法
1.1材料
猪流行性腹泻病毒(PEDV)、猪繁殖与呼吸综合征病毒(PRRSV)、猪传染性胃肠炎病毒(TGEV)等核酸样本由本实验室保存。M-MLV反转录酶、PrimeScript One Step RT-PCR Kit、100 bp DNA Ladder Marker及相应试剂等购自TaKaRa公司;焦磷酸测序仪PyroMarkTM ID System、Vacuum Prep Tool、链霉亲和素包被磁珠、PyroGold SQA Reagents 1×96 DNA序列分析试剂盒及相应试剂均为Gene公司产品。磁珠法RNA提取试剂盒及核酸提取仪由西安天隆科技有限公司提供。引物合成和测序由上海生工生物工程有限公司完成。
1.2方法
1.2.1焦磷酸测序引物的设计。根据GenBank中公布的PEDV N蛋白基因的保守序列,运用PSQ Assay Design SW软件进行分析,设计一对通用扩增引物PF和PR及测序引物PS(表1)[8-11],其中对引物PR在其5’端进行生物素标记,预期扩增片段大小为108 bp。引物均由上海生工生物工程技术服务有限公司合成。

表1 PEDV的扩增引物及测序引物
1.2.2病毒RNA的提取。将收集的PEDV病毒液样本利用磁珠RNA提取法提取核酸,提取的RNA立即用于RT-PCR扩增或置-80 ℃保存备用。
1.2.3RT-PCR反应。以病毒RNA为模板,采用一步法进行RT- PCR扩增并对反应条件进行优化,确定RT- PCR反应条件为:50 ℃ 30 min;94 ℃预变性2 min;94 ℃ 30 s,55 ℃ 30 s,72℃ 30 s,35个循环;72 ℃ 7 min。取5 μL PCR产物进行琼脂糖凝胶电泳鉴定检测扩增结果,将PCR产物送往上海生工生物工程有限公司进行测序。剩余的PCR产物用于焦磷酸测序反应。
1.2.4测序单链模板的制备。按照Gene Company Limited公司的焦磷酸测序反应操作说明制备测序单链模板,在PCR产物中加入含有链霉亲和素包被磁珠的结合缓冲液,常温震荡混匀10 min,将vacuum prep tool在超纯水中清洗30 s后抓取与PCR产物结合的磁珠,然后用70%乙醇清洗5 s;Denatureation buffer洗5 s;最后移到Washing buffer中清洗10 s,将vacuum prep tool放入含有测序引物的PSQ 96孔板中,摇动,释放磁珠。将此PSQ 96孔板置于Thermo Plate上置80 ℃ 2 min,取出自然冷却至室温[8-10]。
1.2.5焦磷酸测序反应。依据仪器说明中设定的程序及程序给定的剂量,在试剂舱中相应的孔内加入酶混合物(DNA聚合酶、ATP硫酸化酶、荧光素酶和三磷酸腺苷双磷酸酶)、底物APS以及dNTP,将试剂舱和96孔测序板放入PyroMark Q96 ID中进行Pyrosequencing,反应完毕后仪器自动给出测序结果,对测序结果在线进行BLAST分析,比较序列特异性[10-13]。
1.2.6特异性试验。分别以PEDV、TGEV、PRRSV的核酸样品为模板进行RT-PCR扩增,采用1.2.4中建立的方法进行焦磷酸测序,对测序结果利用BLAST鉴定测序引物的特异性。同时,将扩增产物进行琼脂糖凝胶电泳,鉴定扩增引物的特异性[11]。
1.2.7灵敏度试验。将PEDV核酸样本(50 ng/ μL)分别进行10倍梯度稀释,并以此为模板进行RT-PCR扩增。根据琼脂糖凝胶电泳检测扩增条带情况,判定用于焦磷酸测序的RT-PCR的最低检测限。
1.2.8重复性试验。将PCR产物进行3次焦磷酸测序,比较序列结果,以确定该方法的重复性和稳定性。
1.2.9焦磷酸测序检测方法在临床样品中的比对应用。对临床采集的疑似PEDV的20个样本提取RNA,并以此为模板进行焦磷酸测序反应,同时将RT-PCR产物送往上海生工生物工程有限公司进行序列测定,通过序列结果的比较,来验证焦磷酸测序方法的高效性和准确性。
2 结果
2.1RT-PCR扩增结果
采用PSQ Assay Design SW软件设计的扩增引物对PEDV核酸进行RT-PCR扩增,扩增片段大小为108 bp,与预期目的片段大小一致(图1)。测序结果分析表明,该目的条带与PEDV N蛋白基因片段同源性达100%。
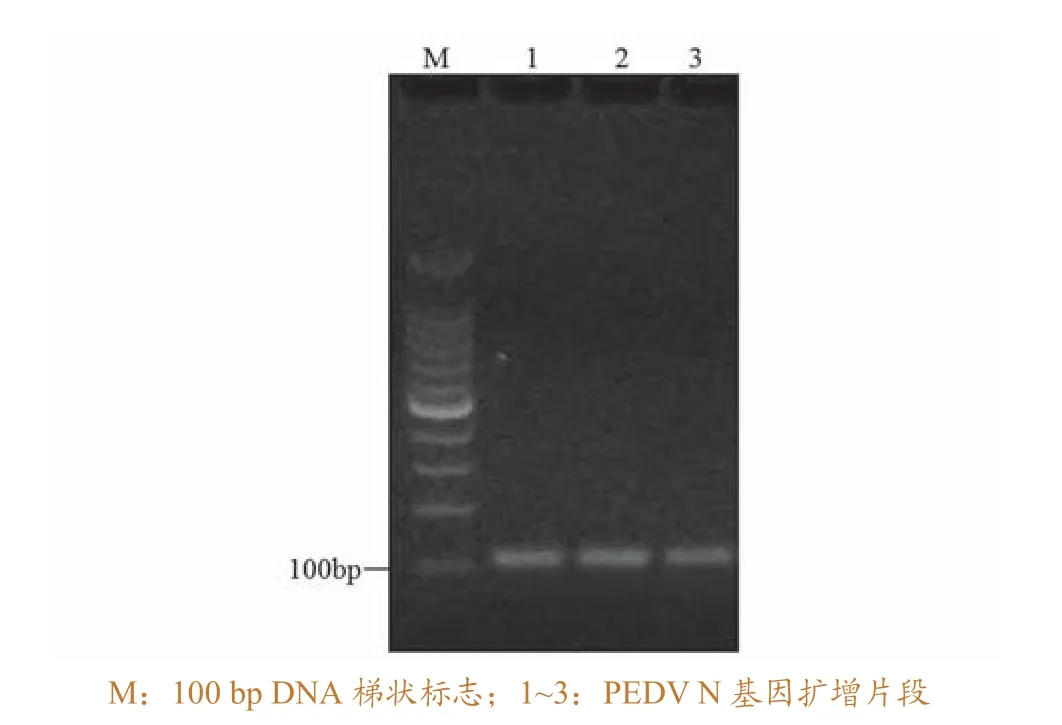
图1 PEDV N基因的RT-PCR扩增结果
2.2焦磷酸测序反应
PEDV N基因片段的焦磷酸测序结果为:CGTTTGATCCTAGTGGTTACCAGCTTTATTTACATAAGGCCA。将该序列进行BLAST比较分析,结果与目的序列片段符合率为100%。该序列能够作为PEDV快速鉴定的靶序列,其焦磷酸测序结果与普通Sanger测序结果的符合率为100%,经BLAST软件分析,该序列属于PEDV N基因,因此该试验方法具有较好的准确性和特异性(图2)。
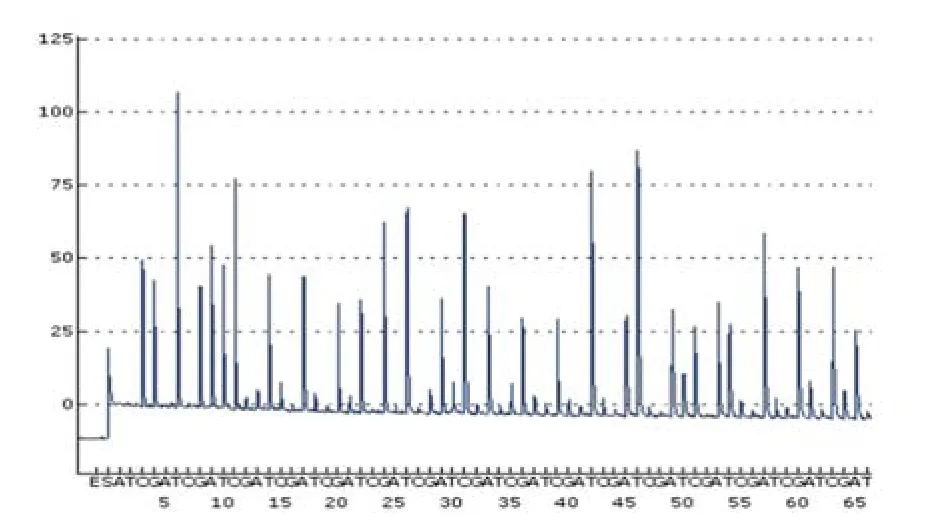
图2 PEDV N 蛋白基因焦磷酸测序结果
2.3特异性结果
以PEDV、TGEV和PRRSV的核酸为模板进行上述焦磷酸测序反应,发现只有PEDV获得了目的序列的结果。将该序列进行BLAST比较分析,结果与目的序列片段符合率为100%;其他无关核酸样品未获得任何序列结果。特异性表明,本研究所设计的PEDV N基因的扩增引物与测序引物具有较好的特异性。
2.4灵敏度结果
由于进行焦磷酸测序需要先进行RT-PCR扩增,故焦磷酸测序的灵敏度也即是RT-PCR的灵敏度,因此可依此来判定焦磷酸测序的灵敏度。依据扩增结果(图3),RT-PCR的最低核酸检测限为0.05 pg/μL(稀释度为10-6时),此时所扩增的PCR产物可以用于焦磷酸测序,得到较好的序列结果。
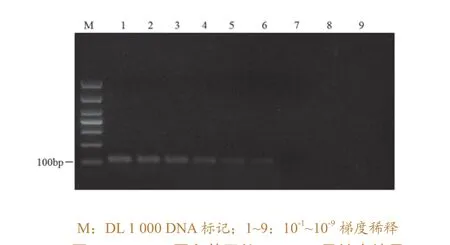
图3 PEDV N蛋白基因的RT-PCR灵敏度结果
2.5重复性结果
对每个RT-PCR产物进行3次重复性检测,检测结果均一致,证明该方法具有很好的重复性和稳定性。
2.6样品检测
对20个疑似PEDV的临床样本进行焦磷酸测序,从序列结果上直观地确诊了15个PEDV阳性,5个PEDV阴性,反应结果与普通测序结果完全一致,序列符合率为100%,但是检测效率明显得到提升。
3 讨论
PED最早于20世纪70年代在英国被发现。此后,除美洲以外,全球多个国家和地区相继报道了PED的发生,尤其是在欧洲和亚洲,包括日本、中国与韩国,给这些国家的畜牧养殖业造成了严重的经济损失。目前我国猪群中的PEDV感染尤其严重,其感染率明显高于猪传染性胃肠炎和猪轮状病毒病[1-2]。
由于PED与猪传染性胃肠炎在临床症状上极为相似,在实际临诊中容易造成混淆误诊,故在基因水平上进行判定是最为准确可靠的。焦磷酸测序技术是近年发展起来的一种能够通过对基因序列测序实现检测和确诊的新型检测技术,具有高通量、快速、 敏感等特点,可将分子诊断的黄金标准——基因序列直观地表现出来,减少了假阳性结果的出现。与普通RT-PCR和real time RT-PCR等检测技术相比,本技术无需将PCR产物送交公司测序,加入特异的碱基后,可在40 min内准确获得样品目的片段的基因序列,因此大大提高了疫病的确诊效率[7,14]。
PEDV共有4种主要的结构蛋白,其中N蛋白是PEDV已知结构蛋白中唯一的磷酸化蛋白,也是组成病毒核衣壳的结构基础。不仅如此,N蛋白还具有保守性强的特点。猪在感染PEDV早期,体内就能产生高水平的抗N蛋白抗体,因而利用N蛋白建立PEDV分子生物学诊断技术具有很好的应用前景[15]。本研究利用软件对PEDV N蛋白基因的保守序列设计了一对通用扩增引物及一条带有生物素标记的测序引物,利用RT-PCR扩增获得纯度较高的PCR产物后进行焦磷酸测序反应,获得了一段特异性强的短序列。这段序列可以作为PEDV鉴定的靶序列,直接从这段基因序列上就可判定是否是PEDV。
焦磷酸测序检测方法准确性高、特异性强,避免了假阳性结果的出现,从而实现了从基因水平上对疫病进行判定。由于焦磷酸测序方法对PCR扩增产物的浓度与纯度有一定的要求,因此该方法的敏感性低于国外常用的荧光定量分型方法[8,16]。但是焦磷酸测序方法可以直观地从结果中观察到序列,避免了二次测序确证,可直接对疫病进行判定,便于快速监控疫情,对出入境动物检疫具有有快速高效的预警作用。
参考文献:
[1] Chen J F,Wang C B,Shi H Y,et al. Molecular epidemiology of porcine epidemic diarrhea virus in China[J]. Arch Virol,2010,155:1471-1476.
[2] 高君恺,刘浩飞,杨倩. 猪流行性腹泻病毒的研究进展[J].南京农业大学学报,2014,37(1):1-5.
[3] 施标,董世娟,朱于敏,等.中国猪流行性腹泻病毒分子流行病学研究进展[J]. 中国农业科学,2013,46(20):4362-4369.
[4] 吴玉璐,程群,虞凌雪,等.猪流行性腹泻病毒RT-PCR鉴别诊断方法的建立[J].中国农业科学,2013,46:4370-4377.
[5] 秦毅斌,卢冰霞,赵武,等. 猪流行性腹泻病毒变异毒株与经典毒株RT-PCR鉴别检测方法的建立及应用[J]. 中国兽医科学,2014,44(5):509-514.
[6] 李秀娟,徐保红,田会方. Pyrosequencing技术在病原微生物检测中的应用[J].中国卫生检验杂志,2008,18(9):1927-1929.
[7] Elah I E,Ronagh I M. Pyrosequencing:a tool for DNA sequencing analysis[J]. Methods in molecular biology,2004,255:211-219.
[8] 王彩霞,林祥梅,张永宁,等. 施马伦贝格病焦磷酸测序检测方法的建立[J].中国动物检疫,2014,31(10):57-65.
[9] 孙涛,张太翔,徐彪,等. 焦磷酸测序技术在确证猪甲型H1N1流感病毒中的应用[J]. 中国动物检疫,2011,28(4):48-58.
[10] 刘华雷,吕艳,黄伟坚,等. 应用焦磷酸测序技术快速检测猪流感病毒金刚烷胺耐药性的分子标签[J]. 微生物学报,2010,50(3):395- 399.
[11] 刘海生,张永强,赵永刚,等. BVDV 1型和2型焦磷酸测序检测方法的建立[J]. 中国兽医杂志,2014,50(7):14-17.
[12] 王群,孙涛,郑小龙,等. 荷斯坦奶牛脊椎畸形综合征焦磷酸测序检测方法建立与应用[J].中国动物检疫,2014,31 (10):70-73.
[13] Zhang Y,Wu S,Wang J,et al. Expression and purifi cation of the nucleocapsid protein of Schmallenberg virus,and prepatation and characterization of a monoclonal antibody against this protein[J]. Protein Expr Purif,2013,92:1-8.
[14] Storm M,Advani A,Pettersson M,et al. Comparison of real-time PCR and pyrosequencing for typing Bordetella pertussis toxin subunit 1 variants[J].J Microbiol Methods,2006,65 (1):153-158.
[15] Lee D K,Cha S Y,Lee C. The N-terminal region of the porcine epidemic diarrhea virus spike protein is important for the receptor binding[J].Korean Journal of Microbiology and Biotechnology,2011,39(1):40 -50.
[16] Ronaghi M,Shokralla S,Gharizadeh B. Pyrosequencing for discovery and analysis of DNA sequence variations [J]. Pharmacogenomics,2007,8(10):1437-1441.
(责任编辑:朱迪国)

《中国动物检疫》2016年重点选题策划
Establishment of Pyrosequencing Assay Detection Method of Porcine Epidemic Diarrhea Virus
Cao Binglei1,Qiu Hongkai2,Sun Tao3,Ling Zongshuai1,Zhang Qun1
(1. Jinan Entry-Exit Inspection and Quarantine Bureau,Jinan,Shandong 250014;2.Shandong Linyi Xincheng Jinluo Animal Husbandry Co.,LTD,Yishui,Shandong 276400;3 Shandong Entry-Exit Inspection and Quarantine Bureau,Qingdao,Shandong 266002)
Abstract:The pyrosequencing(PSQ)assay based on reverse transcription-polymerase chain reaction(RT-PCR)was developed for rapid detection of porcine epidemic diarrhea virus(PEDV) effi ciently and accurately. The pair of amplifi cation primers and a sequencing primer were designed for the conserved region of the N protein gene of PEDV by the analysis of the software PSQ Assay Design SW to establish the pyrosequencing assay for the detection of PEDV. The results showed that this assay could be used for the identifi cation of PEDV by the sequences of the PSQ directly and the rates of detection and the accuracy could be improved greatly. The results of specifi cation assay showed that this assay had good specifi city ,no cross reaction with other porcine viruses. The minimum detection limit of the nuclei acid was 0.05 pg/μL. The pyrosequencing assay with high sensitivity and stability could accurately identify PEDV at the level of gene to avoid the occurrence of false positive results. It was of great signifi cance for the rapid diagnosis of porcine epidemic diarrhea.
Key words:porcine epidemic diarrhea;porcine epidemic diarrhea virus;reverse-transcriptase polymerase chain reaction;pyrosequencing assay;detection
中图分类号:S855.3
文献标志码:A
文章编号:1005-944X(2016)05-0075-05
DOI:10.3969/j.issn.1005-944X.2016.05.024
基金项目:山东出入境检验检疫局科研项目(SK201401);动物病原微生物DNA条形码检测技术研究与示范应用(2012BAK11B04)

