培养条件对海豚链球菌的生长及其胞外产物蛋白组成的影响
刘海波,绳秀珍,唐小千,邢 婧,战文斌(中国海洋大学海水养殖教育部重点实验室,山东青岛 266003)
培养条件对海豚链球菌的生长及其胞外产物蛋白组成的影响
刘海波,绳秀珍,唐小千,邢 婧,战文斌
(中国海洋大学海水养殖教育部重点实验室,山东青岛 266003)
摘 要:本文研究了培养条件对海豚链球菌(Streptococcus iniae)NUF849生长的影响,分析了不同培养条件下海豚链球菌胞外产物的蛋白组成变化。结果显示,海豚链球菌在28 ℃时生长状态最好,胞外产物最丰富,主要有92 kDa、88 kDa、68 kDa、62 kDa、57 kDa、50 kDa、46 kDa、42 kDa、38 kDa、37 kDa、36 kDa、30 kDa、27 kDa和24 kDa等蛋白条带,温度升高或降低皆使蛋白条带减少;相对于普通气体环境,5%~ 10%CO2对海豚链球菌的生长无显著影响,但使胞外产物蛋白条带减少,92 kDa、88 kDa、62 kDa、37 kDa和27 kDa条带丰度升高;培养基含2‰葡萄糖和5‰NaCl时,海豚链球菌生物量最高,5‰和10‰葡萄糖均可增加胞外产物蛋白条带,提高68 kDa、57 kDa、37 kDa和27 kDa蛋白丰度,但20‰葡萄糖和高于10‰的NaCl会抑制海豚链球菌的生长并减少胞外产物蛋白丰度;培养基中添加二联吡啶(DPD)和FeCl3时,海豚链球菌生长受到抑制,胞外产物蛋白条带较BHI培养基条件下明显减少。本文结果有助于认识海豚链球菌对外界环境条件的反应,为揭示其致病机理提供依据。
关键词:海豚链球菌;培养条件;生长状态;胞外产物;蛋白组成
海豚链球菌(Streptococcus iniae)是导致鱼类链球菌病的主要致病菌之一,可感染牙鲆(Paralichthys olivaceus)、大菱鲆(Scophthalmus maximus)、罗非鱼(Oreochromis nilotica)、海鲈(Lateolabrax japonicus)等多种鱼类[1-3],可给水产养殖业造成巨大的经济损失。
细菌的生长状况与其生长环境密切相关。如温度、气体环境、渗透压以及金属离子含量均可对细菌的生长状态产生影响,从而影响菌体蛋白、胞外产物(extracellular products,ECPs)等的表达分泌[4-5]。胞外产物中的很多蛋白,包括酶、细胞因子和激素等,均对细菌的存活和繁衍具有重要作用,尤其是致病性细菌的分泌蛋白往往含有致病或毒力因子[6],其对于细菌致病机理的研究具有重要意义。在不同的培养环境中,细菌会随环境变化改变自身生长代谢,胞外产物也会发生相应变化。因此,研究环境因子对细菌生长及胞外产物分泌的影响,可以更好地认识细菌对外界的反应,为揭示细菌的致病机理提供参考依据。
本实验室前期研究了5株海豚链球菌菌株的毒力特性、各菌株胞外产物的抗原性及其诱导的免疫应答[7-9]。本文选取其中毒力较强的菌株NUF849,研究其在不同温度、气体环境以及培养基盐度、葡萄糖含量、铁元素含量等条件下的生长状况,通过聚丙烯酰胺凝胶电泳(SDS-PAGE)分析不同环境条件下海豚链球菌胞外产物蛋白组成变化。
1 材料与方法
1.1细菌培养
海豚链球菌NUF849由本实验室保藏[10]。NUF849经血平板活化后,转接于脑心浸液(BHI)平板继续培养,再挑取单菌落接种于BHI液体培养基,于28 ℃静置培养至吸光度为0.900 0左右(595 nm,Tecan),然后将其作为种子液置于BHI液体培养基(20 mL液体,100 mL三角瓶)中进行扩大培养。
1.2不同培养条件的设置及生长曲线的测绘
将海豚链球菌NUF849接种于普通BHI液体培养基(含有5‰NaCl和2‰葡萄糖),对温度、气体环境以及培养基的盐度(NaCl含量)、葡萄糖含量、铁离子含量等培养条件作如下设置:(1)分别于15 ℃、20 ℃、28 ℃、37 ℃条件下静置培养;(2)分别置于普通气体环境(空气)和含5%~10% CO2气体环境(烛缸法)中培养;(3)培养基NaCl浓度分别为5‰、10‰、15‰、20‰;(4)培养基葡萄糖浓度分别为2‰、5‰、10‰、15‰、20‰;(5)培养基二联吡啶(DPD,铁离子络合剂)浓度分别为0 mM、0.5 mM、1 mM;(6)培养基三氯化铁(FeCl3,铁离子添加剂)浓度分别为0 mM、1 mM、3 mM、5 mM。除了温度梯度实验组外,其他组皆于28 ℃静置培养。
取样前摇匀三角瓶内液体,测样前同样摇匀96孔板。每隔3 h,在无菌条件下,每瓶取液体培养物200 μL×3,以酶标仪测定其吸光度(595 nm),之后继续培养,连续取样21 h。以吸光度(OD)值代表菌液浓度,以时间(h)为横轴,OD值为纵轴,绘制生长曲线。未接种的培养液作为基底值。每个环境条件设置三个平行,取平均值作为绘图数据。
1.3胞外产物制备
采用平板玻璃纸法,制备胞外产物[11]。将活化后的海豚链球菌接种于BHI肉汤,28 ℃静置培养24 h;取1 mL液体培养物涂布于铺覆灭菌玻璃纸的BHI平板,28 ℃培养60 h;0.01 mol/L无菌磷酸盐缓冲液(PBS)洗下菌苔,收集菌悬液离心(8 000 g,20 min,4 ℃);上清经0.22 μm微孔滤膜除菌,并以截留分子量为8~14 kDa的透析袋于超纯水中4 ℃透析,冻干,以PBS重悬,考马斯亮蓝法测定蛋白浓度后,分装贮存于-20 ℃备用。
1.4SDS-PAGE
将不同培养条件下所得的海豚链球菌NUF849胞外产物进行SDS-PAGE。将胞外产物与电泳样品缓冲液等体积混匀,沸水浴10 min,冷却后上样,每泳道上样10 μg。采用Tris-甘氨酸电泳缓冲液,4 ℃条件下进行电泳。丙烯酰胺浓度 :分离胶10%(v/v)、浓缩胶4.75%(v/v)。设置浓缩胶部分恒定电流为30 mA,分离胶部分恒定电流为60 mA。电泳结束后,用凝胶经考马斯亮蓝R250常规染色,再用全自动凝胶成像系统扫描,观察各组胞外产物蛋白组成,利用Gel-Pro Analyzer软件分析各蛋白分子量。
2 结果
2.1不同培养条件下海豚链球菌的生长曲线
将海豚链球菌NUF849分别置于15 ℃、20 ℃、28 ℃和37 ℃下静置培养,发现28 ℃是NUF849的最适生长温度,其延滞期最短,最终生物量最高;20℃与37 ℃下细菌的生长状态相似生长速度较慢,生物量较少;15℃下细菌生长受到严重限制(图1-A)。
不同气体环境中的海豚链球菌NUF849生长状况差异不大,与普通气体环境条件相比,在含5%~10% CO2气体环境中,细菌较快进入指数生长期,但最终得到的生物量略低(图1-B)。
培养基中NaCl含量为5‰时,海豚链球菌NUF849的最终生物量最高,随着盐度的升高(10‰、15‰和20‰),生物量依次递减(图1-C)。
培养基中葡萄糖含量为2‰时,海豚链球菌NUF849的最终生物量最高,5‰葡萄糖含量较2‰时更快进入指数增长期,但最终生物量略低;随葡萄糖含量从10‰、15‰、20‰逐渐升高,最高生物量依次递减(图1-D)。
培养基中添加FeCl3和DPD后,海豚链球菌NUF849的生长皆受到抑制,其最终生物量明显低于BHI培养基条件下的生物量(图1-E、F)。随着FeCl3浓度的升高,细菌生长速度和生物量均逐渐降低(图1-E);添加0.5 mM DPD会减缓细菌的生长速度,但得到的最高生物量与BHI培养条件下相当,而1.0 mM DPD使最终生物量明显降低(图1-F)。
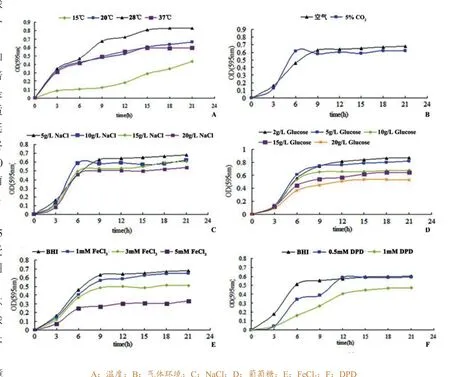
图1 不同培养条件下海豚链球菌的成长曲线
2.2不同培养条件下海豚链球菌胞外产物蛋白组成的变化
温度对海豚链球菌NUF849胞外产物的蛋白组成和丰度有显著影响(图2-A),28 ℃时胞外产物蛋白条带最为丰富,主要蛋白条带有92 kDa、68 kDa、62 kDa、57 kDa、50 kDa、46 kDa、42 kDa、38 kDa、37 kDa、36 kDa、30 kDa、27 kDa 和24 kDa等;15 ℃时胞外产物蛋白条带最少,仅68 kDa一条较为明显且丰度较高;20 ℃时胞外产物蛋白条带较28 ℃时减少,各条带丰度降低;37℃时92 kDa、37 kDa、36 kDa等蛋白条带丰度明显降低,但88 kDa、46 kDa、38 kDa、20 kDa等条带丰度较 28 ℃时略有增加。
CO2对NUF849胞外产物的蛋白组成有较大影响(图2-B)。与普通气体环境相比较,在5%~10%CO2气体环境中,除92 kDa、88 kDa、62 kDa、37 kDa和27 kDa等蛋白条带丰度上升外,其余蛋白条带丰度均呈下降趋势。
培养基中NaCl或葡萄糖含量的改变,均使NUF849胞外产物的蛋白组成产生变化(图2-C、D)。与BHI相比较(内含5‰NaCl、2‰葡萄糖),10‰NaCl含量使胞外产物蛋白条带明显减少,仅48 kDa、37 kDa蛋白条带丰度上升,15‰NaCl含量使大部分蛋白条带丰度降低但57 kDa、37 kDa和27 kDa条带的丰度上升;5‰葡萄糖含量丰富了胞外产物蛋白条带,且提高了68 kDa、57 kDa、37 kDa和27 kDa等条带的丰度,10‰葡萄糖含量具有相似效果,而20‰葡萄糖含量对胞外产物的分泌有抑制作用,所有蛋白条带丰度均下降。
培养基中添加DPD和FeCl3使海豚链球菌NUF849胞外产物蛋白条带较BHI培养基条件下明显减少(图2-E),但1 mM DPD使分子量为27 kDa的蛋白丰度增大,0.05 mM DPD使 25 kDa以下的小分子量蛋白丰度略有增加;随FeCl3浓度增大,胞外产物各蛋白条带数量明显降低,5 mM FeCl3条件下仅27 kDa蛋白条带较为明显。
3 讨论
本文以BHI培养基在不同环境条件下培养海豚链球菌,测绘生长曲线,研究了海豚链球菌NUF849对环境条件的群体反应,利用SDS-PAGE分析了这些环境条件下海豚链球菌胞外产物的蛋白组成变化,发现海豚链球菌的生长状态与胞外产物组成均与外界环境紧密相关。在海豚链球菌生长状态好、生物量高的环境条件下,其所产生的胞外产物也最丰富。因此可通过调节环境条件来调整海豚链球菌的生长状态。
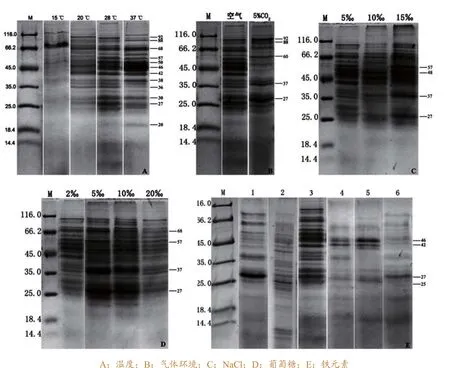
图2 不同培养条件对海豚链球菌NUF849胞外产物的影响
资料显示,由海豚链球菌引发的海水养殖鱼类链球菌病多发生于夏季高温期,20 ℃以下较少发病[12]。本研究中,28 ℃ BHI培养基条件下的海豚链球菌生长最快,胞外产物蛋白条带也最为丰富,与海豚链球菌在28℃易引发疾病的实际情况相对应,说明28 ℃时海豚链球菌产生的胞外产物中可能含有较多致病因子。本实验室前期研究[8]发现,28 ℃时以普通BHI培养基培养的海豚链球菌所分泌的胞外产物中,分子量为36 kDa的蛋白条带仅存在于强致病性毒株的胞外产物中,分子量为24 kDa、30 kDa、38 kDa、46 kDa、50 kDa、62 kDa 及88 kDa等蛋白条带具有抗原性,推测以上蛋白可能是海豚链球菌侵染宿主过程中的重要参与者。本研究中的海豚链球菌胞外产物蛋白组成与前期研究结果一致[8]。通过研究温度对海豚链球菌的影响发现,与28 ℃相比较,温度降至20℃时海豚链球菌生长受到抑制,上述抗原性蛋白条带丰度有所下降,15℃时大部分蛋白条带消失,37 ℃时88 kDa、46 kDa、38 kDa蛋白条带丰度增大,而36 kDa蛋白条带仅在28 ℃和37 ℃条件下出现,即在较高温度下,胞外产物蛋白组成相对较丰富,且丰度较高。这些结果说明温度对海豚链球菌生长及胞外产物分泌影响较大,较高温度下的胞外产物蛋白组成更丰富,胞外产物蛋白组成与丰度随温度变化可能导致其毒力变化,原因可能是不同环境温度下的海豚链球菌感染力不同,且主要在高温季节感染发病。
部分细菌荚膜的形成受CO2调控[13],A群链球菌部分毒力因子的分泌也受CO2浓度的影响[14],这说明CO2会影响细菌菌体蛋白和分泌蛋白的表达。本研究发现5%~10% CO2可诱导海豚链球菌胞外产物部分蛋白丰度产生变化。在上述具有抗原性的蛋白[8]中,88 kDa、62 kDa条带丰度上升,其余蛋白条带丰度均下降;但5%~10% CO2对海豚链球菌的生长无显著影响,可能是由于设定条件尚未超出菌株生长的耐受范围。葡萄糖和NaCl浓度梯度实验显示,5‰葡萄糖含量可促进菌株生长,丰富胞外产物蛋白条带,提高个别条带的丰度,但过量的葡萄糖(20‰)和高浓度NaCl均会抑制菌株的生长和胞外蛋白的表达分泌。在Tadahiro等的研究中也发现,化脓链球菌的部分毒力因子,如补体抑制剂、致热性外毒素、有丝分裂因子等的分泌会随葡萄糖和NaCl含量的增加而减少甚至消失[14]。同时研究发现,在铁元素富足时,A群链球菌许多蛋白表达量降低[14],而M蛋白的表达会因铁元素的缺失受到抑制[15]。本研究中,添加铁离子或铁离子螯合剂均使胞外产物蛋白条带减少,说明培养基中铁离子过多或缺失均对海豚链球菌胞外产物的分泌有抑制作用。另外,当培养基中NaCl、葡萄糖及铁离子浓度发生变化时,上述具有抗原性的蛋白条带[8]的丰度均呈现下降趋势,并且均导致36 kDa蛋白缺失。本研究结果说明气体环境以及培养基的盐度、葡萄糖含量、铁元素含量等培养条件的变化也直接影响海豚链球菌胞外产物蛋白组成和丰度,但至于这些蛋白组成与丰度变化如何影响海豚链球菌的毒力特性还有待进一步研究。
参考文献:
[1]杜佳垠. 海水养殖鱼类链球菌病[J]. 渔业现代化,2001 (5):28-29.
[2]张俊,周树明,李安兴. 广东省养殖罗非鱼、海鲈、尖吻鲈海豚链球菌感染调查[J]. 中国水产科学,2012,19(1):16-161.
[3]Kim M S,Jin J W,HanH J,et al. Genotype and virulence of Streptococcus iniae isolated from diseased olive flounder Paralichthy solivaceus in Korea[J]. Fisheries Science,2014,80:1277-1284.
[4]周德庆. 微生物学教程[M]. 2版. 北京:高等教育出版社,2002:285-286.
[5]Zhou K,Cui T T,Li P L,et al.Modelling and predicting the effect of temperature,water activity and pH on growth of Streptococcus iniae in Tilapia [J]. Journal of Applied Microbiology,2008,105:1956-1965.
[6]Lei B F,Mackie S,Lukomski S,et al. Identification and Immunogenicity of Group A Streptococcus Culture Supernatant Proteins [J]. Infection and Immunity,2000,68(12):6807-6818.
[7]赵娜,唐小千,绳秀珍,等. 海豚链球菌3种免疫原对牙鲆血细胞吞噬及SOD、POD和ACP活力的影响[J]. 中国海洋大学学报,2012,42(4):33-40.
[8]孙敏,唐小千,赵娜,等.海豚链球菌胞外产物的抗原性及免疫保护效果研究[J]. 中国海洋大学学报,2015,45(4):35-39.
[9]费辰杰,赵娜,唐小千,等. 海豚链球菌及其胞外产物诱导的牙鲆血清抗体应答分析[J]. 海洋湖沼通报,2015(1):73-78.
[10]汪笑宇,战文斌,刑婧,等. 豚链球菌和停乳链球菌类M蛋白及其抗原性分析[J]. 水产学报,2008,32 (6):945-949.
[11]Liu P C,Chen Y C,Lee K K. Pathogenicity of Vibrio alginolyticus isolated from diseased small abalone Haliotis diversicolor supertexta [J]. Microbios,2001,104(408):71-77.
[12]战文斌,绳秀珍. 海水养殖鱼类疾病与防治手册[M].1版.北京:海洋出版社. 2010:67-71.
[13]Makino S,Sasakawa C,Uchida I,et al.Cloning and CO2-dependent expression of the genetic region for encapsulation from Bacillus anthracis[J].Journal of Enterprise Information Management,1988,2(3):371-376.
[14]Nakamura T,Hasegawa T,Torii K,et al.Two-dimensional gel electrophoresis analysis of the abundance of virulent exoproteins of group A streptococcus caused by environmental changes [J]. Archives of Microbiology,2004,181:74-81.
[15]McIver K S,Heath A S,Scott J R. Regulation of virulence by environmental signals in Group A Streptococci:infl uence of osmolarity,temperature,gas exchange,and iron limitation on emm transcription [J]. Infection & Immunity,1995,63(11):4540-4542.
(责任编辑:朱迪国)
Effects of Culture Conditions on Growth of Streptococcus iniae and Protein Compositions of Its Extracellular Products
Liu Haibo,Sheng Xiuzhen,Tang Xiaoqian,Xing Jing,Zhan Wenbin
(The Key Laboratory of Mariculture,Ministry of Education,Ocean University of China,Qingdao,Shandong 266003)
Abstract:In this paper,the growth of Streptococcus iniae NUF849 under different culture conditions were studied,and the extracellular products(ECPs)of S.iniae were obtained using plate culture technique with their protein compositions profi led through SDS-PAGE. The results showed that the optimal growth of S. iniae and protein excretion of ECPs were detected under 28℃,and the bands of ECPs mainly included 92 kDa,88 kDa,68 kDa,62 kDa,57 kDa,50 kDa, 46 kDa,42 kDa,38 kDa,37 kDa,36 kDa,30 kDa,27 kDa and 24 kDa protein,while some protein abundance were reduced with the temperature increasing or decreasing;Compared to ordinary gaseous environment,there was no significant effect on the growth of S. iniae with 5%~10% CO2,but the protein bands of ECPs was reduced,although the abundance of several bands with molecular weight of 92 kDa,88 kDa,62 kDa,37 kDa and 27 kDa increased;The maximal biomass could be got when the medium contained 2‰ glucose and 5‰ NaCl,and the bands of ECPs were enriched at 5‰ and 10‰ of glucose with the protein abundance of 68 kDa,57 kDa,37 kDa and 27 kDa.However,20‰ of glucose and over 10‰ of NaCl inhibited the growth of S. iniae and the secretion of ECPs proteins. In addition,the growth of S.iniae was obviously inhibited and the bands of ECPs proteins were signifi cantly decreased when DPD or FeCl3was added to the mediumas compared with BHI medium.The results revealed that the temperature,gaseous environment,salinity,glucose content and iron content in the medium had important effects on the growth of S.iniae and protein excretion of its ECPs,which would help us to have better understanding of responds of S. iniae to the condition changes and its pathogenesis. Key words: Streptococcus iniae;culture condition;growth status;extracellular product;protein composition
中图分类号:S941.42
文献标识码:B
文章编号:1005-944X(2016)05-0085-05
DOI:10.3969/j.issn.1005-944X.2016.05.026
基金项目:国家科技支撑计划课题(2012BAD17B01)、山东省科技发展计划项目(2014GNC111015)、山东省自主创新及成果转化专项项目(2014ZZCX06205)
通讯作者:绳秀珍

