非洲猪瘟病毒p54蛋白的表达及单抗制备
冯春燕,宋晓晖,仇松寅,王淑娟,王彩霞,张永宁,邓俊花,吴绍强,林祥梅(. 中国检验检疫科学研究院动物检疫研究所,北京 0009;. 中国动物疫病预防控制中心,北京004;. 中国动物卫生与流行病学中心,山东青岛660)
非洲猪瘟病毒p54蛋白的表达及单抗制备
冯春燕1,宋晓晖2,仇松寅1,王淑娟3,王彩霞1,张永宁1,邓俊花1,吴绍强1,林祥梅1
(1. 中国检验检疫科学研究院动物检疫研究所,北京 100029;2. 中国动物疫病预防控制中心,北京100142;3. 中国动物卫生与流行病学中心,山东青岛266032)
摘 要:为制备非洲猪瘟病毒p54蛋白的单克隆抗体,本研究扩增p54蛋白的胞外区编码基因,分别克隆到pET30a和pGEX-6p-1中,构建了p54-pET30a和p54-pGEX-6p-1重组质粒;将质粒分别转化到大肠杆菌BL21中,表达C末端带6个His、N端带有GST的p54重组蛋白;利用亲和层析的方法,富集和纯化带His标签的p54蛋白;以带His标签的p54蛋白为抗原,免疫BALB/C小鼠,制备单克隆抗体;以带有 GST标签的p54蛋白为抗原,对制备的单抗进行特异性验证。结果显示:大肠杆菌能高效表达带His标签和GST标签的非洲猪瘟p54蛋白;His标签的p54蛋白免疫BALB/C小鼠后,得到了3株单克隆抗体;Western blot结果表明,3株单克隆抗体能与带有GST标签的p54蛋白相互反应。本研究成功制备了p54的单克隆抗体,为进一步开展非洲猪瘟ELISA、Western blot和细胞免疫荧光检测技术的开发研究奠定了基础。
关键词:非洲猪瘟病毒;p54蛋白;体外表达;单克隆抗体
非洲猪瘟(African swine fever,ASF)是由非洲猪瘟病毒(African swine fever virus,ASFV)引起的,一种猪的急性、热性、高度接触传染性疾病,可以跨境传播[1]。ASFV为DNA病毒,属于非洲猪瘟病毒科、非洲猪瘟病毒属。病毒具有二十面体结构,主要由4层组成:中央核仁、核衣壳、内层囊膜和二十面体的病毒衣壳。病毒衣壳还包裹一层来源于宿主的外囊膜。进一步的分子生物学研究显示,ASFV基因组全长170 101 bp核苷酸,含有151~167个ORFs。目前已经发现的结构蛋白有54个,包括p72、p54、p30等[2-3]。
p54蛋白由ASFV的E183L基因编码,全长含有552个碱基,预测分子量大小为19.9 bp。p54蛋白在病毒的复制过程中起着重要作用,能够引起宿主细胞的凋亡,也是病毒包装必需的蛋白。ASFV感染细胞后,p54蛋白在内质网膜处短暂表达,在病毒复制过程中通过其独特的半胱氨酸形成以二硫键连接的同源二聚体,与宿主的细胞质动力蛋白结合,介导细胞转运[6]。p54蛋白的跨膜结构在病毒蛋白经内质网膜转化成病毒包膜前体时起十分重要的作用。p54蛋白也是血清学诊断和免疫学研究中备受关注的蛋白。研究表明,以p54蛋白为检测抗原建立的检测方法具有高度敏感性和特异性[7]。
目前在我国还未发现ASF感染病例。因缺乏有效的疫苗及防控措施,使得ASF精准检测方法的研究具有重要的意义。本研究利用大肠杆菌表达系统表达带有His标签的非洲猪瘟p54蛋白,利用纯化后的p54蛋白来制备单克隆抗体。利用带有GST标签的p54蛋白对抗体特异性进行验证。本研究将为建立ASF的ELISA方法、细胞免疫荧光检测方法和Western blot方法做好基础准备。
1 材料与方法
1.1酶类、试剂和引物
NdeI、Bam HI、Xho I和PCR相关试剂等,购自大连宝生物工程有限公司;蛋白质marker、IPTG和Western blot 发光液等,购自北京全式金生物技术有限公司;His单抗及辣根酶标记的小鼠IgG二抗,购自北京中杉金桥生物技术有限公司;引物由生工生物工程股份有限北京分公司合成。测序由北京华大基因研究中心有限公司完成。
1.2非洲猪瘟p54表达载体的构建
参考NCBI中ASFV的E75(GenBank:FN557520.1)毒株的p54基因序列,在大连宝生物公司合成p54基因后,直接连接至载体pBR322上,作为后续p54基因扩增的模板。将表达载体pET30a及pGEX-6p-1转化至DH5a感受态细菌,用LB液体培养基大量培养后,提取质粒作为克隆载体。在p54基因两端分别设计带有限制性内切酶的位点,引物序列如表1所示。
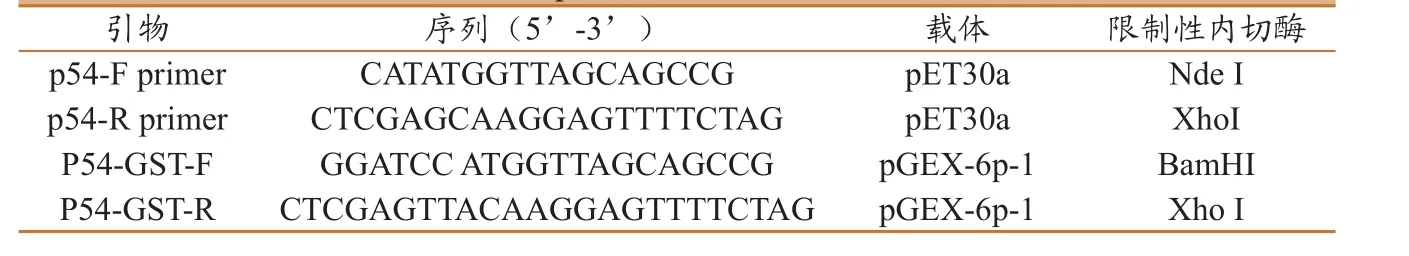
表1 p54 克隆的引物序列
利用设计的引物扩增目标p54片段,将提取的载体(pET30a及pGEX-6p-1质粒)和p54片段分别用相应的酶进行双酶切后,使用DNA胶纯化试剂盒纯化酶切的p54基因片段和载体片段。在连接酶作用下,将酶切的p54基因片段和载体片段进行连接,于4℃过夜,然后将连接产物转化大肠杆菌DH5a感受态细菌,挑取单菌落,提取重组质粒进行测序分析。构建的阳性质粒分别为p54-pET30a 和p54-pGEX-6p-1。
1.3蛋白的表达
将p54-pET30a转化至大肠杆菌BL21(DE3)感受态中,挑取单菌落至LB液体培养基中,37℃振荡培养过夜,然后取过夜培养物。新鲜的LB培养液以1:100(体积比)的比例重新接种,37 ℃振荡培养至OD600为0.4~0.6,然后加入1mM的IPTG,16 ℃诱导8 h,收菌。进行SDS-PAGE凝胶电泳,用考马斯亮蓝染色,观察表达结果。
将p54-pGEX-6p-1质粒转化至大肠杆菌BL21 (DE3)感受态中,用上述同样的方法37 ℃或者16 ℃进行诱导表达,收菌,进行SDS-PAGE凝胶电泳,用考马斯亮蓝染色,观察表达结果。
1.4蛋白的纯化
利用Qiagen的Ni-NTA Argarose(cat.30210)使用说明进行p54蛋白的纯化。简要流程为:收集大量表达带His标签的p54的菌液,用无菌的PBS洗涤2遍,然后利用超声破碎仪进行破碎,高速离心,收集细胞上清。将上清与预先处理好的Ni-NTA Argarose在4 ℃结合过夜,去掉流穿液,用PBS洗涤,去除杂蛋白。利用含有10 mM、20 mM、40 mM、60 mM、80 mM、100 mM、150 mM和200 mM的含有咪唑的洗涤液,对Ni-NTAArgarose进行洗涤,收集洗脱液,进行SDS-PAGE凝胶电泳,观察纯化结果。将纯度较高的p54蛋白合并浓缩。
1.5单克隆抗体的制备
将纯化的带His标签的p54蛋白50 ug加佐剂,免疫BALB/C小鼠,进行单克隆抗体的制备。3周后重复免疫一次,再3周后最后一次加强免疫。3天后,取脾细胞,进行融合筛选。包被p54蛋白,利用ELISA方法进行杂交瘤细胞的筛选。对筛选阳性的细胞扩繁,取上清,然后进行进一步的验证。
1.6单克隆抗体的验证
将含表达p54蛋白(GST标签)的全菌蛋白经SDS-PAGE电泳后转移至PVDF膜上,用含有5%脱脂奶粉的PBST于4 ℃封闭过夜;用PBST洗涤膜3次后加入一抗(细胞上清),于4 ℃缓慢摇动过夜;再用PBST洗涤膜3次后加入辣根过氧化物酶标记的羊抗鼠IgG(1:5 000稀释),室温结合1 h;用PBST洗涤膜3次,加入显色试剂反应,压片并显影。
1.7p54蛋白的抗原表位的预测
将表达的p54蛋白的序列输入到蛋白质表位预测网站进行表位预测(http://www.cbs.dtu.dk/services/ BepiPred/)。将同样的序列输入二级结构预测网站(http://bioinf.cs.ucl.ac.uk/psipred/),整理预测结果。
2 结果
2.1P54蛋白的克隆及质粒鉴定
对P54蛋白的全长进行跨膜区预测,结果如图所示(图1A)。全长蛋白的31位至54位为一段跨膜区。由于带跨膜区的蛋白在大肠杆菌中很难表达,因此本研究对p54蛋白进行截短,去掉蛋白的跨膜序列(图1B),仅表达p54基因的162~549位的基因序列。对这一段序列进行PCR扩增,然后用限制性内切酶进行酶切,分别连接到pET30a 和pGEX-6p-1中。阳性质粒经测序表明,p54基因162位到549位的核苷酸序列成功连接到表达载体pET30a和pGEX-6p-1中,且p54-pET30a表达的p54蛋白C末端增加了6个His氨基酸,便于蛋白的纯化。
2.2p54蛋白的表达及纯化
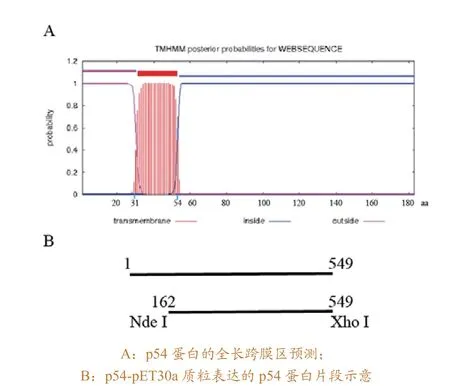
图1 p54的跨膜区预测及表达片段示意
重组质粒转化大肠杆菌,16℃条件下,经IPTG诱导后,表达情况图2 所示。结果表明,与不含重组质粒的BL21菌液对照相比,含有质粒的BL21菌液在25 kd的蛋白marker下有一条明显的条带。该条带很可能为带有His标签的目的条带。对菌种进行扩大培养,利用Ni-NTA agrose对带标签的蛋白进行纯化,结果如图3所示。结果表明,咪唑浓度在40 mM到100 mM时,得到目标大小的蛋白纯度较高。
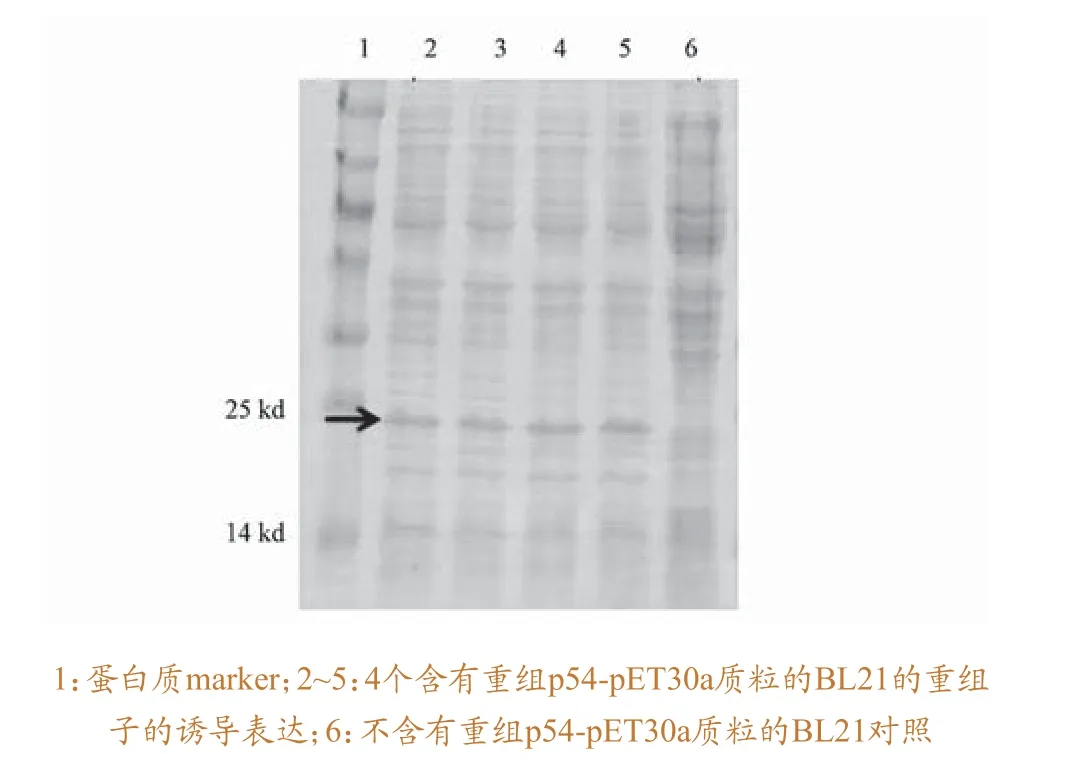
图2 p54蛋白的表达
2.3p54蛋白的验证
为了进一步验证所得到的蛋白为带His标签的p54蛋白,本研究利用His单抗为一抗进行Western blot验证,结果如图4所示。结果表明,在15~25 kd的大小,有非常清晰的带His标签的蛋白出现。结合质粒的测序结果,可以证实该蛋白为p54蛋白。
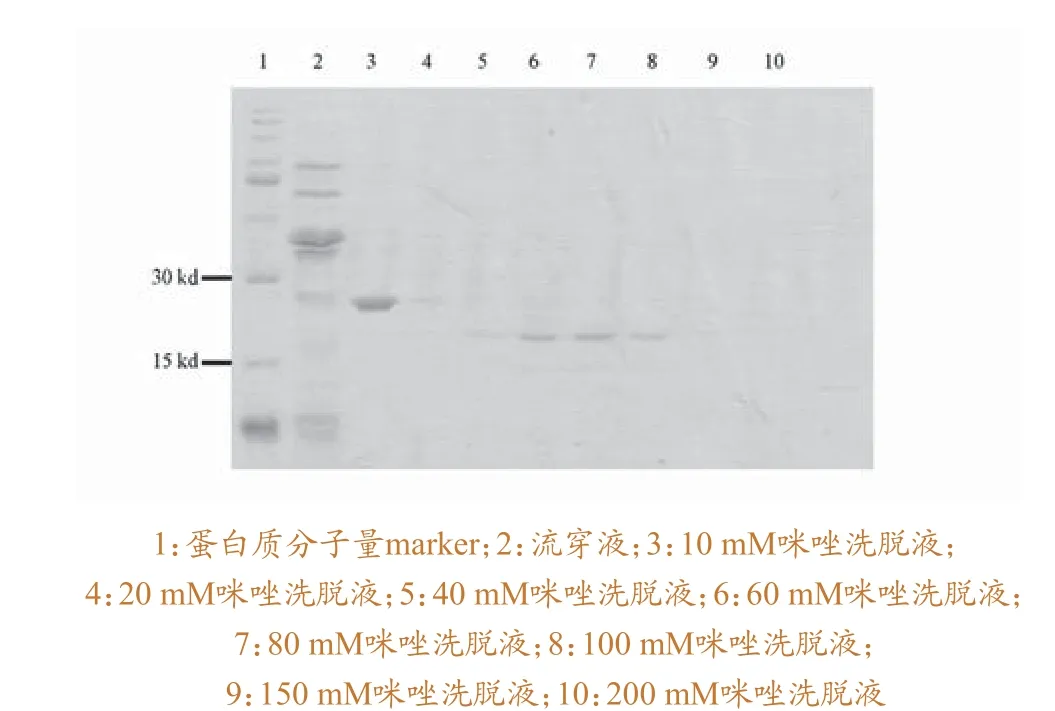
图3 p54蛋白的纯化
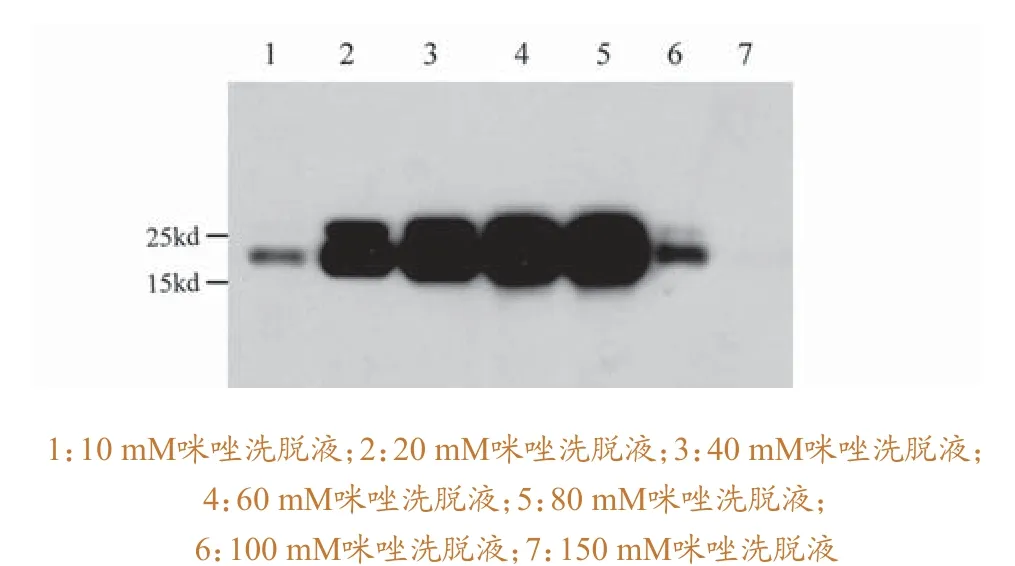
图4 p54蛋白His 单抗的Western blot验证
2.4p54蛋白单克隆抗体的验证
为了验证制备的单抗,本研究构建了p54-pGEX6p-1表达载体,将质粒转入BL21表达菌株进行蛋白表达。结果如图5A所示,在40~50 kd有明显的表达带,与p54-GST融合蛋白的大小相符。将表达的p54-GST蛋白与制备的上述单克隆抗体细胞上清(分别命名为1号、3号和4号)进行Western blot杂交。结果表明(图5B),单克隆抗体的细胞上清能与3株细胞上清相互反应,大小在40~50 kd之间,与P54-GST融合蛋白的大小相符。2.5 p54蛋白质B细胞表位及二级结构的预测
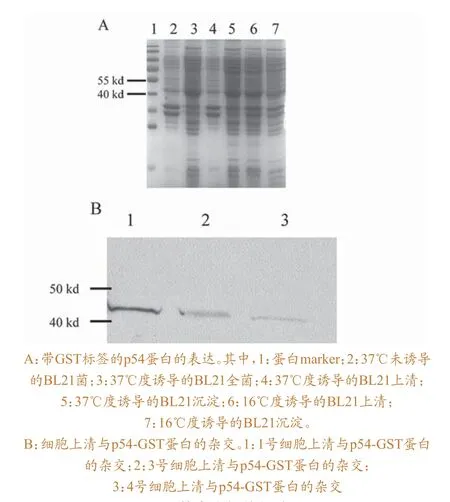
图5 单克隆抗体的验证
对p54的抗原性预测表明,p54具有很强的抗原性。对B细胞识别表位的预测表明,表达的130个氨基酸中,有101个氨基酸可能参与了B细胞表位的形成。这101个氨基酸分别分布在4个不同的区段。对这些区段进行二级结构预测,结果发现,除了在第一个区段为螺旋结构外,其它区段的二级结构均为无规则卷曲(表2)。
3 讨论
ASFV可以感染各年龄段的家猪和野猪。缺乏有效的疫苗是目前防治该疫病面临的最大问题。有研究利用细胞传代获得致弱病毒作为疫苗候选,并在猪中进行攻毒试验,结果表明该致弱病毒只能对同源病毒的感染起保护作用,对异源病毒的保护性有限。有研究将病毒的9GL基因进行敲除,结果表明敲除了该基因的病毒能够复制并具有很好的保护效应,但该研究结果尚未应用[8]。在这种形势下,建立精准的检测方法是防止该病传入我国的重要手段之一。而制备高特异性的单克隆抗体对建立ASF血清学检测方法具有重要意义。

表2 p54蛋白的B细胞表位及二级结构预测
ASFV属于DNA病毒,目前对其分子生物学的研究并不深入。研究表明,p72、p30和p54是重要的抗原蛋白,都能够激发宿主产生抗体[9]。经过跨膜结构预测(图1A)及已有的报道,p54蛋白为跨膜蛋白,全长在大肠杆菌中无法表达。为了解决这一问题,本研究截取了p54的胞外段,即氨基酸N末端54位到C末端183位的氨基酸序列(图1B),进行体外表达,并作为抗原进行单抗制备。根据已有报道,体外表达的可溶序列与感染的猪血清进行western blot反应,结果证实这段体外表达的序列具有抗原性[10-11]。但是,ASF为外来病,目前国内并没有该病毒的阳性血清,因此无法利用阳性血清来验证表达的蛋白是否为所需的重组蛋白。但由于重组蛋白含有His标签,对融合表达的p54 C末端的His标签进行检测,结合蛋白的大小来判断所纯化的蛋白是否为p54蛋白(图3)。
利用带GST标签的p54对得到的单抗进行进一步筛选。研究结果显示,本研究得到了3株特异性较好的单克隆抗体。由于利用Western blot方法进行抗体的特异性鉴定,因此可以断定这些单抗可以识别p54蛋白的线性表位。这3株单抗是否识别同一表位,以及识别序列的具体信息将在今后的研究中进一步探索。
p54的生物信息学预测显示,所表达的130个aa中,有101个aa参与了B细胞表位的形成。这些表位主要集中在4个区域内(表2)。由于B细胞抗原表位的形成[12]有一些自身特点,如:(1)主要由抗原表面的亲水性氨基酸残基组成;由连续的或不连续的氨基酸残基组成。(2)B表位通常位于抗原分子的柔性区,具有可动性,这一特点有利于表位和抗体结合部位呈现最佳的结构互补状态,增强结合的亲和力。据此推测,表位在2~4区域内存在的可能性较大,这也为在未来的研究中进一步分析单抗的抗原表位提供了有用的线索。
综上所述,本研究通过大肠杆菌表达系统表达了p54蛋白的保外区,获得了p54蛋白的单克隆抗体。实验结果为ASFV的western blot、ELISA及细胞免疫荧光等检测方法的建立,疫苗研发以及ASFV分子生物学的深入研究奠定了基础。
参考文献:
[1] Penrith M L. African swine fever: transboundarydiseases[J]. Onderstepoort Journal of Veterinary Research,2009,76(1):91-95.
[2] Dixon L K,Chapman D A G,Netherton C L,et al. African swine fever virus replication and genomics[J]. Virus research,2013,173(1):3-14.
[3] Malogolovkin A,Burmakina G,Titov I,et al. Comparative analysis of African swine fever virus genotypes and serogroups[J]. Emerging infectious diseases,2015,21(2):312.
[4] Costard S,Mur L,Lubroth J,et al. Epidemiology of African swine fever virus[J]. Virus Research, 2013,173(1):191-197.
[5] Anderson E C,Hutchings G H,Mukarati N,et al. African swine fever virus infection of the bushpig(Potamochoerusporcus)and its signifi cance in the epidemiology of the disease[J]. Veterinary microbiology,1998,62(1):1-15.
[6] Hernáez B,Dı az-Gil G,Garcı a-Gallo M,et al. The African swine fever virus dynein-binding protein p54 induces infected cell apoptosis[J]. FEBS letters,2004,569(1):224-228.
[7] Rodriguez F,Ley V,Gómez-Puertas P,et al. The structural protein p54 is essential for African swine fever virus viability[J]. Virus research,1996,40(2):161-167.
[8] O'Donnell V,Holinka L G,Krug P W,et al. African Swine Fever Virus Georgia 2007 with a Deletion of Virulence-Associated Gene 9GL (B119L),when Administered at Low Doses,Leads to Virus Attenuation in Swine and Induces an Effective Protection against Homologous Challenge[J]. Journal of Virology,2015,89(16):8556-8566.
[9] Neilan J G,Zsak L,Lu Z,et al. Neutralizing antibodies to African swine fever virus proteins p30,p54,and p72 are not suffi cient for antibody-mediated protection[J]. Virology,2004,319(2):337-342.
[10] Hou Y,Dong Z,Zhao X,et al. Prokaryotic expression of African swine fever virus P54 gene [J]. Chinese Veterinary Science,2009(4):8.
[11] 龚振华,王丽萍,臧京帅,等. 非洲猪瘟病毒p54 蛋白的高效表达及在 ELISA 中的应用[J]. 畜牧兽医学报,2013,44 (11):1832-1837.
[12] 梁瑾,王靖飞. B细胞表位预测方法研究进展[J]. Chinese Bulletin of Life Sciences,2009, 21(2):320-322.
(责任编辑:朱迪国)
Expression and Purifi cation of p54 Protein of Africa Swine Fever Disease and Production of Its Specifi c Monoclonal Antibodies
Feng Chunyan1,Song Xiaohui2,Qiu Songyin1,Wang Shujuan3,Wang Caixia1,Zhang Yongning1,Deng Junhua1,Wu Shaoqiang1,Lin Xiangmei1
(1. Chinese Academy of Inspection and Qurantine,Institute of Animal Quarantine,Beijing 100029;2.China Animal Disease Prevention and Control Center,Beijing 100142;3.China Animal Health and Epidemology Center,Qingdao,Shandong 266032)
Abstract:This study was aimed to obtain the monoclonal antibodies of P54 protein of African swine fever virus(ASFV). Firstly,the outer-membrane segment of p54 gene was amplifi ed. Then the segment was cloned into pET-30a plasmid and pGEX 6p-1 plasmid respectively. Plasmids were further transformed into BL21E.coli,which could express the soluble P54 protein. Using affi nity chromatography method,the p54 protein was further purifi ed and used for monoclonal antibodies production. Western blot was used to verify the monoclonal antibodies. As shown in the results, 25 kd recombined protein was expressed by E.coli system. Using His specifi c antibody,Western blot experiment proved that this recombined protein was target p54 protein with his tag. After immunizing the mouse with purifi ed P54 protein,three monoclonal antibodies were obtained. Western blot experiment proved that all three monoclonal antibodies could be reacted with GST-p54 fusion proteins. This study will pave the way for further development of detection methods for ASFV,including ELISA,Western blot and immune-fl uorescent assay.
Key words:africa swine fever virus;p54 protein;in vitro expression;monoclonal antibodies
中图分类号:S855.3 文献标示码:A
文章编号:1005-944X(2016)05-0080-05
DOI:10.3969/j.issn.1005-944X.2016.05.025
基金项目:十二五科技支撑计划(2013BAD12B01);国家质检总局科技计划项目(2015IK310)
通讯作者:吴绍强,林祥梅

