儿茶酚抑素对心梗大鼠心肌纤维化的影响
陈继舜,闽新文,陈琴华
湖北医药学院附属东风医院a.心血管内科,b.实验中心,湖北 十堰 442008
*通信作者
儿茶酚抑素对心梗大鼠心肌纤维化的影响
陈继舜a,闽新文a,陈琴华b*
湖北医药学院附属东风医院a.心血管内科,b.实验中心,湖北 十堰 442008
[摘要]目的探讨儿茶酚抑素(CST)治疗对心梗(MI)大鼠心肌纤维化的影响。方法结扎SD大鼠冠状动脉前降支建立心肌梗死模型,将模型大鼠随机分为儿茶酚抑素组、心梗对照组,每组16只,另设假手术组16只。术后1 d开始,儿茶酚抑素组连续3周腹腔注射儿茶酚抑素2 nmol/(kg·d),心梗对照组和假手术组给予等量生理盐水腹腔注射。4周后,记录左室血流动力学改变;处死大鼠,留取心脏标本,Masson染色检测心肌纤维化;Western blot法检测梗死周边Ⅰ胶原蛋白表达。结果与心梗对照组比较,儿茶酚抑素组的心功能损害较轻(P<0.01),梗死百分比及胶原含量显著降低(P<0.05,P<0.01)。结论儿茶酚抑素能改善心脏功能,并能减轻心梗后非梗死区反应性胶原的过多沉积,预防心梗后心肌纤维化。
[关键词]儿茶酚抑素;心肌梗死;心肌纤维化
0引言
儿茶酚抑素(CST)是一个具有21个氨基酸残基的内源性多肽,其前体嗜铬颗粒蛋白A(CgA)广泛存在于心血管系统。研究表明,在急性冠脉综合征中,嗜铬颗粒蛋白A的循环水平为其提供独立的预后信息,预测随访期间其长期死亡率及心衰住院率[1]。而且,嗜铬颗粒蛋白A的血浆水平在心梗后患者升高[2]。儿茶酚抑素是嗜铬颗粒蛋白A活性肽之一,其在体内外均存在心血管活性,是乙酰胆碱刺激儿茶酚胺释放的非竞争性抑制剂[3],通过抑制儿茶酚胺的释放、升高循环中组胺水平而扩张血管[4]。高血压患者及其后代儿茶酚抑素水平降低[5],研究表明,外源性儿茶酚抑素能降低CgA基因敲除小鼠的血压[6]。近年研究显示,对用异丙肾上腺素或内皮素-1预处理的大鼠离体心脏,CST能引起冠状动脉收缩减弱及舒张[7]。结果表明,儿茶酚抑素是心功能和血压的一个新型调节剂。基于上述研究,我们推测,儿茶酚抑素在心梗心肌纤维化中也发挥着重要作用。由于尚缺乏儿茶酚抑素与心梗的研究,所以,笔者观察大鼠心梗后应用外源性儿茶酚抑素是否能改善心梗后心功能及减轻心梗后心肌纤维化。
1材料与方法
1.1心梗模型的建立健康雄性SD大鼠,体重200~250 g,随机分为心梗组(32只)和假手术组(16只),采用3%戊巴比妥钠进行腹腔注射麻醉大鼠,麻醉剂量为40 mg/kg,采用肢体导联进行大鼠心电图监测,气管插管后接小动物呼吸机(呼吸频率70次/min,潮气量4~5 mL),于第4、5肋间隙开胸,在肺动脉圆锥和左心耳之间进针,肺动脉圆锥侧出针,结扎冠状动脉前降支,结扎线以下区域立刻变成暗红色,同时Ⅰ、aVL导联ST段弓背向上抬高>0.2 mV,并持续0.5 h以上,说明结扎成功,关胸缝合。术后连续3 d肌肉注射青霉素80万U预防感染,假手术组中,除了不结扎左冠状动脉前降支,其余的处理方式与MI组相同。
1.2分组及给药将心梗组大鼠随机分为心梗对照组(16只)、儿茶酚抑素组(16只)和假手术组(16只),术后24 h开始给药,儿茶酚抑素组经腹腔注射儿茶酚抑素2 nmol/(kg·d),连续给药3周;心梗对照组和假手术组腹腔注射等量生理盐水,给药3周后处死动物检测相关指标。
1.3方法
1.3.1心功能参数测定麻醉后分离右颈总动脉,插入充满肝素生理盐水的导管,BL-420生物机能实验系统记录动脉收缩压(SBP),然后将导管缓慢插入左心室,记录左室舒张末期压(LVEDP)、左室压力上升最大速率(+dP/dtmax)和左室压力下降最大速率(-dP/dtmax)。
1.3.2心室相对重量测定大鼠处死后分别称取全心重量(Heart weight,HW)、左室重量(Left ventricular weight,LVW),除以体重(Body weight,BW)得到其相对重量。
1.3.3Masson染色检测心肌纤维化指标将石蜡切片在二甲苯中脱蜡,以梯度浓度的乙醇溶液脱水,分别用苏木山、丽春红酸性品红液、1%磷钼酸染色,然后苯胺蓝液复染,梯度浓度乙醇脱水,二甲苯透明,采用中性树胶封片,最后制成心肌组织Masson染色切片,置于60 ℃烘干,光学显微镜下观察。胶原纤维呈绿色,肌成纤维呈红色,红细胞呈橘红色。图像分析软件测定梗死面积并取均值,梗死面积=(疤痕内弧长+疤痕外弧长)/(外周长+内周长)×100%。
心肌胶原容积分数(CVF)及心肌血管周围胶原面积(PVCA)用Masson染色切片测定,CVF=视野中胶原面积(不含血管周围胶原)/心肌组织和结缔组织面积。每份标本在非梗死区随机选取非心内外膜心肌5个视野,取均值。PVCA=壁内小动脉管腔周围胶原面积/动脉管腔面积。每份标本取5个壁内小动脉横切面进行测量,取其均值。精确称取冻存心肌组织100 mg,按照试剂盒说明进行操作,检测羟脯氨酸含量,非梗死区心肌胶原含量=7.46×羟脯氨酸含量。
2结果
2.1心功能参数的变化心梗对照组和儿茶酚抑素组SBP、+dP/dtmax、-dP/dtmax均低于假手术组,LVEDP高于假手术组(P<0.01);儿茶酚抑素组SBP、+dP/dtmax、-dP/dtmax高于心梗对照组(P<0.05),LVEDP低于心梗组(P<0.01)。见表1。
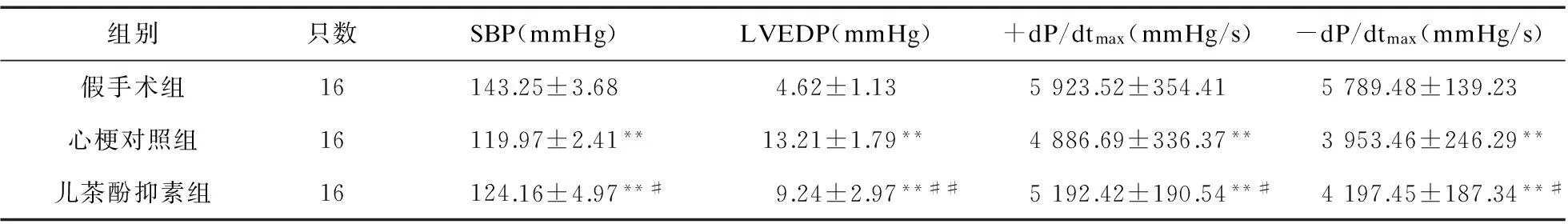
表1 儿茶酚抑素对大鼠心梗后血流动力学参数的影响
注:与假手术组比较,*P<0.05,**P<0.01;与心梗对照组比较,#P<0.05,##P<0.01
2.2左室相对重量、梗死面积心梗对照组左室及全心相对重量均重于假手术组(P<0.01);儿茶酚抑素组及全心相对重量明显轻于心梗对照组(P<0.05)。与心梗对照组比较,儿茶酚抑素组心肌梗死面积减小(P<0.05)。见表2。
2.3心肌纤维化及CVFMasson染色显示,胶原纤维被染成蓝色,心梗对照组大鼠心脏梗死区及梗死周边区域可见纤维增生、排列紊乱;儿茶酚抑素组大鼠心脏纤维增生较心梗对照组明显减弱,胶原纤维排列趋向于规则;假手术组纤维增生不明显。见图1。心梗对照组和儿茶酚抑素组的CVF、PVCA均高于假手术组(P<0.01);但儿茶酚抑素组明显低于心梗对照组(P<0.05)。见表3。
3讨论
急性心肌梗死是一种急性病理性损伤过程,对心脏的结构和功能破坏性极大。其并发症如心力衰竭、心律失常及心脏性猝死使心梗患者的生活质量大大降低,因而对于心梗患者,预防其并发症尤为重要[8]。研究表明,心梗后交感神经过度激活与心梗后恶性并发症的发生密切相关,心梗后心梗周边区域交感神经再生,激活亢进,儿茶酚胺释放增多,高浓度的儿茶酚胺促进心肌细胞凋亡,刺激心肌间质胶原增生,使心肌纤维化,发生室性重构,诱发心力衰竭和心律失常[9]。

图1 儿茶酚抑素对大鼠心梗后心肌纤维化的影响
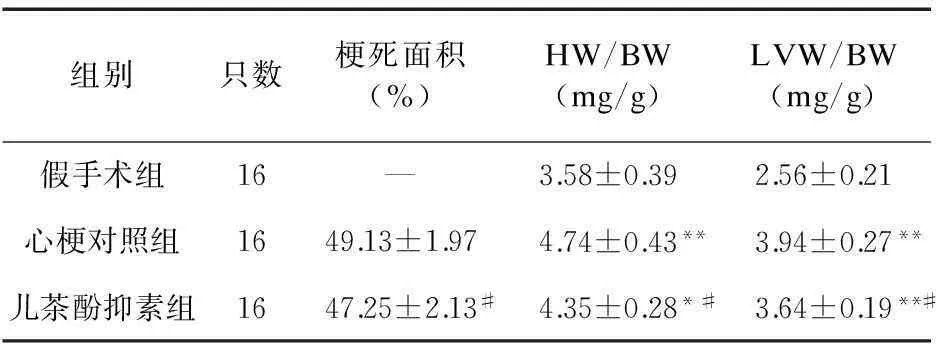
组别只数梗死面积(%)HW/BW(mg/g)LVW/BW(mg/g)假手术组16—3.58±0.392.56±0.21心梗对照组1649.13±1.974.74±0.43**3.94±0.27**儿茶酚抑素组1647.25±2.13#4.35±0.28*#3.64±0.19**#
注:与假手术组比较,*P<0.05,**P<0.01;与心梗对照组比较,#P<0.05
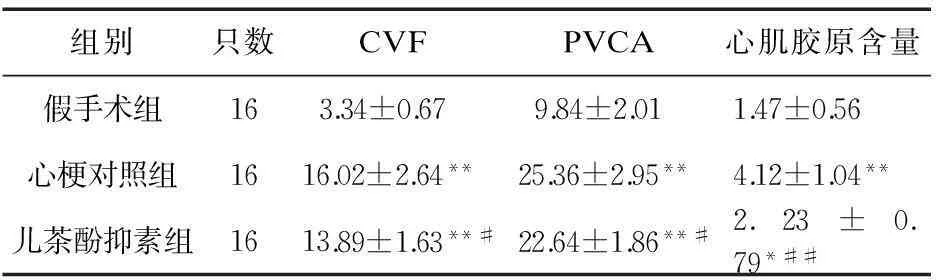
表3 儿茶酚抑素对大鼠心梗后CVP、PVCA及
注:与假手术组比较,*P<0.05,**P<0.01;与心梗对照组比较,#P<0.05,##P<0.01
CgA是48 kDa的酸性分泌蛋白,与儿茶酚胺、利钠肽广泛共存于脊椎动物的神经内分泌系统[10]及心血管系统[11]。CgA的血浆水平长期以来被作为神经内分泌肿瘤的生物学标记[12]。近年来,CgA也用来检测心血管功能异常如原发性高血压[1]、扩张性及肥厚性心肌病、心衰等[11]。通过翻译后的蛋白水解加工,CgA产生多种参与反向调节过程的生物活性肽[13]。儿茶酚抑素是嗜铬颗粒蛋白A活性肽之一。1988年Simon等首次发现,在离体培养的肾上腺髓质嗜铬细胞中,牛儿茶酚抑素能够以自分泌负反馈机制显著抑制乙酰胆碱刺激的儿茶酚胺释放[14]。后续研究发现,儿茶酚抑素可特异性、非竞争性地作用于全部神经元烟酸乙酰胆碱受体(Neuronal nincotinc acetylcholine receptor,nAChR)亚型,抑制儿茶酚胺分泌[15],改善缺血后心室功能,减少缺血再灌注损伤[16],降低交感活性,提高副交感活性,起改善心脏功能的作用[17]。因此,本试验旨在研究其是否能通过降低交感活性减轻心梗后心梗周边区域高儿茶酚胺所致的心肌纤维化。
本研究显示,与心梗对照组比较,儿茶酚抑素组SBP、+dP/dtmax、-dP/dtmax升高,LVEDP降低,全心相对重量减轻;大鼠心脏纤维增生减弱,胶原纤维排列趋向于规则。心梗对照组、儿茶酚抑素组的CVF及PVCA高于假手术组,而儿茶酚抑素组低于心梗对照组。表明外源注射儿茶酚抑素能改善心梗后心功能,减小梗死面积,降低心梗后心肌间质胶原蛋白的表达,明显改善心梗后心肌纤维化。本实验仅证实了儿茶酚抑素能改善心梗后心肌纤维化,但未深入探讨其机制,之后我们将从心肌纤维化信号调控机制进一步研究儿茶酚抑素抑制心梗后心肌纤维化的机制,以期为临床应用提供有力证据。
参考文献:
[1]Jansson AM,Røsjø H,Omland T,et al.Prognostic value of circulating chromogranin A levels in acute coronary syndromes[J].Eur Heart J,2009,30:25-32.
[2]Omland T,Dickstein K,Syversen U.Association between plasma chromogranin A concentration and long-term mortality after MI[J].Am J Med,2003,114:25-30
[3]Mahata SK,Mahata M,Fung MM,et al.Catestatin:a multifunctional peptide from chromogranin A[J].Regul Pept,2010,162:33-43.
[4]Kennedy BP,Mahata SK,O′Connor DT,et al.Mechanism of cardiovascular actions of the chromogranin A fragment catestatin in vivo[J].Peptides,1998,19:1241-1248.
[5]O′Connor DT,Kailasam MT,Kennedy BP,et al.Early decline in the catecholamine release inhibitory peptide catestatin in humans at genetic risk of hypertension[J].J Hypertens,2002,20:1335-1345.
[6]Mahapatra NR,O′Connor DT,Vaingankar SM,et al.Hypertension from targeted ablation of chromogranin A can be rescued by the human orthology[J].J Clin Invest,2005,115:1942-1952.
[7]Angelone T,Quintieri AM,Brar BK,et al.The antihypertensive chromogranin A peptide catestatin acts as a novel endocrine/paracrine modulator of cardiac inotropism and lusitropism[J].Endocrinology,2008,149:4780-4793.
[8]Massare J,BmTy JM,Luo X,et al.Diminished cardiac fibrosis in heart failure is associated with altered ventricular arrhythmia phenotype[J].J Cardiovasc Electrophysiol,2010,21:1031-1037.
[9]Wang Y,Xuan YL,Hu HS,et al.Risk of ventricular arrhythmias after myocardial infarction with diabetes associated with sympathetic neural remodeling in rabbits[J].Cardiology,2012,121(1):1-9.
[10]Helle KB.The chromogranin A-derived peptides vasostatin-I and catestatin as regulatory peptides for cardiovascular functions[J].Cardiovasc Res,2010,85:9-16.
[11]Pieroni M,Corti A,Tota B,et al.Myocardial production of chromogranin A in human heart:a new regulatory peptide of cardiac function[J].Eur Heart J,2007,28:1117-1127.
[12]O′Connor DT,Zhu G,Rao F,et al.Heritability and genome-wide linkage in US and Australian twins identifies novel genomic regions controlling the catecholamine release-inhibitory peptide catestatin[J].Circulation,2008,118:247-257.
[13]Helle KB,Corti A,Metz-Boutigue MH,et al.The endocrine role for chromogranin A:a prohormone for peptides with regulatory properties[J].Cell Mol Life Sci,2007,64:2863-2886.
[14]Simon JP,Bader MF,Aunis D.Secretion from chromaffin cells is controlled by chromograninA-derived peptides[J].Proc Nat Acad Sci USA,1988,85(5):1712-1716.
[15]Mahapatra NR,Mahata M,Mahata SK,et al.The chromogranin A fragment catestatin:specificity,potency and mechanism to inhibit exocytotic secretion of multiple catecholamine storage vesicle CO-transmitters[J].J Hypertens,2006,24(5):895-904.
[16]Theurl M,Schgoeo W,Albrecht K,et al.The neuropeptide catestatin acts as a novel angiogenic cytokine via a basic fibroblast growth factor-dependent mechanism[J].Circulation Research,2010,107(11):1326-1335.
[17]Kabadi SV,Ally A.Negative cardiotropism by catestatin and its variants[J].Endocrinology,2008,149(10):4778-4779.
Effect of catechol endostatin on myocardial fibrosis in rats with myocardial infarction
CHEN Ji-shuna,MIN Xin-wena,CHEN Qin-huab*
(a.Deparment of Vasculocardiology,b.Medical Experimental Center,Affiliated Dongfeng Hospital,Hubei University of Medicine,Shiyan 442008,China)
[Abstract]ObjectiveTo investigate the effect of catechol endostatin on myocardial fibrosis in rats with myocardial infarction (MI).MethodsMI model of Sprague-Dawley (SD) rat was established by ligating the left anterior descending coronary artery.Rats were randomly divided into MI group (n=16) and CST group (n=16),and 16 rats were chosen as sham group.Rats in CST group were given CST 2 nmol/(kg·d) ip for 3 weeks at first day after operation,while an equal amount of 0.9% normal saline was applied to MI group and sham group.The left ventricular hemodynamics was measured.Myocardial interstitial fibrosis was observed by Masson staining,and the peripheral collagen Ⅰ was detected by western blot.ResultsCompared with MI group,cardiac function damage was milder in CST group (P<0.01).Collagen content and infarct size decreased significantly(P<0.05,P<0.01).ConclusionCST can improve the cardiac function and reduce reactive myocardial fibrosis,thus preventing myocardial fibrosis.
Key words:Catechol endostatin;Myocardial infarction;Myocardial fibrosis
收稿日期:2015-07-08
基金项目:湖北省自然科学基金面上项目(2015CFB615);十堰市科学技术研究与开发项目(14Y59)
DOI:10.14053/j.cnki.ppcr.201604006

