miR-210通过下调JAK-STAT信号通路抑制胆囊癌细胞增殖的实验研究
陕西省安康市中心医院普外科(安康 725000) 邱 伟 杨成琳 刘 阳
miR-210通过下调JAK-STAT信号通路抑制胆囊癌细胞增殖的实验研究
陕西省安康市中心医院普外科(安康 725000)邱伟杨成琳 刘阳▲
摘要目的:探讨miR-210抑制胆囊癌细胞系GBC-SD增殖的机制是否与下调JAK-STAT通路有关。方法:Real-time PCR法检测10例胆囊癌与癌旁组织中miR-210、STAT3、STAT5的表达;采用LipofectamineTM2000将miR-210-mimic转染至胆囊癌GBC-SD细胞以及JAK-STAT信号通路特异性阻滞剂AG490处理GBC-SD细胞后,分别检测细胞内miR-210、STAT3、STAT5表达的变化,通过MTT实验、流式细胞仪检测miR-210对GBC-SD细胞增殖、细胞周期的影响。结果:胆囊癌组织中miR-210的表达低于癌旁组织,STAT3、STAT5的表达高于癌旁组织(P<0.05);miR-210转染、AG490处理后GBC-SD细胞内STAT3、STAT5的表达下降;miR-210将GBC-SD细胞阻滞于G0/G1期并抑制细胞增殖。结论:miR-210下调GBC-SD细胞内STAT3、STAT5的表达,通过阻滞JAK-STAT信号通路从而抑制GBC-SD细胞增殖。
主题词胆囊肿瘤/病理学微RNAsSTAT3转录因子 STAT5转录因子
胆囊癌是胆管系统常见的恶性肿瘤,是一种早期诊断困难、生存期较短、病死率较高的恶性肿瘤[1]。中晚期胆囊癌的根治手术疗效欠佳,辅助放化疗的治疗效果局限,5年生存率波动于5%~10%[2]。因此,寻找胆囊癌特异性的诊断标志物、有效的治疗靶点是目前胆囊癌的研究热点。有研究发现多种microRNA(miRNA)在胆囊癌组织与正常胆囊组织或癌旁组织中存在差异表达[3],miRNA是由18~24个核苷酸构成的内源性非编码小分子单链RNA,miRNA转录后参与调控血管生成、肿瘤侵袭和转移等过程[4]。已有研究证实miR-210可通过下调多种信号通路抑制肿瘤细胞增殖。本课题旨在研究miR-210在胆囊癌组织和癌旁组织中表达的差异,并从细胞分子水探讨miR-210抑制胆囊癌细胞系GBC-SD增殖的机制与下调JAK-STAT通路的关系,为探索胆囊癌潜在的治疗靶点提供理论支持。
材料与方法
1材料胆囊癌细胞系GBC-SD,购自中国科学院上海细胞生物学研究所;JAK-STAT信号通路特异性阻滞剂AG490,购自美国Sigma公司;miR-210-mimic、STAT3引物、STAT5引物、β-actin引物由上海生物工程技术服务有限公司合成;Trizol购自美国Amresco公司;转染试剂LipofectamineTM2000、Opti-MEM,购自美国Invitrogen公司。10例胆囊癌与癌旁组织(距癌灶边缘3 cm)均取自2012年1月至2014年12月我院普外科患者,所有组织标本均为手术切除并经过病理证实,10例胆囊癌患者平均年龄58.2±7.35岁,其中男6例,平均年龄61.3±8.45岁;女4例,平均年龄56.8±7.21岁。
2方法①Real-time PCR法检测胆囊癌与癌旁组织miR-210、STAT3、STAT5的表达:将胆囊癌与癌旁组织标本研磨成粉(研磨过程中加入少量液氮),使用Trizol法提取胆囊癌与癌旁组织总RNA并逆转录成cDNA,逆转录反应条件:42℃,15 min;95℃,2 min。利用 Primer Premier 5软件设计目的基因引物,引物序列通过BLAST进行比对均具有特异性,miR-210的上游引物序列为 CTGTGCGT-GTGACAGCGGCTGA,下游引物为通用引物Uni-miR real-time PCR引物;STAT3上游引物5′-TTTGGAGGCAGGAATAGG-3′,下游引物5′-TGGCTTGACGGGTTGAT-3′;STAT5上游引物5′-TTTGGAGGCAGGAATAGG-3′,下游引物5′-TGGCTTGACGGGTTGAT-3′;β-actin上游引物5′-CCAGGTCATCACCATCGG-3',β-actin下游引物5′- CCGTGTTGGCGTAGAGGT-3′。以cDNA为模版,β-actin为内参,使用SYBR Primix Ex Taq Ⅱ( TaKaRa试剂盒) 进行Real-time PCR检测,反应条件:95℃预变性3 min;95℃变性15 s,60℃退火15 s,72℃延伸40 s,总计40个循环。根据公式 Folds=2-△△Ct来计算目的基因的相对表达量,其中△△Ct=(Ct检测基因-Ctβ-actin)实验组-(Ct检测基因-Ctβ-actin)对照组。②miR-210-mimic转染 GBC-SD细胞:用DMEM完全培养基(含5 %胎牛血清、青霉素100 U/ml、链霉素100 mg/L)培养GBC-SD细胞,细胞培养箱的条件:5 %CO2、温度37 ℃,pH7.2~7.4,湿度为95 %。经过3~4次传代后,选取生长状态良好的处于对数生长期的GBC-SD细胞,胰酶消化后以1×105/孔的浓度接种6孔板,放入培养箱中培养24 h,使细胞融合率达到30 %~50 %后弃去培养液。配制转染试剂:将FAM荧光标记的miR-210-mimic(20 pmol)溶于Opti-MEM配制成20 μmol/L的溶液,用Opti-MEM(50 μl)稀释LipofectamineTM2000(1 μl)并充分混匀,室温孵育5 min,将FAM荧光标记的miR-210-mimic和LipofectamineTM2000混合,室温孵育20 min。然后将miR-210-mimic和LipofectamineTM2000混合物加入到GBC-SD细胞6孔板中并轻轻摇晃混匀,置于培养箱孵育4~6 h,荧光显微镜下检测并计算miR-210-mimic转染效率,Real-time PCR法检测转染前后miR-210、STAT3、STAT5的表达水平。选取生长状态良好的处于对数生长期的GBC-SD细胞,弃去培养液,加入AG490,使其终浓度为40 μmol/L,继续培养24 h,Real-time PCR法检测AG490处理GBC-SD细胞后miR-210、STAT3、STAT5的表达水平。③MTT 法检测miR-210-mimic转染对GBC-SD细胞增殖的影响:按照上述方法将miR-210-mimic转染GBC-SD细胞,将转染后的GBC-SD细胞按照1×104个/孔的浓度接种于96孔板并置于37℃、5 %的CO2培养箱中培养,转染24、48、72、96 h后加入20 μl的MTT试剂,置于37℃、5 % CO2培养箱中孵育4 h后,每孔加入150 μl的 DMSO溶解,小心振荡10 min,在酶联免疫检测仪490 nm波长处测定每孔光密度(OD)值;另取处于对数生长期的GBC-SD细胞,加入JAK-STAT信号通路特异性阻滞剂AG490,使其终浓度为40 μmol/L,培养24、48、72、96 h后弃去培养液,加入20 μl的MTT试剂,继续孵育4 h后,每孔加入150 μl的 DMSO溶解,小心振荡10 min,在酶联免疫检测仪490 nm波长处测定每孔OD值。另设对照孔(每孔加200 μl的GBC-SD细胞悬液)。以上各组均设置6个平行孔,实验重复3次,计算各组的细胞抑制率,细胞抑制率(%)=(1-实验组OD值/空白对照组OD值)×100%。④流式细胞仪检测转染miR-210-mimic对GBC-SD细胞周期的影响:将GBC-SD细胞以1×105个/孔接种于6孔板中,培养箱中培养24 h,按照上述方法将miR-210-mimic转染GBC-SD细胞(miR-210-mimic组),胰酶消化后,1000 rpm离心5 min,1 ml的PBS(4℃预冷)洗涤,1000 rpm离心5 min后弃去上清液,加入10 μl的Annexin Ⅳ-FITC和5μl的PI,避光室温反应15 min,加入300 μl结合缓冲液后上流式细胞仪检测,实验重复3次。另设未转染组、AG490处理组(终浓度为40 μmol/L),各组细胞检测过程同miR-210-mimic组。
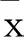
结果
1胆囊癌组织、癌旁组织中miR-210、STAT3、STAT5的表达见图1。胆囊癌组织中miR-210的表达水平低于癌旁组织(P<0.05),而STAT3、STAT5的表达水平高于癌旁组织(P<0.05)。结果提示,胆囊癌组织中,miR-210的低表达以及STAT3、STAT5的高表达可能与胆囊癌的发生、发展有关。
2miR-210-mimic转染、AG490处理GBC-SD细胞后STAT3、STAT5的表达变化见图2。miR-210-mimic转染GBC-SD细胞后,转染效率高达91.07%±3.85%,miR-210表达较转染前升高2.35±0.53(P<0.05),说明 miR-210-mimic已成功转染至GBC-SD细胞。miR-210-mimic转染GBC-SD细胞后STAT3、STAT5的表达分别为转染前的0.35±0.062,0.23±0.044,差异均有统计学意义(P<0.05)。AG490处理GBC-SD细胞后STAT3、STAT5表达分别为转染前的0.30±0.058,0.24±0.046,差异均有统计学意义(P<0.05),AG490处理与miR-210-mimic转染GBC-SD细胞后STAT3、STAT5的表达无统计学差异(P>0.05)。
与癌旁组织比较,* P<0.05
图1胆囊癌组织、癌旁组织中miR-210、STAT3、STAT5表达

与转染前比较,* P<0.05
图2miR-210-mimic、AG490对GBC-SD细胞内miR-210、STAT3、STAT5表达的影响
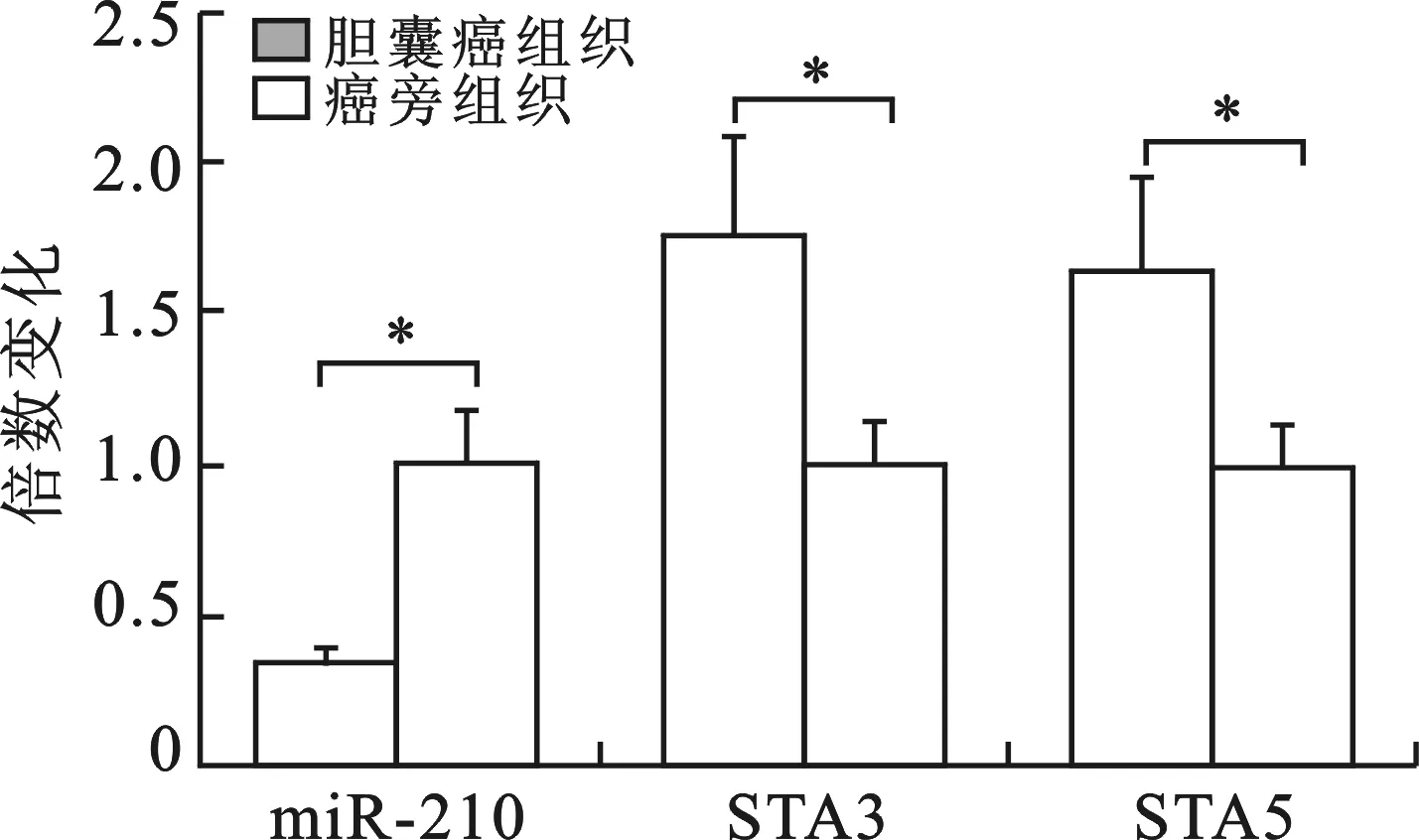
3miR-210对GBC-SD细胞增殖的影响见图3。通过测定转染miR-210-mimic的GBC-SD细胞增殖曲线,发现miR-210可明显抑制GBC-SD细胞的增殖,miR-210-mimic转染GBC-SD细胞后24、48、72、96 h的增殖抑制率分别为34.2%±2.68%,55.3%±4.65%,64.8%±5.06%,82.1%±2.57%,与未转染组均有统计学差异(P<0.05)。AG490处理GBC-SD细胞后24、48、72、96h的增殖抑制率分别为38.7%±2.81%,60.2%±4.33%,68.3%±5.22%,85.5%±5.33%,与miR-210-mimic转染组24、48、72、96 h细胞增殖抑制率的差异均无统计学意义(P>0.05)。
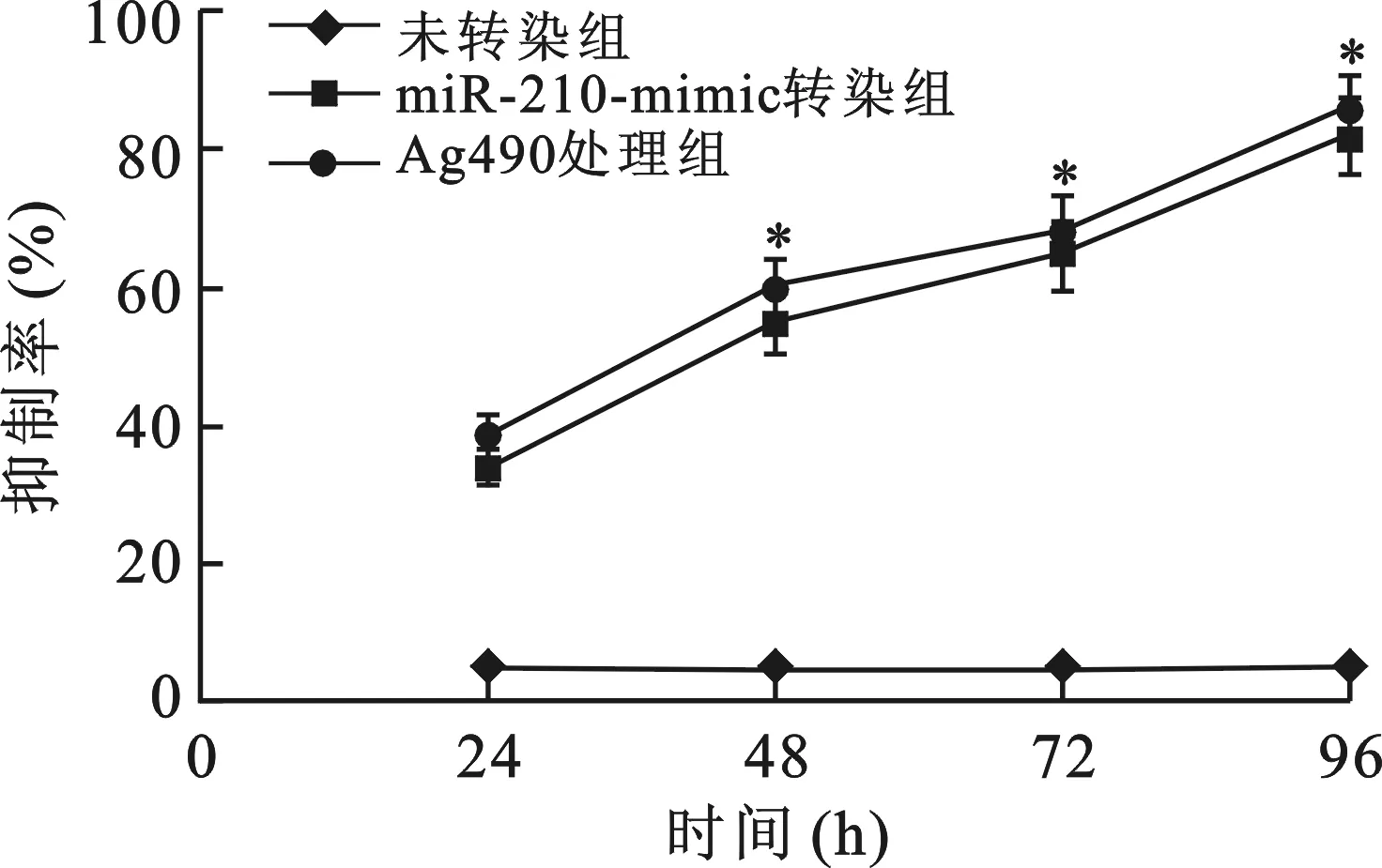
4miR-210对GBC-SD细胞周期的影响见图4。miR-210-mimic转染GBC-SD细胞后,处于G0/G1期的细胞百分比为71.16%±4.28%,较未转染组明显增多47.82%±2.37%,差异有统计学意义(P<0.05);处于S期的细胞百分比为11.95%±0.84%,较未转染组减少34.81%±1.77%,差异有统计学意义(P<0.05);miR-210-mimic转染GBC-SD细胞前后,处于G2/M的细胞百分比分别为15.73%±1.22%、13.95%±0.99%,差异无统计学意义(P>0.05);40 μmol/L的AG490处理GBC-SD细胞后处于G0/G1、S、G2/M期的细胞百分比分别为67.23%±1.84%、13.19%±1.08%、17.56%±0.88%,与miR-210-mimic转染组的差异均无统计学意义(P>0.05)。
与未转染组比较,* P<0.05
图3 miR-210、AG490对GBC-SD细胞增殖的影响
与miR-210-mimic转染前比较,* P<0.05
讨论
胆囊癌占胆道系统肿瘤的80%~95%,占消化系统肿瘤第5位,由于早期症状不典型,缺乏有效的治疗手段,因此预后极差[5]。Kiran等[6]报道胆囊癌患者的中位生存期为4个月。因此探索胆囊癌的发病机制以及潜在的有效治疗靶点有着非常重要的临床意义,有研究发现胆囊癌细胞的增殖在胆囊癌的发生、发展过程中起着关键作用[7]。大量文献报道miR-210在胰腺癌、淋巴瘤、结直肠癌、乳腺癌、肝癌中表达升高,起癌基因样作用,在食管鳞癌组织中表达降低,可能具有抑癌基因样作用[3]。袁源[7]通过miRNA芯片比较正常胆囊上皮细胞与GBC-SD细胞的miRNA差异表达时发现,150个miRNA在GBC-SD细胞中存在差异表达,其中上、下调的miRNA分别有89、61个,miR-210在GBC-SD细胞中表达较正常胆囊上皮细胞低(比值为0.114),但对miR-210在胆囊癌发生、发展过程中的具体机制并未阐述。我们通过检测miR-210在胆囊癌与癌旁组织中的表达也发现miR-210在胆囊癌组织中也呈低表达(与癌旁组织比较)。
有研究发现JAK-STAT 信号通路与癌细胞形成和增殖密切相关,JAK-STAT信号通路广泛分布于各种肿瘤细胞中,STAT3、STAT5是JAK-STAT信号通路中的关键分子,与多种实体肿瘤的发生、发展有关[8]。我们利用Real-time PCR法检测胆囊癌与癌旁组织中STAT3、STAT5的表达,发现STAT3、STAT5在胆囊癌组织中呈高表达(与癌旁组织比较)。有学者依据TargetScan预测并证实了miR-210的下游靶基因是STAT3,我们的研究也证实了这一点,在miR-210-mimic转染GBC-SD细胞后,STAT3、STAT5的表达明显降低,与使用JAK-STAT信号通路特异性阻滞剂AG490后STAT3、STAT5的表达无明显差异。AG490是人工合成的JAK-STAT信号通路特异性阻滞剂,分子结构与酪氨酸类似,可通过与受体酪氨酸激酶竞争结合位置从而抑制STAT磷酸化,是研究JAK-STAT信号通路的重要分子工具。Yang等[9]发现miR-210能明显降低肝癌细胞活性,诱导肿瘤细胞停滞于G0/G1期。我们通过miR-210-mimic转染GBC-SD细胞后发现细胞的增殖受到明显抑制,细胞增殖曲线趋势与使用AG490相似,与未转染组的GBC-SD细胞增殖均存在统计学差异,表明miR-210可以抑制GBC-SD细胞的增殖,通过细胞周期检测发现miR-210可将GBC-SD细胞阻滞于G0/G1期,这可能是miR-210抑制GBC-SD细胞增殖的主要原因。将肿瘤细胞阻滞于G0/G1期可提高细胞对放疗敏感性,这对胆囊癌根治手术后的辅助性治疗极为关键。
总之,miR-210在胆囊癌组织中呈低表达,miR-210的高表达可将GBC-SD细胞阻滞于G0/G1期从而抑制细胞增殖,其分子机制可能与下调JAK-STAT信号通路有关,然而对miR-210在胆囊癌发病机制中的具体作用仍有待于进一步研究。
参考文献
[1] 陈万青,张思维,郑荣寿,等.中国肿瘤登记地区2007年肿瘤发病和死亡分析[J].中国肿瘤,2011,20(3):162-169.
[2] 陈永亮,黄志强,周宁新,等.原发性胆囊癌110例临床分析[J].中华肿瘤杂志,2007,29(9):704-706.
[3] 李刚强,濮亚斌.胆囊癌患者血浆中相关microRNA的表达及其临床意义[J].中国医师杂志,2015,17(8): 1200-1203.
[4] 方茜,郝岗平. miRNA-210在恶性肿瘤中的研究进展[J]. 泰山医学院学报,2013,34(5):396-400.
[5] 李晖,吴武军,范志勇,等. 缺氧诱导因子-1α在胆囊癌组织中的表达及临床意义[J]. 陕西医学杂志,2015,44(5):580-582.
[6] Kiran RP, Pokala N, Dudrick SJ. Incidence pattern and survival for gallbladder cancer over three decades-an analysis of 10301 patients[J]. Ann Surg Oncol,2007,14 (2):277-280.
[7] 袁源. miRNA-145在胆囊癌发病过程中的调控作用及机制研究[D].中南大学,2014.
[8] 洪璇,张艳桥. JAK-STAT信号传导通路在肿瘤中的研究进展[J]. 基础医学与临床,2011,31(4):463-466.
[9] Yang W,Sun T. Downregulation of miR-210 expression inhibits proliferation,induces apoptosis and enhances radiosensitivity in hypoxic human hepatoma cells in vitro[J].Exp Cell Res,2012,318( 8) : 944-954.
(收稿:2015-12-25)
MiR-210 inhibits gallbladder carcinoma cell proliferation by blocking JAK-STAT signaling pathway Department of General Surgery, Ankang City Central Hospital (Ankang 725000)
Qiu WeiYang ChenglinLiu Yang
ABSTRACTObjective:To explore whether miR-210 inhibits gallbladder carcinoma cell proliferation by blocking JAK-STAT signaling pathway.Methods: The expressions of miR-210、STAT3、STAT5 were detected in 10 pairs of gallbladder cancer and paracancerous tissues by Real-time PCR; MiR-210 mimic was transfected into GBC-SD by LipofectamineTM2000 and GBC-SD was also disposed by JAK-STAT signaling pathway blocker AG490, and then the cell proliferation and cell cycle were tested by MTT and flow cytometry. Results: The down-regulation of miR-210 and up-regulation of STAT3, STAT5 were observed in the gallbladder cancer tissues (P<0.05); the expressions of STAT3、STAT5 was lower in GBC-SD disposed by MiR-210 mimic and AG490 than untransfected group; MiR-210 inhibited cell proliferation by blocking GBC-SD into G0/G1 phase. Conclusion: MiR-210 inhibits the expressions of STAT3, STAT5 and GBC-SD cell proliferation by blocking JAK-STAT signaling pathway.
KEY WORDSGallbladder neoplasm/pathologyMicroRNAsSTAT3Transcription factorSTAT5 Transcription factor
通讯作者:▲西安交通大学第二附属医院普外科
【中图分类号】R735.8
【文献标识码】A
doi:10.3969/j.issn.1000-7377.2016.06.004

