骨形态发生蛋白9促成骨的分子机制
罗进勇
(重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016)

罗进勇
骨形态发生蛋白9促成骨的分子机制
罗进勇
(重庆医科大学临床检验诊断学教育部重点实验室,重庆 400016)
骨形态发生蛋白(bone morphogenetic proteins,BMPs)属于转化生长因子β(transforming growth factor-β,TGF-β)超家族的成员,因其具有诱导骨形成的能力而得名。在人类中,BMPs家族至少包括15个以上的成员,其中具有促成骨作用的(成骨性BMPs)包括BMP2、BMP4、BMP6和BMP7,而BMP2和BMP7已经在临床用于促进脊柱融合。近年发现,BMPs中的成员BMP9又称生长分化因子2(growth differentiation factor 2,GDF2)也具有诱导成骨分化和骨形成的能力,而BMP9促成骨的相关分子机制也得到了一定的解析。
1BMP9具有强效促成骨作用
BMP9主要存在于肝脏,其具有诱导和维持胚胎神经元的类胆碱分化、调节葡萄糖和脂肪酸代谢、调节体内铁的动态平衡、参与肿瘤发生及血管生成等多种重要功能。但是对BMP9在骨形成及骨再生中的作用,长期以来都缺乏研究和了解。基于此,Kang等[1]利用重组腺病毒介导的方法,系统研究了BMP2~BMP15共14种BMPs在骨形成中的作用,结果发现BMP9也具有诱导成骨活性,且其促成骨能力远强于已在临床应用的BMP2和BMP7。在体外细胞实验中,BMP9可以促进多种细胞如间充质干细胞(mesenchymal stem cells,MSCs)、小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)、成骨前体细胞、牙周膜干细胞(periodontal ligament stem cells,PDLSCs)和肌源干细胞(muscle-derived stem cells,MDSCs)等定向成骨分化[1-5]。而且,相比于其他的成骨性BMPs,BMP9的促成骨作用很难被BMP3和Noggin抑制[1,6]。在动物实验中,BMP9也显示出较强的促成骨作用,BMP9对小鼠骨缺损愈合及大鼠腰椎脊柱融合均有明显的促进作用[7-8]。因此,BMP9是一种强效的促成骨因子。
2BMP9促成骨的信号转导途径
2.1BMP9促成骨相关受体BMPs均可与具有丝氨酸/苏氨酸激酶活性的跨膜TGF-βⅠ型和Ⅱ型受体结合,启动信号转导。因此TGF-β受体作为BMPs早期信号转导的最重要的分子之一,是BMPs信号转导的关键起始点,与其诱导成骨活性关系密切。为鉴定与BMP9促成骨相关的受体,Luo等[2]构建了一系列TGF-βⅠ型和Ⅱ型受体的突变体,并利用其进行系统,结果分析发现BMP9促成骨相关的Ⅰ型受体是ALK1和ALK2;而与BMP9促成骨相关的Ⅱ型受体为BMPRⅡ、ActRⅡ[3]。当抑制BMP9促成骨相关受体的表达后,BMP9下游的信号转导和BMP9的促成骨作用均受到抑制。从受体的角度看,BMP9与其他成骨性BMPs既有相同的促成骨受体,同时BMP9也有其独特的促成骨受体如ALK1,见表1。

表1 成骨性BMPs促成骨相关的TGF-β受体
2.2Smad信号途径BMP9与相应受体结合后,可激活下游的信号途径。与其他BMPs一样,BMP9与相应受体结合后,可以促进经典的Smad信号活化,导致Smad1、Smad5、Smad8磷酸化和核内转移,并使Smad1、Smad5、Smad8的转录调控活性增强[2,3,9]。当抑制Smad信号后,BMP9诱导骨形成的能力减弱,因此,经典的Smad信号在BMP9的促成骨作用中发挥重要作用。值得注意的是,虽然BMP3和Noggin可以抑制BMP2等成骨性BMPs的经典Smad信号的活化,其对于BMP9所活化的Smad信号的抑制作用很弱[1,6],提示了BMP9促成骨作用的独特性。
2.3非Smad信号途径除经典的Smad信号外,BMP9 亦可活化其他非Smad的信号途径如MAPKs、PI3K/AKT和PKA/CREB等[9-12]。BMP9可以激活MAPKs途径的p38、ERK1/2和JNK[9-10],但是3者对于BMP9促成骨作用的调控效应并不相同,当抑制p38和JNK信号时,BMP9促成骨作用减弱[9-10];而抑制ERK1/2时,BMP9的促成骨作用反而增强[10]。由此表明,p38和JNK对BMP9的促成骨活性可能是正向调控作用,而ERK1/2则是负向调控作用。此外,BMP9也可活化PI3K/AKT和PKA/CREB信号,当抑制AKTPI3K/AKT及PKA/CREB信号后,BMP9的促成骨作用相应减弱[11-12]。
BMP9所活化的经典Smad信号途径和非Smad途径存在联系,当非Smad信号发生变化时,经典Smad信号也发生相应的改变[9-12],这表明BMP9的经典Smad信号途径和非Smad途径同时存在,相互补充,互有联系,形成其信号转导和功能发挥的一个全面的信号转导体系,并进而发挥促成骨的功能
3BMP9促成骨信号的下游关键靶分子
BMP9通过上游的信号转导,作用于下游的多种靶分子,这些靶分子对于BMP9的促成骨活性也具有重要的调控作用,Peng等[13]首先利用基因芯片技术系统分析BMP9促成骨过程中的基因表达变化。以此为基础,后续对其中的某些关键靶分子对BMP9的促成骨作用的调控进行了分析和研究,目前发现BMP9促成骨的关键靶分子有Id、CTGF、Crlde2、PPARγ、COX2、HIF1α和Hey1等[14-20],见表2。
4BMP9促成骨的表观遗传调控
表观遗传指DNA序列不发生变化,但基因表达却发生了可遗传的改变。表观遗传包括DNA甲基化、组蛋白乙酰化、非编码RNA、染色质重塑等。表观遗传在骨骼发育中有重要作用。BMP9促成骨的表观遗传调控目前研究较少,主要也仅集中于MicroRNA(miR)和组蛋白乙酰化[21-23],见表3。因此,BMP9促成骨的表观遗传调控机制可能成为今后一个重要的研究领域。

表2 BMP9促成骨的关键靶分子

表3 BMP9促成骨的表观遗传调控
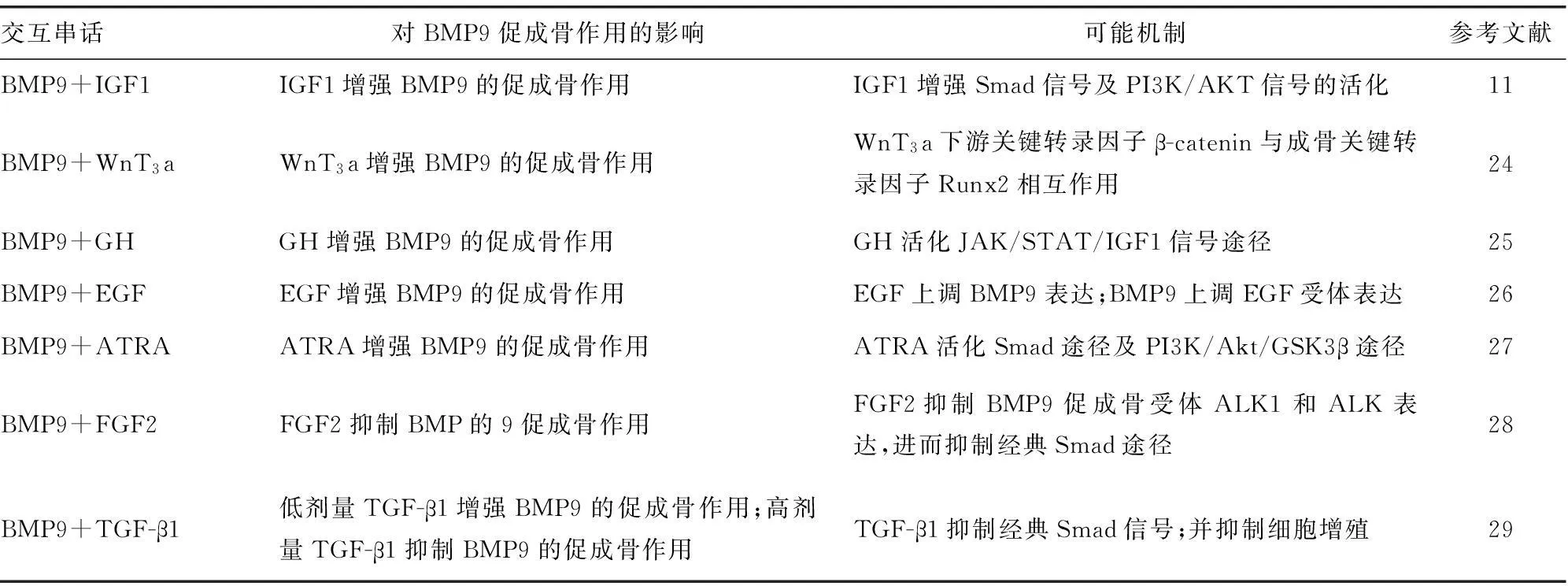
表4 BMP9促成骨过程中与其他信号途径的交互串话
5BMP9促成骨过程中与其他信号分子的交互串话(crosstalk)
在BMP9促成骨过程中,其他一些关键的信号分子也可与BMP9发生相互串话,这些信号分子包括胰岛素样生长因子(insulin-like growth factor,IGF)WnT3a、生长激素(growth hormone,GH)、表皮生长因子(epidermal growth factor,EGF)、全反式维甲酸(all-trans retinoic acid,ATRA)、成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)、TGF-β1等[11,24-29]。但是这些信号分子对BMP9促成骨作用的影响并不尽相同,有些可以协同增强BMP9的促成骨作用[11,24-27],有些可抑制BMP9的促成骨作用[28],另有些则因剂量不同而产生不同的效应[29],见表4。
5结语
BMP9是目前BMPs家族中诱导成骨能力最强的成员因子,有希望作为一种促进成骨的细胞因子候选者,具有潜在的临床应用价值。但由于对BMP9促成骨能力的研究相对较晚,因此对于其促成骨的相关分子机制的解析目前还不完善,还有待深入研究,以期为其将来在临床的实际应用奠定理论和实验基础。
参考文献
[1]Kang Q,Sun MH,Cheng H,et al.Characterization of the distinct orthotopic bone-forming activity of 14 BMPs using recombinant adenovirus-mediated gene delivery[J].Gene Ther,2004,11(17):1312-1320.
[2]Luo J,Tang M,Huang J,et al.TGFbeta/BMP type Ⅰ receptors ALK1 and ALK2 are essential for BMP9-induced osteogenic signaling in mesenchymal stem cells[J].J Biol Chem,2010,285(38):29588-29598.
[3]Wu N,Zhao Y,Yin Y,et al.Identification and analysis of type Ⅱ TGF-β receptors in BMP-9-induced osteogenic differentiation of C3H10T1/2 mesenchymal stem cells[J].Acta Biochim Biophys Sin,2010,42(10):699-708.
[4]Ye G,Li C,Xiang X,et al.Bone morphogenetic protein-9 induces PDLSCs osteogenic differentiation through the ERK and p38 signal pathways[J].Int J Med Sci,2014,11(10):1065-1072.
[5]Xiang L,Liang C,Zhen-Yong K,et al.BMP9-induced osteogenetic differentiation and bone formation of muscle-derived stem cells[J].J Biomed Biotechnol,2012,2012(1):610952.
[6]Wang Y,Hong S,Li M,et al.Noggin resistance contributes to the potent osteogenic capability of BMP9 in mesenchymal stem cells[J].J Orthop Res,2013,31(11):1796-1803.
[7]Kimelman-Bleich N,Pelled G,Zilberman Y,et al.Targeted gene-and-host progenitor cell therapy for nonunion bone fracture repair[J].Mol Ther,2011,19(1):53-59.
[8]Dumont RJ,Dayoub H,Li JZ,et al.Exvivo bone morphogenetic protein-9 gene therapy using human mesenchymal stem cells induces spinal fusion in rodents[J].Neurosurgery,2002,51(5):1239-1244.
[9]Zhao YF,Xu J,Wang WJ,et al.Activation of JNKs is essential for BMP9-induced osteogenic differentiation of mesenchymal stem cells[J].BMB Rep,2013,46(8):422-427.
[10]Zhao Y,Song T,Wang W,et al.P38 and ERK1/2 MAPKs act in opposition to regulate BMP9-induced osteogenic differentiation of mesenchymal progenitor cells[J].PLoS One,2012,7(8):e43383.
[11]Chen L,Jiang W,Huang J,et al.Insulin-like growth factor 2 (IGF-2) potentiates BMP-9-induced osteogenic differentiation and bone formation[J].J Bone Miner Res,2010,25(11):2447-2459.
[12]Zhang H,Li L,Dong Q,et al.Activation of PKA/CREB signaling is involved in BMP9-induced osteogenic differentiation of mesenchymal stem cells[J].Cell Physiol Biochem,2015,37(2):548-562.
[13]Peng Y,Kang Q,Cheng H,et al.Transcriptional characterization of bone morphogenetic proteins (BMPs)-mediated osteogenic signaling[J].J Cell Biochem,2003,90(6):1149-1165.
[14]Peng Y,Kang Q,Luo Q,et al.Inhibitor of DNA binding/differentiation helix-loop-helix proteins mediate bone morphogenetic protein-induced osteoblast differentiation of mesenchymal stem cells[J].J Biol Chem,2004,279(31):32941-32949.
[15]Luo Q,Kang Q,Si W,et al.Connective tissue growth factor (CTGF) is regulated by Wnt and bone morphogenetic proteins signaling in osteoblast differentiation of mesenchymal stem cells[J].J Biol Chem,2004,279(53):55958-55968.
[16]Zhang J,Weng Y,Liu X,et al.Endoplasmic reticulum (ER) stress inducible factor cysteine-rich with EGF-like domains 2 (Creld2) is an important mediator of BMP9-regulated osteogenic differentiation of mesenchymal stem cells[J].PLoS One,2013,8(9):e73086.
[17]Huang J,Yuan SX,Wang DX,et al.The role of COX-2 in mediating the effect of PTEN on BMP9 induced osteogenic differentiation in mouse embryonic fibroblasts[J].Biomaterials,2014,35(36):9649-9659.
[18]Hu N,Jiang D,Huang E,et al.BMP9-regulated angiogenic signaling plays an important role in the osteogenic differentiation of mesenchymal progenitor cells[J].J Cell Sci,2013,126(Pt 2):532-541.
[19]Sharff KA,Song WX,Luo X,et al.Hey1 basic helix-loop-helix protein plays an important role in mediating BMP9-induced osteogenic differentiation of mesenchymal progenitor cells[J].J Biol Chem,2009,284(1):649-659.
[20]Kang Q,Song WX,Luo Q,et al.A comprehensive analysis of the dual roles of BMPs in regulating adipogenic and osteogenic differentiation of mesenchymal progenitor cells[J].Stem Cells Dev,2009,18(4):545-559.
[21]Song Q,Zhong L,Chen C,et al.miR-21 synergizes with BMP9 in osteogenic differentiation by activating the BMP9/Smad signaling pathway in murine multilineage cells[J].Int J Mol Med,2015,36(6):1497-1506.
[22]ZhangR,WengY,LiB,etal.BMP9-induced
induced osteogenic differentiation is partially inhibited by miR-30a in the mesenchymal stem cell line C3H10T1/2[J].J Mol Histol,2015,46(4/5):399-407.
[23]Hu N,Wang C,Liang X,et al.Inhibition of histone deacetylases potentiates BMP9-induced osteogenic signaling in mouse mesenchymal stem cells[J].Cell Physiol Biochem,2013,32(2):486-498.
[24]Tang N,Song WX,Luo J,et al.BMP-9-induced osteogenic differentiation of mesenchymal progenitors requires functional canonical Wnt/beta-catenin signalling[J].J Cell Mol Med,2009,13(8B):2448-2464.
[25]Huang E,Zhu G,Jiang W,et al.Growth hormone synergizes with BMP9 in osteogenic differentiation by activating the JAK/STAT/IGF1 pathway in murine multilineage cells[J].J Bone Miner Res,2012,27(7):1566-1575.
[26]Liu X,Qin J,Luo Q,et al.Cross-talk between EGF and BMP9 signalling pathways regulates the osteogenic differentiation of mesenchymal stem cells[J].J Cell Mol Med,2013,17(9):1160-1172.
[27]Zhang W,Deng ZL,Chen L,et al.Retinoic acids potentiate BMP9-induced osteogenic differentiation of mesenchymal progenitor cells[J].PLoS One,2010,5(7):e11917.
[28]Song T,Wang W,Xu J,et al.Fibroblast growth factor 2 inhibits bone morphogenetic protein 9-induced osteogenic differentiation of mesenchymal stem cells by repressing Smads signaling and subsequently reducing Smads dependent up-regulation of ALK1 and ALK2[J].Int J Biochem Cell Bio,2013,45(8):1639-1646.
[29]Li RD,Deng ZL,Hu N,et al.Biphasic effects of TGFβ1 on BMP9-induced osteogenic differentiation of mesenchymal stem cells[J].BMB Rep,2012,45(9):509-514.
doi:·专家述评·10.3969/j.issn.1671-8348.2016.09.001
[中图分类号]R68
[文献标识码]A
[文章编号]1671-8348(2016)09-1153-03
(收稿日期:2015-11-08修回日期:2016-01-15)
罗进勇:(1974-)博士,教授,硕士生导师。主要研究方向为干细胞定向分化与骨再生,对于间充质干细胞定向分化相关信号分子及网络有较深入研究。担任国家自然科学基金委员会生命科学部一审专家、重庆市科委自然科学基金评审专家、广西自然科学基金评审专家、天津市自然科学基金评审专家。为SCI杂志《J Cell Mol Med》、《Curr Pharm Design》、《Archives of Oral Biology》、《Stem Cells International》审稿人,《生物化学与生物物理进展》、《中国生物化学与分子生物学报》、《遗传》、《中国组织工程研究》杂志审稿专家。

