小鼠原始生殖细胞分离培养方式和生物特性研究*
王 茜,李玉艳,梁志清,包碧慧
(第三军医大学西南医院妇产科,重庆 400038)
小鼠原始生殖细胞分离培养方式和生物特性研究*
王茜,李玉艳,梁志清△,包碧慧
(第三军医大学西南医院妇产科,重庆 400038)
[摘要]目的探索一种简单高效的分离、培养小鼠原始生殖细胞(PGCs)的方法,为小鼠模型提供充足的PGCs来源。方法体外分离小鼠12.5 dpc胚胎生殖嵴,剪碎后用含血清、胰岛素-转铁蛋白-硒添加剂、卵泡刺激素、重组表皮生长因子的α-MEM培养基进行组织块贴壁培养;于倒置显微镜下观察细胞形态,采用流式细胞术检测阶段性特异性胚胎抗原,采用实时荧光定量聚合酶链反应(RT-PCR)、细胞免疫荧光等方法检测干细胞的多能性基因Oct4及减数分裂Ⅰ期的几个特异性基因的表达。结果体外分离培养的小鼠PGCs具有良好的细胞形态、极强的增殖能力,SSEA-1表达阳性,SSEA-4表达阴性,同时检测到Oct4、Stra8、Vasa、SCP3、ZP3表达均为阳性。结论利用该实验方法能培养出高纯度、具有良好干性及极强增殖能力的小鼠PGCs,并使该细胞进入减数分裂。
[关键词]小鼠原始生殖细胞;细胞培养;减数分裂
目前,已有3种生殖细胞可以演化出多能干细胞,它们分别为:胚胎生殖细胞(embryonic germ cells,EGCs)、胚胎癌细胞(embryonic carcinoma cells,ECCs)及多潜能种系干细胞(multipotentgermline stem cells,MGSC-s)[1-3]。其中,来源于原始生殖细胞(primordial germ cells,PGCs)的EGC较ECC和MGSC,具有建系效率高,取材容易等优势,因此在多能干细胞的培养中,利用PGCs进行培养更加便利。虽然国内外多家实验室对PGCs培养进行了相关研究[4-7],但均采用培养于STO饲养层上的方法,培养周期长且步骤繁琐。本研究取12.5 dpc小鼠胚胎生殖嵴行组织块贴壁培养PGCs并进行鉴定,为建立小鼠EGCs系奠定实验基础,现报道如下。
1材料与方法
1.1动物与试剂8~10周龄雌、雄Balb/c小鼠(购自第三军医大学动物中心)。L-谷氨酰胺、青霉素-链霉素混合溶液(100×双抗):Gibco公司;高糖DMEM 培养基、α-MEM培养基、胰蛋白酶:Hyclone公司;丙酮酸钠、维甲酸、明胶、牛血清清蛋白:Sigma 公司;胎牛血清:PAN-Biotech GmbH公司;胰岛素-转铁蛋白-硒添加剂:Atcc公司;卵泡刺激素、重组表皮生长因子:Prospec公司;阶段特异性胚胎抗原(stage specific embryonic antigens,SSEA)-1抗体:Biolegend公司;SSEA-4抗体、Vasa抗体、Scp3抗体:Abcam公司;BCIP/NBT碱性磷酸酶显色试剂盒、FITC及Cy3标记的羊抗鼠二抗:碧云天公司;实时荧光定量聚合酶链反应(RT-PCR)试剂盒:TaKaRa公司。
1.2小鼠PGCs(mPGCs)体外分离与培养参照Hayashi等[8]报道方法,(1)实验用12.5 dpc(days posteoltum,发现阴栓的当天记为0.5 dpc)孕鼠断颈处死后于75%乙醇中浸泡15 min,无菌条件下取出小鼠子宫,再从中取出胎鼠,置于DMEM高糖培养液(含10%胎牛血清、2 mmol/L 谷氨酰胺、100 U/mL青霉素和100 mg/mL链霉素);(2)解剖显微镜下分离出胎鼠生殖腺,去除中肾保留生殖嵴,将收集的生殖嵴组织置于15 mL的离心管后用2~3倍体积的PBS冲洗3次。(3)显微剪剪碎生殖嵴后,以每孔1~3个生殖嵴的密度接种于0.1%明胶包被2 h的24孔板,培养体系为α-MEM培养液(含有10%胎牛血清、1%胰岛素-转铁蛋白-硒添加剂、1 ng/mL重组表皮生长因子、0.1 mmol/L卵泡刺激素、 0.23 mmol/L丙酮酸钠、10 μmol/L维甲酸),置于5% CO2、95%湿度、37 ℃的培养箱内培养;(4)培养24 h后全量换液,每3天换液1次,待组织块爬出细胞达到80%融合时用0.25%胰蛋白酶消化传代于明胶包被过的新培养皿,隔天换液;倒置相差显微镜下持续观察并记录培养细胞的生长情况。
1.3表面标记流式分析用流式细胞仪对第3代细胞的表面特异性抗原进行检查。0.25%胰蛋白酶消化待检细胞1~2 min,含血清培养基终止消化后,收集细胞,室温离心5 min(1 000 r/min),弃培养液,PBS冲洗后再次离心,PBS重悬,血细胞计数仪计数,调整细胞浓度为(0.5~1.0)×106个/mL,吸取1 mL细胞悬液加入1.5 mL EP管中,室温下1 000 r/min离心5 min,100 μL PBS重悬沉淀细胞,加入0.5 μL待检抗体,4 ℃避光孵育30 min,期间混匀2次,1 mL PBS混匀,室温下1 000 r/min离心5 min,弃上清液,1 mL PBS冲洗,室温下1 000 r/min离心5 min,弃上清液,重复2次。200 μL PBS重悬后用300目滤网过滤细胞,流式细胞仪分析鉴定。
1.4碱性磷酸酶(alkaline phosphatase,AP)染色第3代细胞吸去培养基后用PBS漂洗3次,每次2 min,加入4%多聚甲醛室温下固定3 min,PBS漂洗3~4次,每次2 min;加入现配染色工作液共3.03 mL[包含:BCIP溶液(300×)10 μL、NBT溶液(150×)20 μL、AP显色缓冲液3 mL],室温避光孵育5~30 min,去除染色工作液后,用蒸馏水洗涤1~2次。
1.5细胞免疫荧光染色细胞经4%多聚甲醛固定10 min。用PBS充分漂洗3次,每次3 min,穿膜处理20 min,PBS充分漂洗2次,每次3 min,加入5%BSA封闭20~30 min。滴加稀释适度的一抗(VASA抗体1∶400稀释,SCP3抗体1∶100稀释),4 ℃冰箱孵育过夜。PBS充分漂洗3次,滴加荧光标记的二抗37 ℃避光孵育1 h。PBS冲洗3次,每次5 min,滴加DAPI染色3~5 min,PBS漂洗3次后封片,记录。
1.6实时荧光定量聚合酶链反应(RT-PCR)采用RT-PCR法检测第3代细胞特异性基因Oct4、Stra8、Vasa、Scp3、Zp3在mRNA水平的表达,以GAPDH作内参进行PCR。引物序列如下。Oct4 上游:CTG TAA CCG GCG CCA GAA,下游:TGC ATG TGA GAG CCC AGA,其扩增片段长237 bp;Stra8上游:GCC CAG CGT CTG TCT AAC C,下游:CAA CAT CAC GTC GTC ATC C,其扩增片段长171 bp;Vasa上游:ATA ATC ATT TAG CAC AAC CT,下游:GGG AGT AAG AAC AGA AGA AC,其扩增片段长372 bp;SCP3上游:ATG ATG GAA ACT CAG CAG CAA CAG A,下游:TTG ACA CAA TCG TGG AGA GAA CAA C,其扩增片段长301 bp;ZP3上游:CGG CCA GAG ACT CTC CAG TT,下游:ATG TAG AGC GTA TTT CTG GAG CTG TT,其扩增片段长71 bp;GAPDH 上游:GAG AAT GGG AAG CTT GTC ATC AAC GGG AAG,下游:CCC ATC ACC ATC TTC CAG GAG CGA GAC CCC,其扩增片段长181 bp。PCR循环参数:(1)预变性:95 ℃ 5 min;(2)95 ℃ 30 s 退火温度59 ℃,退火时间30 s,72 ℃延伸45 s共35个循环;(3)72 ℃继续延伸 5 min,4 ℃ 10 min。电泳检测:用0.8%琼脂糖凝胶电泳后,在多向分析凝胶成像系统中扫描,并进行分析。
2结果
2.1倒置相差显微镜下观察胎鼠生殖腺及PGCs细胞的形态学特点胎鼠生殖腺呈条索状,于背侧后壁对称分布,均由生殖嵴及中肾构成。原始睾丸因直细精管呈条纹样(图1A),原始卵巢则较小且有斑点(图1B)。生殖嵴组织块3~5 d开始爬出贴壁细胞,5~7 d细胞能生长至70%~80%融合,细胞轮廓清楚,排列紧密,大部分细胞形态为核质比大的圆形或椭圆形细胞(图1C);到80%左右融合状态时传代,传代接种的细胞密度为(0.5~1.0)×104个/cm2,传代后细胞增殖迅速,常于传代后3 d再次接近融合状态,能连续传代6代以上。
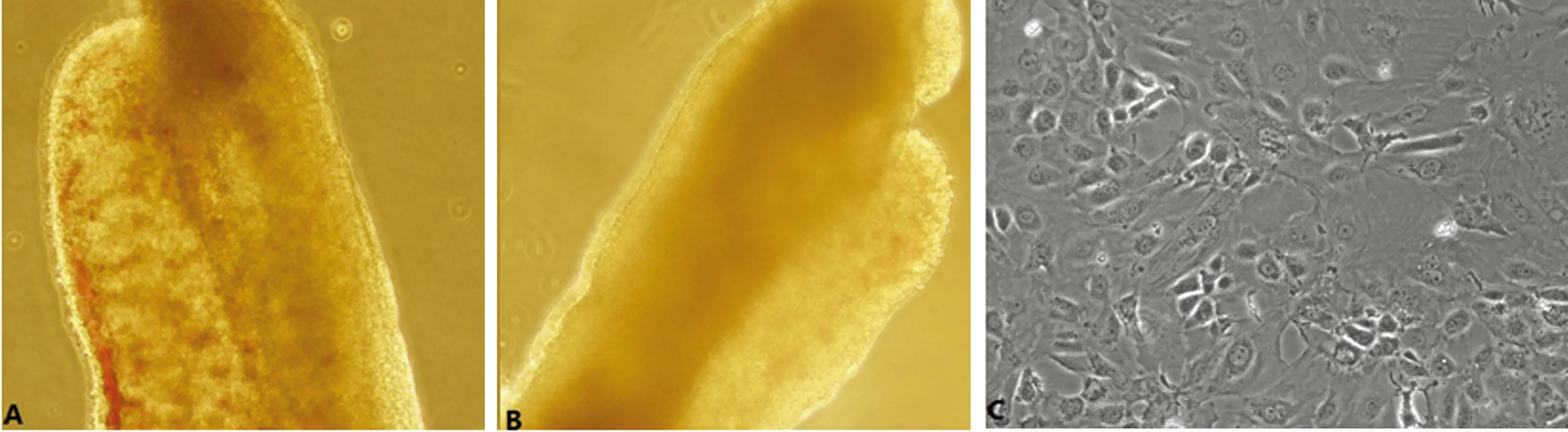
A:12.5 dpc原始睾丸(×200);B:12.5dpc原始卵巢(×200);C:培养6 d的原代PGCs(×100)。
图1显微镜下的胎鼠生殖腺及PGCs细胞
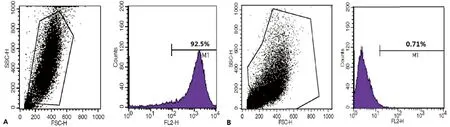
A:SSEA-1;B:SSEA-4。
图2第3代PGCs免疫表型的FCM分析鉴定
2.2流式细胞仪检测传至第3代的mPGCs,阶段特异性胚胎抗原SSEA-1表达阳性,SSEA-4表达阴性,见图2。
2.3AP染色细胞持续AP阳性,表明含有碱性磷酸酶活性阳性的胚胎PGCs,见图3。
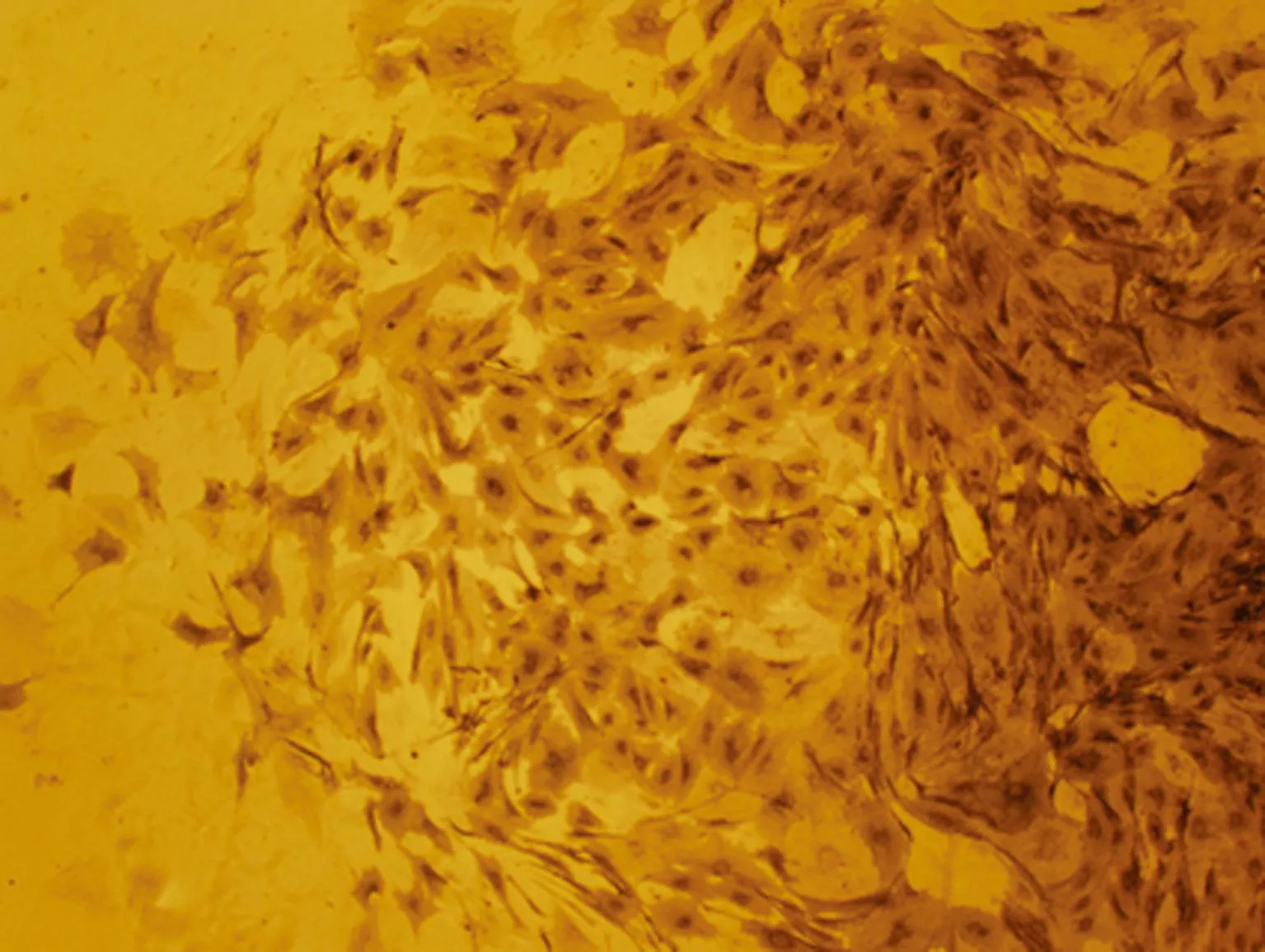
图3 第3代PGCs的AP染色鉴定图(×100)
2.4细胞免疫荧光染色Vasa和Scp3的表达是生殖细胞特有的减数分裂基因。培养至第3代的mPGCs免疫荧光染色显示,绝大部分细胞均表达Vasa和Scp3,见图4。
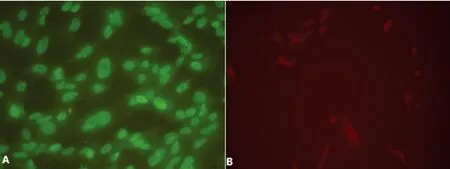
A:Vasa;B:Scp3。
图4第3代PGCs免疫荧光鉴定图(×200)
2.5RT-PCR检测结果第3代mPGCs采用RT-PCR方法检测其特异性基因的表达。电泳结果如图5所示,经连续传代后mPGCs在mRNA水平上存在基因Oct4、Vasa(DDX4)、Stra8、Scp3、ZP3表达。

1:Marker,2:GAPDH,3:ZP3;4:Stra8;5:Oct4;6:Scp3;7:Vasa。
图5RT-PCR检测第3代PGCs减数分裂特异性基因的表达
3讨论
PGCs分化自外胚层细胞,mPGCs最早可在7~7.5 dpc于尿囊基膜附近被发现,并于12.5 dpc到达生殖腺。12.5 dpc的胎鼠生殖嵴、生殖细胞处于减数分裂前期,而13.5 dpc生殖嵴的PGCs已开始减数分裂,提示12.5 dpc的PGCs可能是研究卵子发生的关键时期[5-8]。因此本研究中,首要解决问题即为分离12.5 dpc胎鼠生殖嵴。该时间段胎鼠组织体积小,平均5~8 mm,且脆性极大,生殖嵴更是于显微镜下也寻找不易,导致提取时间长,组织易污染,细胞活性减低等情况,均增加了实验难度。参照Hayashi等[8]的方法将胎鼠从雌鼠子宫取出后,置于DMEM高糖培养液进行生殖腺分离,减少了组织污染,有利于保留组织细胞的活力;分离出胎鼠生殖腺后,采用弯针去除中肾保留生殖嵴,较之使用显微镊等工具,更能将中肾剔除干净,利于后续培养中细胞的纯化。
传统培养PGCs的方法均是将PGCs细胞接种在成纤维细胞制备的饲养层表面,使其在饲养层表面不断生长与发育[4-7,9]。但该方法步骤繁琐且耗时较长。本实验采取将12.5 dpc胎鼠生殖嵴剪碎后,直接行组织块贴壁培养,首先省去了将组织消化为单细胞这一步骤,减少了因消化不足或消化过度对细胞的影响;其次本方法省略了制备饲养层,降低了因饲养层质量不稳定,而对PGCs培养的影响。培养3~5 d后在倒置相差显微镜下可观察到从组织块爬出PGCs细胞,5~7 d细胞即可生长至70%~80%融合进行传代,又在培养时间上短于传统饲养层法。本试验的直接贴壁法,较之传统的饲养层法,不仅简化了实验步骤,又缩短了培养时间。而且通过后续SSEA-1、SSEA-4检测、AP染色等初步鉴定是mPGCs。
SSEA是一种糖蛋白,一般表达于胚胎发育早期,也可表达于未分化的多能性干细胞,故其表达具有种属特异性[10]。且研究发现,人类及某些灵长类ECCs中,表达SSEA-3、SSEA-4,不表达SSEA-1,而其EGCs中SSEA-1、SSEA-3、SSEA-4均为阳性表达,与之不同的是小鼠EGCs和ECCs表达SSEA-1,却不表达SSEA-3或SSEA-4。在本研究中,分离的mPGCs通过流式细胞仪鉴定表达SSEA-1,不表达SSEA-4,与小鼠EGCs细胞表达相似,表明本研究所培养的细胞属于小鼠的EGCs。而该细胞AP染色阳性,结合其主要在未分化或低分化状态的细胞中呈阳性反应的特点[11],表明该培养方法可使mPGCs在保持不分化的同时,还能继续生长与增殖。
Oct4是POU转录因子家族的一员,由Pou5 f1基因编码产生。Oct4与细胞的亚全能性有关[12],在未分化的EGCs、ECCs和MGSCs及生殖系细胞中均有表达[13],其表达与细胞的功能有关,维持一定水平的Oct4表达对干细胞自我更新和多能性的维持起重要作用。有研究表明,Oct4最早在所有卵裂球都有表达,之后表达局限于内细胞团,在滋养外胚层和原始内胚层则表达下调。且一旦PGCs启动分化,其表达立即下调,不仅如此,Oct4表达的定量分析揭示,Oct4的表达降低,PGCs细胞会朝向滋养外胚层分化[14]。说明Oct4 基因的表达对维持PGCs的未分化状态具有十分重要的意义。Stra8是哺乳动物生殖细胞由有丝分裂转变为减数分裂前特异表达的基因,即系减速分裂的早期标志[15]。Vasa则为PGC s迁移后期标志基因,位于人类染色体5q且靠近着丝点。Vasa基因在两性生殖细胞中特异表达,在其迁移后期到减数分裂后的生殖细胞中均有表达[16]。Scp3即联会复合体蛋白3是生殖细胞减数分裂中联会复合体侧生元件的核心部分,其表达对于第一次减数分裂的完成具有重要作用,系减速分裂特异标志基因[17]。而Zp3是组成透明带最外层的一种硫酸糖蛋白,是卵母细胞向生殖细胞分化发育形成初级卵母细胞、次级卵母细胞、极体及透明带的标记物[18]。本研究中,经过细胞免疫荧光染色及RT-PCR检测发现,Oct4、Stra8、Vasa、Scp3、Zp3均为阳性表达,表明本研究培养的PGCs不仅是一种来自小鼠胚胎早期的胚胎生殖细胞,处于未分化状态,而且可进入减数分裂Ⅰ期。
综上所述,本试验已成功地进行了mPGCs体外增殖培养研究,所用组织块直接贴壁法较传统培养方法具有简单、稳定,操作便利等优势。且通过上述鉴定,证明该方法培养后,mPGCs均能表达标志多能性的Oct4基因及减数分裂Ⅰ期的几个特异标志物Stra8、Vasa、SCP3、ZP3。但目前尚未能进一步证实,在体外培养下能否最终完成减数分裂。因此还需要进一步探索适合PGCs生长的培养体系,期望能进一步研究体外培养PGCs完成减数分裂的可能性机制,同时也为建立小鼠EGCs系奠定实验基础。
参考文献
[1]Donovan PJ,Gearhart J.The end of the beginning for pluripotent stem cells[J].Nature,2001,414(6859):92-97.
[2]Smith AG.Embryo-derived stem cells:of mice and men[J].Annu Rev Cell Dev Biol,2001(17):435-462.
[3]Turnpenny L,Spalluto CM,Perrett RM,et al.Evaluating human embryonic germ cells:Concord and conflict as pluripotent stem cells[J].Stem Cells,2006,24(2):212-220.
[4] Labosky PA,Barlow DP,Hogan BL.Embryonic germ cell lines and their derivation from mouse primordial erm cells[J].Ciba Foundation Symposium,1994,182(2):157-178.
[5]汪亚芬,冯涵琪,王兴玲,等.男性原始生殖细胞中LIN28和Oct4的表达[J].郑州大学学报:医学版,2015(3):389-392.
[6]冷少华,李彩霞,梁志清,等.人原始生殖细胞的分离和培养[J].第三军医大学学报,2009,31(8):679-683.
[7]Kimura T,Kaga Y,Sekita Y,et al.Pluripotent stem cells derived from mouse primordial germ cells by small molecule compounds[J].Stem Cells,2015,33(1):45-55.
[8]Hayashi K,Saitou M.Generation of eggs from mouse embryonic stem cells and induced pluripotent stem cells[J].Nat Protoc,2013,8(8):1513-1524.
[9]Irie N,Weinberger L,Tang WW,et al.SOX17 is a critical specifier of human primordial germ cell fate[J].Cell,2015,160(1/2):253-268.
[10]Kajiura S,Mii S,Aki R,et al.Cryopreservation of the hair follicle maintains pluripotency of Nestin-Expressing hair Follicle-Associated pluripotent(HAP)stem cells[J].Tissue Eng Part C Methods,2015,21(8):825-831.
[11]Mclaren A.Primordial germ cells in the mouse[J].Dev Biol,2003,262(1):1-15.
[12]Jerabek S,Merino F,Schöler HR,et al.OCT4:dynamic DNA binding pioneers stem cell pluripotency[J].Biochim Biophys Acta,2014,1839(3):138-154.
[13]Ahn BC,Parashurama N,Patel M,et al.Noninvasive reporter gene imaging of human Oct4 (pluripotency) dynamics during the differentiation of embryonic stem cells in living subjects[J].Molecular Imaging and Biology,2014,16(6):865-876.
[14]Niwa H,Burdon T,Chambers I,et al.Self-renewal of pluripotent embryonic stem cells is mediatedvia activation of STAT3[J].Genes Dev,1998,12(13):2048-2060.
[15]Li MZ,Yu M,Zhu HJ,et al.The effects of Nanos2 on Boule and Stra8 in male germline stem cells (mGSCs)[J].Mol Biol Rep,2013,40(7):4383-4389.
[16]Medrano JV,Ramathal C,Nguyen HN,et al.Divergent RNA-binding proteins,DAZL and VASA,induce meiotic progression in human germ cells derived in vitro[J].Stem Cells,2012,30(3):441-451.
[17]Yang S,Ping P,Ma M,et al.Generation of haploid spermatids with fertilization and development capacity from human spermatogonial stem cells of cryptorchid patients[J].Stem Cell Reports,2014,3(4):663-675.
[18]Xia FU,Yuan L.The effects of umbilical cord mesenchymal stem cell transplantation on immune premature ovarian failure[J].Guangdong Yi Xue,2013,34(23):3535-3538.
Study on isolation and culture modes of mouse primordial germ cell and its biological characteristics*
Wang Xi,Li Yuyan,Liang Zhiqing△,Bao Bihui
(Department of Obstetrics and Gynecology,Southwest Hospital,Third Military Medical University,Chongqing 400038,China)
[Abstract]ObjectiveTo explore a simple and efficient method for isolating and culturing mouse primordial germ cells(mPGCs) in vitro in order to provide the sufficient mPGCs sources of mouse model.MethodsThe 12.5 dpc mouse embryonic genital ridge were isolated in vitro and cut into pieces,then the organization to adherent culture was performed in a-MEM medium containing fetal calf serum and insulin-transferrin-selenium (ITS) and follicle stimulating hormone(FSH) and recombinant endothelial growth factor(rEGF).The inverted microscope was used to observe the cellular morphology.Flow cytometry was used to identify the stage specific embryonic antigens of cultured cells.Reverse transcription-polymerase chain reaction(RT-PCR) and immunofluorescence were used to identify the pluripotency gene Oct4 expressions of stem cells and specific genes in the meiosis phaseⅠ.ResultsThe in vitro isolated and cultured mPGCs showed good cell morphology,extremely strong proliferation capacity and the positive expression of SSEA-1 and negative expression of SSEA-4,Oct4,meanwhile the expressions of Stra8,Vasa,Scp3,Zp3 were detected to be positive.ConclusionUsing this culture method can culture the high purity of mPGCs with the excellent stem cell properties and extremely strong proliferative ability,moreover which makes the cells entering the meiosis stage.
[Key words]mouse primordial germ cells;cell culture;meiosis
doi:论著·基础研究10.3969/j.issn.1671-8348.2016.09.003
* 基金项目:国家自然科学基金项目资助(31101058);重庆市自然科学基金资助项目(CSTC2011jjA10075)。
作者简介:王茜(1990-),硕士在读,主要从事生殖医学研究工作。△通讯作者,E-mail:zhi.lzliang@gmail.com。
[中图分类号]Q813.1
[文献标识码]A
[文章编号]1671-8348(2016)09-1159-04
(收稿日期:2015-10-22修回日期:2015-12-26)

