检测牛奶中布鲁氏菌套式PCR方法的建立
孙光野,张 露,王珊珊,侯喜林
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
检测牛奶中布鲁氏菌套式PCR方法的建立
孙光野,张 露,王珊珊,侯喜林*
(黑龙江八一农垦大学动物科技学院,黑龙江 大庆 163319)
为了建立一种快速检测牛奶中布鲁氏菌的方法,本研究采用套式PCR的方法,通过对PCR条件的优化,改进布鲁氏菌提取DNA方法,经验证,最佳退火温度50.1℃、dNTP最佳浓度为0.2 mM、引物最佳浓度为0.4 μM 、Taq DNA聚合酶最佳浓度为0.1 μL、本方法最小检测菌数为8个。说明用套式PCR的方法提高了检测牛奶中布鲁氏菌的敏感性。
布鲁氏菌;套式PCR;奶样
布鲁氏菌病于1859年由Morston首次报道[1],是由布鲁氏杆菌引起的一种全世界广泛分布的人兽共患慢性细菌传染病。世界动物卫生组织(OIE)已将其列为B类动物疫病,我国将其列为二类动物疫病[2]。
布鲁氏菌病(Brucellosis)病原是布鲁氏杆菌(Brucella),它是革兰氏阴性的兼性细胞内寄生菌,主要侵害动物的淋巴系统和生殖系统,可以引发世界范围内人和牲畜及野生哺乳动物的感染[3]。目前,流行病学、临床病理变化、细菌学和血清学等方法均能诊断本病[4-5]。血清学诊断方法有很多,包括平板凝集反应、试管凝集反应、虎红平板凝集反应、补体结合反应[6]、ELISA等,虽然上述方法均可检测布鲁氏菌病,但由于检测结果不够精确,存在假阴性可能,均不能适应现代快速检验检疫需求。实际临床操作时往往需要多种方法结合应用,成本较高,耗费时间。因此,寻求一种快速检测奶样布鲁氏菌的方法迫在眉睫,本文利用CTAB/NaCl方法提取牛奶样品的布氏杆菌染色体DNA,以特异性引物进行套式PCR扩增,建立牛奶样品布氏杆菌套式PCR检测方法,对奶牛感染布氏杆菌病进行普查和监测,为牛奶制品的食品安全监测提供新的技术手段。建立一种高效准确的布鲁氏菌诊断方法,为在实际生产中检测奶样中布鲁氏菌病奠定基础。
1 材料与方法
1.1 菌株 S2型猪布鲁氏菌疫苗株由黑龙江八一农垦大学动物科技学院预防兽医实验室保存
1.2 引物 根据GenBank中公布猪型布鲁氏菌外膜蛋白 25ku基因序列(GenBank 登录号为:AM712381),应用Oligo 6.0软件设计2对引物。由上海生工生物工程有限公司合成。
外部上游OMP1:5’-CGTGCCGCAATACCCTC-3’
外部下游OMP2:5’-CCGTCAGCTTGGCTTCGA-3’
内部上游OMP3:5’-GATGCTGCCCGCCCGATAA-3’
内部下游OMP4:5’-GCACCGAGCGAGCCTTGAAA-3’
2 试验方法
2.1 细菌培养 在布氏杆菌培养基平板上划线接种S2型猪布鲁氏菌,在37℃保温箱里放置24 h,挑取单菌落接种到液体培养基,37℃温箱培养OD600≈0.5。
2.2 细菌计数 取50 μL细菌培养物,以液体培养基进行连续10倍的倍比稀释,取10-5、10-6、10-7稀释的菌液各100 μL均匀涂布于琼脂平板,置37℃温箱培养24 h,对各稀释度进行菌落计数。
2.3 布鲁氏菌基因组的提取 参照邱昌庆等[5]和杜振昆等[2]报道的方法,应用CTAB/NaCl[6]方法,并在此基础上加以改进。具体方法如下:取1 mL不同稀释度的布鲁氏菌奶样于离心管中,10 000 r/ min离心10 min,弃掉上清液,加100 μL NET悬浮沉淀;加入100 μL 24%SDS,置于80℃孵育10 min,冰上冷却3 min;在邱昌庆的步骤中提到了使用蛋白酶K和RNaseA的终浓度为325 μg/μL和75 μg/μL,分别作用2 h。本研究将蛋白酶K和RNaseA的终浓度都定为800 μg/mL,置于50℃水浴2 h。加入预热至65℃的CTAB/NaCl 300 μL,置于65℃水浴锅中10 min。加入600 μL酚-氯仿-异戊醇,颠倒混匀,10 000 r/min离心5 min,将上清液移入另一离心管中,加入600 μL酚-氯仿-异戊醇,重复操作;在上清液中加入400 μL的异丙醇,混匀,室温放置5 min,10 000 r/min离心10 min,弃上清液。用1 mL 70%的乙醇洗2次,混匀,l0 000 r/ min离心2 min。加100 μL无菌去离子水,溶解DNA。
2.4 套式PCR扩增体系及循环参数 PCR一扩反应体系。10×PCR buffer 2.5 μL,2.5 mM dNTP 2 μL,上下游引物各0.5 μL,模板0.5 μL;TAKARA Taq DNA聚合酶0.2 μL;补水至25 μL;循环参数为:PCR反应条件为95℃预变性5 min;94℃变性1 min,50℃退火1 min,72℃延伸1 min,35个循环,最后72℃延伸10 min。
二扩反应体系采用25 μL反应体系,10×PCR buffer 2.5 μL,2.5 mM dNTP 2 μL,上下游引物各0.5 μL,模板1 μL;TAKARA Taq DNA聚合酶0.2 μL;补水至25 μL;循环参数为:95℃预变性5 min;94℃变性30 s,50℃退火1 min,72℃延伸1 min,20个循环,最后72℃延伸6 min。
2.5 套式PCR条件的优化
2.5.1 退火条件的优化 选择8个温度进行优化,分别为46、47.1、47.9、48.8、50.1、51、52.6和54℃,其他条件按上述参数设置,进行套式PCR反应,确定最佳的退火温度。
2.5.2 dNTP最佳浓度优化 选取dNTP终浓度分别为0.05、0.1、0.2、0.4、0.8、1.2和1.6 mm,7个梯度,其他条件不变,进行套式PCR反应,确定最佳的dNTP浓度。
2.5.3 引物浓度的优化 引物的终浓度分别为0.08、0.16、0.24、0.32、0.4、0.48、0.56和0.62 μm,其他条件不变,进行套式PCR反应,确定最佳引物浓度。
2.5.4 Taq DNA聚合酶浓度优化 体系中Taq DNA聚合酶分别为0.05、0.1、0.15、0.2、0.25和0.3 μL,其他条件不变,进行套式PCR反应,确定最佳的Taq DNA聚合酶浓度。分别取4 μL上样进行1.2%琼脂糖凝胶电泳,凝胶成像仪中观察扩增结果。
2.5.5 敏感性试验 对菌液进行细菌计数,确定细菌数为8×106CFU/mL,然后利用奶样对菌液进行10倍连续稀释,分别取1 mL进行基因组DNA提取和套式PCR扩增,产物经1.2%琼脂糖凝胶电泳、凝胶成像仪检测扩增结果。
3 结果
3.1 PCR条件优化结果
3.1.1 退火温度的优化 最佳退火温度为50.1℃,结果见图1。
3.1.2 dNTP浓度优化 dNTP最佳浓度为0.2 mm(2 μL),结果见图2。
3.1.3 引物浓度优化 引物最佳浓度为各0.4 μM(0.5 μL),结果见图3。
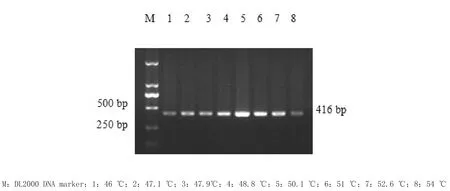
图1 退火温度优化Fig.1 Annealing temperature optimization
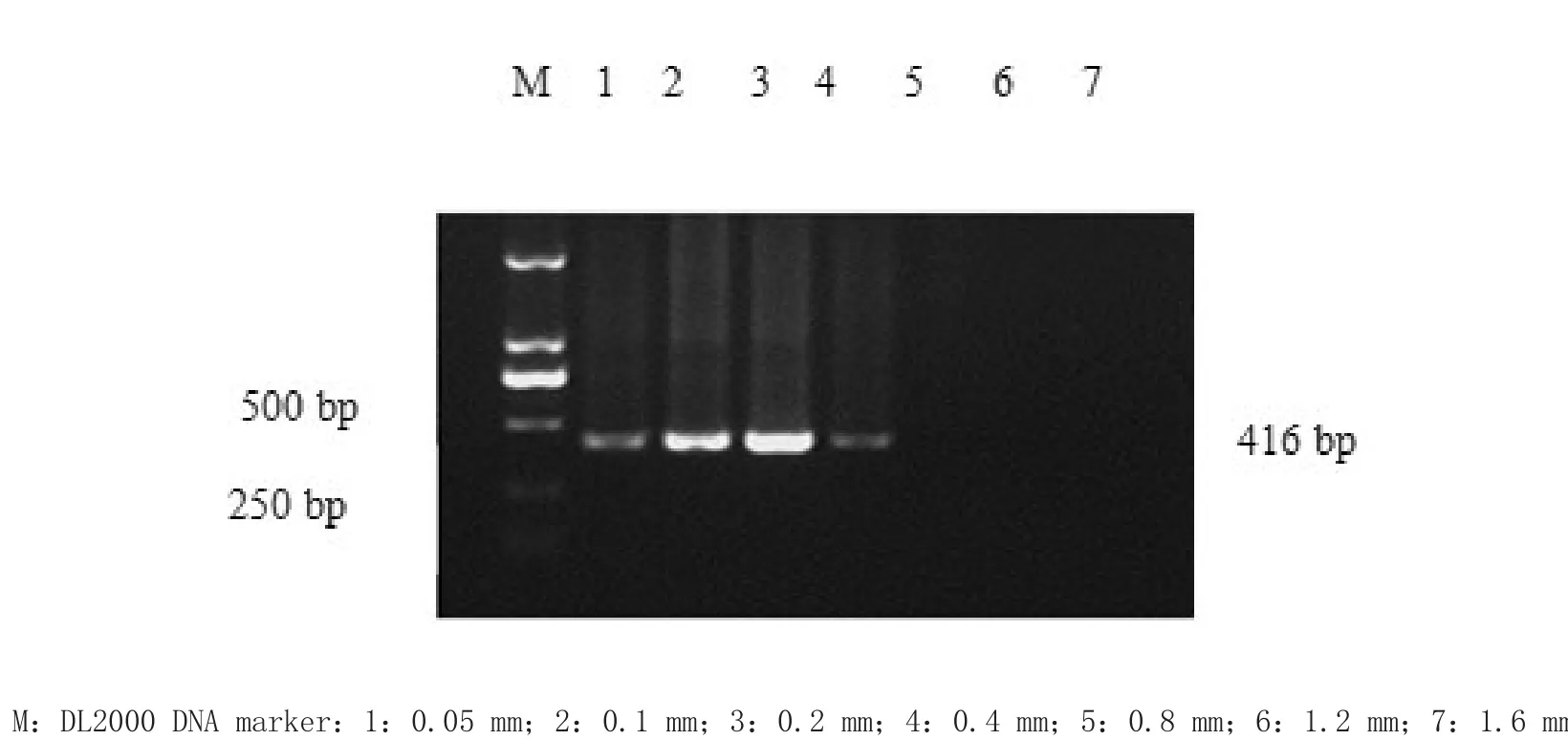
图2 dNTP浓度优化Fig.2 dNTP Concentration optimization

图3 引物浓度优化Fig.3 Optimization of primer concentration
3.1.4 Taq DNA聚合酶浓度优化 Taq DNA聚合酶最佳浓度为0.1 μL,结果见图4。
3.2 敏感性试验结果 应用上述最优的套式PCR方法,最佳退火温度50.1℃、dNTP最佳浓度为0.2 mm、引物最佳浓度为0.4 μm、Taq DNA聚合酶最佳浓度为0.1 μL,进行的敏感性试验检测布鲁氏菌的最少菌数为8 CFU/mL,结果见图5。。
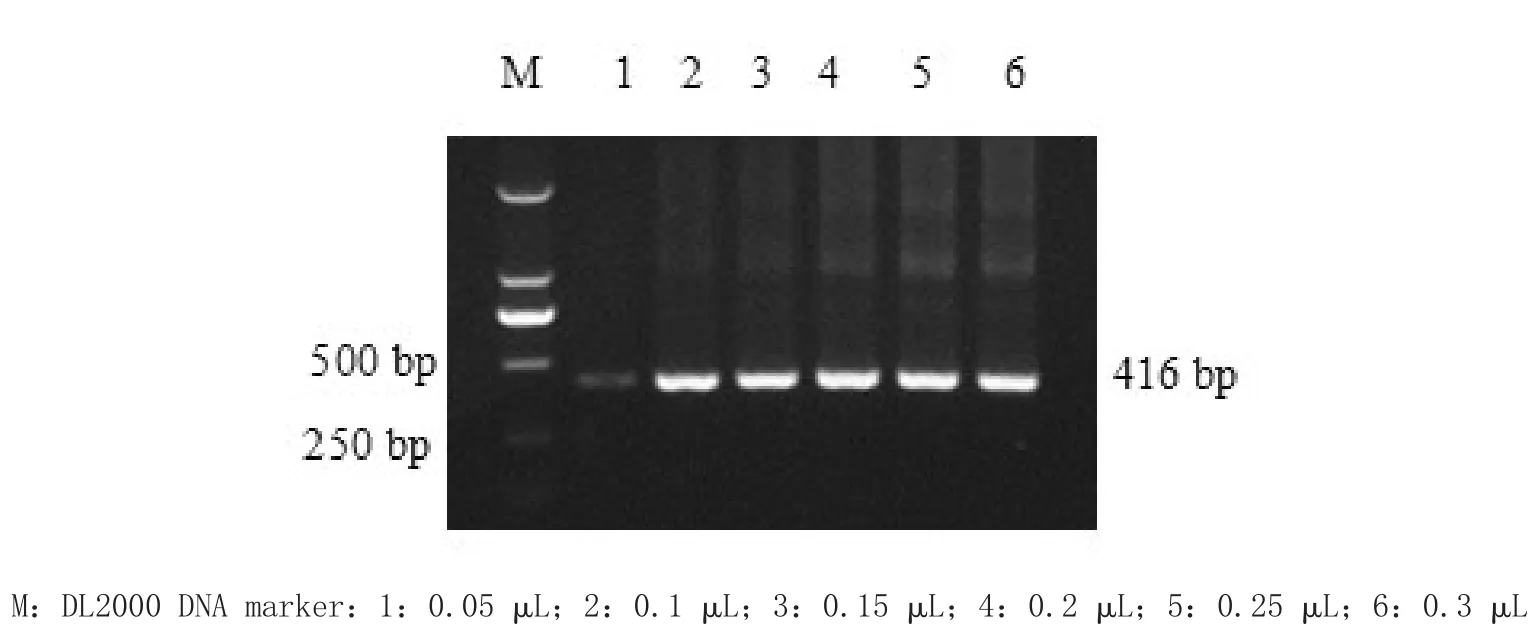
图4 Taq DNA聚合酶浓度优化Fig.4 Taq DNA Optimization of polymerase concentration
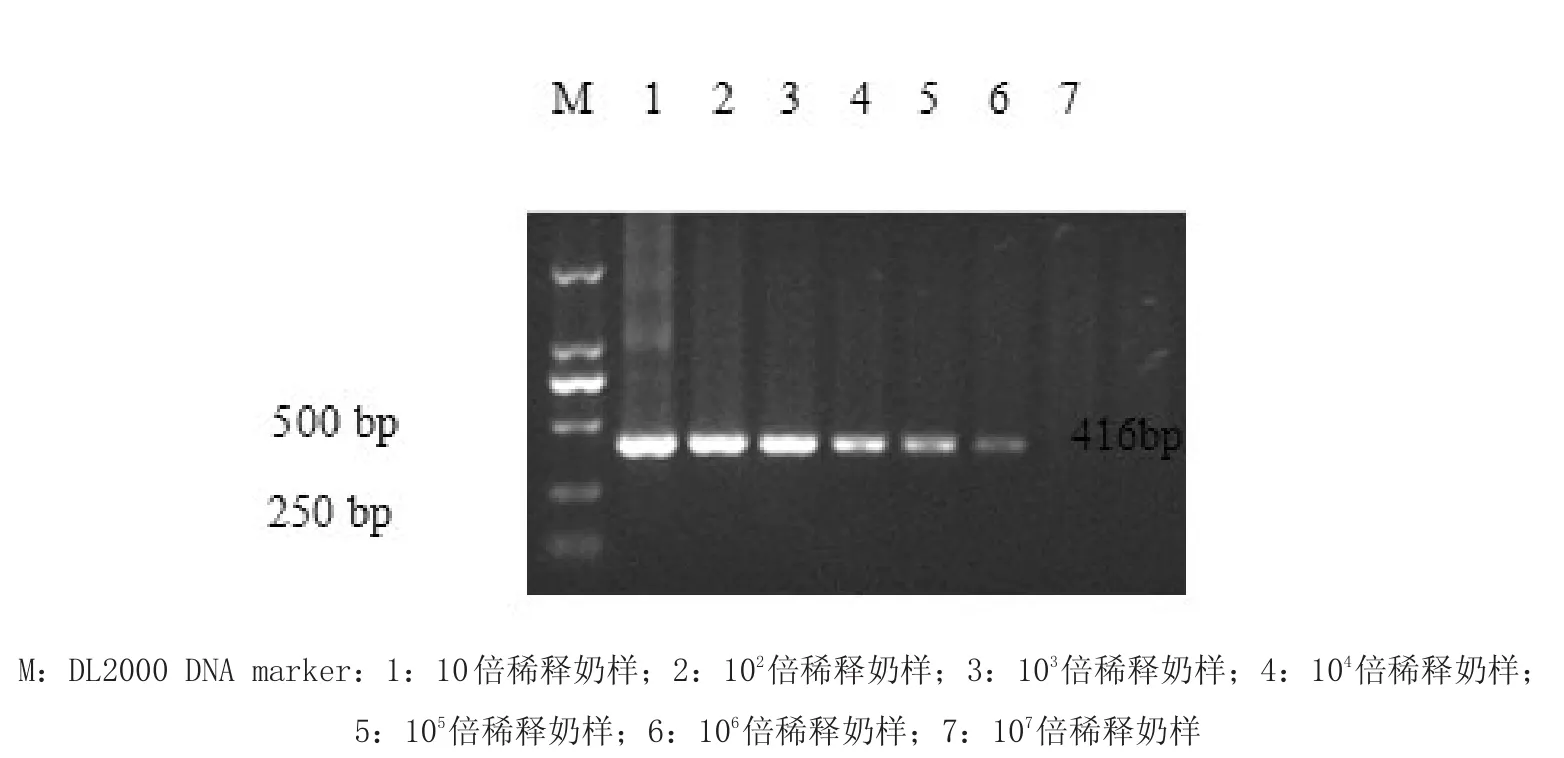
图5 套式PCR敏感性检测Fig.5 Nested PCR sensitivity test
4 讨论
在布鲁氏菌病研究中,用PCR的方法检测布鲁氏菌病始见于1990年,Fekete等[8]最早利用PCR扩增布鲁氏菌外膜蛋白基因。1997年首次将PCR应用于中国布病患者的诊断。Bosnakovsk等首次建立了牛乳中布鲁氏菌外膜蛋白(OMP)25 Ku套式PCR检测技术,试验结果表明,此方法具有较强的特异性,只扩增布鲁氏菌DNA。据Lucer报道也有人用其他的布鲁氏菌基因区设计引物进行试验,均能特异性地检测到布鲁氏菌核酸。
鉴于此国内外学者开展了利用PCR方法检测布鲁氏菌的研究。2005年邱昌庆等[7]通过扩增布鲁氏菌外膜蛋白建立了套式PCR检测奶样中布鲁氏菌,其检测的灵敏度为50 CFU/mL。本研究根据邱昌庆发表的奶牛布鲁氏菌病PCR诊断技术的提取DNA方法的基础上优化了提取DNA的步骤。在邱昌庆的提取DNA步骤中提到了使用蛋白酶K和RNaseA的终浓度为325 μg/μL和75 μg/μL,分别作用2 h。本研究应用CTAB/NaCl,并且将蛋白酶K和RNaseA的终浓度都定为800 μg/mL,共同作用2 h,提取DNA效果较好,然后对套式PCR条件进行了优化,优化后套式PCR的灵敏度8 CFU/mL,证明本研究建立的方法结果可靠,灵敏度高,节省成本,节省时间。本研究为以后实际生产中检测奶样奠定基础。
参考文献
[1]Aleixo M J,erreira M L,Antunes F.Brucellosis[J].1999,12(12):323-330.
[2]杜振昆,郭军庆,张妙仙,等.牛奶样品布氏杆菌套式PCR检测方法的建立[J].浙江大学学报,2008,34(2):169-174.
[3]何明清.畜禽传染病的防治[M].成都:四川科学技术出版社,1985:167-168.
[4]Mantur B G,Mangalgi S S,Mulimaig B.Burcella melitensis-a sexually transmissible agent [J].Lancet,1996,347:1763.
[5]Ruben B,Band J D,Wong P,et al.Person-toperson tras-mission of burcella melitensis [J].Lancet,1991,337:14-5.
[6]孙耀贵,黄姜生,陈佳.三种血清学方法检测奶牛布鲁氏杆菌病的比较试验[J].黑龙江畜牧兽医,2005(1):42-43.
[7]邱昌庆,曹小安.乳牛布鲁氏菌病病原DNA快速检测技术的研究[J].中国兽医科技,2005,35(2):85-89.
[8]Fekete A,Bantle J A,Halling S M,et al.Preliminary development of a diagnostic test for Brucella using polymerase chain reaction [J].Journal of Applied Bacteriology,1990, 69(2):216-227.
For detection of Brucella in milk nested PCR methods
Sun Guangye,Zhang Lu,Wang Shanshan,Hou Xilin*
(College of animal science and technology,Heilongjiang Bayi Agricultural University,Heilongjiang Daqing 163319)
In order to establish a method for Brucella in milk rapid detection,this study nested PCR method,by optimizing PCR conditions,improved Brucella DNA extraction method,proven,optimal annealing temperature of 50.1℃,best dNTP concentration is 0.2 mM,optimum primer concentration was 0.4 μM,Taq DNA polymerase,the optimal concentration was 0.1 μL,the present method is the minimum number of detected bacteria 8.The results show that by nested PCR method to improve the sensitivity of detection of Brucella in milk.
Brucella;Nested-pcr;Milk sample
S852.61+9
:B
:1672-9692(2016)09-0001-05
2016-07-09
孙光野(1992-),男,硕士研究生,研究方向为动物传染病诊断。
侯喜林(1965-),男,博士,教授,博士生导师,研究方向为动物传染病诊断与防治。

